博文
偏头痛原来是大脑暂时关机导致!
|
偏头痛原来是大脑暂时关机导致!
《自然》新闻
对于全球十亿人来说,偏头痛的症状可能是令人衰弱的:剧烈的头部疼痛、恶心、视力模糊和持续数日的疲劳。但长期以来,科学家们一直对大脑活动如何触发这些最严重的头痛——偏头痛——感到困惑。
一项在7月4日发表于《科学》杂志上的小鼠研究现在提供了关于引发偏头痛的神经事件的线索。研究表明,当神经元活动关闭时,大脑短暂的“停电”现象会暂时改变脑脊液的内容物,脑脊液是围绕大脑和脊髓的清澈液体。研究人员推测,这种改变了的液体通过一个以前未知的解剖学间隙流向颅骨内的神经,在那里它激活了疼痛和炎症受体,引起头痛。
德克萨斯大学达拉斯分校的神经科学家格雷戈里·杜索尔说:“这项工作改变了我们对头痛起源的看法。” “头痛可能只是大脑内部发生的许多不正常情况的一般警告信号。”
哥本哈根大学的神经科学家、研究共同作者麦肯·内德加德说:“从这个意义上说,偏头痛实际上是保护性的。疼痛是保护性的,因为它告诉人们需要休息、恢复和睡眠。”
无痛感的大脑
大脑本身没有疼痛受体;头痛的感觉来自于大脑外部属于外周神经系统的区域。但是,大脑如何直接与外周神经系统相连并触发神经引起头痛的机制尚不清楚,这使得它们难以治疗。
使用一种特定类型的头痛——耳偏头痛的小鼠模型工作的科学家们开始探索这一点。三分之一的偏头痛患者会在头痛之前经历一个称为先兆的阶段,其症状包括恶心、呕吐、对光敏感和麻木。这可以持续五分钟到一个小时。在先兆期间,大脑经历了一种称为皮层扩散性抑郁(CSD)的停电现象,此时神经元活动短暂停止。
对偏头痛的研究表明,当脑脊液中的分子从大脑排出并激活脑膜中的神经时会发生头痛,脑膜是保护大脑和脊髓的层次。
内德加德的团队想要探索是否存在类似的脑脊液泄漏激活三叉神经,该神经贯穿面部和颅骨。神经分支在颅底的三叉神经节处汇合。这是传递面部和下巴到大脑感觉信息的枢纽,包含疼痛和炎症蛋白的受体。
神经束
作者培育了经历CSDs的小鼠,并分析了它们的脑脊液的运动和内容。在CSD期间,他们发现液体中一些蛋白质的浓度降至通常水平的一半以下。其他蛋白质的水平增加了一倍以上,包括疼痛传递蛋白CGRP,这是偏头痛药物的一个靶点。
研究人员还发现了围绕三叉神经节的保护层中一个以前未知的间隙,允许脑脊液涌入这些神经细胞。因此,他们测试了具有不同蛋白质浓度的脊髓液是否会激活对照组小鼠的三叉神经。
在CSD后不久收集的液体增加了三叉神经细胞的活动——表明头痛可能由这些被激活的细胞发送的疼痛信号触发。但在CSD后2.5小时收集的液体没有同样的效果。
内德加德说:“脑脊液中释放的物质被降解了。所以,这是一个短暂的现象。”
伦敦国王学院的神经科学家菲利普·霍兰说:“这确实展示了大脑变化如何影响外围的一种很好的潜在相互作用。这两个神经系统组成部分之间可能存在交叉对话,我们应该更加意识到这一点。”
杜索尔建议未来的研究应该探索为什么触及三叉神经节的脊髓液中的蛋白质会导致头痛而不是其他类型的疼痛。“这将在该领域提出许多有趣的问题,并且可能成为许多新研究项目的来源。”
《科学》介绍
偏头痛的疼痛被认为源于偏头痛先兆阶段(1)相关的皮层扩散性抑郁(CSD)后,疼痛受体(伤害感受器)的激活。先前的研究已经证明,临床前CSD事件通过脑脊液(CSF)释放小分子,这些小分子激活并敏化了脑膜内的传入三叉神经纤维(2, 3)。然而,人们一直认为三叉神经节位于血脑屏障“之外”,因此并未直接暴露于CSF中(4)。在本期刊的第80页上,Rasmussen等人(5)在一种小鼠偏头痛模型中展示了,CSD发生后,蛛网膜下腔CSF携带来自皮质的信号直接到达三叉神经节中的细胞体,在那里它们通过绕过脑膜三叉神经传入通路的途径激活伤害感受器。证明了三叉神经节位于血脑屏障内,以及识别出连接先兆和头痛的信号,可能会为预防和治疗偏头痛提供新的途径。
通过结合蛋白质组学、组织学、成像和功能方法,Rasmussen等人使用一种经典偏头痛的小鼠模型展示了CSD导致蛛网膜下腔CSF内容的变化,包括与偏头痛联系紧密的降钙素基因相关肽(CGRP)水平的升高(6)。相应地,CSD条件下的CSF可以引起三叉神经节神经元的激活。他们还发现,由于缺乏紧密的神经屏障,CSF可以进入三叉神经节的近端区域。这些发现一起提供了一种新的机制,通过一个颅内体液途径将中枢神经系统和外周神经系统联系起来,从而反过来调节三叉神经节内的神经元、胶质细胞和免疫细胞之间的神经化学交流(7)(见图)。
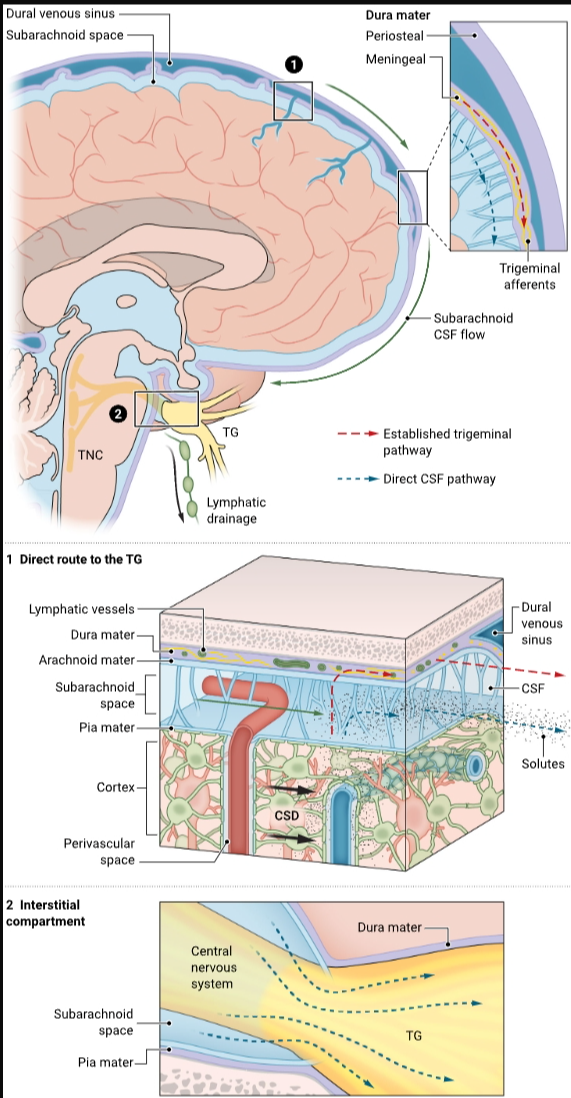
Rasmussen等人描述的从中枢神经系统(CNS)到三叉神经节的体液途径在CSD后与早已确立的脑膜途径在几个方面有所不同(1, 2)。最值得注意的是,在小鼠中,这两条途径似乎具有不同的动力学特性,皮质间质溶质向颅底三叉神经节的移动比向脑膜三叉神经传入部位的移动更快。然而,这一发现应谨慎解读,因为在人类和小鼠大脑中这种通信所经过的解剖距离差异很大,而且成像研究表明,人类大脑中的淋巴性CSF和溶质运输明显慢于啮齿动物大脑(8)。尽管如此,通过直接CSF介导的和经典的三叉神经传入途径的通讯很可能同时发生,并有助于伴有先兆的偏头痛中外周敏化的发生。这些观察的一个关键含义是,应当将三叉神经节以及脑膜视为用于减轻皮质启动病理状态的外周限制药物的目标。
Rasmussen等人的研究为理解颅骨液体和溶质运输提供了重要的新见解。就在十多年前,通过胶质淋巴系统进行的血管周围液体和溶质运输在清除大脑废物方面的作用开始得到定义(9)。对嵌入包围大脑和脊髓的厚膜(硬脑膜)内的功能淋巴管的表征,这些淋巴管有助于从大脑清除溶质,重新定义了长期以来认为大脑缺乏淋巴管的普遍看法(10)。实际上,最近的研究表明,CGRP在偏头痛中的重要性通过一项研究得以说明,该研究展示了CGRP在小鼠偏头痛模型中促进淋巴管与免疫细胞之间的相互作用并减少CSF流出(11)。
随着Rasmussen等人的研究,修正的过程仍在继续,该研究描述了一种迄今为止未被充分认识的基于CSF的通讯途径,连接了CNS和三叉神经节。多年来,人们一直认为CSF通过神经鞘向外流动,但并不认为它会穿透神经节。作者的发现表明这种观点是错误的,并且神经节内CSF溶质转运和激活很可能具有功能性重要性。
Rasmussen等人研究的延伸之一是睡眠可能影响偏头痛相关溶质从蛛网膜下腔CSF和三叉神经节间质腔本身清除的速率。这将为睡眠中断与偏头痛之间的临床联系提供潜在的机械解释(12)。值得注意的是,睡眠中断是偏头痛的一个常见触发因素,而睡眠本身经常被报告为有效的偏头痛缓解方法。来自小鼠和人类研究的数据显示,胶质淋巴交换是一个睡眠活跃过程,睡眠期间从神经组织清除溶质的速度更快(13, 14)。同样,这种机制可能解释创伤性脑损伤、睡眠中断和创伤后头痛之间交织的临床关联。例如,重复CSD事件后,皮质CGRP升高通过体液运输到三叉神经节(15)可能有助于创伤后头痛症状的形成。睡眠活跃胶质淋巴功能在偏头痛和创伤后头痛发病机制中的潜在作用,非常适合在临床前研究中进行评估。
激活三叉神经神经元的两条途径
在偏头痛发作期间,三叉神经纤维被溶质激活。在已知的途径中,皮质扩散性抑郁(CSD)期间和之后从皮质释放的溶质进入蛛网膜下腔脑脊液(CSF),在那里它们敏化嵌入硬脑膜中的三叉神经痛觉传入神经。这导致三叉神经节(TG)神经元激活,并通过三叉神经尾核(TNC)传递信号,引起与偏头痛相关的疼痛(红色虚线箭头)。在新报道的途径中,释放的溶质直接通过CSF到达TG(1)。然后,溶质进入TG间质间隙(2),以引发TG激活和偏头痛疼痛(蓝色虚线箭头)。
最后,由于其最初的特征描述(9, 13),胶质淋巴系统主要被描述为大脑的“废物清除系统”,工作集中在清除与阿尔茨海默病相关的病理蛋白上。然而,从根本上说,胶质淋巴功能反映了围绕CNS间质间隙和CSF内及之间的液体溶质交换的生物学。Rasmussen等人的研究进一步阐述了这一主题,展示了胶质淋巴交换在颅内远距离中心之间的体液通讯中之前未知的作用。尽管这项工作提供了迄今为止关于胶质淋巴系统在偏头痛中作用的一些最有力的数据,但关于大脑中液体和溶质运输仍有许多待发现之处。也许,理解胶质淋巴功能及其功能障碍在广泛的神经和精神疾病中所扮演角色的旅程才刚刚开始。
https://blog.sciencenet.cn/blog-41174-1441222.html
上一篇:人造红细胞!解决输血问题的理想技术
下一篇:偏头痛原因是脑子有病