博文
产氢力约等于年轻态【20章】
||
第20章 产氢力意味着年轻态
本研究来自俄罗斯,通过比较两种不同来源的动物内源性产氢气和产甲烷的不同,分析了两种动物在服用难消化碳水化合物后氢气和甲烷的产生差异,结果发现,高氢气动物能产生更多氢气,产甲烷动物产生更多甲烷。
这一研究结果中,高氢气组动物的特点更符合年轻人的特点,而高甲烷组动物更接近老年人的特点。这一现象如果在人类确实如此,具有非常重要的价值。首先,研究说明肠道菌群产生氢气的能力和年龄相关,年龄越大产氢气能力越低,产甲烷能力越高。虽然甲烷和氢气都发现具有抗氧化能力,但是对于肠道蠕动的作用是完全不同,氢气促进肠道蠕动,而甲烷则抑制肠道蠕动。所以,对于益生元来说,老年人因为会产生更多甲烷,其作用就比较有限。服用氢水则不存在这种影响,老年人促进肠道蠕动的效果会更好。其次,氢气产生能力可和年龄负相关,当然存在个体差异,或者说产氢气能力强的更年轻或更年轻化。对一些内源性产氢气能力不足的老年人来说,为年轻化补充氢气更有价值。这些看法目前仍然存在主观因素,需要更多研究证据。
为了验证低甲烷和高甲烷产生者对不可消化碳水化合物的反应是否不同的假设,进行了一项研究。在之前的研究中,我们发现Puschino繁殖场(SPF状态)的Wistar大鼠是低甲烷产生者,而Stolbovaya繁殖场的常规大鼠是高甲烷产生者。在每个繁殖场的25只大鼠中,评估了氢气和甲烷呼吸测试以及肠道菌群的分类内容。使用仅鼻部装置从清醒的大鼠那里采集呼出的空气样本,并通过气相色谱法进行分析。每只大鼠的肠道菌群分类内容通过16S rRNA方法进行评估。乳果糖、瓜尔胶和菊粉以每周时间间隔通过灌胃法给予每只大鼠。在碳水化合物给药后的8小时内测量呼出空气样本中的氢气和甲烷水平。不同组之间的分类微生物组构成差异很大。低甲烷产生大鼠具有较低的α和β多样性,Christensenellaceae和Akkermansia细菌丰度较高,Helicobacteraceae丰度较低,且没有Methanobacteriaceae,这与新生儿和儿童的微生物组相似。高甲烷产生大鼠(来自Stobovaya繁殖场)的微生物菌群多样性要高得多,像Helicobacteraceae和Methanobacteriaceae这样的耗氢微生物丰度更高,接近老年人的微生物组成。低甲烷产生大鼠灌胃碳水化合物后,只有呼出空气中的氢气水平增加,而相同的碳水化合物只在甲烷水平上引起增加。我们推测,外源性氢气(富含氢气的水)的给药将更有效地提高老年人的抗氧化防御能力,因为食用食物纤维并不会导致血液中氢气水平的增加。
介绍
在科学界广泛讨论了肠道菌群不仅参与胃肠疾病的发病机制——克罗恩病、肠易激综合症、腹泻等,还涉及肥胖症[1]、动脉粥样硬化[2]、2型糖尿病[3]、心力衰竭[4]、动脉性高血压[5]等疾病的发展中。宏基因组学研究可以检测到肠道微生物组中的大量微生物,但它们不能评估每个检测到的微生物或其群体和群落的功能或代谢特征。代谢组学研究,即由菌群产生的低分子量生物标志物的研究,吸引了科学界的大量关注。这样的生物标志物包括气体,如氢气、甲烷、硫化氢,以及短链脂肪酸(SCFA)和其他低分子量挥发性物质[6]。已经表明,氢气是由肠道菌群专门产生的,而不是宿主的体细胞[7, 8]。长时间以来,生物甲烷的形成被认为是只有产甲烷古菌才能产生的。然而,近年来在体外实验中表明,在缺氧条件下,人类细胞系也能产生甲烷[9]。几乎70%列入人体微生物组项目胃肠道(HMP GI)参考基因组数据库的微生物物种编码了氢化酶,这对于展示产氢(产生氢气)或耗氢(消耗氢气)活性是必需的[10]。检查胃肠道中氢气产生的最初测试之一是乳果糖呼吸测试。乳果糖是人类不消化的碳水化合物。当给予人类或啮齿类动物时,乳果糖将穿过肠道,直到到达能够消化该底物的肠道菌群库。作为发酵的副产物,产生了氢气。氢气(以及其他肠道产生的气体)进入血液,循环,扩散到肺泡空间,并在呼吸中呼出[11]。
根据对正常受试者的研究,屁的主要成分包括:氢气(3-20%)、二氧化碳(9-14%)、甲烷(7.2%)、氧气(2-4%)和硫化氢(0.00028%)[12, 13]。肠道微生物群中的古菌会代谢氢气。两种主要的甲烷产生物种——Methanobrevibacter smithii和Methanosphaera stadtmanae在人类结肠中是主要产甲烷菌。它们的数量沿着结肠增加,直到在直肠达到最大值。Methanobrevibacter smithii利用氢气将二氧化碳还原为甲烷,而Methanosphaera stadtmanae利用氢气将甲醇还原为甲烷。合成一分子甲烷需要四个氢分子和一个二氧化碳分子:CO2 + 4H2 → CH4 + 2H2O [14, 15]。
直到2007年,氢气(氢气)被认为是生理上惰性的气体。太田成男教授及其同事在《自然》杂志上发表了关键性文章,证明了氢气的抗氧化活性[16]。在过去的二十年里,来自临床前和临床研究的积累证据表明,氢气可能作为一种抗氧化剂,对包括代谢性疾病在内的各种疾病发挥治疗和预防作用[17]。此外,获得的证据显示,氢气影响信号通路,通过这些通路信息传递穿过细胞膜,并且还具有细胞保护作用,减少促炎细胞因子的合成和细胞凋亡。随后进行的临床试验在很大程度上证实了之前在动物身上实验研究的结果,从而确认了氢气的心脏保护和神经保护效果,以及对内皮功能障碍的积极影响[18, 19]。
一方面,氢气积极效应的发现导致了研究外源性氢气效应的研究数量增加;另一方面,也重新激发了对肠道微生物群产生的内源性氢气效应分析的兴趣。
几项研究表明,健康个体可以根据碳水化合物引发的氢气和甲烷产量被分为三个条件亚组。第一组在乳果糖给药后呼出的空气中氢气和甲烷水平较低。第二组,甲烷阳性,甲烷增加而氢气几乎没有增加。第三组只观察到氢气水平的增加[20, 21]。使用不同结构的不可消化膳食纤维作为益生元是一种安全有效的方法,可以改善微生物群的功能状态,因为它们是产生氢气微生物的主要底物[22,23,24]。
因此,我们的研究旨在调查是否可以通过使用不同的不可消化碳水化合物来增加低产甲烷和高产甲烷大鼠的内源性氢气产量,从而提高机体的抗氧化防御能力。
材料和方法
实验动物
根据欧洲议会和欧洲联盟理事会关于保护用于科学目的动物的2010/63/EU指令,对动物的饲养和所有操作均按规定执行。实验方案已由莫斯科国立大学伦理委员会批准(申请编号129-Zh,日期为2021年5月31日)。动物来自两个不同的养殖场。第一批,25只大鼠——来自“普希诺”实验室动物养殖场(生物有机化学科学研究所,莫斯科地区)。根据证书,Wistar大鼠具有SPF状态。第二批,25只大鼠——来自实验室动物分部“斯托尔博瓦亚”(俄罗斯联邦医疗生物学局,莫斯科区)。这些大鼠符合遗传标准,这一点通过质量证书得到了确认。
动物到达后立即被放置在动物房内,检查是否有伤口、疼痛和/或不适的迹象,并被安置在T3笼中,每笼2只大鼠。动物在标准条件下饲养,光照时间为12小时,可无限量获取水和食物,并且定期控制室内温度和湿度。适应动物房条件的时间至少为7天。为了最佳实施实验操作并避免压力对研究结果的影响,所有动物都经过了处理程序。
胃内给药
所有调查物质均通过灌胃法使用无菌胃内管(尺寸16,适用于200-300克重的大鼠)给药。对于每个动物组,“普希诺”和“斯托尔博瓦亚”,都使用了单独的胃内管,以尽量减少微生物群在组间的转移。
用于氢气/甲烷呼气试验的饮食化合物
乳果糖(Fresenius Kabi IPSUM S.r.l.,意大利)。乳果糖(2克/公斤体重,通过灌胃)是一种二糖,由半乳糖和果糖残基组成。
PHGG(部分水解瓜尔胶,4克/公斤,Optifiber ®,雀巢健康科学,德国)。其主要成分是刺梧桐果实提取物,即瓜尔胶。化学结构是100%瓜尔半乳甘露聚糖,由甘露糖和半乳糖以大约2:1的比例组成。
菊粉(蛋白公司,俄罗斯)。菊粉是一种D-果糖的聚合物,由30-35个呋喃糖形式的果糖残基组成。菊粉以4克/公斤剂量给药。
给药物质的重量是根据动物的体重计算的。所有物质在给药前都溶解在2-3毫升纯净水中。每种类型的不可消化碳水化合物都在两组的每只大鼠上进行了测试。每只大鼠的连续测量时间间隔为一周,以排除先前测试的影响。
呼出气体样品采集实验设计
实验装置采用了生命支持系统的改进版本,用于氢气的定量收集[25],但我们没有将大鼠放置在密封的动物室中,而是使用了一种带有Allay™约束领的Rat Breathalyzer系统[26]的版本,以便于采集呼出气体样本,测量氢气和甲烷的水平[27](见图20.1)。在本研究中,Allay™约束领与通风的仅限鼻子的腔室结合使用。该装置是由合著者之一(Bondarenko G.)构建的。
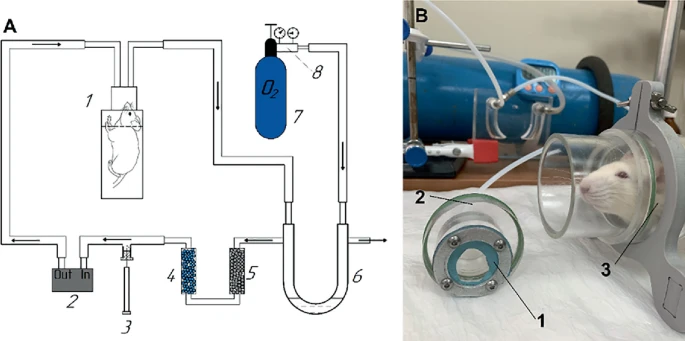
图20.1实验装置示意图,用于收集实验中全部空气样本。1—气瓶箱,2—空气泵,3—玻璃注射器,4—吸湿剂(水凝胶),5—二氧化碳吸收剂(苏打石灰),6—压力计,7—氧气瓶,8—气体减压阀;B 动物笼的照片:1—两个腔室分隔平面上的橡胶膜孔,2—动物头部放置腔室,用于动物重复呼吸,3—动物身体放置腔室,用于固定动物的颈部区域
气体实验装置由三个关键部分组成——气瓶箱、生命支持系统和循环通风系统。动物的头部用颈部塑料夹固定,仅从上方和侧面紧密贴合颈部区域,这允许动物自由呼吸。大鼠的鼻子位于一个特殊的头部隔间内,周围紧密贴合橡胶膜。这样,装置的密封性得到保证,呼出的空气在系统内部循环,不会逸出。头部隔间内有输入和输出连接器。
通过过滤器循环的呼出空气被清除了水分和二氧化碳。氧气水平维持在20-21%。这样,氢气和甲烷的积累就发生了,这对于测量气体装置系统中的气体浓度是必要的。进气通过密封阀进行,使用特殊的气密型Hamilton注射器进行气相色谱分析。我们系统的优势在于,我们能够收集到未受胀气干扰的仅呼出的空气,这使我们的系统类似于人类呼吸测试中的采样空气。
首次空气样本是在动物禁食12小时后采集的,当时大鼠可以自由饮水。然后,将动物从笼子中取出,并通过灌胃法给予特定碳水化合物溶液。在每只大鼠中,呼出空气样本共收集五次:基线、碳水化合物给药后2、4、6和8小时。每次采样后,大鼠被送回其笼中,直到下一个时间点。为了排除不同难消化碳水化合物在肠道微生物群中的交叉作用,大鼠在用另一种难消化碳水化合物进行测量前,会在标准饮食中保持几天。
样本分析
在气体色谱仪(TRILyzer mBA-3000,日本)上进行了呼出空气中氢气、甲烷和一氧化碳的测定,使用含有低浓度(空气中氢气、甲烷和一氧化碳,每种5ppm)和高浓度(氢气、甲烷和一氧化碳—空气中每种50ppm)的气体进行校准。
绘制了氢气和甲烷的浓度-时间曲线,并计算了AUC 0-8小时曲线下的面积(ppm*h),这反映了实验8小时内气体生成的速率。
粪便样本收集
粪便样本收集在单个Eppendorf管中。Eppendorf管立即盖上盖子,标记并冷冻在-80°C。对于每只动物,一次取两个粪便样本。取样是在呼吸测试前夕进行的。
微生物群落组成分析
使用QIAampPowerFecal Pro DNA Kit(Qiagen,Hilden,德国)按照制造商的说明从粪便中分离DNA。通过荧光计(Thermo Fisher Scientific,MA,美国)评估DNA的数量和浓度。使用1-2 ng的DNA进行文库准备。使用引物515F [28]和Pro-mod-805R [29]通过两步PCR制备16S rRNA V4高变区扩增子文库。
每个DNA样本的PCR都是根据之前的协议[30]进行的。在Veriti热循环仪(Applied Biosystems,MA,美国)上进行扩增。得到的文库在琼脂糖凝胶上检查并等摩尔混合。最终混合物使用QIAquick Gel Extraction Kit(Qiagen,德国)按照制造商的协议纯化。
使用个人测序系统(Illumina,San Diego,CA,美国)进行测序,2×156bp配对末端。
统计学分析
实验结果的统计分析和随机分组是使用GraphPad Prism 8软件完成的。使用Shapiro-Wilk标准检验分布的正态性。对于频率超过3个测量点以上的呼吸测试结果,采用曲线下面积(AUC)计算进行比较。使用单因素单方向方差分析(ANOVA)比较多于两个样本中单个指数的平均值。为了确定组别和暴露持续时间的同时效应,以及这些因素之间的相互作用,使用双因素ANOVA方差分析来识别组间差异,通过配对和非配对t检验分别分析相关样本和独立样本。对于非正态分布的组间成对比较,使用Wilcoxon检验分析相关样本,Mann-Whitney检验分析独立样本。使用Spearman等级相关系数计算相关性。使用ROUT标准排除统计异常值,Q值不超过1%。在p < 0.05时,认为差异具有统计学意义。所有数据以均值±标准差(Mean±SD)呈现。微生物群落组成、alpha和beta多样性指标和统计使用R(版本4.2.0)进行分析。高质量读取对使用DADA2管道[29]处理,根据已发布的协议[31]执行。使用Silva138数据库[32],通过朴素贝叶斯分类器确定扩增序列变体(ASVs)的分类。为了进一步分析,使用Phyloseq包[33]对读取进行稀薄化处理。获得的ASV参考序列、样本元数据、丰度表和分类导入到Phyloseq包中,所有后续操作都在Phyloseq对象上执行。使用microeco包(基于距离矩阵的多变量方差分析)[34]和vegan包[35]进行微生物群落组成的可视化。
结果
不同结构单一碳水化合物负载(乳果糖、菊粉、PHGG纤维)对大鼠呼出气中气体标记物(氢气和甲烷)含量的影响
在“Puschino”实验组中,使用乳果糖溶液和PHGG纤维时,氢气和甲烷水平有显著差异,p < 0.0001和p = 0.001,分别(图20.2a)。在菊粉组中,氢气和甲烷的水平大致相同(约35-40 ppm*h),差异不显著,p = 0.6(图20.2a)。在“Stolbovaya”实验组中比较氢气和甲烷水平时,所有实验组中气体代谢物水平的差异均达到高度显著性,p < 0.0001(图20.2b)。平均而言,所有实验组中甲烷水平比氢气水平高出12倍,氢气的总平均水平为25 ± 8 ppm*h(乳果糖35 ± 23 ppm*h,PHGG 18 ± 13 ppm*h,菊粉22 ± 13 ppm*h),甲烷的平均水平为320 ± 38 ppm*h(乳果糖334 ± 122 ppm*h,PHGG 276 ± 134 ppm*h,菊粉350 ± 156 ppm*h)(图20.2b)。

图20.2 显示了在“Puschino”组和“Stolbovaya”组的大鼠中,单次灌胃不同结构非消化性碳水化合物(乳果糖、PHGG和菊粉)后呼出气中氢气和甲烷的比较。
当比较最初具有不同氢气产生活性微生物群的大鼠时,发现这些大鼠对某些碳水化合物的氢气反应不同。因此,在“Puschino”组的大鼠中,与“Stolbovaya”组的大鼠相比,乳果糖和PHGG组中氢气产生的显著增加分别为1.9倍和2.7倍,p < 0.0001(图20.3a)。对于最初具有高氢潜力的大鼠来说,菊粉的反应比“Stolbovaya”组的大鼠高出1.4倍,但这个差异没有统计学意义,p = 0.2(图20.3a)。
对于最初具有不同甲烷生成活性基线的大鼠组,单次灌胃非消化性碳水化合物的甲烷反应也有所不同。在“Stolbovaya”组中,与“Puschino”组的大鼠相比,单次应用非消化性碳水化合物后的甲烷水平高出11.5倍或更多(使用乳果糖高出12倍,PHGG高出11.5倍,菊粉高出14倍),p < 0.0001(图20.3b)。
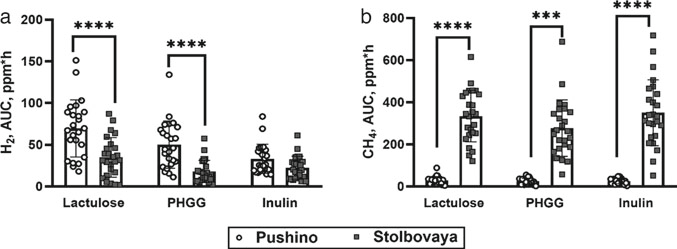
图20.3 比较了“Puschino”和“Stolbovaya”组的大鼠在单次灌胃不同非消化性碳水化合物后呼出气中的a 氢气和b 甲烷水平。
所有最初具有基础氢潜力且没有明显甲烷生成活性的“Puschino”组大鼠,对所有类型额外饮食化合物的单次应用都有氢气反应(图20.4)。氢气产生的增加按以下顺序:菊粉 → PHGG → 乳果糖。记录到的最大氢气产生是在注射乳果糖的情况下。所有组之间的差异均具有统计学意义,PHGG与菊粉组之间的显著性水平为p = 0.03,乳果糖与PHGG组之间为p = 0.009,乳果糖与菊粉组之间为p < 0.0001(图20.4a)。同时,在使用所有非消化性碳水化合物时,既没有记录到相对于“空腹”状态(零测量点)的甲烷水平的显著增加,也没有记录到呼出气中甲烷水平之间的组间差异,所有组之间的显著性水平p > 0.9(图20.4b)。
在“Stolbovaya”组的大鼠中,记录到了高的甲烷生成活性(图20.4b)和低的氢潜力(图20.4a)。当使用与“Puschino”组大鼠相同的非消化性碳水化合物时,大鼠的反应完全相反。在任何实验组中都没有记录到氢气的增加,而且氢气的基线水平也非常低,p > 0.9(图20.4a)。
对所有三个组的纤维应用的甲烷生成反应都很高,并且在PHGG → 乳果糖 → 菊粉系列中一致增加。只在PHGG和菊粉组之间发现了统计学上的显著差异,p = 0.03。乳果糖与PHGG组之间以及乳果糖与菊粉组之间的差异分别为p = 0.1和p = 0.9(图20.4b)。

图20.4 显示了在“Puschino”和“Stolbovaya”组的大鼠中,单次使用不同非消化性碳水化合物后呼出气中的a 氢气和b 甲烷水平比较。
肠道微生物群组成分析
在去复用和读取预处理之后,每个样本重复平均获得了19,201个读取对。经过DADA2处理步骤(额外过滤、去噪、合并和嵌合体移除)后,每个重复的平均读取计数为15,017。稀化分析显示所有测序样本都具有良好的饱和度,这表明测序深度足够。DADA2流程产生了1854个扩增序列变体(ASVs)。
微生物多样性分析
通过微生物组学包进行的alpha多样性指标分析显示,观察到的ASV数量,以及Shannon和逆向Simpson指数,在“Stolbovaya”组中显著高于“Puschino”组(p < 0.001)(图20.5A)。通过vegan包的adonis2函数使用Bray-Curtis距离进行的beta多样性分析显示,“Puschino”和“Stolbovaya”组的微生物群落彼此显著不同(10,000次置换;F1, 96 = 88.36,p = 0.001),这通过PCoA分析也得到了清晰的支持(图20.5B)。在1854个ASVs中,有717个是“Puschino”组特有的,843个是“Stolbovaya”组特有的,而294个ASVs在两个实验组中都被检测到(图20.5C)。
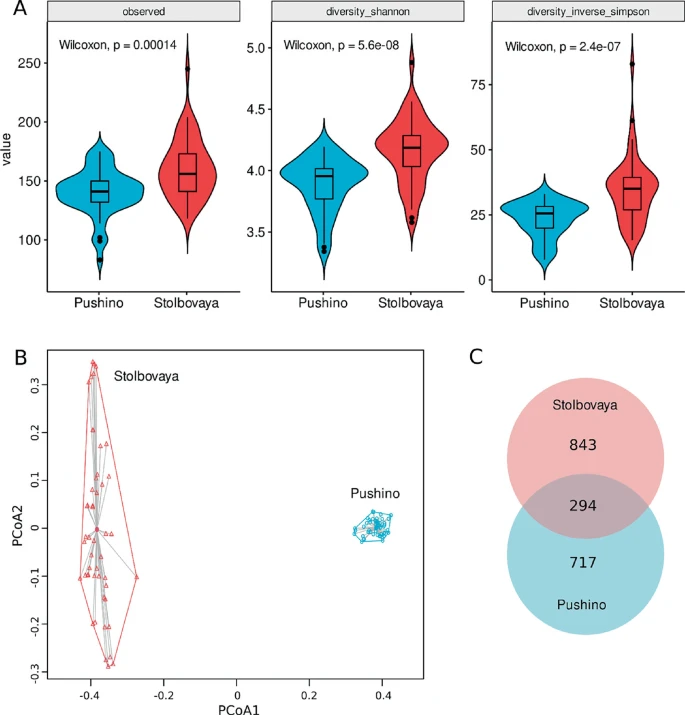
图20.5 实验组的多样性分析。A 是alpha多样性指标比较分析的可视化;B 是“Puschino”和“Stolbovaya”组大鼠群体中细菌群落的主坐标分析(PcoA);C 是在实验组中检测到的ASVs的维恩图。
微生物群落组成
在所有实验组中,大鼠肠道菌群的群落组成主要由厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)所主导。在来自“Stolbovaya”组的粪便样本中,Campylobacterota的数量显著,而在“Puschino”组中几乎未检出。在两个组中,拟杆菌目(Bacteroidia)和梭菌目(Clostridii)较为普遍。在目级别上,拟杆菌目(Bacteroidales)、螺旋体目(Oscillospirales)和Lachnospirales在两组中均占主导地位。在其他细菌目中,乳杆菌目(Lactobacillales)在“Stolbovaya”组中占优势,而梭菌UCG-014群(Clostridia UCG-014)在“Puschino”组中更为普遍。
肠道菌群气态代谢产物(氢气和甲烷)水平与分类组成的相关性分析
通过冗余分析和Pearson相关性分析(在microeco包中进行)来分析气态代谢物(氢气和甲烷)水平与微生物群落组成之间的相关性。结果表明,“Stolbovaya”组粪便样本中的微生物群落与甲烷水平相关,而“Puschino”组粪便样本中高氢气水平与微生物组成强烈相关(图20.6)。在细菌类群中,与氢气呈最强正相关的是拟杆菌属(Bacteroides)、Alistipes和Enterococcus,而甲烷水平与普雷沃氏菌属(Prevotella)、Prevotellaceae NK3B31群和Rickenellaceae RC9肠道群的代表呈正相关。

图20.6 相关性分析。RDA排序图展示了呼出气中气态代谢物(氢气和甲烷)水平与实验组中细菌属相对丰度之间的关系。
讨论
我们的研究显示,来自两个不同养殖场的大鼠在肠道菌群的分类组成和氢气与甲烷产生比例方面可能存在显著差异。
一组大鼠购自Puschino养殖场,具有SPF(无特定病原体)状态。这些大鼠的微生物群落多样性较低,通过微生物组进行的alpha多样性指标分析显示,Shannon和逆向Simpson指数与另一组(Stolbovaya)相比明显较低(p < 0.001)。两组研究中的微生物群落谱系差异很大。在Puschino组的1011个扩增序列变体(ASVs)中,只有294个与Stolbovaya组的1137个ASVs共有。
偶然发现两组大鼠之间存在的显著差异,可能模拟了人类中高氢组和高甲烷组的情况[20, 21, 36],为测试内源性氢气可用性可能取决于所摄取的不易消化碳水化合物的类型以及氢产生菌和甲烷产生菌的比例这一假设提供了基础。
我们的研究结果显示,在产氢大鼠组中,通过灌胃给予乳果糖、瓜尔胶或菊粉后,仅观察到纤维依赖性的氢气释放增加。相反,将相同的碳水化合物灌胃给高产甲烷大鼠(Stolbovaya养殖场)后,观察到呼出气中甲烷的增加,而非氢气。
据推测,肠道中的氢气主要由属于Firmicutes门的Ruminococcus spp.、Roseburia spp.、Clostridium spp.;属于Bacteroidetes门的Bacteroides spp.等细菌产生[10, 37]。此外,超过200种致病菌可以产生氢气[38]。饮食中包含不可消化的碳水化合物通常会导致肠道菌群产生的氢气增加[7, 10, 23, 37, 39]。
啮齿动物研究的结果揭示了不同群体实验大鼠的肠道菌群产生的氢气量在摄入相同膳食纤维的背景下存在显著差异。因此,第一组大鼠的门静脉血氢气浓度为1.54 μmol/l,而第二组为17.4 μmol/l。
将产氢气高的大鼠结肠菌群通过口服移植到第一组低氢气产生的动物中,导致门静脉中氢气浓度从3.07增加到9.95 μmol/l,以及属于Actinobacteria门的Bifidobacterium属、Firmicutes门的Allobaculum属和Bacteroidetes门的Parabacteroides属细菌数量的增加。同时,属于Bacteroidetes门的Bacteroides属、Firmicutes门的Ruminococcus属和Proteobacteria门的Escherichia属的水平降低[40]。
比较产氢气和产甲烷大鼠组之间的分类学差异表明,氢气产生者的菌群组成接近于新生儿和幼儿的菌群组成。氢气产生者的Christensenellaceae细菌丰度是已知的氢气产生领导者的几倍。
人类的年龄与Christensenellaceae和Christensenella的丰度呈负相关,表明年轻受试者携带更高相对丰度的Christensenellaceae和Christensenella[41]。Goodrich等人分析了416对双胞胎的肠道菌群,发现Christensenellaceae的丰度与低BMI相关,且将Christensenella minuta移植到无菌小鼠中可减少体重增加[42]。在产氢气的大鼠中发现了Akkermansia基因,但在产甲烷的大鼠中没有发现。Verrucomicrobia门的丰度和Akkermansia属Akkermansiaceae muciniphila在健康人类中约占90%,占粪便菌群的约1%至3%,并在生命第一年内定殖肠道。它的流行率可能会随着年龄的增长或疾病状态而降低[43]。
Akkermansia的基因组中含有丰富的氢化酶,如HypE、HypD、HypA、HypB、HypF、HypC、HybG和HupF,因此Akkermansia能够催化分解和利用氢气。因此,持续和充足的氢气供应可能促进这种细菌作为营养物质的传播[44]。Everard等人展示了A. muciniphila的相对丰度与葡萄糖代谢的有利效果相关联,而在肥胖和糖尿病小鼠及人类中减少[45]。
实验表明,产氢的大鼠体内的Helicobacteraceae细菌(包括Helicobacter pylori和Helicobacter ssp.)的数量比产甲烷的大鼠少四倍。Helicobacteraceae能够氧化氢气,导致肠道中氢的减少[38]。在产氢的大鼠组中,我们未能检测到Methanobacteriaceae的丰度(可能是它们的水平低于我们方法的检测限),但这些古菌在产甲烷的组中被发现。
因此,基于以下观察结果(低alpha和beta多样性、Christensenellaceae和Akkermansia细菌的高丰度、Helicobacteraceae的低丰度以及Methanobacteriaceae的缺失),我们可以假设高产氢的大鼠组可以作为年轻人类微生物群的模型。
无菌大鼠的实验为长久以来的观点提供了基础,即甲烷和氢气一样,完全由肠道微生物群产生[46]。一些研究得出结论,人类的细胞也能产生甲烷,但所有支持这一结论的证据都是在体外获得的,并且到目前为止还没有通过体内实验得到证实。基于这些数据,有人提出,除了微生物来源外,可能还有其他尚未确定的内源性甲烷产生的来源[47]。Methanobrevibacter smithii和Methanosphaera stadtmanae是人类结肠中主要的甲烷生产者。它们的数量沿着结肠增加,直到在直肠达到最大值[48]。Methanobrevibacter smithii利用氢气将二氧化碳还原为甲烷,而Methanosphaera stadtmanae则利用氢气将甲醇还原为甲烷[49, 50]。合成一个甲烷分子需要四个氢分子和一个二氧化碳分子:二氧化碳 + 4氢气 → 甲烷 + 2H2O。肠道微生物群中产甲烷菌的数量随着年龄的变化而变化。通常,新生儿的肠道微生物群不含有产甲烷菌[46],以及三岁以下的儿童[51]。随着年龄的增长,产甲烷的人类比例增加,80-90岁年龄组的比例达到40-77%[52, 53]。我们推测,高产甲烷的大鼠可以作为老年人微生物群的模型。
通过使用不可消化的碳水化合物乳果糖、瓜尔胶(化学结构为100%瓜尔豆半乳甘露聚糖,由曼诺糖和半乳糖以大约2:1的比例组成)和菊粉(D-果糖的聚合物)负荷的呼吸测试,仅在产氢大鼠中引发了不同数量的氢气增加。在给予乳果糖后,氢气反应的最大增加,尽管食物纤维(瓜尔胶和菊粉)的剂量是乳果糖的两倍,但是瓜尔胶和菊粉引起的氢气反应的幅度较低。Bond和Levitt在人类上的实验中也显示了类似的结果。这种个体碳水化合物在产氢效果上的差异已在体外[24, 54]和体内实验[22]中显示,并可以通过宿主微生物群的分类组成差异来解释。例如,半乳甘露聚糖主要由B. ovatus降解,而菊粉则由Bacteroides ovatus和Bacteroides caccae降解[55]。乳果糖最大的氢气刺激效果可以解释为其简单的结构(人造二糖,含有果糖和半乳糖),并且在人类粪便中筛选出35种能够利用乳果糖的物种[56]。
在产甲烷的大鼠组中观察到所有研究的碳水化合物的意外效果。给予任何一种三种研究的碳水化合物后,仅伴随着甲烷产量的增加。在人类研究中也展示了类似的结果[21, 23]。肠道微生物群产生的氢气可以被几种氢营养体消耗,如产甲烷的古菌、产生硫化氢的硫酸还原细菌和产醋菌[57]。不同种类的产甲烷古菌利用氢气与二氧化碳、甲醇或三甲胺(TMA)合成甲烷[10, 58]。由于合成甲烷需要氢气的存在,因此不能说产甲烷的人类或动物不产生氢气。我们假设,导致仅产生甲烷的碳水化合物负荷实验的结果可以通过存在高活性的氢营养体(本例中为甲烷菌)来解释,它们消耗了任何可用的氢气。Ruaud等人进行的优雅研究结果为我们的假设提供了强有力的支持,他们能够培养出这样的厌氧菌,如产氢的Christensenella和产甲烷的Methanobrevibacter。在单独培养时,Christensenella细菌产生氢气,而Methanobrevibacter古菌产生甲烷。当两种微生物在同一管中培养时,它们形成了紧密接触,称为团块,Christensenella产生的全部氢气被Methanobrevibacter消耗[41]。氢气产生菌(Bacteroides thetaiotaomicron)和氢营养体(Desulfovibrio vulgaris)产生硫化氢的配对也显示了类似的效果[59]。
为了评估肠道菌群的总体发酵能力,我们认为最佳方式是评估原始的、初级产生的氢气(氢气)总量,这些氢气可能随后通过肺部呼出,被不同的氢营养菌消耗。初级产生的氢气总量可以计算为呼出的氢气(单位为ppm)和呼出的甲烷(单位为ppm)的总和乘以4的系数。这种计算方法在之前的研究[60]中已被采用。我们假设这项研究的结果对于健康饮食建议以及提高机体的抗氧化能力具有重要意义。增加食物纤维的摄入是众所周知的建议,但如果肠道菌群的高产甲烷活性很高,这将是无效的。我们认为饮用富含氢的水将导致氢气在胃肠道上部被吸收,扩散到血液中,并通过门静脉系统到达肝脏,起到抗氧化剂的作用。
关于菌群发酵活性研究方法的简报。在临床研究中,用于诊断小肠细菌过度生长(SIBO)、吸收不良、不同碳水化合物的耐受性、口盲肠传输时间以及其他一些病状,氢气呼吸测试占主导地位。在大多数关于啮齿类动物(小鼠和大鼠)的实验研究中,动物被放置在密封的玻璃瓶或代谢笼中[25, 61,62,63,64]。
这种方法与人类的呼吸测试不同,因为在密封空间中偶尔排气(放屁)时,高浓度(以%计,而非像呼出空气中的ppm)的肠道气体会产生所研究气体浓度的峰值,从而增加了结果的离散度。在这项工作中,我们使用了一个改良的仅鼻系统结合Allay™约束项圈[26, 27]来简化呼吸测试程序,并仅收集大鼠呼出气中的氢气,这使得该方法接近人类的呼吸测试,并便于将实验结果与临床结果进行比较。
结论
不同食物纤维在增加内源性氢气释放方面的有效性取决于菌群中氢气产生菌和甲烷产生菌的丰度比。甲烷产生菌的呈现越高,食物纤维的氢气刺激效果就越低。由于随着年龄的增长,产甲烷菌的比例更高,我们推测对施用的食物纤维的积极反应会更低。我们认为,对于老年人群体来说,饮用富含氢的水或吸入氢气以提高机体的抗氧化保护将更为有效。
https://blog.sciencenet.cn/blog-41174-1427039.html
上一篇:AI如何帮助天气预报
下一篇:社交媒体宣传研究论文可以提高参与度,但不能提高引用率