博文
活性氧小体redoxosomes是关节软骨修复的关键信号
|
纤连蛋白 (FN) 片段刺激分解代谢信号转导,并通过与整合素结合,诱导软骨细胞增加基质金属蛋白酶(包括 MMP-13)的产生。在本期《科学信号传导》中,缪等人揭示了α5β1整合素对纤连蛋白片段的内化,但不是完整的纤连蛋白,导致产生ROS的内体(redoxosomes)的形成,软骨细胞通过产生更多的MMP-13来检测和响应受损的基质。
整合素是异源二聚体跨膜受体,将细胞外基质(ECM)与细胞骨架连接起来,并在各种组织和疾病背景下形成调节细胞迁移、增殖、分化以及基质重塑的胞内信号复合物。在变性类疾病中,蛋白酶过度产生是一种常见现象,可以通过整合素对ECM变化的反应来介导(1)。软骨细胞产生许多不同的整合素,它们与基质蛋白特异性相互作用,以维持细胞生存和稳态,但它们也能识别软骨降解过程中由过度蛋白水解活性产生的ECM蛋白质的生物活性片段,如胶原蛋白、蛋白聚糖和纤维粘连蛋白(FN)(2,3)。
在软骨细胞中,α5β1整合素作为机械感受器,介导对正常和异常软骨加载的反应(1)。作为主要的FN受体,α5β1整合素通过结合FN片段参与软骨降解,导致MMPs(如MMP-3和MMP-13)的产生增加。在软骨中,软骨细胞被含有完整FN的周细胞基质(PCM)包围。MMPs(如MT1-MMP、MMP-1、MMP-3和MMP-13)和其他蛋白酶可以响应机械扰动,在PCM内作用,可能降解FN为含有RGD三肽结合位点的多种大小的片段,该位点被α5β1整合素识别。由于骨关节炎或类风湿关节炎中缺乏可以清除积聚的软骨基质降解产物的巨噬细胞或其他类型的细胞,因此已经提出了一种由软骨细胞清除FN片段的替代机制。
整合素通过内吞体进行转运,为ECM片段引发的胞内信号提供了进一步的特异性(4)。MMP-14介导的FN降解促进内吞作用,作为各种类型细胞中去除受损基质的一种机制。在软骨细胞PCM中积累的基质片段的内吞可能是其有效去除的一种机制。然而,过度激活可能导致软骨细胞源性蛋白酶的增加,从而产生“正反馈循环”,导致骨关节炎的典型特征——广泛的软骨破坏。软骨细胞与FN片段的结合还通过需要活性氧物质(ROS)的机制增加细胞因子、趋化因子和其他降解或炎症介质的产生(5)。
在《科学信号》杂志上,缪等人(6)揭示了FN片段FN7–10而不是完整FN特异性激活α5β1整合素,导致NADPH氧化酶2(Nox2)组成的氧化还原活性早期内体(redoxosomes)的形成。这项研究描述了一种软骨细胞检测和响应受损基质的机制。在之前的工作中,该团队证明,用FN7–10处理软骨细胞会导致氧化事件,引起包括酪氨酸激酶Src中的半胱氨酸氧化在内的氧化还原敏感蛋白质的翻译后修饰,从而导致其持续激活,以及丝裂原活化蛋白激酶(MAPK)信号的刺激,这两者都增加了MMP-13的产生(7)。
在这项研究中,缪等人(6)比较了FN7–10和完整FN对原代人类关节软骨细胞中α5β1整合素转运和下游信号的影响。他们发现,完整FN刺激了α5β1整合素和FN的内吞作用,进入早期的Rab5+ 内体,稍后出现在Rab11+ 内体中,表明了一种将整合素循环到细胞膜的途径(图1)。相比之下,FN7–10片段诱导了活化的α5β1整合素-FN7–10复合物在内吞作用后的前2小时内早期内体易位,然后在2至4小时后,该复合物进入晚期Rab7+ 内体,这些内体能够与溶酶体融合进行降解(图1)。
缪等人(6)进一步发现,α5β1整合素与FN7–10的结合诱导了胞质ROS的产生,刺激了MAPK信号传导和MMP-13的产生。首先在质膜上产生过氧化氢,然后在细胞质中产生,并在包含α5β1整合素和Nox2作为过氧化氢来源的Rab5+ 氧化还原小体内产生,这也导致了Src的招募。总的来说,这些细胞内事件将驱动整合素信号朝向Src半胱氨酸巯基的氧化(5),从而导致Src的激活。在临床相关性方面,对患有骨关节炎的患者受损软骨的三维成像研究表明,与正常对照样本的正常软骨相比,软骨细胞中的Nox2和Src与Rab5+ 共定位增加。这些发现表明在软骨细胞中存在氧化还原小体,并与骨关节炎发病机制相关,从而支持体外实验的结果。对公开可得的RNA测序数据分析也支持整合素信号在氧化还原小体中在骨关节炎发病机制中的作用。
α5β1–FN7–10复合物向Rab7+ 晚期内体的转运代表了一种以前未知的去除基质片段的机制。这与完整的FN通过Rab11+ 内体循环回到质膜的过程形成对比。发现氢过氧化物的空间和时间定位与早期内体中Src的信号传导有关也是显著的,因为它提供了一种整合素刺激持续下游信号传导的机制。尽管这种机制在其他FN普遍存在的组织中具有更广泛的应用性,但软骨具有较差的固有修复能力,并且软骨细胞显示出有限的吞噬活性,这在关节炎条件下去除受损基质蛋白时构成了独特的挑战。这项工作还澄清了长期以来关于整合素和下游分解代谢和炎症反应的不同FN片段在骨关节炎中的调节方式的争议。此外,在原代人类软骨细胞培养中对这些机制进行的详细阐明得到了与在骨关节炎中基质损伤中的作用一致的支持。最后,这项工作表明氧化还原小体是其他疾病模型的药物靶点(8, 9),也是骨关节炎治疗的潜在靶点。
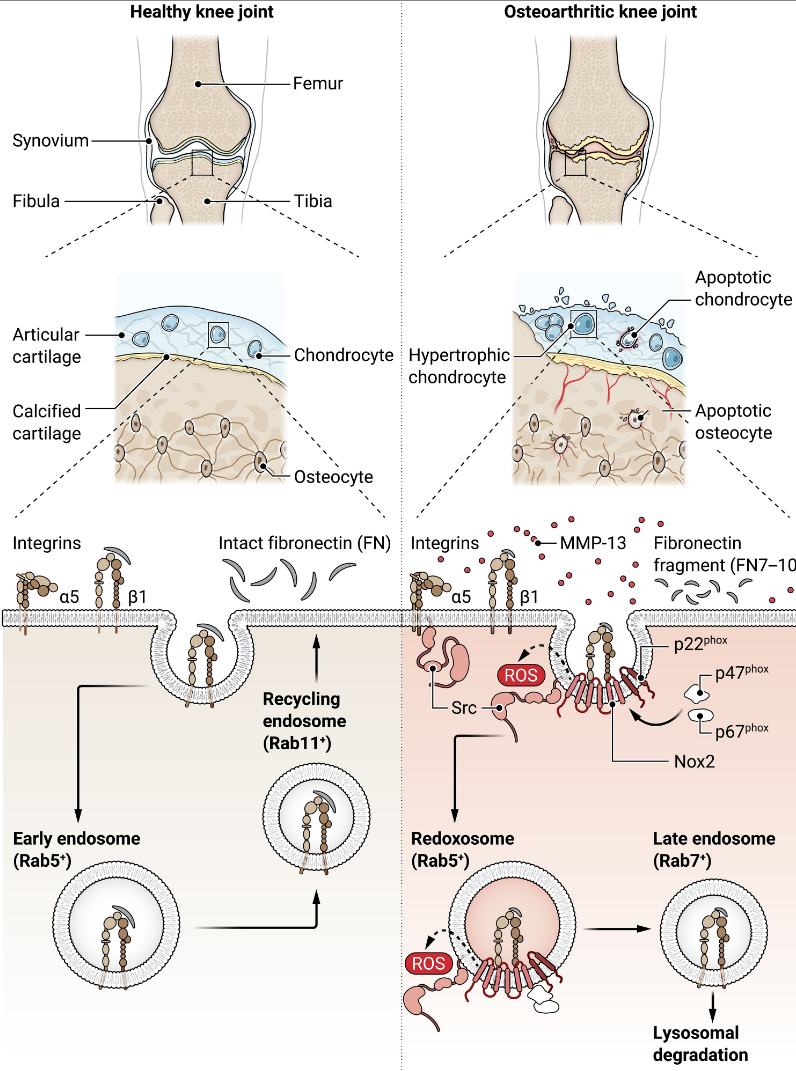
图1. 完整FN和骨关节炎软骨中蛋白水解切割产生的FN片段引起的α5β1整合素信号差异。
在健康的关节中,软骨细胞被包埋在厚厚的关节软骨层中,关节软骨层与骨之间由一层薄的钙化软骨隔开。完整的FN与α5β1整合素的结合导致复合物被内吞进入早期内体,成熟为Rab11+内体,这可能在正常、未受损的软骨中回收整合素和FN。骨关节炎关节的特征是关节软骨退化和受损,以及存在凋亡、肥大和簇集的软骨细胞。血管和神经从下方受损骨的微裂纹延伸到扩张的钙化软骨层。在骨关节炎软骨中,FN蛋白水解切割产物FN7-10与α5β1整合素的结合诱导了复合物的内吞作用,并通过招募和激活Nox2复合物亚基(Nox2、p22phox、p47phox和p67phox)形成氧化还原体。Src也被招募到这些氧化还原体中。Nox2产生的ROS激活Src,导致下游信号传导,诱导MMP-13的产生和分泌,促进额外的基质降解。氧化还原体维持细胞内信号传导,直到它们成熟为Rab7+晚期内体,这可能将整合素和FN7-10传递到溶酶体进行降解。
https://blog.sciencenet.cn/blog-41174-1408108.html
上一篇:学术开放出版Plan S的革命性倡议
下一篇:迷幻疗法正在加速获得批准,但没有人知道它们的具体作用机制