博文
干燥综合征患者氢疗案例【台湾】
||
氢气疗法用于干燥综合征患者案例【台湾】
氢气疗法在干燥综合征伴肺动脉高压和右侧心力衰竭中的应用
背景/目的:结缔组织病相关的肺动脉高压(CTD-PAH)是一种严重的并发症,其特征是肺动脉压力升高,如果不治疗,可能导致右心衰竭和死亡。标准治疗往往无法充分管理症状,突显了需要新的治疗方法。本研究调查了氢气(H2)疗法在一名CTD-PAH患者中的疗效。病例报告:我们报告了一例56岁的女性患者,她于2013年被诊断为干燥综合征,并伴有间质性肺疾病(ILD)和PAH。尽管接受了西地那非、波生坦、马昔替坦、伊洛前列素和皮质类固醇的治疗,她的病情在2020年恶化,导致严重呼吸困难和心脏休克。2023年5月,开始使用氢气作为辅助治疗。患者每天服用氢气胶囊,导致CD127+ Treg细胞增加,抗Ro抗体减少,B细胞亚群降低。她的临床症状稳定,没有不良反应。结论:这个病例突显了氢气疗法在CTD-PAH中的潜在益处。H2疗法表现出抗炎和免疫调节作用,导致免疫细胞概况改善,并在对传统治疗无反应的患者中稳定临床症状。需要进一步研究以阐明H2疗法的机制,并在更大的队列中验证其效果。氢气疗法作为一种安全的辅助治疗方法显示出前景,为管理这一具有挑战性的疾病提供了一种新方法。
结缔组织病相关的肺动脉高压(CTD-PAH)由于其复杂的发病机理和如果不治疗可能带来的生命威胁后果,在临床管理中提出了重大挑战。在各种涉及的结缔组织病(CTDs)中,干燥综合征被认为是CTD-PAH的一个显著贡献者。PAH的特点是肺动脉压力升高,如果不治疗,会增加右心衰竭和死亡的风险。CTD背景下PAH的发病机制涉及免疫介导的血管损伤、慢性炎症和纤维化的复杂相互作用。CTD-PAH的常见症状包括呼吸困难、疲劳、胸痛和晕厥,需要多学科的管理方法。当前针对CTD-PAH的治疗策略包括免疫抑制疗法和特定于PAH的治疗。免疫抑制疗法,包括皮质类固醇和改变病情抗风湿药(DMARDs),旨在控制炎症和管理基础CTD。特定于PAH的治疗,如内皮素受体拮抗剂(ERAs)、磷酸二酯酶类型5抑制剂(PDE5i)和前列环素类似物,针对肺动脉压力并缓解与PAH相关的症状。
在寻求创新治疗模式的过程中,氢气(H2)疗法因其独特的生物学特性而成为一种有前途的方法。氢气通过各种机制发挥作用,包括抗氧化、抗炎、抗凋亡和基因表达调控。重要的是,H2在治疗浓度下自然存在且无毒,适合长期使用。H2疗法的研究涵盖了多种医疗条件,包括中风、心肌缺血再灌注损伤、慢性肾病、糖尿病和慢性阻塞性肺病(COPD)。H2发挥其治疗效果的一个关键机制是通过激活转录因子核因子红细胞2相关因子2(Nrf2)。Nrf2因增强一系列抗应激酶(包括抗氧化酶)的转录而闻名。H2通过与羟基自由基(•OH)和血红素(PrP-Fe(II))的复杂相互作用激活Nrf2。最初,羟基自由基氧化血红素,形成PrP-Fe(III)-OH,随后与H2反应产生PrP-Fe(III)-H和水。PrP-Fe(III)-H复合物作为亲电体氧化Kelch样ECH结合蛋白1(Keap1),触发Nrf2的释放和活化。这条通路使H2能够间接通过激活Nrf2及其下游抗氧化应答来减轻氧化应激。
氢胶囊通过将氢气固定在主要由珊瑚外骨骼衍生的珊瑚钙表面而制成。这种方法确保了氢气的稳定传递,并表现出抗氧化特性(13,15)。一项研究评估了氢胶囊在代谢综合征患者中的安全性和降脂效果,表明其在降低血脂水平方面具有潜在益处(13)。在采用蛋氨酸和胆碱缺乏(MCD)饮食诱导的非酒精性脂肪性肝病(NAFLD)小鼠模型的实验中,发现氢胶囊能够减轻脂质积累和肝功能障碍。该研究还进一步强调了氢胶囊的抗氧化和抗炎作用(15)。氢胶囊在减少乙醇诱导的小鼠肝脏炎症和缓解酒精宿醉症状方面表现出有效性,包括降低促炎细胞因子(如TNF-α、IL-6和CCL2)的水平(16)。另一项研究观察到,在对一位患有肺炎并发的PF-ILD(肺纤维化合并间质性肺病)患者进行氢胶囊治疗后,其静息调节性T细胞水平显著升高,而Fas+辅助T细胞和细胞毒性T细胞亚型的数量则明显减少(17)。这些发现强调了氢胶囊的多种治疗潜力,包括抗氧化、抗炎和降脂特性,特别是在肝脏健康、肺部疾病和代谢综合征的背景下。
本文报道了一例56岁女性患者的案例研究,该患者被诊断为结缔组织病相关肺动脉高压(CTD-PAH),正在等待肺移植。尽管接受了标准治疗,但病情仍未缓解,因此开始采用氢气疗法作为辅助治疗(18,19)。
本研究已获得医院机构审查委员会(IRB)的批准,并遵循了相关指南(IRB编号:B202105106,批准日期:2023年7月18日)。所有患者均已签署书面知情同意书(编号:B202105106-24)。本研究遵循了本院的伦理标准以及《1964年赫尔辛基宣言》及其后续修正案或同等伦理标准。
详细病例报告内容
一名56岁女性患者因呼吸困难就诊,需要补充氧气。其病史可追溯至2013年7月,当时她因呼吸困难、咳嗽伴黄痰入住胸科病房。随后被诊断为干燥综合征(20)并发间质性肺病(ILD)(21)和肺动脉高压(PAH)(22)(见表I)。当时的胸部X光片显示血管纹理增粗、肋膈角变钝和心影增大(图1A)。超声心动图显示肺动脉(PA)收缩压为99 mmHg,右心房和右心室扩大,左心室(LV)呈D形,以及重度三尖瓣反流。胸部CT血管造影(CNYCT)未见充盈缺损,排除肺栓塞;同时显示肺动脉干、右心房(RA)和右心室(RV)扩大,进一步证实存在肺动脉高压(图1E和F)。患者出现口干、眼干和舌黏膜裂纹等症状,Schirmer试验显示双眼(OU)湿润长度<5 cm。小唾液腺活检阳性,核医学扫描显示唾液腺功能受损,抗Ro抗体阳性,确诊为干燥综合征(表I)(20)。她开始服用Revatio(西地那非)(图2),每日三次(TID),每次20 mg,以控制肺动脉高压,2016年因病情加重(7),加用Tracleer(波生坦)(图2)。2017年,右心导管插入术(RHC)显示平均肺动脉压(PAP)为39 mmHg,肺血管阻力(PVR)接近15 Woods单位,楔压为4 mmHg,提示为毛细血管前型、I组、结缔组织病相关肺动脉高压(23)。右心导管插入术(RHC)报告使其能够获得Opsumit(马昔腾坦)(图2)的保险赔付,每日一次(QD),每次10 mg,于2017年替换Tracleer(波生坦)。从2017年至2020年,她因需治疗基础疾病干燥综合征而多次住院接受类固醇治疗(6)。

表I.2013年8月22日,患者罹患间质性肺病(ILD)、干燥综合征以及肺动脉高压(PAH)伴心力衰竭(HF)。
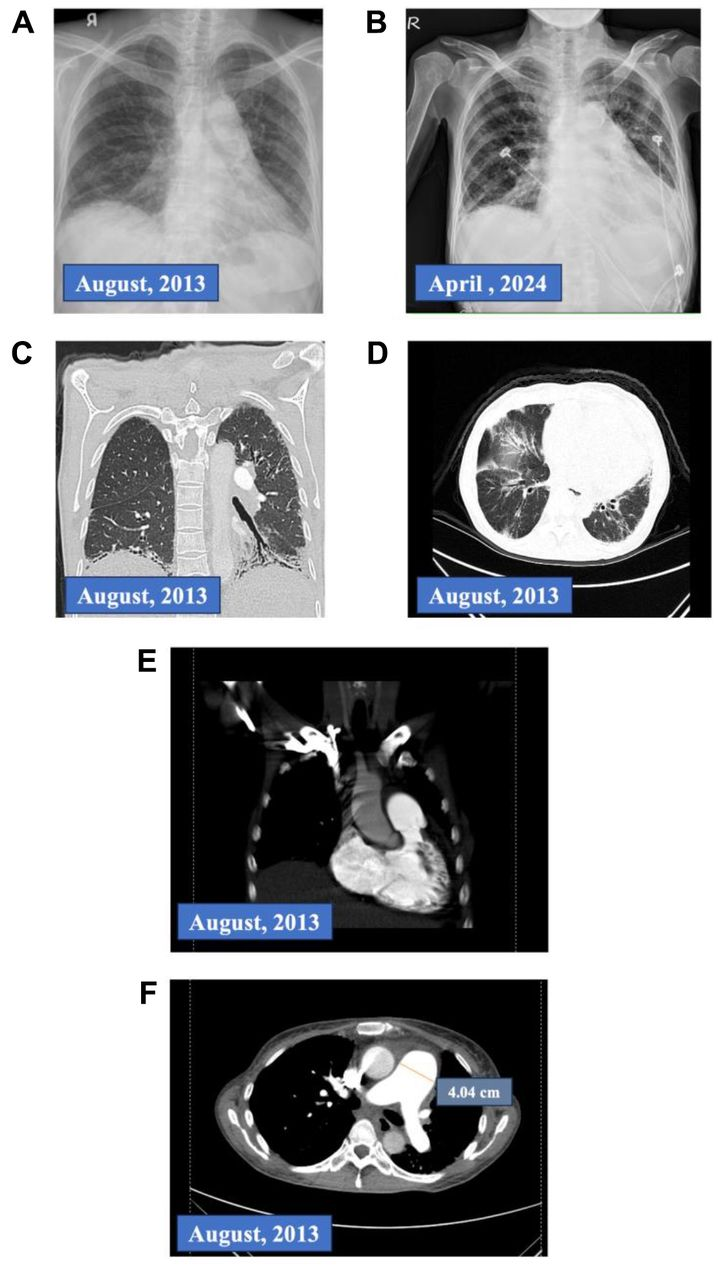
图1.患者临床病程。(A)2013年8月7日的胸部X光片(CXR),显示双侧肺野肺血管增多,间质线增厚。(B)2024年4月12日的胸部X光片,显示双侧肺部出现模糊阴影和支气管扩张,双侧肺底出现网状结构。(C和D)2013年8月拍摄的高分辨率计算机断层扫描(HRCT)图像,显示磨玻璃样模糊影和间质线增厚。2013年8月拍摄的增强胸部计算机断层扫描(CT)显示肺动脉干扩张至4.04 cm,以及右心房(RA)和右心室(RV)扩张。
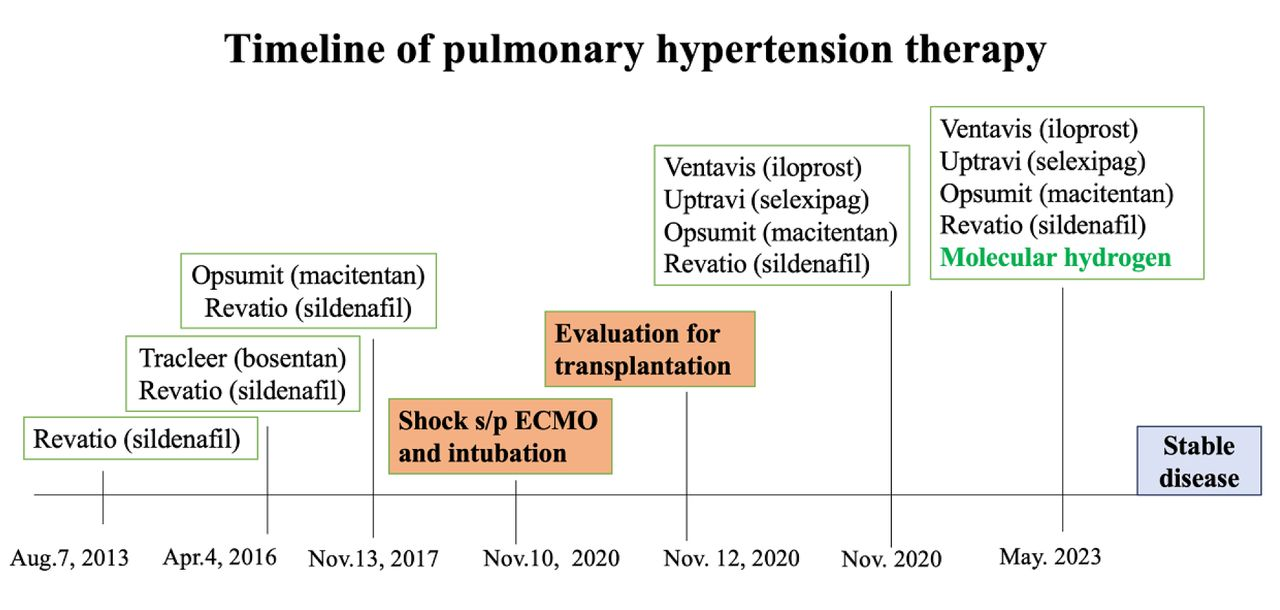
图2.肺动脉高压治疗的时间线。橙色方块表示评估肺移植和心源性休克后体外膜肺氧合(ECMO)及气管插管的时间。蓝色方块表示加用氢气作为辅助治疗后的病情稳定。绿色高亮部分表示加用氢气的时间。
肺动脉高压的治疗基于风险评估(24),直至2017年(图2),患者被认为处于低风险至中风险,通过两种药物(西地那非+马昔腾坦)进行控制。她的病情保持稳定,直至2020年10月,出现呼吸困难加重,伴有咳嗽和咳白痰,提示感染。2020年11月10日,患者出现严重呼吸困难、冷汗和发绀,血氧饱和度(SpO2)降至70%,需通过面罩给予100%氧气。血气分析和实验室检查显示,乳酸水平为5.2 mmol/L,脑钠肽(BNP)超过10,000 pg/mL,强烈提示心源性休克。患者被准备送入重症监护室(ICU),进行气管插管,并开始使用四种肺动脉高压药物(图2)。她的病情稳定并有所好转,避免了进一步恶化。2020年11月12日,开始评估心肺移植。她的病情持续改善,于2020年11月13日停用升压药,11月14日拔管,11月21日转入普通病房,氧气供应减至鼻导管2升/分钟。后续右心导管插入术检查仍显示肺动脉压力升高,这可能是由于长期高血压导致右心负担加重,最终导致衰竭。重症监护室(ICU)治疗后,她被转诊至大学医院评估心肺移植。
回顾患者发病以来的记录,可以明显看出肺动脉压力持续升高,6分钟步行测试的距离也逐渐缩短。目前,患者被归类为高风险,仍需定期住院以控制病情。尽管病情相对稳定,但住院期间她的主要诉求仍然是呼吸困难。体格检查发现,患者患有轻度ILD湿啰音和提示严重心脏瓣膜病的全收缩期杂音,未发现其他显著异常。2020年,加用万他维(伊洛前列素)(图2),剂量为10微克/毫升,每次2毫升。2023年5月,开始加用氢气疗法(每日1粒胶囊)(图2)。氢气胶囊(PURE HYDROGEN)购自和和生物科技有限公司(中国台湾省台北市)。每粒胶囊含有170毫克富氢珊瑚钙,其中包含1.7×10^21个氢分子,这相当于24杯每200毫升含1200 ppb氢(或0.6 mM氢)的水。加用氢胶囊辅助治疗后,患者体内CD127+ Treg细胞数量增加,抗Ro抗体减少,B细胞亚群减少(图3和图4),且临床症状和体征趋于稳定。服用氢胶囊后,未观察到不良反应或事件。采用流式细胞术和血清学检查进行全血分析,以评估氢疗法前后免疫细胞和自身抗体的变化。对于后续的流式细胞术全血分析,使用标准荧光染料制备方法和含干燥试剂的荧光抗体试剂盒(美国加利福尼亚州布里亚市贝克曼库尔特公司)制备血样。方法、步骤、免疫表型分析及细胞分群均按照先前描述的程序进行(17, 25, 26)。我们对氢疗法前后的免疫表型标志物进行分析,发现治疗后CD127+ Treg细胞数量增加,B细胞亚群减少(图3)。此外,本研究遵循CARE报告指南(2013年CARE清单)。
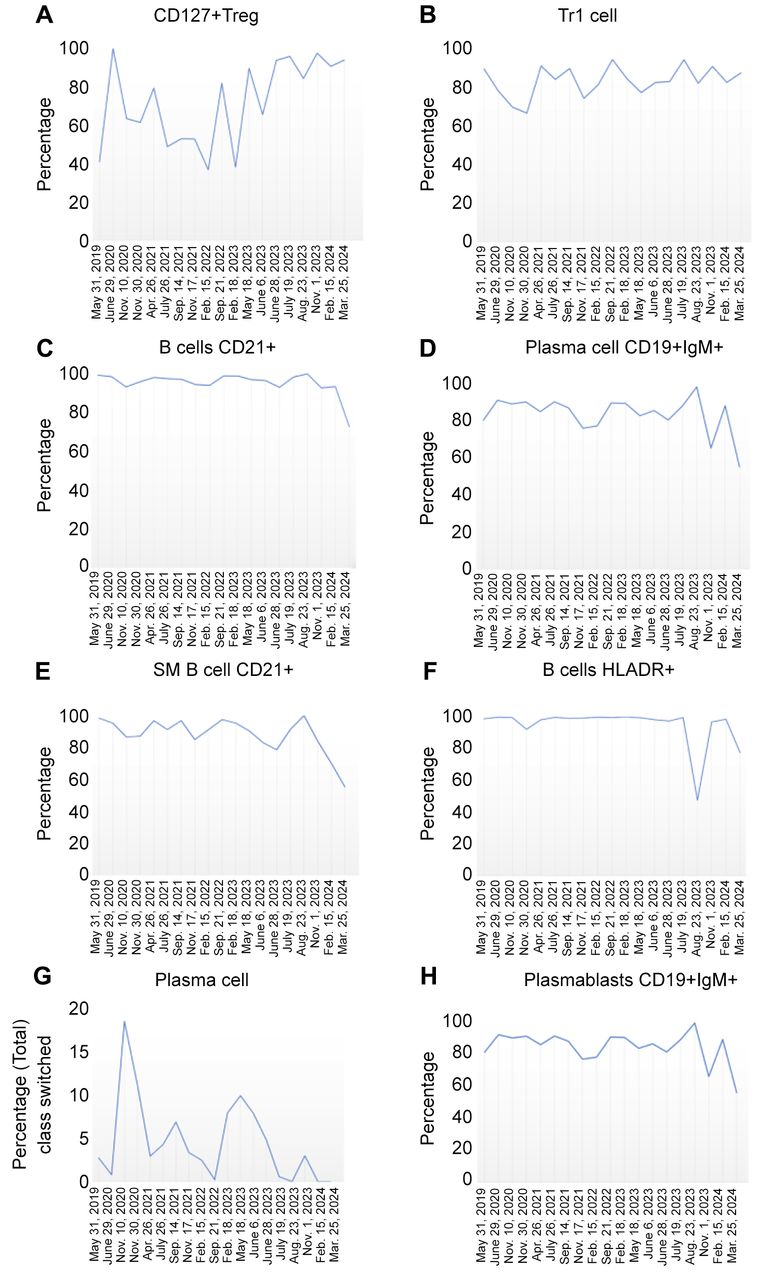
图3. 氢气疗法前后的免疫表型变化
进行了19次全血分析:氢气疗法前(截至2023年2月18日)和疗法后(从2023年5月18日至2024年3月25日)。
(A) CD127+Treg百分比变化,显示氢气疗法后呈上升趋势。
(B) Tr1细胞百分比变化,显示氢气疗法后呈上升趋势。
(C) B细胞CD21+百分比变化,显示氢气疗法后呈下降趋势。
(D) 浆细胞CD19+IgM+百分比变化,显示氢气疗法后呈下降趋势。
(E) 转换记忆B细胞CD21+百分比变化,显示氢气疗法后呈下降趋势。
(F) B细胞HLADR+百分比变化,显示氢气疗法后呈下降趋势。
(G) 浆细胞百分比变化,显示氢气疗法后呈下降趋势。
(H) 浆母细胞CD19+IgM+百分比变化,显示氢气疗法后呈下降趋势。
SM:转换记忆(Switch Memory)。
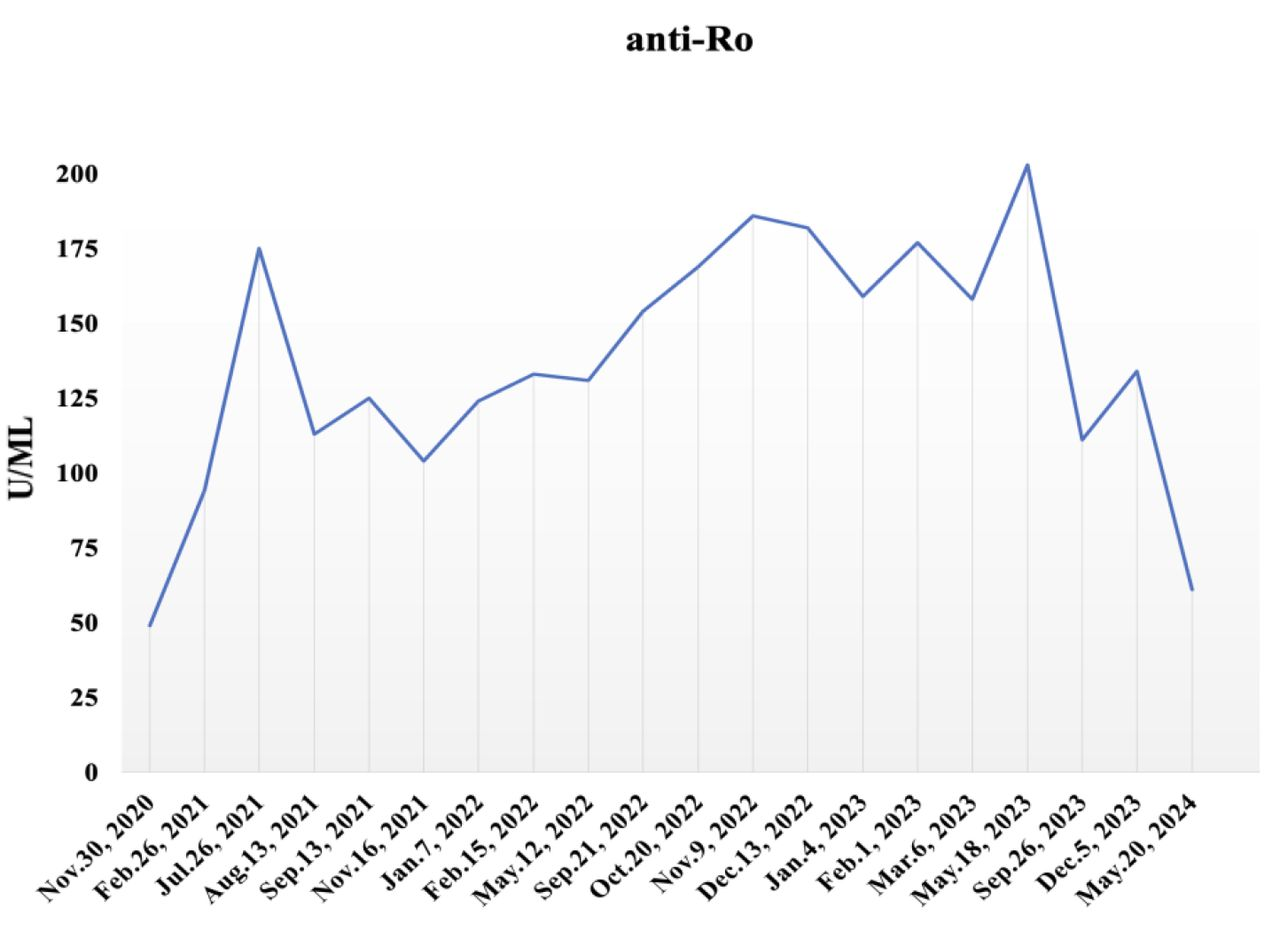
图4.氢气治疗前后抗Ro抗体的免疫表型变化。全血分析进行了二十次:氢气治疗前(截至2023年3月6日)和治疗后(从2023年5月18日至2024年5月20日)。氢气治疗后,抗Ro抗体显示出下降趋势。
讨论
本病例研究强调了迫切需要新型干预措施来治疗CTD-PAH病例。尽管经过约十年的不断增加的药物和非药物干预,如西地那非、司来帕格、马昔腾坦和伊洛前列素,症状持续未缓解,最终因心源性休克需要紧急处理(图2)。氢气治疗后观察到CD127+调节性T细胞(Treg)增加,提示可能具有免疫调节作用。CD127+ Treg细胞在免疫调节和耐受中发挥关键作用,其扩增可能有助于抑制CTD-PAH发病机制中涉及的过度免疫反应(27)。这一发现与先前突出氢气抗炎特性的研究一致(8)。氢气治疗后抗Ro抗体减少表明可能减轻了与CTD-PAH相关的自身免疫过程。抗Ro抗体经常在像干燥综合症这样的自身免疫疾病中被检测到(20),并且已与肺血管并发症相关联(28)。氢气调节自身免疫并减少抗体产生的能力强调了其作为管理CTD-PAH的新型治疗手段的潜力。B细胞亚群的减少表明通过氢气治疗调节了B细胞功能。失调的B细胞反应已被认为与自身免疫疾病和肺动脉高压的发病机制有关(29)。通过针对B细胞亚群,氢气可能有助于缓解异常免疫激活并防止CTD-PAH患者的进一步血管损伤(30)。总的来说,这项病例研究的发现支持了氢气在管理CTD-PAH中的潜在的治疗益处。通过其抗炎和免疫调节作用,氢气在缓解疾病进展和改善对传统治疗有抵抗力的患者临床结果方面显示出希望。此外,氢气的良好安全性表现在这项研究中未见不良反应,突显了其作为等待肺移植的CTD-PAH患者的良好耐受辅助治疗的潜力。
总之,这项病例研究强调了对等待肺移植的CTD-PAH患者进行氢辅助治疗的有效性。需要进一步研究以阐明氢气治疗的潜在机制,并优化治疗方案以提高疗效。需要进行长期前瞻性研究以评估治疗效果的持久性和对CTD-PAH患者疾病预后及生存结果的影响。此外,比较氢气治疗与标准治疗的随机对照试验对于验证其治疗潜力并指导CTD-PAH管理临床实践指南至关重要。尽管氢辅助治疗作为一种治疗选择显示出前景,但未来需要更大规模的研究和长期随访来证实其疗效,并建立氢治疗与CD127+ Treg细胞、抗Ro抗体和B细胞亚群之间的相关性。
结论
氢气具有多方面的作用机制,包括强效的抗氧化、抗炎和抗凋亡效应(8),因此氢气治疗疾病的潜力是充满希望的。涉及Nrf2由H2激活的复杂相互作用表明,H2可能通过增强Nrf2活性及其下游抗氧化反应间接减轻氧化应激。可能需要在临床环境中进一步调查Nrf2。氢气在各种疾病中的广泛应用凸显了其多功能性和安全性,这促使进一步研究其作为新型治疗方法的潜力。这在像CTD-PAH这样的条件下尤其相关,其中氧化应激和炎症起着关键作用。
https://blog.sciencenet.cn/blog-41174-1458588.html
上一篇:脑动脉瘤伴脑梗和系统性红斑狼疮患者氢疗法个案报道【台湾2024】
下一篇:与僵尸大学斗争数十年的学术侦探André Hesselbäck