博文
Si氢剂对幼鼠神经毒性的保护作用
|
Si氢剂对幼鼠神经毒性的保护作用
神经毒素已经在神经科学领域被广泛研究。它们在神经元上引发毒性损伤、氧化应激和炎症,触发神经元功能障碍和神经退行性疾病。在这里,我们展示了一种基于硅(Si)的产氢剂(Si基制剂)在由6-羟基多巴胺(6-OHDA)诱导的幼年神经毒性小鼠模型中的神经保护作用。Si基制剂在肠道中产生氢气,并作为一种抗氧化剂和抗炎剂发挥作用。然而,Si基制剂对病变区域以外的神经退行性变化及其引起行为改变的影响尚不清楚。此外,哺乳期和婴儿期使用Si基制剂的神经保护效果在之前的研究中尚未探索。在本研究中,我们使用小鼠模型展示了Si基制剂在哺乳期和婴儿期对6-OHDA的神经保护效果。Si基制剂保护多巴胺能神经元免受6-OHDA引起的降解和死亡,以及在纹状体(STR)和腹侧被盖区(VTA)中多巴胺能纤维的丢失。此外,Si基制剂对内侧前额皮层(mPFC)第2/3层(L2/3)神经元轴突起始段(AIS)的长度表现出神经保护作用。因此,Si基制剂减轻了由6-OHDA诱导的幼年神经毒性小鼠模型的多动行为。这些结果表明,Si基制剂作为有效的神经保护剂和抗氧化剂对抗大脑中的神经毒性效应,提供了将Si基制剂作为神经系统疾病神经保护剂的可能性。
Togawa, S., Usui, N., Doi, M., Kobayashi, Y., Koyama, Y., Nakamura, Y., ... & Shimada, S. (2024). Neuroprotective effects of Si-based hydrogen-producing agent on 6-hydroxydopamine-induced neurotoxicity in juvenile mouse model. Behavioural Brain Research, 115040.
一、引言
神经毒素,是一类具有特定能力针对和破坏神经元功能的化合物,代表了神经科学研究中的关键工具。它们来源于动物、环境、内源过程、细菌、植物和某些药物等多样的来源,可以将神经毒素分类为生物毒素、环境毒素、内源性分子、细菌毒素、植物来源的毒素以及与药物相关的毒素。这些毒素通过多种机制发挥作用,包括干扰神经传递、诱发氧化应激和调节细胞信号传导途径。
神经毒素独特的能力可以有选择性地损害或损伤神经元,这使它们在阐明复杂的神经系统运作中变得无比宝贵。通过精确地针对特定类型的神经元或神经递质系统,研究人员可以诱导受控且局部化的损伤,从而允许调查细胞反应并揭示复杂的神经回路。此外,神经毒素作为理解与复制与神经退行性疾病和神经系统疾病相关的病理条件的关键模型。值得注意的是,某些神经毒素模仿了在帕金森病(PD)、阿尔茨海默病和亨廷顿病等疾病中涉及的分子过程。
6-羟多巴胺(6-OHDA)是一种常用于选择性损伤多巴胺能和去甲肾上腺素能神经元的神经毒素,使其成为神经科学中的宝贵工具。6-OHDA通过多巴胺转运体被细胞摄入,并发生自氧化以产生活性氧物种。利用这一机制,6-OHDA被用来建立成年阶段的帕金森病动物模型和幼年阶段的注意力缺陷/多动障碍(ADHD)动物模型。ADHD是一种以注意力缺陷、多动和冲动性为特征的神经发育障碍,通常在儿童时期出现并持续到成年。在我们之前的报道中,使用6-OHDA生成的ADHD小鼠模型显示,内侧前额皮层(mPFC)和初级躯体感觉桶状野(S1BF)的轴突初始段(AIS)长度缩短。
医用氢气表现出抗氧化、抗炎、抗过敏和抗凋亡效果。它选择性地减少活性氧物种(ROS)中的羟基自由基(•OH),并且仅与羟基自由基反应,使其成为与氧化应激和炎症相关的疾病的潜力治疗剂,并且没有副作用。我们开发了一种硅(Si)基产氢剂(基于Si的制剂),能够在类似肠道的条件下与水反应,持续产生大量的氢气。已知硅及其反应产物二氧化硅(SiO2)是无毒的,使得可以口服基于Si的制剂。到目前为止,我们已经报道了基于Si的制剂在各种疾病动物模型中的预防和抗炎效果,包括母婴传播、母体免疫激活、慢性肾脏病、溃疡性结肠炎和PD。
在本研究中,我们调查了基于Si的制剂对6-OHDA在幼鼠大脑中有选择性地损伤多巴胺能神经元所产生的神经保护作用。利用6-OHDA诱导的幼年神经毒性小鼠模型,我们进行了全面的组织学和行为分析。我们的结果揭示了基于Si的制剂对6-OHDA诱导的神经元退化、结构改变和行为障碍在幼鼠中的神经保护影响。这些发现为支持基于Si的制剂的神经保护作用提供了新的证据。
二、材料与方法
2.1. 小鼠 所有程序均按照ARRIVE指南和相关官方指南进行,并获得大阪大学动物研究委员会的批准(#27–010),遵循#01–040和#27–010协议。使用C57BL/6 J(日本SLC公司,静冈,日本)雄性小鼠。小鼠被安置在大阪大学屏障设施内的笼子中(尺寸为143 mm × 293 mm × 148 mm),在12小时光照-黑暗周期下饲养,可以自由饮水和进食。本研究共使用了66只新生小鼠,它们来自10个不同的母鼠。实验由不了解基因型的实验人员执行。
2.2. 6-OHDA给药
如前所述产生ADHD小鼠模型。6-OHDA诱导的ADHD小鼠模型表现出ADHD样的行为异常,例如多动、冲动和注意力缺失[19],[20]。在出生后第5天(P5),雄性小鼠通过低温麻醉。盐酸地西泮(20 mg/kg)(#D3900; Sigma-Aldrich, MO, USA)单侧皮下注射,30分钟后再给予生理盐水或含有0.1%抗坏血酸作为稳定剂的6-OHDA氢溴酸盐(25 μg溶解于3 μL生理盐水,#H116; Sigma-Aldrich)。注射以1.5 mL/min的速度进行,坐标为距离中缝线外侧0.6 mm,前囱前方2.0 mm,以及皮肤深度1.3 mm,使用一个10-µL气密封注射器(#1701RN; Merck, Darmstadt, Germany)和一个30 G小口径无针座(#7803–07: 30GA, RN, 6PK, 16MM, 45°; Merck)。给药后,幼鼠被放在37°C的加热垫上直到恢复,然后随机归还给母鼠。幼鼠一直与母鼠同住,直到在P24时进行分析。
2.3. Si基制剂和治疗
Si基制剂和含Si基制剂的饲料是按照之前的描述准备的。Si基制剂是由多晶Si粉末(Osaka Titanium Technologies Co., Ltd., Osaka, Japan; Si 4Nup)制成。在研磨Si粉末之后,进行了表面处理和聚集。因此,Si基制剂由Si纳米粉末的聚集体组成。对照实验室饲料使用的是AIN-93M饮食(Oriental Yeast Co., Ltd., Tokyo, Japan)。含Si基制剂的实验室饲料是通过将2.5 wt%的Si基制剂加入到AIN-93M中特别制备的。从P3开始至P24,粉状饲料提供给母亲和后代,可以自由进食和饮水。在进行动物实验之前,使用传感器气相色谱仪SGHA-PA(FIS Inc., Hyogo, Japan)评估了饲料中的氢气产量。
2.4. 免疫组织化学
免疫组织化学按先前描述的方法进行[38]。用4% PFA固定小鼠大脑,在PBS中过夜,4°C,然后在PBS中的30%蔗糖中保护,接着包埋在Tissue-Tek O.C.T. Compound(#4583, Sakura Finetek Japan Co.,Ltd., Osaka, Japan)中冷冻切片。放置20 μm厚的冷冻切片在PBS中。切片用以下一抗染色:兔多克隆抗酪氨酸羟化酶(1:500, #AB152, Merck, Burlington, MA),小鼠单克隆抗NeuN(1:500, #MAB377; Merck),小鼠单克隆抗Ankyrin-G(1:200, #MABN466; Merck)。对于荧光免疫染色,应用特异性结合Alexa Fluor 488的二抗(1:2000; ThermoFisher, Waltham, MA),并用Fluoromount/Plus(#K048, Diagnostic BioSystems, Pleasanton, CA)安装盖玻片。使用奥林巴斯显微镜和数码相机系统(BX53和DP73, Olympus, Tokyo, Japan)、一体化荧光显微镜(BZ-X700, KEYENCE Corporation)和Zeiss共聚焦激光扫描显微镜(LSM 710, Carl Zeiss, Oberkochen, Germany)收集图像。使用ImageJ定量荧光强度和AIS长度。实验者对基因型不知情的情况下进行定量分析。
2.5 开场实验
开场实验按照先前描述的方法进行[39]。雄性小鼠被放置在一个新的箱子(尺寸为宽700毫米×深700毫米×高400毫米,#OF-36(M)SQ, Muromachi Kikai Co., Ltd., Tokyo, Japan)的角落之一,并允许自由探索10分钟。运动活动使用ANY-maze行为跟踪软件进行测量和跟踪。对基因型不知情的实验者进行了测试。测试在10:00至16:00小时之间进行。
2.6 统计分析
数据以独立生物实验的平均值呈现,采用小提琴图(最小值至最大值)或均值±标准误差(SEM)。统计分析(单因素方差分析)使用Prism 9进行。P < 0.05的显著性水平被认为具有统计学意义。
三、结果
3.1 Si基制剂保护6-OHDA诱导的选择性神经元退化 为了评估Si基制剂对抗6-OHDA在大脑中诱导的多巴胺能和去甲肾上腺素能神经元选择性损伤的神经保护效果,我们生成了一个已建立的ADHD小鼠模型,代表一种青少年神经毒性模型。从P3开始直到P24解剖,母亲和后代小鼠被提供含有或不含2.5% Si基制剂的AIN-93M饮食粉末。为了保护去甲肾上腺素能神经元并产生ADHD模型, desipramine皮下注射,然后在P5时对小鼠进行室内脑室注射生理盐水或6-OHDA(见方法)。我们验证了由6-OHDA在腹侧被盖区(VTA)及其在纹状体(STR)和黑质致密部(SNc)的纤维中诱导的多巴胺能神经元的选择性损伤和多巴胺能纤维的丧失(图1A,B)。我们在对照(CTR)小鼠的STR和VTA观察到酪氨酸羟化酶(TH)阳性免疫反应(图1A-D),但在6-OHDA处理的小鼠中未观察到(图1A-D)。有趣的是,我们还在用Si基制剂处理的6-OHDA小鼠的STR和VTA中观察到TH阳性免疫反应(图1A-D)。这些结果表明,Si基制剂可以保护小鼠大脑中6-OHDA诱导的多巴胺能神经元的选择性损伤和多巴胺能纤维的丧失。
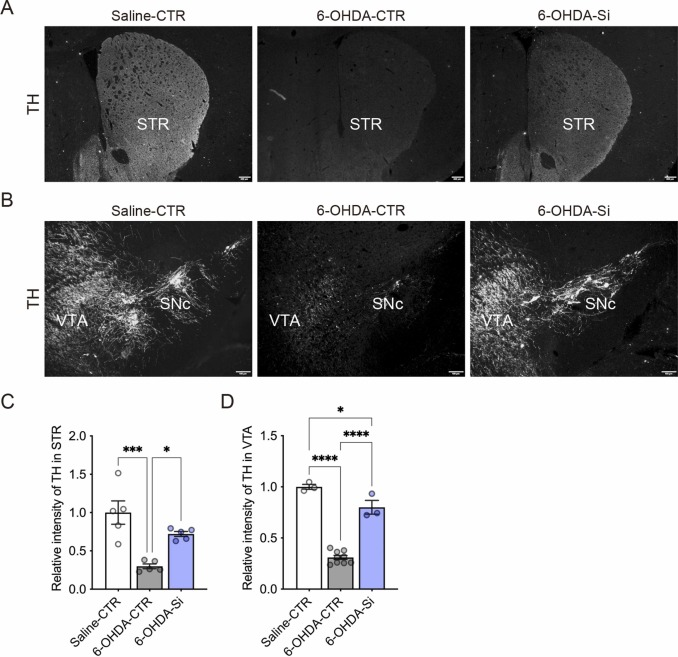
图1. Si基制剂保护6-羟多巴胺(6-OHDA)诱导的小鼠神经元退化。(A) P24时小鼠纹状体(STR)中多巴胺能神经元纤维的酪氨酸羟化酶(TH)阳性免疫反应的典型荧光图像。(B) P24时小鼠腹侧被盖区(VTA)和黑质致密部(SNc)中多巴胺能神经元和多巴胺能纤维的TH阳性免疫反应的典型荧光图像。(C, D) STR (C)和VTA (D)中TH免疫反应的定量。6-OHDA诱导的神经元退化被Si基制剂保护。数据以均值±标准误差表示。星号表示****P<0.0001, ***P<0.001, *P<0.05,单因素方差分析及Tukey多重比较检验。n=3–9/条件。比例尺:100 μm。
3.2 Si基制剂保护6-OHDA小鼠mPFC中的AIS长度
接下来,我们研究了Si基制剂的神经保护作用是否扩展到其他脑区。在先前的研究中,我们报道了在同一6-OHDA诱导的ADHD模型小鼠中mPFC第2/3层神经元AIS长度缩短的表型[23]。与先前的结果一致,在P24时,6-OHDA小鼠mPFC第2/3层神经元的AIS长度比CTR小鼠短(图2A,B)。mPFC第2/3层神经元AIS长度的累积频率分布图在6-OHDA小鼠中相比CTR小鼠表现出向左偏移(图2C)。相比之下,用Si基制剂处理的6-OHDA小鼠mPFC第2/3层神经元的AIS长度得到恢复(图2A,B)。mPFC第2/3层神经元AIS长度的累积频率分布图在用Si基制剂处理的6-OHDA小鼠中显示出与CTR小鼠相似的曲线(图2C)。这些结果表明,Si基制剂的神经保护作用不仅限于受损的脑区,还扩展到其他脑区的神经元。
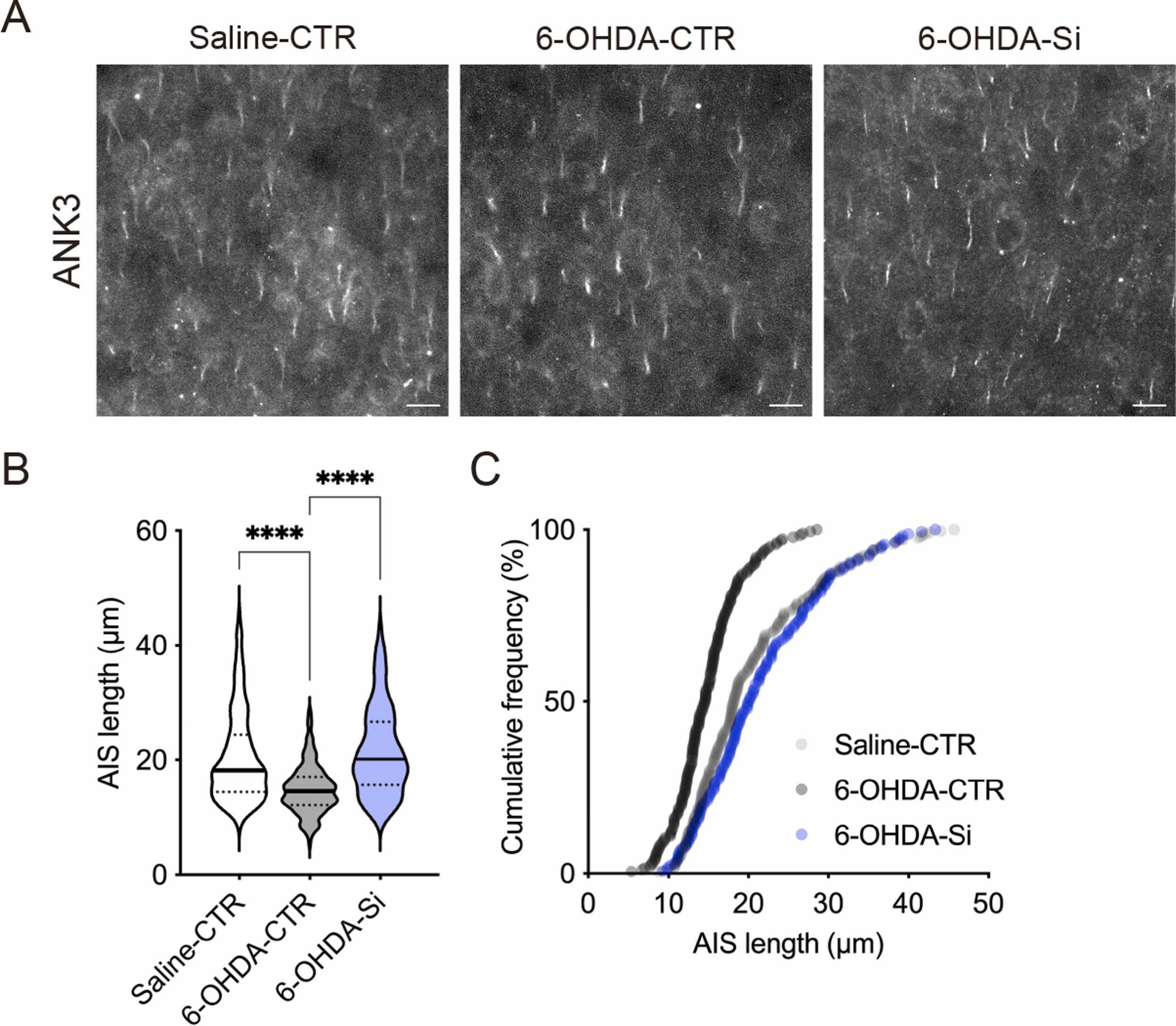
图2. Si基制剂对小鼠轴突起始段(AIS)的神经保护作用。(A)P24时,在小鼠内侧前额叶皮层(mPFC)第2/3层神经元中ANK3阳性AIS的典型荧光图像。(B, C)mPFC第2/3层神经元AIS长度的定量和累积频率分布。Si基制剂显示了对mPFC AIS长度的神经保护作用。数据以均值±标准误差表示。星号表示****P<0.0001,单因素方差分析及Tukey多重比较检验。n = 165–252个细胞,来自3–5只动物/条件。比例尺:100 μm。
3.3. Si基制剂改善了6-OHDA小鼠的多动症状
最后,我们研究了Si基制剂的神经保护作用是否扩展到行为结果。一个由6-OHDA诱导的ADHD小鼠模型表现出类似ADHD的行为,包括多动、冲动和注意力不集中[19],[20],[23]。在这些行为中,我们在P24使用开放场测试评估了多动症状。与对照(CTR)小鼠相比,用6-OHDA处理的小鼠在移动距离、平均速度和移动时间上显示出显著增加(图3A-D)。有趣的是,这些表型在用Si基制剂处理的6-OHDA小鼠中得到了恢复(图3A-D)。对小鼠体重没有影响(图3E)。这些结果表明,神经保护作用不仅防止了神经损伤,而且间接减轻了行为结果。

图3. Si基制剂缓解了6-OHDA在小鼠中引起的多动症状。(A)P24时,在开放场测试中小鼠探索活动的典型热图。(B-D)开放场测试期间总移动距离(B)、平均速度(C)和移动时间(D)的量化。与CTR小鼠相比,6-OHDA小鼠表现出多动症状,但在用Si基制剂处理的6-OHDA小鼠中未观察到这种多动症状。(E)体重方面没有差异。数据以均值±标准误差表示。星号表示****P<0.0001, ***P<0.001, **P<0.01,单因素方差分析及Tukey多重比较检验。n=16–22/条件。
四、讨论
在本研究中,我们证明了Si基制剂对6-OHDA在小鼠大脑中诱导的多巴胺能神经元选择性损伤和多巴胺能纤维丢失的神经保护作用。此外,Si基制剂保护了AIS的长度,并减轻了6-OHDA小鼠的多动行为。我们的结果突出了Si基制剂对抗神经毒素诱导的中枢神经系统退化和改变的神经保护作用。
为了探索Si基制剂在神经保护作用中的角色,我们使用了一个已建立的ADHD小鼠模型中的6-OHDA作为神经毒素,代表一种青少年神经毒性模型。6-OHDA通过诱导氧化应激和活性氧(ROS)的产生,选择性地使大脑中的多巴胺能和去甲肾上腺素能神经元发生变性和损伤。这种6-OHDA的神经毒性效应通常用于生成动物模型,用于研究ADHD和PD等疾病的潜在病理机制。需要注意的是,这两种不同疾病模型在生成方法如6-OHDA注射区域以及行为结果表型方面存在显著差异。实际上,通过纹状体注射6-OHDA生成的PD模型在开放场测试中显示出减少的运动或正常的运动活动。
Si基制剂像氢气一样,由于体内产生氢气而产生神经保护作用。在氧化还原反应的背景下,氢气和Si基制剂展现了神经保护作用,包括抗氧化、抗炎、抗过敏和抗凋亡效应,且无副作用。此外,我们已经报道了Si基制剂调节抗氧化基因的表达,并抑制炎症相关基因的表达。其中,HMOX1和NQO1在NFE2L2/KEAP1氧化还原反应(也称为NRF2)中起核心作用。在一项类似的研究中,已经报道阿波吗啡激活了NFE2L2-ARE途径,并抑制了由6-OHDA诱导的氧化应激引起的神经细胞死亡。基于这些发现,我们推测Si基制剂作为一种神经保护剂,展示了针对6-OHDA神经毒素的增强抗氧化效果。
先前,我们报道了在ADHD小鼠模型的mPFC和S1BF中,用ANK3标记的AIS缩短的长度,这表明较短的AIS长度可能有助于ADHD行为异常。ANK3(被称为Ankyrin-G)是AIS的主要组成部分,在其功能和结构中发挥关键作用,包括动作电位的启动和钠通道的聚集。在ADHD患者中已经发现了ANK3的突变,而Ank3 cKO小鼠表现出包括多动和冲动在内的ADHD样表型[54]。皮质中Ank3的表达在L2/3而非L5和L6中被强烈观察到,表明L2/3神经元的AIS长度有助于多动和冲动[54]。6-OHDA小鼠的多动表型因Si基制剂改善的一个原因可能是由于L2/3神经元AIS长度的改善。之前的研究还报道了在6-OHDA诱导的ADHD小鼠的mPFC中,从L2/3到L6的皮层厚度减少以及L2/3锥体神经元失去树突复杂性,这表明L2/3神经元失去树突复杂性导致AIS长度缩短。在ADHD患者中,多个研究报告了大脑区域的体积减少以及它们连接的改变,包括受VTA中多巴胺影响的PFC、前扣带皮层和基底神经节。儿童ADHD的功能磁共振成像研究也报告了皮层纹状体回路的功能缺陷。因此,这表明Si基制剂保护多巴胺能神经元免受6-OHDA诱导的神经毒性,并间接防止6-OHDA小鼠mPFC中的形态改变,包括AIS表型。总的来说,这些发现也表明Si基制剂不仅是在受伤区域,而且在神经系统相关区域范围内都是有效的神经保护剂。
此外,这项研究揭示了关于Si基制剂效果的新见解,扩展了我们对其影响的理解。这次,Si基制剂是在哺乳期给予的。对于刚出生后的幼鼠来说,直接摄取Si基制剂是具有挑战性的。因此,有可能母鼠摄入了Si基制剂或母体释放的氢元素直接影响了幼鼠。推测幼鼠从某个时期开始经历了Si基制剂的神经保护效果,这归因于母源效应和直接摄取效应。尽管我们之前已经报告了孕期通过母亲对胎儿的Si基制剂效果,但这是第一次报告来自母鼠乳汁和母体的效果,以及在哺乳期和早期产后阶段直接摄入Si基制剂的效果。
这项研究的几个局限性应该被承认。Si基制剂的详细分子功能机制和母婴之间的传递方式仍然大部分未知。关于这些问题,我们正在探索进一步的调查作为未来的研究。我们强调这项研究检验了Si基制剂对6-OHDA诱导的多巴胺能神经元神经毒性的影响,而不是对ADHD的影响。换句话说,我们在这项研究中并不声称Si基制剂作为ADHD的治疗是有效的。这是因为我们只评估了Si基制剂对6-OHDA诱导的ADHD小鼠模型中mPFC L2/3神经元AIS长度和多动行为的影响,而不是Si基制剂对注意力或冲动性的影响。此外,控制行为的神经回路是复杂的,需要更深入的见解。
总体而言,在这项研究中,我们证明了Si基制剂保护发育中的多巴胺神经系统的回路形成及其可塑性,减少了6-OHDA诱导的神经毒性的影响。这项研究表明Si基制剂作为神经保护剂和抗氧化剂对抗大脑中的神经毒性效应,提供了Si基制剂作为神经系统疾病神经保护剂的可能性。此外,我们的发现为Si基制剂的神经保护作用提供了新的视角,特别是在其在哺乳期和婴儿期使用的背景下。
五、结论
我们的研究阐明了Si基制剂作为神经保护剂对6-OHDA诱导的小鼠大脑中神经元退行性变的神经保护效果。
https://blog.sciencenet.cn/blog-41174-1433352.html
上一篇:氢气生物医学的历史进展和未来使命【26章】全文结束
下一篇:生物的氧化还原调节【自然】