博文
生物的氧化还原调节【自然】  精选
精选
|
Helmut Sies是第一提出氧化应激概念的学者,也是当今自由基生物学领域的领军人物,现在德国杜塞尔多夫大学工作,经常写一些自由基生物学领域的综述性文章,这篇文章是刚刚出笼的大作,值得大家学习。
氧化还原反应是指化学物质之间的电子转移反应。它们是生命过程的基础,从在产生氧气的光合作用中捕获太阳能到驱动细胞代谢。各种氧化还原反应在所谓的氧化还原调节中引导和控制生物过程。氧化还原调节中的核心作用是由蛋白质中的含硫和含硒氨基酸残基执行的,其被生理氧化剂(如过氧化氢(H2O2))可逆氧化,作为控制和调节酶活性和蛋白质功能的开关。这些氧化还原开关使细胞和生物体能够对各种不同的刺激做出反应,例如生长因子、毒素和营养物质可利用性的变化。
在早期开创性工作的基础上,分子细胞生物学技术的进步在描述反应物种作为氧化还原调节过程介质的不同功能方面取得了惊人的进展。本综述的重点主要是活性氧(ROS)包括自由基和非自由基衍生物,包括超氧阴离子(O2•−)和过氧化氢。我们将讨论线粒体、内质网、过氧化物酶体、细胞核、胞质溶胶或质膜中的氧化还原途径产生的过氧化氢如何作为第二信使,通过蛋白质半胱氨酸残基的可逆氧化触发细胞信号。在生物体水平上,胚胎发生和组织发育、细胞迁移、神经活动、伤口愈合等过程都需要过氧化氢信号。值得注意的是,活性氮(RNS,例如,一氧化氮•NO)、活性硫(RSS;例如,硫化氢H2S)、亲电试剂(RES;例如,4-羟基-2-壬烯醛)或羰基的反应性物质也发挥信号传导作用,其中的每一种都描述了具有不同性质和细胞相互作用的广泛化学物质8,但将不进行详细讨论。
本综述的范围仅限于哺乳动物细胞代谢,没有详细包括生物氧化还原科学的其他大领域,如植物。我们通过对氧化剂(最重要的是过氧化氢)的有机物间和细胞间信号传导特性及其在控制细胞功能中的重要性提出综合观点,讨论了氧化还原生物学领域的新进展。我们讨论了氧化还原顺势动力学的最新概念,其特征是连续的氧化还原传感、氧化还原信号转导的激活以及随后的信号转化为多种类型的细胞应激反应的激活。这些反应涉及氧化还原调节蛋白(即氧化还原蛋白质组)活性的变化,并最终导致表观遗传学景观和基因表达的变化。我们将讨论hormesis(来自希腊语hormaein:“启动”),它描述了暴露于低剂量应激源(例如氧化剂)后的整体生物适应性反应,并探索非编码RNA(ncRNA)在氧化还原调节中的新认识作用。我们将介绍与外部环境的多方面相互作用的新知识,统称为暴露,最后考虑氧化还原医学的发展领域,并对现有的知识差距进行展望。
一、氧化还原稳态动力学与氧化还原密码
氧化还原稳态指的是维持氧化剂和抗氧化剂之间平衡的状态。尽管过量的氧化剂产生会导致细胞生物分子的氧化损伤并引起氧化应激,但缺乏足够的氧化剂水平会损害关键的信号传导过程并导致还原应激20。氧化剂和抗氧化剂之间的平衡通过氧化还原调控获得,包括氧化还原感应、氧化还原信号传导、氧化还原响应和反馈控制途径(见图1)。氧化修饰的还原是由NADPH和NADH的还原力驱动的,它们充当“理想的可扩散的两电子转移货币包”,以维持数百种不同蛋白质和小分子的氧化还原状态。NADPH与细胞蛋白巯基(细胞氧化还原修饰的主要目标)之间的联系是通过硫氧还蛋白和谷胱甘肽(GSH)系统介导的,分别由硫氧还蛋白还原酶和GSH二硫化物还原酶催化21。
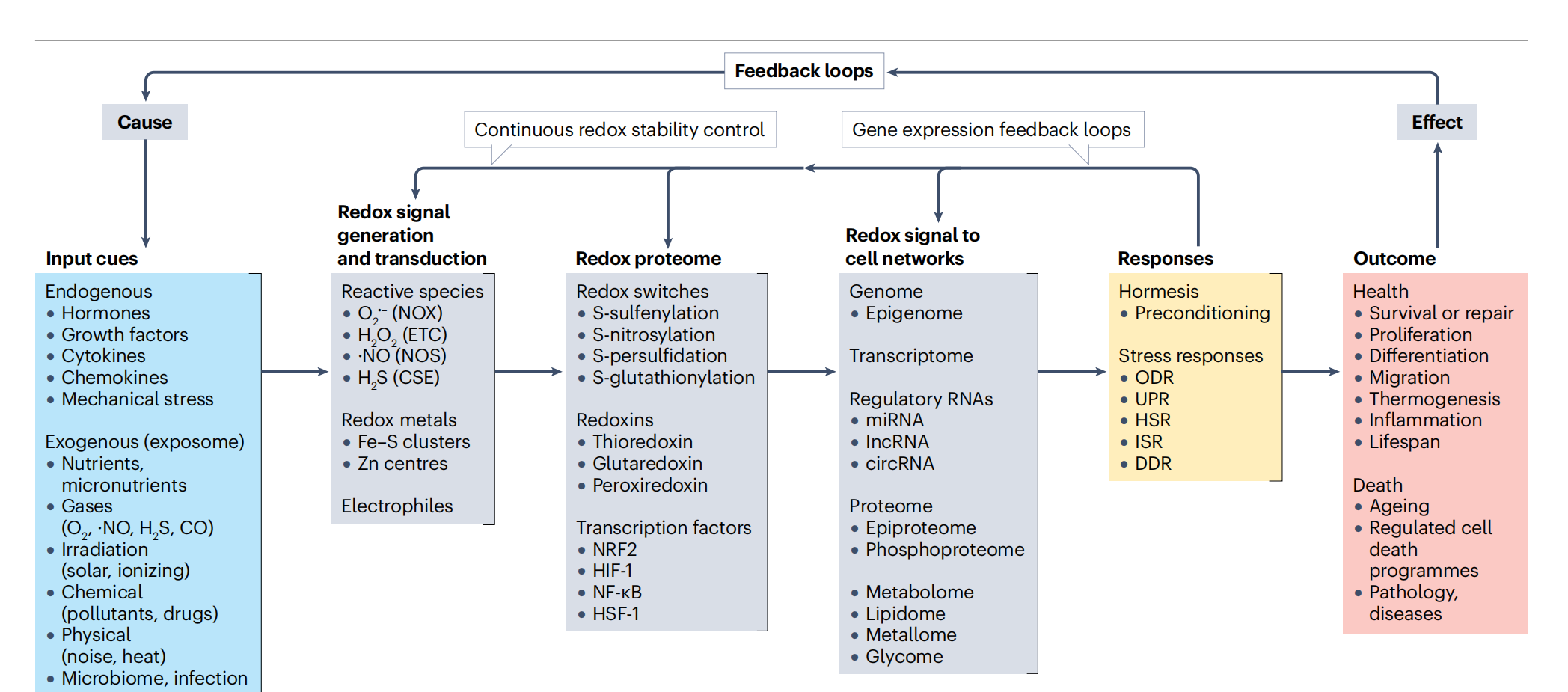
图1:氧化还原调控原理。
氧化还原调控的过程始于初始的因果输入线索(如,内源性刺激如激素或外源性输入来自营养素)。内源性和外源性氧化还原信号的产生导致活性氧物种(ROS)、氮物种(RNS)和硫物种(RSS)的产生。这些氧化还原信号可以通过超氧阴离子(O2•−)、过氧化氢(H2O2)、一氧化氮(•NO)和硫化氢(H2S)传播,这些物质分别由NADPH氧化酶(NOX)、电子传递链(ETC)和其他FAD依赖性线粒体脱氢酶、一氧化氮合酶(NOS)和半胱氨酸γ-裂解酶(CSE)产生。氧化还原信号也可以通过亲电体、脂质过氧化物和硝基烯传播。氧化还原信号的转导导致氧化还原蛋白质组和代谢组的调节。氧化还原信号通过半胱氨酸开关的位点特异性氧化和还原传播,也称为氧化还原开关。正如在盒子2中详细讨论的,氧化还原开关受到可逆的氧化和还原,通过S-亚磺酰化、S-谷胱甘肽化、S-亚硝酰化或其他氧化还原敏感的修饰传递氧化还原信号。氧化还原信号的传播还通过redoxin家族的酶(硫氧还蛋白、谷氧还蛋白和过氧化物还原蛋白)介导,这些酶通过催化巯基的氧化和还原被激活和/或失活。诸如红细胞核因子2相关因子(NRF2)、核因子-κB(NF-κB)、缺氧诱导因子1(HIF-1)或热休克因子1(HSF-1)等应激感应转录因子也是氧化还原传感器,并通过半胱氨酸巯基的氧化和还原激活或失活,这影响了它们激活表达所需以引发细胞应激反应的基因的能力。累积起来,氧化还原信号的存在影响从基因组和蛋白质组到其他组的细胞网络的运作,导致氧化还原信号的整合。另一种氧化还原调控模式是由各种类型的调控性非编码RNA(如微RNA(miRNAs)、长非编码RNA(lncRNAs)或环状RNA(circRNAs))提供的多方面相互作用。激活各种应激反应(如氧化应激反应(ODR)、未折叠蛋白反应(UPR)、热休克反应(HSR)、综合应激反应(ISR)和DNA损伤反应(DDR))的激活效应结果导致在适应、维持、修复和健康或细胞破坏、移除或死亡之间的决策。持续运作的反馈回路通过迭代协调的波动和振荡来维持氧化还原稳定性,包括基因表达反馈回路或转录-翻译反馈回路,然后加强或减弱氧化还原信号。
除了各种脱氢酶、氧化酶、氧化还原酶、加氧酶和电子转移复合物产生的氧化剂外,各种类型的细胞刺激,例如生长因子、营养素和毒素,也会触发受控产生一系列的氧化还原第二信使,尤其是低生理浓度下的H2O2、•NO和H2S(其他地方综述3,9)。然后,细胞内和细胞间器官的网络中受氧化还原调控的蛋白质协调并整合信号以维持生命过程。构成氧化还原系统组织的基础原则已被制定为“氧化还原密码”22。盒子1简要介绍了这套组织原则以及当前活跃研究领域的一些新视角。稳态范式与持续进行的代谢流的维持有关:由于生命过程以非平衡热力学为特征23,维持稳态需要不断监测和重新编程氧化还原波动,即,氧化剂水平的空间和时间变化24。这一点甚至在更大尺度的结构层面上令人印象深刻地得到了例证,即线粒体嵴的连续重塑——由内线粒体膜折叠形成的褶皱,这些褶皱富含产生氧化剂的脱氢酶和电子传递链(ETC)复合物——在秒的时间尺度上发生25。由该领域的先驱者帕拉塞尔苏斯、克洛德·伯纳德、沃尔特·坎农和路德维希·冯·贝塔朗菲等人阐述的经典稳态概念,以内部环境的恒定为中心26。然而,由于其动态自我组织的能力,生物系统在不断进行的代谢流中是“自动态的”27。因此,与其使用氧化还原稳态,不如使用氧化还原自动态来描述这一过程更为恰当。图1描述了细胞中氧化还原信息的流动,特别是不同的生理和环境线索通过氧化还原开关和网络汇集到细胞上,诱导反应和功能结果,包括迭代反馈回路,如基因表达反馈回路28。理解细胞如何响应这些刺激是一个具有挑战性的任务29,这将需要对涉及的过程有更详细的分子层面的见解。然而,正如随后讨论的,最近在氧化还原生物学方法方面的进步揭示了细胞如何整合各种氧化还原调控途径进行细胞内和细胞间通信的机制。
盒子1 生物氧化还原调控的基本原则:氧化还原密码
2015年制定了一套生物氧化还原反应在活细胞和生物体中组织的基本原准则,称为氧化还原密码(参考文献22)。这里简要介绍四个原则。如其最初制定时所述22,随着氧化还原研究揭示新的见解,它开放于更新,最近的扩展到植物世界也证明了这一点261。相关研究的当前文献在这里以示范性的方式呈现。
第一原则:生物能量学、分解代谢和合成代谢通过分别操作接近与中央代谢燃料平衡的高流量NADH和NADPH系统来组织。
NADH和NADPH系统的氧化还原调控在各种亚细胞室中发生128。这些辅酶系统在细胞中的含量通过几种方式由调节酶控制。NAD+激酶(NADK)从NAD+补充NADP+(参考文献262),而能量连接型烟酰胺核苷酸转氢酶(NNT)从NADH补充NADPH263,264。NADPH在氧化还原调控中具有双重功能:它为redoxins(即硫氧还蛋白和谷氧还蛋白系统)以及谷胱甘肽二硫化物还原酶提供还原等价物,同时通过NADPH氧化酶(NOX)催化的反应将分子氧还原为超氧阴离子而产生氧化剂。NAD+是许多参与调节代谢的酶的共底物,包括sirtuin家族的蛋白质去乙酰化酶265。
第二原则:大分子结构和活性通过动力学控制的硫开关与NADH和NADPH系统相连,在氧化还原蛋白质组中。
氧化剂和亲电体的氧化还原信号主要通过可逆的翻译后蛋白质半胱氨酸修饰发生,这影响了大分子结构和活性13。氧化剂的氧化还原信号,尤其是H2O2,通过可逆的分子巯基氧化还原开关进行。这些是特别适合于可逆信号转导的蛋白质半胱氨酸和甲硫氨酸残基,因为它们的反应性、丰富性和位置169。细胞氧化还原蛋白质组以分子术语描述了整体的氧化还原状态,如通过“OxiMouse”数据集153所示例的,可在‘OxiMouse’访问。
第三原则:与NADH和NADPH系统相连接的H2O2产生激活和失活周期支持氧化还原信号传导和时空序贯响应,用于分化和多细胞发育。
内源和外源线索在特定细胞位置触发氧化物的产生。这些信号作为第二信使传递至目标位点,主要通过氧化还原中继,例如利用过氧化物还原酶传递H2O2信号。对于•NO,信号传递通过向目标扩散或通过S-亚硝基谷胱甘肽(GSNO)进行转亚硝基化来实现。
第四原则:从微环境到亚细胞和细胞组织的氧化还原网络,构成了一个适应系统以响应环境。
氧化还原调节信号高度整合。嵌入在氧化还原网络中的氧化物生产者、抗氧化系统和氧化还原敏感应答器促进细胞内和细胞间的氧化还原通信。过氧化蛋白允许H2O2穿过膜,这在维持细胞内H2O2梯度方面很重要。或者,氧化物可以通过间隙连接直接在细胞之间移动,或者通过细胞外空间136间接移动,或者通过细胞外囊泡74。时空氧化还原控制发生在将氧化还原信号与其他应激响应信号通路和激素以及器官到器官和细胞到细胞的信号转导连接起来的调控枢纽16。
二、氧化还原稳态、氧化应激和还原应激
有氧细胞代谢中氧化还原反应的主要方向是朝向氧化,这由使用NADH和NADPH的还原反应来平衡。氧化应激的概念(见参考文献30,31)指的是偏离生理性氧化还原平衡。氧化应激被定义为“氧化物和抗氧化剂之间的失衡,倾向于氧化物,导致氧化还原信号和控制和/或分子损伤的破坏”30。关注损害方面的研究一直在该领域占据主导地位,直到最近。然而,人们逐渐认识到氧化应激具有双重性:注意力已从超生理浓度的氧化物的影响转移到生理浓度范围内的氧化物的作用。之前提到的持续氧化还原监测的观念导致了“eustress”(希腊语“eu”表示良好的压力)一词的出现,用以表示氧化还原调控中的动态本质。这种正常生理偏差的范围也被称为homeodynamic space32、金发姑娘地带33或黄金均值(aurea mediocritas)34。H2O2是氧化还原稳态中的核心氧化还原信号分子,通过蛋白质巯基的两电子氧化来发挥作用35。一电子机制的氧化还原信号,即通过自由基,也可能在稳态中发生,但这需要进一步探索36。图2描述了在生理线索如锻炼或营养状态变化下,感知氧化物以激活对维持细胞功能、适应性和韧性至关重要的有益氧化还原稳态信号的homeodynamic范围。尽管本综述主要集中在氧化还原调控中的稳态上,我们也将简要提及细胞对超生理性氧化还原平衡偏差(即,氧化应激)的响应,这具有多方面的病理生理学和医学后果。相反,抗氧化剂或NADPH等还原剂的过量也会触发称为还原应激的压力反应,这也会导致细胞功能障碍(图2)。
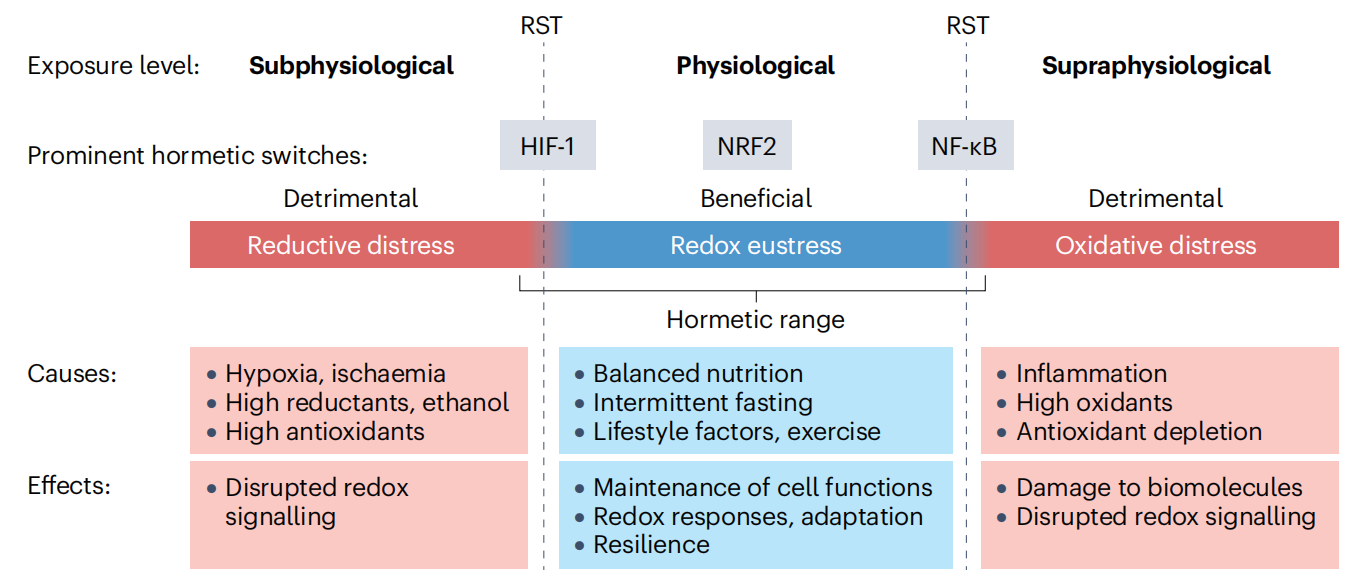
图2氧化物暴露的范围从最小(还原应激)到生理性(氧化还原稳态)到非常高的水平(氧化应激)。毒物兴奋效应范围包括从生理性(蓝色)到非生理性(红色)暴露水平的过渡阶段,即,毒物兴奋效应剂量-反应,这导致激活促进细胞适应的氧化还原感应转录因子。从生理水平到低于生理或高于生理水平的临界阈值被称为氧化还原应激信号阈值(RSTs)65。缺氧诱导因子1(HIF-1)主要在氧化物水平低时(趋向于低于生理水平一侧)被激活,而核因子-κB(NF-kB)在趋向于高于生理水平一侧起作用,核因子红细胞生成素2相关因子(NRF2)主要涵盖生理范围。图底部列出了引起氧化还原稳态和两种形式氧化还原应激的一些主要原因及其随后在主文中详细提到的影响。
(作者用三种氧化状态对氧化还原平衡进行了全面总结,低氧化是还原,高氧化过度,正常氧化,低氧是冷状态低氧诱导因子负责,高氧是热态炎症态是NF-kB,常态则是Nrf2负责,这是比较意外的。)
细胞对氧化应激的反应
细胞对氧化还原应激的理解主要来自研究氧化剂浓度增加对细胞和生物体的生化和生理影响。如图1所示,细胞利用各种蛋白质、酶和转录网络来响应氧化剂的增加暴露,这会破坏稳态信号并可能导致不可逆的大分子损伤。对氧化还原应激的响应由被氧化物修饰的氧化还原敏感蛋白控制,在这种修饰形式下它们的功能发生变化37。一组主要的参与对抗氧化应激的氧化还原调控蛋白是转录调节因子(表1),它们引发对细胞氧化生理增加的适应性响应38,39。最近的一项研究检查了在暴露于氧化剂时转录因子激活的变化是如何在时间上协调的40,代谢和转录组响应依赖于细胞类型和氧化剂浓度41。一个特别能表征生理氧化剂水平变化的传感器是普遍表达的核因子红细胞生成素2相关因子(NRF2)及其抑制剂Kelch样ECH相关蛋白1(KEAP1)42。KEAP1是一个氧化剂和亲电试剂传感器,当氧化剂水平低时,它与Cullin 3(Cul3)基泛素连接酶结合,将NRF2标记为蛋白酶体降解43。氧化剂增加触发KEAP1中特定半胱氨酸的氧化,导致NRF2释放并扩散到核内,从而表达一系列抗氧化基因,这些基因是GSH生物合成和消除H2O2所必需的(例如,GSH过氧化物酶)44。这种基于NRF2的基因表达上调构成了毒物兴奋效应剂量-反应机制的基础45(图2)。作为弹性的基本机制,毒物兴奋效应的一般原则46具有广泛的重要性,例如在神经保护方面的文献中有记录47。NRF2还激活NRF2诱导的分泌表型基因,这是一个免疫监视系统,它可以清除已损坏到无法修复的细胞48。其他氧化还原调控的转录因子包括缺氧诱导因子1(HIF-1α)和热休克因子1(HSF-1)。缺氧和热休克条件都会导致线粒体在核周围积聚,并在核内引起ROS产生的增加49,50。虽然HIF-1α似乎通过氧化剂介导的脯氨酰羟化酶失活而稳定,并诱导许多参与糖酵解和GSH生物合成的基因,但HSF-1活性对氧化剂介导的半胱氨酸次磺酰化敏感,并诱导分子伴侣和其他蛋白质稳态网络组分的表达51。
表1:受氧化还原控制的细胞调节蛋白
除了直接或间接被氧化剂激活外,几个与氧化还原相关的转录因子还受到短(<200 nt,sncRNA)或长(>200 nt,lncRNA)非编码RNA的调节,这些RNA的表达水平由H2O2诱导(参考文献52)。例如,像LINC00239这样的lncRNA和miRNA-200a触发KEAP1 mRNA降解,从而增加NRF2的稳定性53。反义lncRNA HIFAL增强了HIF-1介导的糖酵解基因的转录54,而lncRNA HEAT是HSF-1的转录刹车,用于在不再需要时取消热休克反应55。这些非编码RNA共同作为一个叠加的信号,与氧化剂一起工作,调节关键的氧化还原敏感转录因子,激活细胞应激反应。
细胞对还原应激的反应
还原应激也可能对细胞构成危险,可能是对慢性NRF2激活的反应。例如,它可以通过增加乙醛脱氢酶3的表达来引发,这是一种产生NADH的酶56。为了抵消还原应激,存在特定的传感器蛋白,当它们被还原时,会激活产生氧化剂的途径57(图2)。一个这样的传感器蛋白是与Follicle相互作用蛋白1(FNIP1),在其氧化形式下,通过抑制柠檬酸循环代谢和氧化磷酸化作用,作为线粒体H2O2生成的门卫57。这种蛋白的还原增加了电子通过电子传递链(ETC)的流动,从而增加了氧化剂的产生。此外,还原应激可以通过诱导乳酸脱氢酶来缓解56。因此,还原应激感应是一种至关重要的反应,需要用来对抗慢性过度刺激的氧化剂响应系统,如NRF2。
细胞应激反应的综合
一个关键的研究领域涉及在何时以及如何在氧化还原应激后激活各种细胞应激反应的问题58。氧化应激反应与其他类型的应激反应相互联系并精细调节,例如综合应激反应59、未折叠蛋白反应(UPR)60、热休克反应(HSR)51、DNA损伤反应(DDR)61等。NRF2、NF-κB、HIF-1和HSF-1与综合应激反应、UPR、HSR和DDR相互联系,将氧化还原感应整合到这些应激反应中62,63。在此,重要的是要指出,即NRF2、NF-κB、HIF-1等主要的氧化还原应激反应系统(表1和图2)以低空载速率运行,而不是作为开/关开关,调整基因表达反应以满足细胞的氧化还原需求。这允许对任何突然增加的氧化剂做出迅速反应。定义临界点的是什么,即从有益应激转变为有害应激的过渡?答案可能因情境和细胞而异。这可以在单细胞水平上进行监测和进一步探索64。在秀丽隐杆线虫中计算氧化还原应激信号阈值(RST)(图2)已在实验上进行了尝试。尽管暴露于超氧阴离子(O2•−)发生器百草枯在低浓度下会增加寿命,但更高水平的暴露导致寿命缩短65。这些实验划定了C. elegans用来激活氧化还原调节途径的氧化剂浓度范围,以及发生氧化应激的阈值。使用细胞培养,发现低剂量的H2O2触发UPR和HSR,这对于在轻微热预处理下维持蛋白质稳定性是必需的66。同样,通过轻微的氧化应激激活DDR,使细胞对明显的应激挑战有所准备67。
三、细胞内和细胞间的氧化还原信号传导
氧化还原研究中的一个活跃话题是关于如何在局部产生的氧化剂和全局的氧化还原状态变化在细胞内部和不同细胞之间进行通信的问题。许多生长因子受体68、整合素69、细胞因子和其他信号模式(见“环境适应”部分)直接在质膜处启动一个氧化还原级联,导致细胞内和不同细胞位置之间的氧化还原通信70。本节介绍了有关氧化还原通信的当前知识。
细胞内氧化还原通信
各种亚细胞细胞学空间各有其特定的氧化还原微环境,在这些微环境中存在相当大的异质性和波动。为了讨论细胞内氧化还原通信,我们首先将介绍各个细胞位置的关键氧化还原特征。
细胞质膜
细胞质膜中嵌入的NADPH氧化酶(NOX)通过信号介导的磷酸化作用激活,产生超氧阴离子自由基,随后在胞外超氧化物歧化酶(SOD3)催化的反应中转化为H2O2(图3)。这种NOX-SOD3胞外氧化还原串联对于氧化还原信号传导至关重要,例如,从巨噬细胞到其他细胞类型的信号传递71。胞外的H2O2通过专门的水通道蛋白(AQPs)、过氧化物通道72或形成具有氧化还原活性的内体73扩散进入细胞,这些内体被称为“redoxosomes”74,为随后的细胞内氧化还原信号传导铺平了道路。Redoxosomes从细胞释放到胞外空间,使它们能够促进细胞间的氧化还原信号转导75。
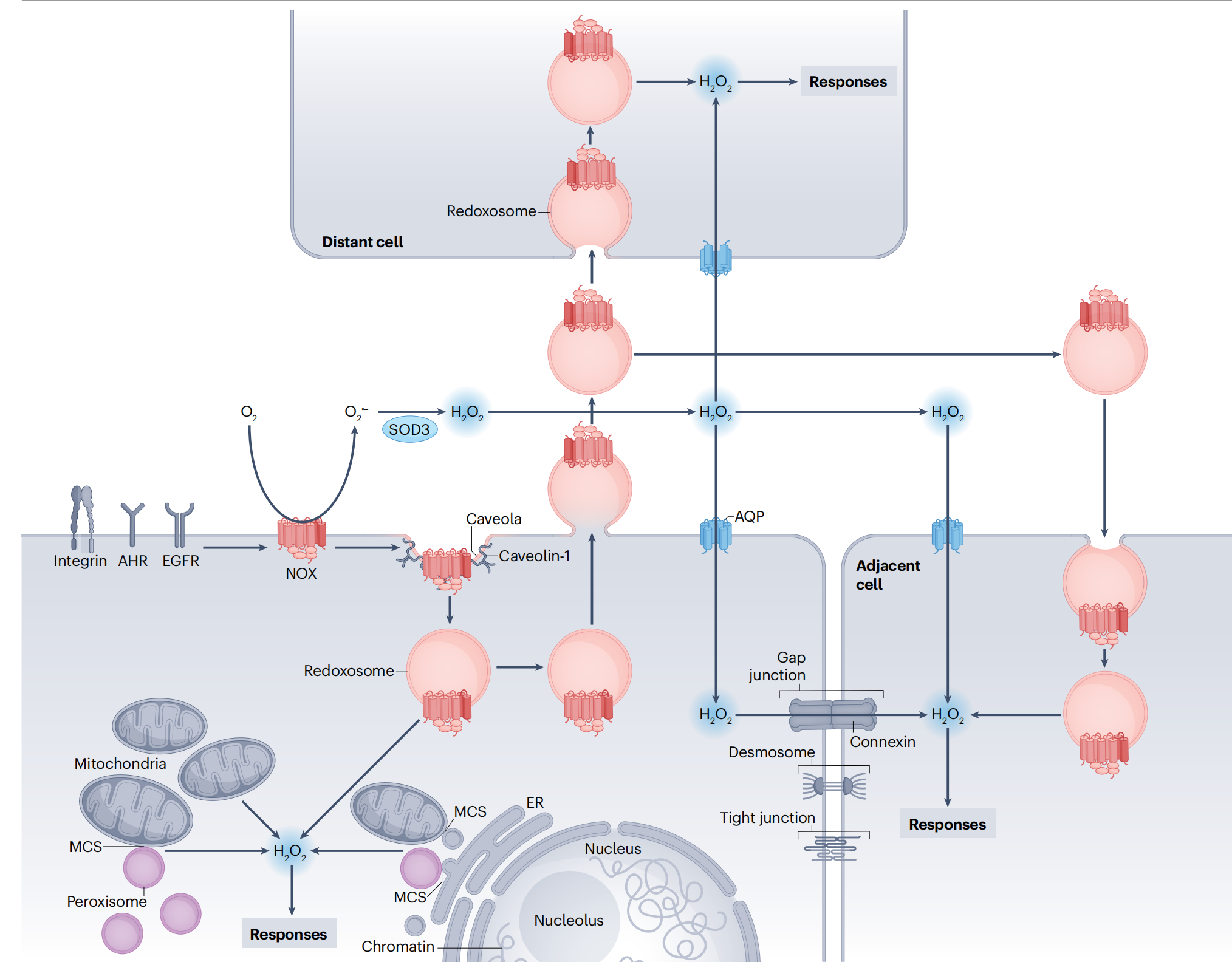
图3:细胞内外氧化还原通信的概览图
这个简化的方案聚焦于H2O2作为一种主要的细胞信号氧化剂。定位于细胞质膜的NADPH氧化酶(NOX)在胞外产生O2•−,然后被超氧化物歧化酶(SOD3)转化为H2O2。H2O2进入细胞要么通过专门的水通道蛋白(即过氧化物通道),要么通过内吞作用形成具有氧化还原活性的内体73,这些内体被称为‘redoxosomes’75,主要在窖状结构处形成。在细胞内,如线粒体、过氧化物酶体和内质网(ER)等细胞器以及大约40种氧化酶产生用于信号传递的H2O2(参见参考文献9)。这三个细胞器通过膜接触点(MCSs)处的膜锚定而紧密接触。细胞间的氧化还原通信通过直接相邻细胞之间的连接子进行间隙连接通信,连接子由两个连接蛋白半通道组成,或者通过水通道蛋白或内吞作用的胞外囊泡(EVs)(前面提到的redoxosomes)。桥粒和紧密连接有助于将细胞彼此连接起来,将接收氧化还原信号的邻近细胞带到产生H2O2信使的细胞附近。蛋白质desmin具有一个半胱氨酸(Cys333),其氧化会导致桥粒破坏259。对于远处的细胞,H2O2信号可以通过内吞作用的redoxosomes或通过水通道蛋白进行。值得注意的是,还存在其他氧化还原通信模式,例如,释放氧化还原活性酶进行细胞间的旁分泌信号传递141,以及从一氧化氮合酶释放一氧化氮。redoxosome和其他EVs在细胞间氧化还原信号传递中的全部潜力有待探索。AHR,芳烃受体;EGFR,表皮生长因子受体。
细胞骨架
肌动蛋白细胞骨架是氧化还原调节的主要目标76,77。在β-肌动蛋白中,Cys374的氧化降低了丝状(F-)肌动蛋白聚合的速率,并诱导肌动蛋白-肌球蛋白解聚,这有助于在细胞迁移过程中细胞骨架的收缩。值得注意的是,细胞骨架与NRF2-KEAP1抗氧化系统之间存在功能关系:KEAP1通过其双甘氨酸重复结构域与肌动蛋白丝结合,这被发现是其抑制NRF2活性所必需的78。作为细胞骨架组成部分的微管也受到氧化修饰79。在细胞骨架的各种丝系统中,包括角蛋白、vimentin和lamin在内的中间丝组成的细胞蛋白在压力韧性中具有氧化还原响应作用80。
过氧化物酶体
过氧化物酶体在氧化还原调节中的作用(在其他地方综述81)已经大大扩展82,83。研究表明,过氧化物酶体产生的H2O2靶向超过400种蛋白质,这些蛋白质位于过氧化物酶体内,并且重要的是,也在细胞质和线粒体中的细胞器外。过氧化物酶体中产生的H2O2通过调节其磺酰化轮廓影响靶蛋白,这有助于细胞器间的氧化还原信号传递84。此外,过氧化物酶体通过抑制过氧化氢酶进入过氧化物酶体来对抗氧化挑战85,从而通过增强过氧化物酶体外过氧化氢酶的能力86,增加细胞对氧化应激的抵抗力。过氧化物酶体的氧化还原信号通过几种机制调节细胞免疫代谢,包括通过NF-κB激活87。
内质网
内质网被认为是膜运输和细胞器功能及动态的主导调节器(随后讨论)88。在其众多功能中,内质网在氧化蛋白折叠以供分泌方面起着主要作用。二硫键的形成是由蛋白质二硫键异构酶和内质网氧化还原酶-1的联合作用完成的,每个二硫键产生一个H2O2 89。维持内质网中的氧化还原平衡对于抵消蛋白质毒性应激及其后果很重要90。
线粒体
线粒体是氧化还原调节的基石91,92,其范围从嵴动力学到与多种氧化还原相关功能的细胞器间交流93,这些功能超越了生物能量学94,95,96。线粒体如何产生氧化物长期以来一直是一个活跃的研究领域97,当前的焦点在于内质网和线粒体之间在称为内质网-线粒体微域的膜接触点上的H2O2通量动态98,99。关于线粒体特别是电子传递链在氧化还原调节中的作用,已有大量文献报道100。两个典型的受氧化还原调节的线粒体过程涉及产热101和昼夜节律102,这里不再详细展开。
细胞核
尽管细胞核只是氧化物生成的次要场所,但它在细胞多个方面的氧化还原调节中发挥作用。位于细胞核中的硫氧还蛋白家族成员核黄素氧化还原酶103是细胞氧化还原控制的关键调节器。它在细胞核和细胞质之间穿梭,并以氧化还原敏感的方式与几种蛋白质相互作用104。DNA对氧化还原调节的进一步间接贡献是DNA中氧化产生的碱基修饰。特别是,与修复糖苷酶OGG1结合的7,8-二氢-8-氧代鸟嘌呤(8-oxoG)作为表观遗传调控标记105。OGG1结合8-oxoG并促进激活蛋白招募106。8-oxoG在氧化还原调节中的生物学意义还扩展到表转录修饰,例如RNA的共价修饰107。染色质重塑因子如赖氨酸特异性组蛋白去甲基酶1A,与其他染色质调节蛋白如组蛋白脱乙酰酶结合,也被认为在DNA修复蛋白和组蛋白去甲基化的近端氧化还原调节中产生H2O2 108。
如前所述,非编码RNA通过影响氧化还原控制机制提供差异基因表达的复杂层次109。尽管氧化应激改变mRNAs52和lncRNAs110的表达,miRNAs111和环状RNAs112改变执行氧化还原调节的酶的表达。例如,miR-23通过调节硫氧还蛋白还原酶-1的表达在骨骼肌分化中发挥功能作用(参考文献113)。p53通路在ncRNA对氧化应激的反应中起着核心作用114。
细胞器间的氧化还原相互作用
亚细胞器之间的氧化还原信号通路成为控制的主要手段。一系列新的细胞器接触领域的阐明以及微域和纳米域的结构和功能鉴定115,116以及分子拥挤117的介绍,为分析引入了新的维度。亚细胞氧化还原组织的一般布局(见参考文献3,9)已经通过在完整细胞和器官内的原位器官研究达到了新的水平,这与缺乏周围细胞微环境的孤立器官制备的研究相对。
内质网-线粒体-过氧化物酶体接触被称为“氧化还原三角”,这三个细胞器通过膜接触点彼此靠近。它们通过水通道蛋白和未识别通道将氧化物产生并运输到细胞质中118。通过将物理上接近的质膜作为氧化还原调节的重要贡献者包括在内,甚至可以称之为“氧化还原四边形”。此外,这些细胞器还与溶酶体和脂滴形成氧化还原相互作用119。内质网和线粒体之间的线粒体相关膜在脂质和Ca2+转移中起作用,并调节这些细胞器之间的氧化还原信号120。过氧化孔蛋白AQP11允许H2O2高效地跨内质网膜运输121,并促进线粒体H2O2向内质网的转移122。质膜水通道蛋白在内质网-质膜接触点与内质网相互作用123。不同组织还表达独特的AQP同工型,这可能影响H2O2通过这些内质网-质膜接触点的运输124。线粒体-质膜接触用于有效地交换代谢物和离子,并生成富含各种蛋白质的信号平台。线粒体甚至可以通过隧道纳米管在细胞之间转移125,这可能促进H2O2的交换以传播氧化还原信号。细胞间的氧化还原通信是器官和系统生理学的一个基本特征(见图3)。这种通信通过几种方式发生,包括直接和间接的从细胞到细胞的扩散、通过连接子的间隙连接通信以及外泌体。细胞间氧化还原代谢物扩散的典型例子是通过乳酸-丙酮酸氧化还原对在细胞和器官之间平衡细胞质NADH/NAD+的氧化还原电位127,这是一个较大的研究领域,参考文献128中有综述。间隙连接通信通过连接子蛋白发生,这些跨膜蛋白在相邻细胞的膜中形成通道,称为连接子129。当这些通道打开时,它们允许小分子(高达约1000 Da)快速在细胞间交换,从而连接两个相邻细胞的细胞质。在连接子蛋白和氧化还原信号之间的相互作用中,通道的开闭状态通过翻译后修饰受到氧化还原调节130。
通过外泌体的细胞对细胞通信是短距离和长距离相互作用的另一种形式131。外泌体,包括外来体和胞外囊泡(微囊泡),在质膜或内溶酶体系统中产生。它们被认为是细胞间通信的关键组成部分,携带并在特定上下文的调节过程中传递选择性货物132。理解外泌体在细胞间氧化还原通信中的功能正在迅速发展133。当各种细胞表面受体被配体结合激活时,会形成专门的氧化还原活性内体,称为redoxosomes(见图3)。这些之前提到过的redoxosomes74也可能被处理成从细胞释放出来的外来体,携带着氧化还原活性成分134和水通道蛋白135。一个细胞间氧化还原信号传递的例证是在巨噬细胞来源的氧化还原活性外泌体转移到神经内体后受损轴突的再生134。在这种情况下,含有NOX2的外来体与受损轴突融合。然后NOX2产生氧化物,使磷酸酶PTEN失活,延长PI3K-AKT通路在受损神经元轴突再生中的诱导134。
细胞周围的氧化还原微环境表现出相当大的多样性。作为对应激反应的细胞间氧化还原信号传播已被形象化为“ROS波”16,136。相邻细胞之间的通信可以引发适应性反应,以增强对环境压力的抵抗力。在哺乳动物细胞中,面向细胞外空间的质膜外叶与细胞外基质接触137。细胞外基质的组织特异性细胞蛋白聚糖轮廓有助于调节氧化还原信号通路,并且糖的功能变化与氧化还原状态之间存在联系,称为糖-氧化还原相互作用138,139。由于糖基转移酶和糖苷酶的作用,例如超氧化物歧化酶等氧化还原活性酶的性质可以被修饰。氧化还原变化与蛋白质糖基化(主要是O-GlcNAcylation)之间的相互关系构成了应激反应信号通路交叉对话的重要组成部分140。关于细胞周围释放硫氧还蛋白、过氧化物还原酶、蛋白质二硫键异构酶和巯基氧化酶的证据表明它们在细胞外氧化还原信号传递中的作用(例如,在调节免疫细胞功能方面)141,142。
这些关于细胞周围环境的观察为体液中细胞外氧化还原控制开辟了新视角143。哺乳动物的细胞外空间由(较大的)间质空间和血管床组成。血浆中H2O2的浓度已被报告为1-5 µM(参考文献144),而使用表面增强拉曼光谱技术探测细胞质膜表面的生物传感器揭示了不均匀分布的斑块,其H2O2浓度在1 µM到12 µM之间,而细胞内H2O2浓度为5 nM(参考文献145)。
四、氧化还原调控的蛋白质组
氧化还原优应激依赖于对细胞刺激产生的氧化剂和还原剂(见图1)。细胞功能的氧化还原调节主要是通过强大的氧化还原活性酶以及各种生物分子来实现的,这些生物分子包括非编码RNA、DNA衍生的分子、脂质和碳水化合物,以及低分子量化合物,如营养供应的辅因子和微量营养素,还有维生素和“生物因子”(生育酚、类胡萝卜素、抗坏血酸和多酚类)。优应激信号通过氧化还原蛋白质组传播,这是一个总称,指的是蛋白质组中经历可逆或不可逆氧化还原反应的组分146。氧化还原蛋白质组依赖于半胱氨酸、甲硫氨酸、硒代半胱氨酸和硒代甲硫氨酸进行可逆氧化还原反应的能力。其他氨基酸,如色氨酸、酪氨酸、精氨酸和蛋白质主链,也可以被氧化147。氧化还原蛋白质组感知、传播并放大氧化还原信号。在氧化还原调节中的信号转导利用了前面提到的小分子活性物质(ROS、RNS、RSS等),它们被总结为活性物质相互作用组148,149(见图1)。在操作上,在氧化还原研究中,全球性的术语氧化还原蛋白质组通常在更狭义的意义上用来指代半胱氨酸氧化还原蛋白质组150。
蛋白质半胱氨酸在氧化还原调节中的作用
蛋白质半胱氨酸的氧化后翻译修饰(Box 2)在细胞水平、组织范围和有机体内具有重要的调节作用151。随着能够区分各种巯基修饰的复杂定量氧化还原蛋白质组学技术的发展152,以及通过质谱检测低丰度蛋白的改进153,现在可以在单细胞水平研究经历可逆半胱氨酸修饰的蛋白质。在年轻和年老的小鼠中进行了全面的细胞特异性和组织特异性蛋白质半胱氨酸氧化的体内评估,生成了一个名为Oximouse的数据集,列出了10个组织中约171,000个半胱氨酸残基的氧化状态153。大约34,000个半胱氨酸位点在约9,400个蛋白质中被发现经历可逆半胱氨酸氧化,这强调了氧化还原信号在哺乳动物中是一个普遍现象。这个汇编可以通过一个交互式网络资源('Oximouse')访问,它使得验证控制每个组织独特生理和代谢特征的不同半胱氨酸氧化网络成为可能。值得注意的是,在解释氧化还原蛋白质组数据时应该谨慎,因为当前方法的非凡敏感性,它们也可以检测到不是氧化还原信号目标的半胱氨酸残基。因此,应该进行后续研究,以探究使用氧化还原蛋白质组学鉴定的候选半胱氨酸的细胞功能154。随着氧化还原蛋白质组学技术变得更加精细和有针对性,关于可逆半胱氨酸开关的细胞效应的宝贵进一步见解将变得可用155。
基于反应的荧光探针用于检测蛋白质半胱氨酸氧化(CysOx)使研究人员能够追踪蛋白质S-亚磺酰化位点,这是巯基氧化过程的第一步,并在活细胞中识别调节性半胱氨酸156。此外,氧化还原蛋白质组学分析可以与化学遗传工具结合,例如D-氨基酸氧化酶,它允许在补充D-氨基酸后在一部分细胞或组织中控制产生H2O2 157。通过将D-氨基酸氧化酶与H2O2感应模块如HyPer结合,可以同时刺激和分析体内的H2O2合成158。这种方法为氧化还原敏感蛋白与改变的代谢之间的相互作用提供了独特的新见解159,正如一项关于H2O2对心脏收缩力影响的研究所示160。HyPer探针还被用来通过将探针融合到单个酵母蛋白的C末端,创建可筛选的酵母菌株库,从而在酵母细胞中识别H2O2微域161。
氧化还原蛋白质组的联合分析揭示了,在细菌、果蝇、蠕虫、小鼠和人类组织中,氧化还原敏感蛋白几乎嵌入到细胞的每一个代谢途径和生理过程中162,163。蛋白质半胱氨酸对氧化的特异性和敏感性是由周围物理化学微环境的局部静电调节所决定的,并且受到邻近带电侧链(如Arg或Lys)的强烈影响153。特别是锌中心的半胱氨酸配位金属中心也是氧化性半胱氨酸修饰的目标164,165。根据它们在细胞中的特定位置,蛋白质如蛋白磷酸酶可以发现处于不同类型的氧化修饰中166。
巯基氧化影响蛋白质功能的机制是多种多样的,通常需要详细的案例逐一生化和结构分析;在表1中给出了一些突出的例子。许多活性位点半胱氨酸可以成为氧化修饰的目标,导致生理相关的功能性氧化还原开关。一个典型例子是糖醛酸-3-磷酸脱氢酶,其活性位点半胱氨酸可以通过几种类型的氧化后翻译修饰被修改,引发特定于后翻译修饰的细胞反应167。响应于细胞氧化剂的适度增加,糖醛酸-3-磷酸脱氢酶的氧化失活将葡萄糖代谢重定向到戊糖磷酸途径,这增加了NADPH的产生,以维持细胞氧化还原状态。许多其他酶的活性也通过可逆的半胱氨酸氧化而降低,从而导致代谢的重新配置以进行细胞信号传导168。
位于非活性位点的半胱氨酸的巯基氧化也可能导致功能性结果,范围从蛋白质降解和蛋白质重新定位到获得新的蛋白质功能。这些是由蛋白质构象变化触发的,这些变化从小的改变周围的氢键网络169到可以启动局部展开事件的主要结构重排170,寡聚状态的变化171或溶解度172。这些构象变化取决于受影响半胱氨酸巯基的分子内相互作用网络,并通过特定的巯基氧化产物(如S-谷胱甘肽化或二硫键形成)或简单的稳定巯基丢失173介导。例如,酵母ATPase GET3结合了这些特征的一些。在两个关键半胱氨酸最初氧化后,GET3局部展开,寡聚化,并同时从ATP依赖性靶向因子切换到有效的ATP独立伴侣,保护蛋白质免受蛋白质氧化的有毒效应173。
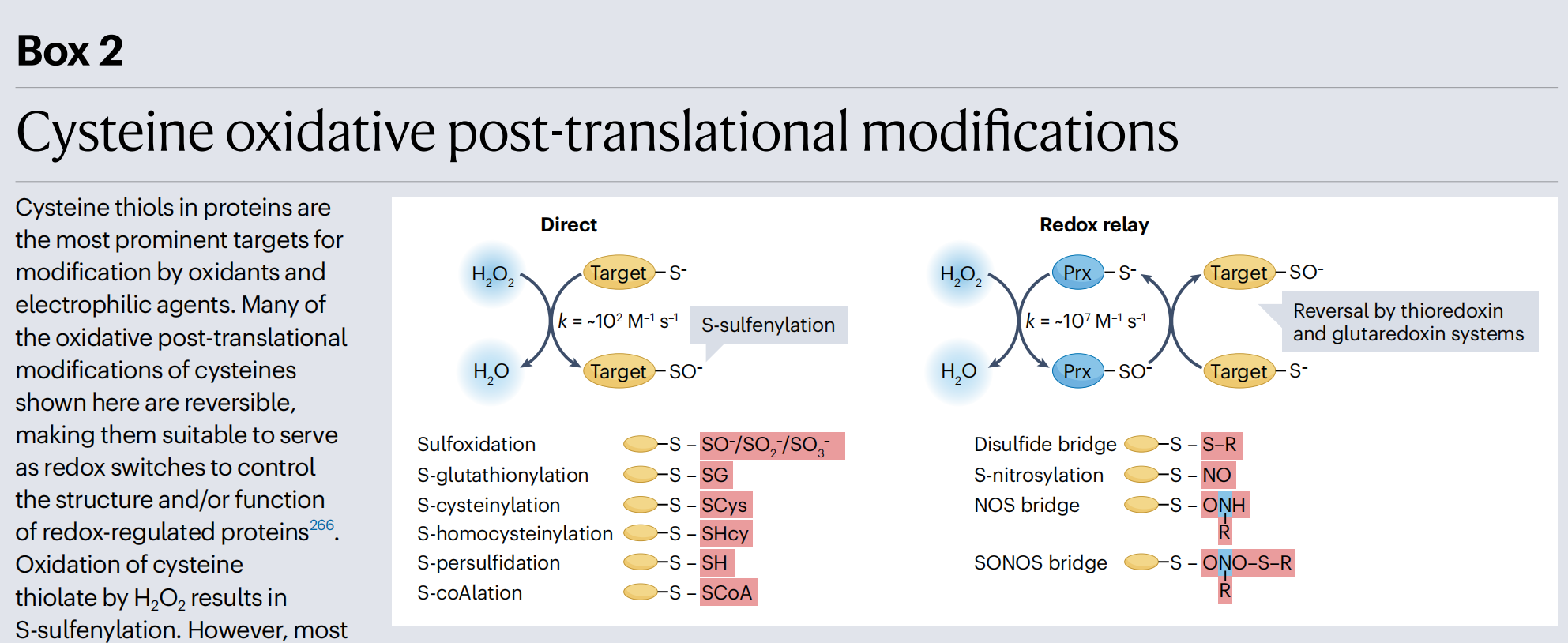
Box 2 半胱氨酸氧化后翻译修饰
蛋白质中的半胱氨酸巯基是氧化剂和亲电试剂修饰的最主要目标。这里显示的许多半胱氨酸的氧化后翻译修饰是可逆的,使它们适合作为控制氧化还原调节蛋白质的结构和/或功能的氧化还原开关266。半胱氨酸巯基的氧化会导致S-硫酰化。然而,大多数蛋白质巯基与H2O2的反应很慢,限制了直接巯基氧化的影响。相比之下,过氧化物还原酶(Prx,右)含有迄今为止最活跃的半胱氨酸,它们与H2O2的二级反应常数约为107 mol−1 s−1,因此比大多数其他活性蛋白质半胱氨酸高五到六个数量级(左)267。因此,过氧化物还原酶是S-硫酰化的主要目标。然后过氧化物还原酶氧化靶蛋白中的巯基,这被称为氧化还原中继机制268。硫酸酯的形成使过氧化物还原酶失活,这可以由GSH过氧化物酶和硫氧还蛋白迅速逆转。然而,硫酸酯也可以被H2O2进一步氧化为亚硫酸酯269。亚硫酸酯可以被硫氧还蛋白逆转。通过H2O2对亚硫酸酯的进一步氧化产生磺酸酯,这在氧化应激期间发生。或者,硫酸酯可以与含巯基的化合物反应,形成与GSH(R-SSG)(S-谷胱甘肽化)168、半胱氨酸(R-SS-Cys)、同型半胱氨酸(R-SS-HCys)270或辅酶A(R-SSCoA)271的混合二硫化物,或在与附近蛋白质半胱氨酸反应时参与分子内或分子间二硫键(R-SSR)。半胱氨酸巯基与RNS如一氧化氮(NO)反应导致S-亚硝基巯基(R-SNO)272,而其与硫化氢(H2S)的相互作用导致过硫化(R-SSH)270,273。过硫化的半胱氨酸可以还原回原生巯基224。其他氧化性半胱氨酸修饰包括半胱氨酸-赖氨酸(NOS)274和半胱氨酸-赖氨酸-半胱氨酸(SONOS)275氧化还原桥,这些是在氮(N)、氧(O)和硫(S)之间发生的蛋白质交联。这些氧化后翻译修饰的大多数的还原是由硫氧还蛋白和谷氧还蛋白家族的成员催化的,它们使用NADPH作为其最终电子供体。
在氧化还原调控中,蛋白质的甲硫氨酸 (Met) 可以被氧化成甲硫氨酸亚砜 (MetO),然后通过立体特异性的甲硫氨酸亚砜还原酶 (Msrs) 再次还原为甲硫氨酸174。甲硫氨酸的氧化在硫原子上产生了一个手性中心,形成了两种异构体,R-MetO 和 S-MetO174。相对应地,存在两种Msr同工酶来还原这些中心并促进调控的特异性:MsrA(针对R-MetO)和MsrB(针对S-MetO)174,175。蛋白质甲硫氨酸残基的氧化可以由MICAL家族的单加氧酶催化,并与MsrB1一起控制,这一过程是通过单体肌动蛋白的聚合作用来调控的176。已经鉴定出多个功能性目标,它们平衡了蛋白质中的甲硫氨酸和氧化型甲硫氨酸(MetO)的水平,范围从钙离子调节、泛素化系统到转录因子(例如FOXO)174。
在氧化还原调控和保护中,蛋白质硒代半胱氨酸和硒代甲硫氨酸也发挥作用。硒代半胱氨酸是第21个蛋白质氨基酸,包含在25种人类蛋白质中,其中许多在氧化还原调控中起作用177。硒代半胱氨酸比半胱氨酸具有更高的亲核性和更低的pKa值,导致其具有更高的氧化还原反应性177。硫氧还蛋白还原酶和谷胱甘肽过氧化物酶是硒蛋白组中最突出的成员。它们在氧化还原调控中的作用已被广泛研究(最近的综述见参考文献178)。硒代甲硫氨酸在一些植物和真菌中合成,通过食物链进入哺乳动物体系,并直接替代甲硫氨酸掺入蛋白质中。它通过自由基介导的机制与氧化剂反应,其反应速率大约比甲硫氨酸高10倍179。硒代甲硫氨酸氧化物可以通过谷胱甘肽迅速有效地还原回硒代甲硫氨酸,建立了对抗活性氧和活性氮的有效防线180。
在氧化还原调控中,蛋白质酪氨酸的氧化导致形成稳定的共价连接的邻位二酪氨酸或3,4-二羟基-L-苯丙氨酸(L-dopa)181。最近在大肠杆菌中的蛋白质组学研究揭示了70多种不同的蛋白质,在暴露于外源或内源压力时对二酪氨酸的形成敏感182。然而,鉴于尚未(至少目前)鉴定出还原系统,因此酪氨酸氧化可能是氧化损伤的结果,而不是用来调控蛋白质活性的氧化还原182。蛋白质酪氨酸被过氧亚硝酸盐硝化形成3-硝基酪氨酸,这通过超氧阴离子与•NO反应形成过氧亚硝酸盐的扩散控制反应间接与氧化还原调控相关183。因此,硝化蛋白质组在细胞信号传导中发挥作用10,184。
五、分子和生物体的氧化还原异质性
细胞内可以采取不同氧化还原状态的生物分子的分布是不均匀的,含有可氧化半胱氨酸巯基的蛋白质可以以多种不同的形式存在,称为“氧化形态”185。例如,一个含有三个半胱氨酸的蛋白质可以采取八种功能上不同的氧化状态(如果只考虑两个半胱氨酸的氧化还原状态),这为细胞空间内的单个蛋白质分子提供了独特的“氧化还原特征”。如果考虑到细胞产生多种类型的氧化剂,氧化形态的异质性可以通过几个数量级进一步增加186。这种氧化形态模式显著增强了细胞内蛋白质的氧化还原异质性。由于氧化还原活性蛋白质半胱氨酸的形式远不止两种(见图,Box 2),因此在给定细胞条件下蛋白质可能的氧化形态数量大大增加。
在个体细胞水平上也存在着氧化还原异质性。随着遗传编码的体内氧化还原传感器蛋白的发展,例如感应H2O2的HyPer187或GSH氧化还原状态传感器Grx-roGFP188,即使是高度同步的克隆细胞群体189或整个同基因生物体如秀丽隐杆线虫190,191也显示出明显的个体间差异在氧化还原状态上。对具有不同氧化还原状态的克隆细胞亚群或秀丽隐杆线虫的分析揭示了在整体群体研究中未被注意到的氧化还原敏感过程。这些研究表明,生命早期的内在氧化还原异质性有助于个体间的表观遗传景观、表达模式以及最终生物体的寿命的差异192。
细胞过程的氧化还原调控
细胞的氧化还原环境通过氧化还原调控蛋白对大多数细胞过程进行调控。一些显著的过程示例如图4所示并在此总结。氧化还原环境微调代谢途径并调节代谢物组,这影响酶的活性,例如NAD+依赖性组蛋白去乙酰化酶(即沉默信息调节蛋白),从而改变表观基因组193,194。响应氧化剂水平变化的氧化还原调控组蛋白修饰酶会影响基因表达,促进可能持久甚至跨代的记忆效应192,195。氧化剂可以上调转录因子生物合成或改变它们的稳定性,例如之前讨论过的NRF2在转录、mRNA稳定性和翻译水平上的变化。转录因子活性通过氧化还原调控的激酶和磷酸酶引发的翻译后修饰而发生改变39。几乎蛋白质合成的每一个方面,从mRNA稳定性和翻译起始到核糖体结构和转运RNA动力学,都涉及氧化还原敏感组分,负责根据细胞的氧化还原条件调整全局蛋白质翻译速率3。生理水平的氧化剂还调控激酶、磷酸酶和转录因子的活性,以诱导增殖、分化和迁移11,196,197,198。最后,受调控的细胞死亡(RCD),即像凋亡这样的途径,涉及氧化还原敏感蛋白来控制细胞生存还是死亡的决定199。尽管它们的氧化通常诱导凋亡200,但在执行者半胱天冬酶——最终负责凋亡性细胞死亡的蛋白酶——的活性位点半胱氨酸的修饰被用来保护细胞免受不希望的不可逆凋亡性RCD程序的激活199(图4f)。例如,在静息的HeLa细胞中,前半胱天冬酶3和9的发生持续性过硫化(因此失活)作用,并通过硫氧还蛋白介导的去过硫化作用抵消201。氧化还原修饰的类型以及促凋亡信号如何激活氧化还原蛋白进而激活半胱天冬酶似乎取决于细胞类型和具体情境199。铁死亡,一种由Fe2+介导的不饱和脂肪酸过氧化触发的非凋亡形式的RCD202,被GSH过氧化物酶GPX4有效阻断,后者使用硒代半胱氨酸基催化来还原脂质过氧化物203。硫氧还蛋白的丧失也有助于铁死亡,可能是通过氧化剂积累及其对GSH-谷氧还蛋白系统的影响204。用一种小分子ferroptocide处理,它能共价修饰硫氧还蛋白活性位点半胱氨酸,非常有效地引发癌细胞中的铁死亡204。参与RCDs的其他氧化还原敏感参与者包括p62,涉及主要由氧化剂介导的DNA损伤调控的RCD途径parthanatos205,涉及oxeiptosis的氧化还原敏感KEAP1(参考文献206),这是一种ROS依赖性、半胱天冬酶独立的RCD,以及涉及炎性细胞死亡程序焦亡的核苷酸结合域样受体蛋白3207。

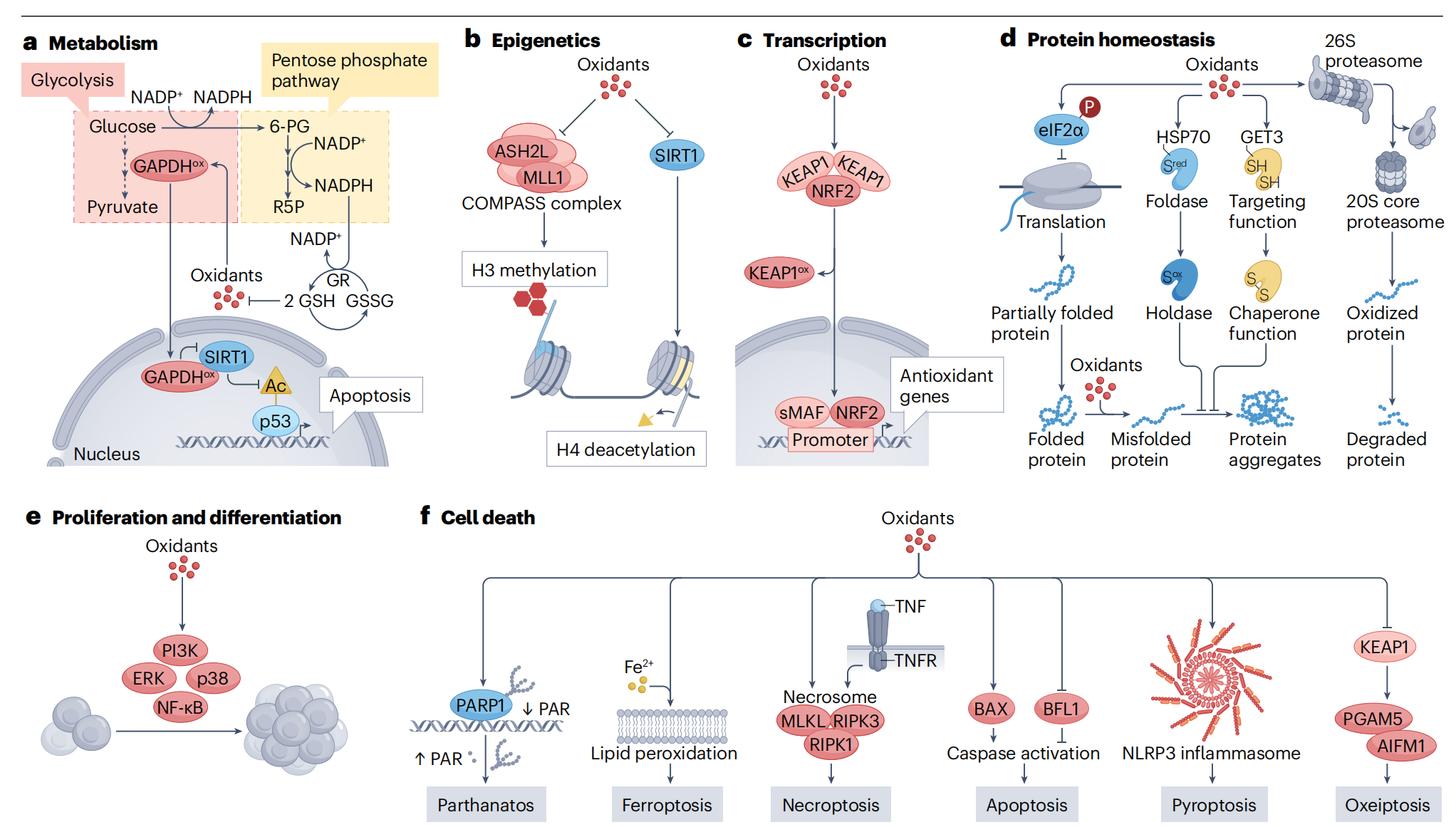
图4:氧化还原调控下的主要细胞过程。
a,代谢:作为氧化还原控制代谢途径的典型例子,糖酵解的核心酶——甘油醛-3-磷酸脱氢酶(GAPDH)在其活性位点含有一个氧化还原敏感的半胱氨酸。它的氧化修饰导致脱氢酶功能的损失(GAPDHox)并阻断糖酵解。葡萄糖被转向戊糖磷酸途径以形成NADPH,这是恢复还原型谷胱甘肽(GSH)池所必需的。GAPDHox还可以穿梭到细胞核中,在那里它氧化修饰并失活依赖于NAD的蛋白去乙酰化酶sirtuin-1(SIRT1)。未能去乙酰化p53可能导致细胞凋亡。b,表观遗传学:细胞内的表观遗传景观由其主导的氧化还原环境微调。这里展示了两个氧化还原敏感的组蛋白修饰酶:组蛋白赖氨酸N-甲基转移酶2A(MLL1,也称为KMT2A),是COMPASS复合体的成员,含有一个氧化还原敏感的锌中心,其氧化导致全球H3K4me3水平下降。SIRT1的氧化导致其去乙酰化酶功能的失活,从而导致组蛋白上乙酰化赖氨酸的积累。这有助于基因表达的改变。c,基因表达:氧化剂和亲电子物质直接激活特定的转录因子,导致基因表达的变化(表1)。一个突出的例子是类似Kelch的ECH相关蛋白1(KEAP1),它在非应激条件下结合核因子红细胞2相关因子(NRF2)并将其靶向降解。KEAP1中氧化还原敏感半胱氨酸的氧化导致NRF2的释放,随后NRF2重新定位到细胞核,与小MAF(sMAF)家族蛋白异源二聚体化,并激活编码抗氧化防御系统蛋白质的基因。d,蛋白质翻译、折叠和降解:这些过程通过氧化还原调控蛋白直接或间接控制。氧化应激导致通过引起启动因子(例如eIF2α)的磷酸化、转运RNA动态和核糖体功能的变化,从而全局限制蛋白质合成。ATP依赖性折叠伴侣(即折叠酶)热休克蛋白70(HSP70)或蛋白靶向因子GET3作为氧化应激激活的伴侣的例子。关键硫醇的氧化修饰导致它们转变为ATP独立型保持伴侣(即持留酶),它们结合未折叠蛋白并防止其聚集。这种应激特异性激活补偿了氧化应激介导的细胞ATP水平下降和随之而来的ATP依赖性伴侣的功能下调。蛋白质泛素化和26S蛋白酶体功能受到氧化还原介导的变化抑制,而20S蛋白酶体活性增加以降解氧化损伤的蛋白质。e,增殖、分化和迁移:许多诱导增殖和分化的激酶和转录因子都受到氧化还原控制。激活是通过半胱氨酸开关的直接氧化或通过上游途径抑制剂的间接抑制发生的。磷脂酰肌醇-3-激酶(PI3K)或细胞外信号调节激酶(ERK)的激活通过氧化还原敏感的上游磷酸酶如磷酸酶和张力蛋白同源物(PTEN)和蛋白酪氨酸磷酸酶1B(PTP1B,未显示)的氧化失活而延长。核因子κ-轻链增强子(NF-κB)通过半胱氨酸氧化直接激活,并通过NF-κB抑制剂的抑制间接激活。同样,应激激活的丝裂原活化蛋白激酶(MAPK)p38通过氧化剂的存在直接和间接激活。f,受调控的细胞死亡(RCD)模式:parthanatos是一个主要由氧化剂介导的DNA损伤调控的RCD途径。多聚[ADP-核糖]聚合酶1(PARP1)的过度激活产生过多的多聚A-核糖(PAR),导致从线粒体释放促凋亡因子,导致细胞死亡205。铁死亡是一种非凋亡形式的RCD,由Fe2+介导的不饱和脂肪酸过氧化触发202。坏死是由肿瘤坏死因子(TNF)介导的,它激活一个称为坏死体的多蛋白复合体。坏死体的一个氧化还原敏感参与者是受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1),在氧化后,它经历自磷酸化,与RIPK3和混合谱系激酶结构域样蛋白(MLKL)相互作用,并形成活性坏死体260。凋亡是由(pro)半胱天冬酶的蛋白水解级联反应介导的,它们在激活形式下降解细胞成分并导致细胞死亡。凋亡调节因子BAX的氧化激活或抗凋亡因子BFL1(也称为BCL2A1)的氧化失活触发凋亡200。焦亡是一种炎症性细胞死亡形式,涉及多蛋白复合体炎性体,其成员半胱天冬酶1激活孔复合体gasdermin D。含有核苷酸结合域(NOD)样受体蛋白3(NLRP3)作为其传感器模块的炎性体似乎对氧化剂特别敏感207。Oxeiptosis是一个直接受氧化还原敏感参与者KEAP1控制的RCD途径206。KEAP1氧化后,线粒体丝氨酸/苏氨酸磷酸酶PGAM5被释放,并随后去磷酸化并激活死亡因子,促凋亡因子线粒体1(AIFM1)。
环境适应性的氧化还原调节
在生命的整个过程中,生物体依赖于与外部环境的相互作用。"暴露组"(Exposome)指的是一生中暴露于各种生物和非生物因素的模式,包括至关重要的营养成分和氧气供应。暴露组中有许多化学和物理成分,例如致癌物、空气污染、噪音、电离辐射和太阳辐射,以及感染和生活方式因素。在人类和其他动物中,暴露组相互作用的主要位置是上皮-环境界面,包括胃肠和肺部空间、皮肤和眼睛。这些地方是大量微生物的家园,统称为微生物组。营养、化学和物理暴露具有有益以及潜在的危险效应,这取决于剂量和时空应用。监测暴露组的信号并将其整合到响应和记忆功能中是各种应激反应的基本角色(参见前面讨论的内容)。框3提醒我们关注暴露组,并强调氧化还原调节和芳香烃受体(AHR)的作用,后者是一个“暴露组受体”。暴露组与蛋白质组、基因组和表观基因组的界面涉及一个氧化还原网络,该网络将输入信号整合为适应性细胞反应输出(图1)。AHR信号在多个生命过程中的复杂作用开始得到阐明,例如在衰老过程和免疫细胞代谢的氧化还原调节中。氧化还原变化的记忆力效应已被证明可以调节免疫应答。
框3 外源性暴露于氧化物
终身暴露于各种线索和影响的配置,称为“暴露组”,不仅包括至关重要和有益的,还包括与氧化还原调节相关的潜在的有害成分。其中最重要的是营养和氧气供应,还有化学、物理、感染和生活方式的暴露组成分。氧化还原信号网络作为暴露组和细胞行为变化诱导之间的接口。
营养暴露。营养的一个基本作用是为氧化还原调节提供组织特异性和细胞特异性的构建块。这包括微量营养素和矿物质用于氧化还原酶,以及低分子量的氧化还原活性生物因子,如维生素和植物化学物质(类胡萝卜素、黄酮等)。宏量营养素提供NADPH和FADH2的底物氢以供生物能量使用。潜在的有毒饮食成分可以通过氧化还原过程代谢和解毒,特别是单加氧酶(细胞色素P450)、双加氧酶和其他氧化酶。
化学暴露。非营养化学物质构成了环境剂的巨大群体,尤其是污染物,这是毒理学的关注焦点。氧化应激和炎症是环境伤害的基本特征。芳香烃受体(AHR)用于启动对各种化学暴露的氧化还原相关反应(“暴露组受体”)。AHR是一种感应暴露组线索的配体激活转录因子,它激活了多种途径的复杂转录反应,并通过调节器和共调节器来微调反应。像二恶英类化合物这样的AHR配体与表皮生长因子受体(EGFR)的细胞外结构域相互作用,从而影响其在氧化还原调节中的功能。人类环境暴露组的生物监测工作流程是可用的。
物理暴露。通过超生理学水平的太阳辐射和其他形式的辐射引起的有害氧化还原反应引起关注。这些包括电离辐射和电磁辐射、热、噪音和机械挑战,对此有强大的应激反应。例如,噪音引起的心血管和神经失调是通过氧化还原过程介导的。皮肤老化可能是由紫外线辐射或空气污染的氧化挑战引起的。
感染和免疫应答。细菌和病毒感染是机体外部挑战的一部分,氧化还原调节在防御机制中起作用。例如,氧化剂在胃肠道免疫保护中至关重要。
生活方式因素。在暴露组中包含的各种行为模式中,体育锻炼通过增加NADPH氧化酶引发的H2O2产生以及通过增强脂质过氧化作用与氧化还原活性相连。在有氧训练中,系统性氧化还原通信是通过循环的细胞外囊泡介导的。循环因子,如生长因子和细胞因子,统称为运动素,介导锻炼对氧化还原平衡的影响。
结论与展望
在阐述氧化还原调控的基本原理时,本综述旨在提供一个概览,介绍细胞功能在有氧代谢中如何维持的基本准则。为了持续的功能运作,细胞及整个生物体使用一个协调的氧化还原控制系统,该系统包括多方面的输入线索,这些线索导致产生氧化还原信号,并随后转导至特定目标位点。这些位点反过来激活基因组、表观基因组、蛋白质组以及其他“-组”,以在一个协调的网络活动中产生功能性响应结果。总体设置(图1)由适当的反馈系统完成,这些系统会加强或减弱氧化还原信号,其详细机制仍需揭示。鉴于这种协调努力的持续活动性质,这种状态被称为稳态动力学,也被欧压力这一术语所暗示。通过蛋白质半胱氨酸的翻译后氧化修饰(氧化还原蛋白质组)和通过氧化还原敏感转录因子的基因激活机制(表1)的生物化学信号已在很大程度上得到阐明。此外,随着亚细胞器的新相互作用被发现(图3),细胞内和细胞间的氧化还原通信途径也变得更加清晰。描述细胞氧化还原反应组织的一系列原则,即氧化还原代码(框1),描述了氧化还原调节对生命过程的贡献22。
然而,仍有几个关键问题有待回答。一个主要问题涉及氧化还原调节的层次结构。正如已发表文献中提到的,以及在本综述的几个实例中,存在所谓的主调节器,包括内质网88、非编码RNA111、AHR216、核红蛋白104、PGC-1α217、miRNA218等,但问题来了:谁来调节调节器?换句话说,谁来监督“守门人”219?整体指挥是如何运作以将不同信号整合为共同响应的,即什么原则构成剂量效应的基础?是什么决定了“设定点”?例如,如何识别决定健康结果与细胞死亡途径之间的“临界点”?要更好地理解这些问题,将需要在时空模式上进行网络分析,考虑反馈和前馈回路,即基因表达反馈回路220。另一个需要考虑的维度是氧化还原调节与其他主要代谢调节方式如磷酸化/去磷酸化、钙信号和电化学信号的相互作用。
另一个新兴研究领域涉及各种类型的活性物种之间更细致的相互作用,例如ROS、RNS、RSS等。H2O2作为主要的氧化还原信号分子一直是本综述的重点,但对其他ROS如超氧阴离子连同一氧化氮10、单线态氧分子221、激发态醛类222、脂质过氧化物223或硫醇化反应在氧化还原调节中的作用224等新见解正在涌现。
正如本综述所述,生理学上的氧化还原过程调节构成了健康225,226和健康老化过程227的基本特征。与此不同,疾病过程是由氧化还原失衡和氧化还原应激引起的或与之相关。这个快速增长的研究领域在这里没有详细涉及。关于有限数量的器官系统(例如,心脏病学、神经学、免疫学、代谢、骨骼肌、癌症、老化和神经退行性疾病)的氧化还原医学方面已在其他地方回顾4,9,228,229,230。以细胞特异性和位点特异性的方式在适当的时空传递中进行氧化还原控制,将有助于精确氧化还原医学231的发展。氧化还原过程的药理学正在从针对单一分子靶点转向网络医学,应用系统生物学范式来研究病因机制而非治疗症状232,233。这取决于对抗氧化剂作用机制的更好理解234。进一步阐明环境、营养、微生物组和感染暴露等终身暴露与基因组相互作用的分子细节,是一个重大的研究挑战。
https://blog.sciencenet.cn/blog-41174-1433535.html
上一篇:Si氢剂对幼鼠神经毒性的保护作用
下一篇:衰老的时钟是如何运转