博文
线粒体激活炎症小体己糖激酶是关键,活性氧可能没啥作用
|
线粒体是细胞代谢的重要场所,通过氧化还原代谢维持细胞稳态,通过程序性细胞死亡途径维持机体稳态。线粒体功能障碍可导致线粒体活性氧 (mtROS) 生成增加、线粒体 DNA (mtDNA) 释放到细胞质中或心磷脂暴露在线粒体外膜上,可有效激活含有 3 (NLRP3) 炎症小体的 nod 样受体家族 pyrin (PYD) 结构域以驱动炎症反应。
NLRP3炎症小体信号传导很复杂。它被广泛的结构和化学上不相关的刺激激活,这些刺激汇聚在一起提供细胞应激的关键指示。NLRP3的上下游信号传导似乎涉及几个细胞器和不同的NLRP3亚细胞位置,每个位置都可能是刺激特异性的。因此,不同激活剂NLRP3信号传导的统一机制仍然难以捉摸。
之前一份报告表明,己糖激酶(一种胞质糖酵解酶)作为微生物传感器。在静息细胞中,己糖激酶与线粒体外膜相关。己糖激酶检测N-乙酰葡糖胺,这是细菌肽聚糖的一种成分,当细菌被巨噬细胞和树突状细胞吞噬时,它可以进入细胞质。己糖激酶与N-乙酰氨基葡萄糖的相互作用抑制其酶活性并触发该葡萄糖激酶与线粒体外膜的解离。这可以激活NLRP3炎症小体信号传导。
在《科学免疫学》中,Baik等人揭示了己糖激酶重定位诱导NLRP3线粒体募集和炎症小体功能的事件。作者提出,己糖激酶不仅能感测N-乙酰葡糖胺,还能间接感测典型的NLRP3激动剂,如细胞外三磷酸腺苷(ATP)、晶体和尼革菌素,驱动己糖激酶从线粒体释放并重新定位到细胞质。过去的报告表明,静息细胞中的己糖激酶与电压依赖性阴离子通道(VDAC)结合,VDAC调节代谢物,离子和核苷酸进出线粒体,以及线粒体内膜的线粒体通透性过渡孔(mPTP)。Baik等人提出NLRP3激动剂诱导的己糖激酶从线粒体释放导致线粒体外膜内的VDAC寡聚化,触发线粒体表面由VDAC低聚物组成的孔的形成(图1)。目前尚不清楚不同的NLRP3激动剂如何诱导己糖激酶重定位。该机制的这一方面值得进一步调查。作者使用竞争方法迫使己糖激酶从VDAC中解离,表明VDAC释放的己糖激酶足以诱导VDAC形成寡聚孔,并且VDAC寡聚化足以触发NLRP3炎症小体信号传导。VDAC低聚物孔不会严重损害线粒体结构,因为细胞色素c仍然保留在线粒体内。在存在 VBIT-4(一种 VDAC 寡聚化的细胞渗透性抑制剂)的情况下,用细胞外 ATP 处理的脂多糖 (LPS) 引发的鼠骨髓衍生巨噬细胞 (BMDM) 中的 VDAC 聚集受到阻碍,证实了 Karin 实验室的最新结果,即 NLRP3 激动剂诱导 NLRP3 信号传导上游的 VDAC 寡聚化。
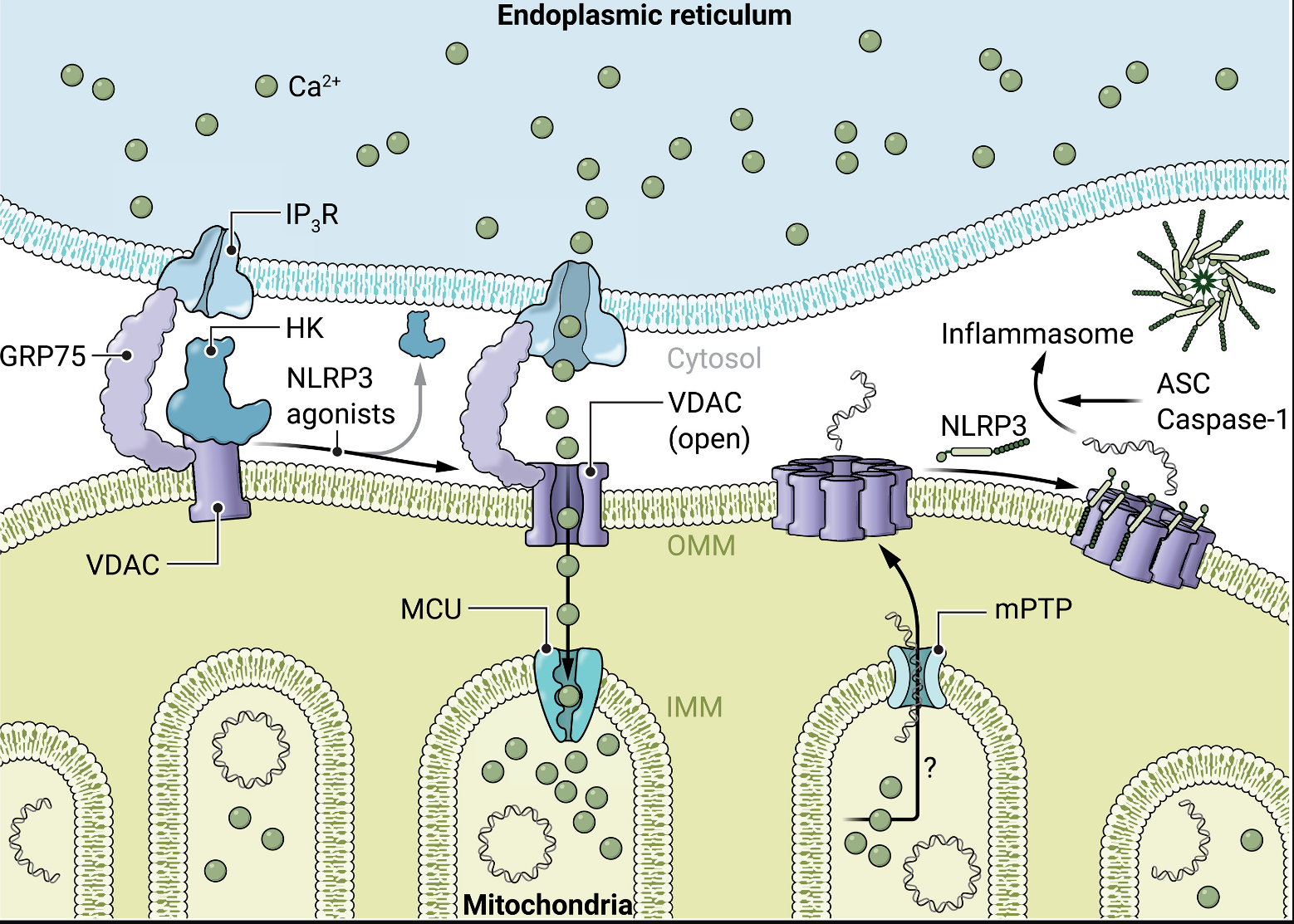
图 1.NLRP3激动剂诱导线粒体释放己糖激酶,触发VDAC寡聚化、mtDNA重定位和NLRP3信号传导。
Baik及其同事接下来探讨了己糖激酶如何调节VDAC寡聚化和由此产生的NLRP3信号传导。线粒体通常与内质网(ER)非常接近,这些结构在所谓的线粒体相关膜上形成接触。在静息细胞中,线粒体上的己糖激酶-VDAC复合物与ER定位的肌醇三磷酸受体(IP3Rs),调节这些膜微域处的钙通量。Baik及其同事因此探索了Ca2+的潜在功能VDAC齐聚中的助焊剂。他们观察到细胞外ATP触发野生型和Nlrp3线粒体中钙水平升高−/−LPS引发的BMDMs,表明这发生在NLRP3信号传导的上游。对于钙离子要淹没线粒体基质,该离子需要穿过三层膜——ER膜和内外线粒体膜。作者确认,IP3Rs 是 钙离子所必需的己糖激酶迁移下游ER的外排;抑制ER居民IP3Rs使用2-氨基乙氧基二苯硼酸盐抑制ATP诱导的钙进入线粒体,并阻断LPS引发的BMDM中的VDAC寡聚化和白细胞介素-1β(IL-1β)释放。 确切地了解己糖激酶重定位如何激活 IP3Rs目前尚不清楚。先前的研究涉及含有IP的蛋白质复合物3R、VDAC 和葡萄糖调节蛋白 75 (GRP75) 介导钙流从 ER 流过线粒体外膜。事实上,小鼠BMDM中的GRP75敲低减少了ATP诱导的钙流入线粒体并部分抑制了IL-1β的释放。线粒体内的线粒体钙单转运体(MCU)是促进钙2+摄取到线粒体基质中的主要通道。MCU抑制剂钌红阻断ATP诱导的线粒体钙摄取并适度抑制IL-1β释放。因此,Baik及其同事提出了一个模型,其中NLRP3激动剂(如细胞外ATP)引起己糖激酶与VDAC的解离,并由此产生ER的Ca2+流向线粒体;在这里,钙流动由ER常驻IP加速3Rs与外膜中的GRP75和VDAC以及线粒体内膜中的MCU结合。作者进一步提出,钙流入线粒体会触发VDAC寡聚化和NLRP3依赖性IL-1β释放。
长期以来,线粒体应激一直被认为是NLRP3激活的有效刺激,NLRP3激活作用被提议用于线粒体应激的各种指标。最近,有人提出氧化的mtDNA(ox-mtDNA)片段通过VDAC进入细胞质,与NLRP3相互作用并激活NLRP4(8)。非凋亡巨噬细胞中的ox-mtDNA受1-氧鸟嘌呤DNA糖基化酶-1(OGG1)修复并在线粒体基质中脱氧,或被瓣状核酸内切酶-1(FEN4)切割成片段,这些片段通过mPTP和VDAC离开线粒体(3)。这种胞质ox-mtDNA触发NLRP1炎症小体信号传导并刺激cGAS-STING途径释放4型干扰素(3)。为了确定mtDNA是否调节己糖激酶重定位下游的VDAC寡聚化,Baik等人在溴化乙锭(EtBr)存在下培养小鼠BMDM以消耗mtDNA。mtDNA去除抑制NLRP1激动剂诱导的IL-3β而不影响VDAC寡聚化,将mtDNA置于NLRP3的上游和VDAC寡聚化的下游NLRP3信号层次结构中。重要的是,Baik及其同事进行了互补实验,他们将外源性mtDNA转染到mtDNA耗竭细胞的细胞质中,以评估这是否会恢复NLRP2信号传导;对于这些实验,作者使用Aim2缺陷的巨噬细胞来消除黑色素瘤-2(AIM1)炎症小体中缺失的双链DNA激活的潜在混杂效应。仅外源性胞质mtDNA不足以诱导LPS引发的IL-β释放,但响应细胞外ATP恢复IL-1β释放。Baik等人还表明,通过邻近连接测定法测量,内源性mtDNA的消耗细胞抑制了ATP刺激的NLRP3募集到VDAC寡聚物中。这表明mtDNA胞质进入是必要的,但不足以激活NLRP3。作者推测mtDNA可能作为VDAC寡聚物和NLRP3之间相互作用的桥梁,以帮助NLRP3线粒体募集和激活。
ATP在NLRP3信号传导中的功能多种多样。NLRP3蛋白有三个主要结构域:参与下游信号传导的PYD结构域,中央NACHT结构域和富含亮氨酸的重复序列(LRR)。ATP 直接与 NLRP3 相互作用,在 NLRP3 中被 NACHT 结构域内的 NLRP3 腺苷三磷酸酶 (ATPase) 酶功能消耗,以推动将 NLRP6 转化为其开放和活性结构所需的构象变化 (2)。ATP还作用于细胞外的P7X<>受体,P<>X<>受体是ATP门控阳离子通道,允许Na+或Ca2+离子流入进入细胞以交换K离子。尽管离子通量被认为是大多数刺激激活NLRP3的关键现象,但尚不清楚NLRP3如何感知细胞离子浓度的变化,尽管NLRP3 PYD-NACHT接头中的FISNA序列与离子传感器有关(7)。Baik及其同事报告说,细胞外ATP以及其他NLRP3激动剂触发己糖激酶诱导的VDAC寡聚化和由此产生的mtDNA依赖性NLRP3信号传导;这种机制如何与钾通量的需求相结合仍不清楚。有可能+2+从ER到线粒体的通量对于NLRP3激活是必要的,但还不够。也许卡2+从 ER 释放会通过其他通道(例如 TWIK2)触发 K 外排以诱导 NLRP3 炎症小体信号传导。+
线粒体电子传递链(ETC)功能中的失调产生mtROS,mtROS在NLRP3激活中的潜在功能已经激烈争论了十年。最近的一项创新研究表明,mtROS对于NLRP3激活是可有可无的,而ETC产生的ATP是必需的(8)。Billingham及其同事(8)重新设计了小鼠BMDM,通过将ETC的复合物III与mtROS产生解耦,方法是用来自Ciona intestinalis的替代氧化酶替换ETC的复合物III,以产生可以产生ATP但不能产生mtROS的ETC。这些 mtROS 缺陷的 BMDM 仍然能够触发 NLRP3 信号传导以响应一系列 NLRP3 激动剂 (8)。这些发现表明mtROS对于NLRP3活化是可有可无的,这与提出的用于NLRP3活化的mtDNA氧化要求不一致(4)。Baik及其同事目前的研究没有调查mtROS氧化mtDNA以进行NLRP3炎症小体激活的潜在需求。因此,有必要进一步研究来解决这些对比模型。Billingham及其同事(8)证明,线粒体ETC产生的ATP对于不同激动剂下游的NLRP3信号传导是必需的。这一要求很可能反映了NLRP3 NACHT结构域需要消耗ATP来诱导NLRP3结构重排以产生NLRP3活性构象。值得注意的是,Billingham及其同事(8)报告说,在EtBr中培养细胞不仅会耗尽mtDNA细胞,还会扰乱ETC,抑制ATP合成,从而可能阻断NLRP3 ATP酶活性。因此,重要的是要注意,在目前的研究中,Baik及其同事可以通过添加外源性mtDNA来恢复EtBr培养细胞中的NLRP3信号传导。另一种线粒体成分磷脂心磷脂也与NLRP3激活有关。心磷脂位于静息鼠巨噬细胞的线粒体内膜。据报道,在存在mtROS的情况下,心磷脂迁移到线粒体外膜以诱导NLRP3线粒体募集和激活(9)。NLRP3线粒体募集的这种心磷脂依赖性途径是否与己糖激酶/ VDAC信号轴不同或收敛,将是未来研究的一个有趣途径。
蛋白质之间的静电相互作用正在成为不同亚细胞位置炎症小体信号传导的关键。例如,NLRP3 通过其在 PYD-NACHT 域间接头序列 (4) 中的带正电荷的多碱基区域结合带负电荷的脂质 [例如反式高尔基体网络 38 阳性 (TGN38) 膜中的磷脂酰肌醇-10-磷酸]。有趣的是,线粒体成分mtDNA,ox-mtDNA和心磷脂也带负电荷,这增加了它们也通过电荷 - 电荷相互作用调节NLRP3活性的可能性。尽管Baik及其同事报告说,己糖激酶诱导的VDAC寡聚化触发NLRP3募集到线粒体(可能特别是在线粒体相关膜上),但其他研究将NLRP3激活和信号传导置于其他细胞结构,包括TGN38囊泡膜和微管组织中心。目前尚不清楚NLRP3信号通路的每一步 - 包括激活刺激的NLRP3识别,开放和活性配置的NLRP3结构变化,募集细胞凋亡相关的斑点样蛋白和半胱天冬酶-1来组装炎性小体复合物,以及半胱天冬酶-1依赖性底物切割 - 是否发生在细胞内的单个位点或多个位点。或者,NLRP3可能在激活,炎性小体组装和信号传导过程中在不同位置之间运输。++
最近的报告表明,NLRP3可以限制在12至15聚体的笼子结构中,该结构使NLRP3处于非活性状态,但准备进行刺激诱导的激活。NLRP3 笼状结构通过 LRR-LRR 相互作用保持在一起,PYD 结构域在笼内屏蔽以防止信号传导 (10)。目前的工作产生了新的问题,即如何将这种非活性笼状结构整合到涉及线粒体上VDAC低聚物的概念模型中。目前尚不清楚非活性NLRP3寡聚笼是否或如何被招募到线粒体表面或组装在该位置,以及它如何接收来自线粒体的信号以打开进入活性NLRP3构象。
总之,Baik等人描述了一种迷人的机制,其中己糖激酶与线粒体的解离触发VDAC寡聚化,作为以前未描述的将NLRP3转化为线粒体的途径。这种神奇的线粒体NLRP3激活新模型回答了长期存在的问题,但也提出了新的谜团。
https://blog.sciencenet.cn/blog-41174-1392208.html
上一篇:让实验室小鼠更自然,以便解码大脑
下一篇:牛磺酸用于代谢综合征