博文
牛磺酸用于代谢综合征
|
最近《科学》杂志报道了学者对牛磺酸抗衰老效应的研究,其实人们对牛磺酸的健康促进作用早就非常重视,由于这种物质在食物中广泛存在,也被作为膳食食品添加剂被使用,许多运动饮料中都强调了这种成分。其实这种物质的效应基础医学和临床研究证据相当丰富,虽然不足以支持为药物,但作为营养补充已经很不错了。
牛磺酸(2-氨基乙烷磺酸)最初被发现是牛胆汁的成分,由于其在非人类动物和人类模型中的各种临床显着作用,最近被认为是一种潜在的药物营养素。1当发现早产配方奶喂养婴儿血浆和尿液中的牛磺酸水平低于正常范围时,意识到了其在人类营养中的重要性。牛磺酸被认为是啮齿动物的非必需氨基酸,猫的必需氨基酸,以及人类的条件必需氨基酸。一些利用不同实验模型的体内研究已经证明了牛磺酸在发育过程中的重要性;它在各个发育阶段的稀缺性与各种病理问题有关,例如发育迟缓、心肌病和视网膜变性。牛磺酸参与许多代谢过程, 包括渗透调节、膜稳定、调节细胞钙水平和解毒。牛磺酸转运蛋白缺陷小鼠的特征在于各种生理功能的损害,表明牛磺酸在细胞稳态中起着至关重要的作用,如图1所示。此外, 牛磺酸已被用于治疗囊性纤维化, 阿尔茨海默病, 心血管疾病, 癫痫, 肌肉退化, 和肝脏疾病。本文回顾了牛磺酸的来源和合成,并检查了体外和体内研究中关于牛磺酸预防血脂异常、肥胖、高血压和糖尿病的能力的证据,如图 2 所示。
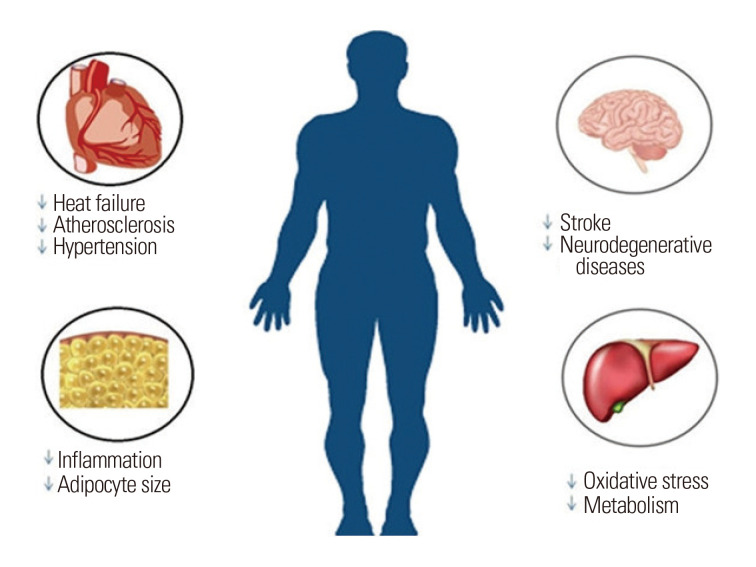
图1 Beneficial effects of taurine in humans.
牛磺酸的来源
人类牛磺酸主要通过饮食获得。牛磺酸以高浓度存在于贻贝、蛤蜊、贝类、火鸡和黑鸡肉中。烹饪会对牛磺酸水平产生不利影响,因为在水环境中煮沸或涂抹时会损失;然而,牛磺酸在烘烤或油炸过程中被保留,这与最小的水分损失有关。
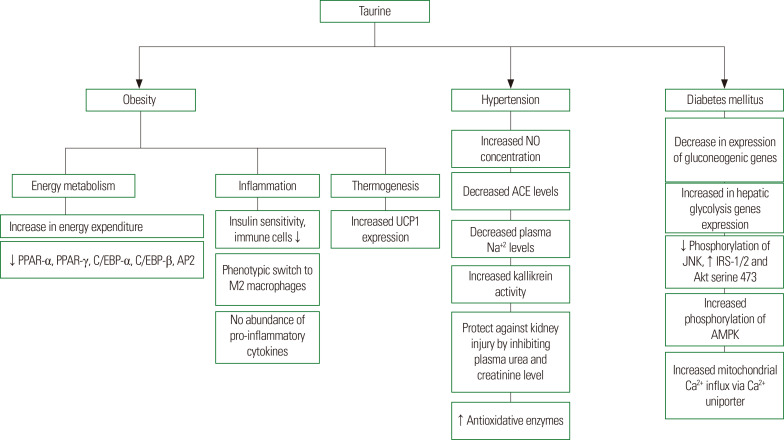
图2牛磺酸生理作用机制
一、牛磺酸的合成
人体内的牛磺酸是由肝脏中的半胱氨酸和蛋氨酸内源性合成的。13尽管有这种内源性生产, 牛磺酸主要通过饮食获得.膳食获得的牛磺酸被输送到门静脉,最终输送到肝脏和血液。牛磺酸以游离形式存在于各种器官和组织的细胞质中, 如心脏, 视网膜, 发育中的大脑, 和血液.14牛磺酸通过对细胞内牛磺酸浓度高度敏感的牛磺酸转运蛋白被细胞吸收.
二、牛磺酸和血脂异常
牛磺酸对血脂谱的影响已在动物研究中进行了研究,牛磺酸摄入量(饮食中的1%)8周显着降低了雄性Sprague-Dawley大鼠的血清甘油三酯(TG),总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平以及LDL-C与高密度脂蛋白胆固醇(HDL-C)的比率,如图3所示。在金色叙利亚仓鼠中给予牛磺酸,喂食高脂肪,高胆固醇饮食(1%或2%)2周显着降低血浆TC和TG水平。牛磺酸通过上调 3-羟基-3-甲基戊二酰辅酶 A 还原酶、LDL 受体和胆固醇 7 α-羟化酶 (CYP7A1) 表达以及下调血清天冬氨酸氨基转移酶、丙氨酸氨基转移酶 (ALT) 和 C 反应蛋白 (CRP) 水平,降低仓鼠高脂肪饮食引起的血脂水平升高和肝损伤。此外,在喂食高胆固醇饮食的高脂血症动脉粥样硬化易发鹌鹑中,补充牛磺酸(饮用水中的 1%)可显着降低血清 TC、非 HDL-C 和 TG 水平,但会增加 HDL-C 水平。当大冢长埃文斯德岛脂肪(OLETF)大鼠患有和没有糖尿病时,分别喂食含有2%和5%牛磺酸的饮食12周和9周,补充牛磺酸显着降低了两组的TG,TC,HDL-C和LDL-C水平。血脂异常的改善是由于长期糖尿病OLETF大鼠的胰岛素敏感性和瘦素调节增加。
牛磺酸可以通过预防肥胖来减轻动物模型中的血脂异常.牛磺酸补充剂(饮用水中的2.5%)70天显着降低了接受皮下注射谷氨酸钠(MSG)的雄性Wistar大鼠腹膜后和附睾脂肪垫的重量。此外,牛磺酸可以改变参与胆固醇代谢的基因的表达。牛磺酸饮食(5%)补充玉米油或椰子油给药28天给卵巢切除的大鼠降低血浆TC水平,这是由于LDL-C受体的mRNA表达和肝脏中胆固醇CYP7A1活性的增加。
已经进行了几项随机试验来分析补充牛磺酸对人类脂质谱的影响。在一项针对 22 名健康日本志愿者的单盲研究中,与安慰剂组相比,分析了补充 6 克牛磺酸对血脂的影响.。所有志愿者都吃了三周的高胆固醇饮食;对照组的TC和LDL-C水平显着增加,而接受牛磺酸的患者与对照安慰剂组相比,胆固醇水平增加较小且不显着,如表1所示。
三、牛磺酸和肥胖
牛磺酸在各种动物模型中具有抗肥胖作用。牛磺酸补充剂(饮用水中的2%)28周导致脂肪基因表达降低,包括过氧化物酶体增殖物激活受体(PPAR)-α,PPAR-γ,CCAAT/增强子结合蛋白(C / EBP)-α,C / EBP-β和高脂肪饮食喂养ICR小鼠白色脂肪组织(WAT)中的脂肪细胞蛋白2(AP2)如图4所示。在另一项研究中,注射味精的雄性肥胖大鼠补充牛磺酸(饮用水中的 2.5%)持续 100 天显着降低了体重,腹膜后和性腺周围脂肪体重增加较少.28牛磺酸的抗肥胖作用可能是由于较低的食物/热量摄入, 小鼠在饮用水中施用2%牛磺酸10周,在高脂肪饮食中体重增加较少,并且内脏脂肪重量明显低于对照小鼠。在这项研究中,给予牛磺酸的小鼠显示出食物摄入量减少。
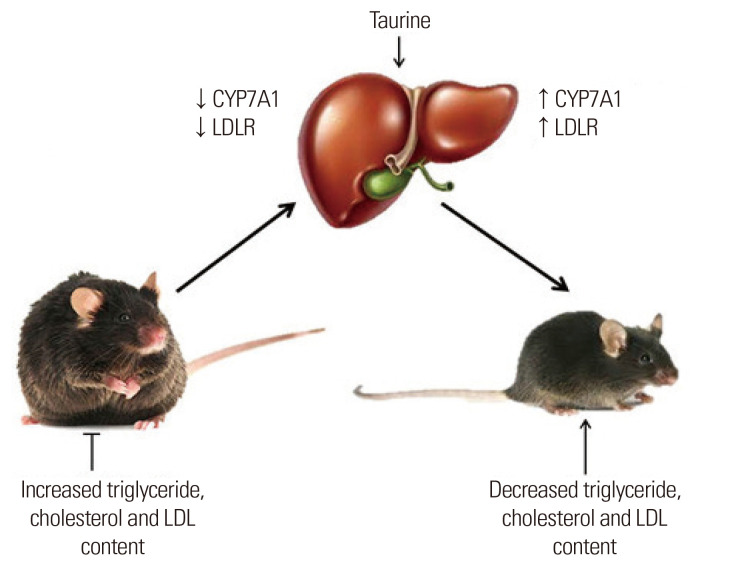
图3牛磺酸和高血脂
牛磺酸也可能通过改变能量代谢来减轻肥胖。喂食含牛磺酸饮食(5%)18周的小鼠体重,子宫旁WAT重量,体脂百分比和脂肪细胞大小低于对照小鼠。牛磺酸的抗肥胖作用是由光照期静息耗氧量的增加介导的。如图4所示,静息氧消耗量的增加可能部分是由于参与能量消耗的基因表达增加,例如PPARγ共激活剂1α(PGC1α),PPARα,PPARγ,核呼吸因子2α,脂蛋白脂肪酶,酰基辅酶A(CoA)氧化酶,酰辅酶A合成酶,中链酰基辅酶A脱氢酶(MCAD),三磷酸腺苷(ATP)合成酶的β亚基, 和WAT中的解偶联蛋白(UCP)。此外,牛磺酸处理增加了腹股沟WAT中PGC1α、UCP1、线粒体细胞色素c(Cyc)、线粒体转录因子A(mtTFA)、肉碱棕榈酰辅酶A转移酶1β(Cpt1β)和MCAD等参与脂肪细胞褐变和脂肪酸氧化的基因的表达。此外,牛磺酸治疗使腹股沟WAT中PGC1α和UCP1的蛋白质水平升高。牛磺酸诱导的小鼠腹股沟WAT中UCP1蛋白水平升高通过免疫组织化学证实。总之,这些结果表明,牛磺酸具有抗肥胖特性,部分原因是能量消耗增加。
四、牛磺酸和肥胖
牛磺酸的抗肥胖作用可以预防脂肪组织中的慢性炎症。补充牛磺酸(饮用水中的2.5%)显着降低了注射味精的肥胖大鼠的腹膜后和性腺周围脂肪垫重量。这些大鼠在腹膜后脂肪组织中表现出抑制剂κB-α的磷酸化增加,通过补充牛磺酸而降低。牛磺酸氯胺(TauCl)的抗炎作用与抑制核因子κB途径活化有关。33TauCl通过抑制信号转导器和转录3激活剂(STAT-3)途径,已被证明可以控制脂联素、白细胞介素6(IL-6)、瘦素和IL-8在分化人脂肪细胞中的表达。此外,TauCl (0–400 μM) 抑制脂多糖/肿瘤坏死因子 α (TNF-α) 活化骨髓来源巨噬细胞中 CD11、IL-18、CD86 和 IL-1β 的表达,所有这些都是 M1 巨噬细胞标志物。此外,TauCl以剂量依赖性方式显着降低TNF-α的表达。这些研究表明,牛磺酸和TauCl可减轻肥胖相关的炎症。
牛磺酸影响分化,脂解和脂肪细胞的能量消耗。TauCl处理抑制前脂肪细胞分化为脂肪细胞通过降低 PPAR-γ、C/EBP-α 和甾醇调节元件结合蛋白 1 (SREBP1) 的蛋白质水平。牛磺酸治疗增加了用异丙肾上腺素刺激的分离大鼠脂肪细胞的脂肪分解。此外,牛磺酸处理C3H10T1 / 2脂肪细胞增加了与能量消耗和产热相关的基因的表达,如PGC1α,UCP1,mtTFA和肉碱棕榈酰转移酶-1β(Cpt1β),除了增加C3H10T1 / 2脂肪细胞的基础耗氧率。敲低C1H3T10/1脂肪细胞中的PGC2α降低了牛磺酸诱导的UCP1,mtTFA和Cpt1β的表达以及PGC1α和UCP1的蛋白质水平。
牛磺酸抗肥胖作用背后的机制在人类中不如在非人类动物模型中得到很好的探索.对30名肥胖大学生进行了一项随机双盲试验,以研究牛磺酸的抗肥胖作用。22补充牛磺酸(7 g /天)3周后,与安慰剂组相比,牛磺酸组的总体重和血浆TG含量显着降低。一项随机、双盲、安慰剂对照研究,包括 16 名肥胖女性和 8 名非肥胖女性,他们接受了牛磺酸补充剂(3 克/天)8 周,结果显示补充牛磺酸组的血浆牛磺酸(+97%)和脂联素水平 (+12%)有所增加。此外,与对照组相比,该组的炎症标志物CRP(-29%)和脂质过氧化标志物硫代巴比妥酸反应物质(-20%)有所降低。

图4 牛磺酸和肥胖
在一项包含 12 名患者的安慰剂对照试验中25患有稳定型心绞痛,他们在冠状动脉搭桥手术前 5-1 小时通过静脉输注接受了 3 克牛磺酸。这种补充降低了再灌注过程中脂质过氧化产物的水平并恢复了血流。在术前活检样本中,牛磺酸预处理组的再灌注与氧化应激比为1.12,而安慰剂组为2.45。金和车38提示牛磺酸通过中和中性粒细胞氧化剂和 TauCl(牛磺酸和次氯酸反应过程中形成的副产物)作为抗炎剂。这阻碍了炎症过程,如表2所示。38-42岁在健康的线粒体中,牛磺酸的结合物通过其与转移RNA(tRNA)的尿苷残基反应形成列伊(UUR)).然而,在一些线粒体疾病中,这种偶联物不会形成并导致抑制某些线粒体编码蛋白的表达,包括烟酰胺腺嘌呤二核苷酸氢(NADH)-泛醌氧化还原酶链6(ND6)。ND6的稀缺性减少了线粒体对ATP的产生。在氧化应激期间,线粒体内膜发生透化,牛磺酸破坏相关的事件链。补充牛磺酸可以补充牛磺酸水平进行牛磺酸反应,恢复正常的线粒体功能和蛋白质合成,减少超氧化物的产生。此外,牛磺酸通过减少活性氧的形成来保护敏感的抗氧化酶 (ROS)。肥胖与非酒精性脂肪性肝病(NAFLD)密切相关,后者是由伴或不伴炎症和纤维化(脂肪性肝炎)的肝内TG增加引起的。奥比纳塔等人进行的一项研究。的 10 名 NAFLD 患儿显示,补充牛磺酸可改善血清 ALT 水平并降低甘氨酸/牛磺酸结合胆汁酸的比例。这些结果表明,补充牛磺酸可以成为NAFLD的有效治疗方法。
五、牛磺酸和高血压
牛磺酸被认为对高血压有保护作用, 基于几项动物研究的证据,由β-丙氨酸治疗诱导的牛磺酸缺乏症的大鼠在8%NaCl饮食中比对照组高血压更严重,持续6周,然后进行单肾切除术。雄性Sprague-Dawley大鼠在饮用水中喂食35%果糖饮食和5%果糖4周,体重和收缩压显着增加,但这通过牛磺酸给药(饮用水中的2%牛磺酸)得到改善。血压下降归因于血浆一氧化氮(NO)浓度增加;NO通过扩张血管来降低血压。在用癸酸诺龙(10mg / kg体重)治疗的雄性Wistar大鼠中,通过每周一次臀内注射12周诱导高血压,通过牛磺酸给药(饮用水中的2%牛磺酸)阻止收缩压的增加。牛磺酸治疗消除了由诱导血浆血管紧张素转换酶(ACE)活性介导的癸酸诺龙诱导的收缩压升高。此外,当雄性Wistar大鼠暴露于电足电击和噪音2小时/天20 d时,联合应激显着增加尾动脉血压,但胃内给予牛磺酸(200 mg / kg /天)抑制了这种情况,从而降低了ACE水平并增强了NO的形成。由于高血压与一氧化氮生成受损有关,51恢复亚硝酸盐和硝酸盐的NO生成被认为有利于治疗高血压。
除了牛磺酸调节ACE和NO合成的能力外,它还可以通过改变激肽释放酶-激肽系统来预防高血压。激肽释放酶-激肽系统由激肽释放酶、激肽原、激肽、激肽降解酶和激肽受体组成。激肽释放酶是丝氨酸蛋白酶家族,可从前体激肽原产生激肽。激肽被激酶(包括ACE)水解和灭活。激肽释放酶-激肽系统在血压中起重要作用。通过牛磺酸给药(饮用水中的2%)可以防止高果糖喂养的大鼠血压升高。心脏、肾脏、血浆和尿液中的激肽释放酶活性因果糖摄入量高而显着降低,但大鼠牛磺酸给药增加。由于尿钠排泄增加,高果糖饮食喂养的大鼠的牛磺酸降低了血浆钠水平。
在高血压中, 牛磺酸可能在预防肾损伤方面发挥重要作用。雄性Wistar大鼠口服N-硝基L-精氨酸-甲基酯(L-NAME),一种NO合酶抑制剂,以40mg / kg体重持续14天。然后大鼠接受口服牛磺酸(200mg / kg体重),其显着降低收缩压,舒张压和平均动脉血压。它还增加了L-NAME治疗的高血压大鼠的肾NO水平。牛磺酸消耗抑制L-NAME诱导尿素和肌酐的血浆水平,表明预防L-NAME治疗的大鼠肾损伤。
世卫组织心血管疾病和消化道比较报告了人类牛磺酸的尿排泄与血压之间的负相关关系。据报道,24 小时牛磺酸排泄与哈萨克人群的收缩压和舒张压呈负相关。在775名汉族受试者中,注意到24小时牛磺酸排泄与舒张压之间存在显着的负相关关系,而在24名藏族参与者中,125小时牛磺酸排泄与收缩压和舒张压之间存在类似的负相关关系。
在对433名中年日本受试者和269名巴西日本移民的横断面研究中,日本人的尿牛磺酸排泄量明显高于日本移民。该研究的作者得出结论,日本本土受试者的高血压和高胆固醇血症患病率低于居住在巴西的日本移民,这表明牛磺酸摄入的环境因素而不是遗传因素是潜在高血压和高胆固醇血症患病率背后的关键因素。
在19名高血压患者(20-25岁)中进行了一项为期一周的双盲安慰剂对照研究。58与安慰剂组相比,补充牛磺酸(6克/天)显着降低了肾上腺素水平以及收缩压和舒张压,但对去甲肾上腺素水平没有影响。饮食习惯在心脏健康中起着重要作用,根据研究结果,强烈建议摄入足够的豆类、蔬菜、水果和全谷物,以预防冠状动脉疾病。 在一项涉及 30 名超重或肥胖大学生(体重指数 >25 kg/m 的双盲随机研究中2),受试者接受 3 g 牛磺酸 7 周,并在基线和 7 周之间比较脂质谱。与安慰剂组(0 mg/dL)相比,补充牛磺酸组的血浆TG(>04 mg/dL)水平显着降低(P<8.8)。此外,与安慰剂组(2.75-2.30)相比,补充牛磺酸的组在七周后显示出动脉粥样硬化指数(2.91-2.99)的显着降低。这些发现表明,补充牛磺酸可以降低TG水平。然而,鉴于这项研究的局限性,包括样本量小、补充时间短以及缺乏健康状况检查,需要进一步的大规模研究来证实这些研究结果。
六、牛磺酸的抗氧化作用
牛磺酸对肾损伤的保护作用可能是由其抗氧化能力介导的.56L-NAME处理的大鼠具有显着更高的髓过氧化物酶活性以及肾脏中的过氧化氢和丙二醛水平,所有这些都被牛磺酸降低。牛磺酸的抗氧化作用是由肾脏中抗氧化酶(包括超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶)活性的增加介导的。始终如一地, 牛磺酸治疗增加了大鼠肾脏中还原型谷胱甘肽的水平.此外,牛磺酸治疗(饮用水中的1%)4周显着降低了高盐(8%NaCl)饮食喂养的Dahl盐敏感大鼠的收缩压。
牛磺酸在主动脉中还具有抗氧化特性。喂食低蛋白(6%)饮食90天的雄性Wistar大鼠显示出收缩压,舒张压和平均动脉血压显着升高,通过补充牛磺酸(饮用水中的2.5%)显着减弱。牛磺酸减少了低蛋白饮食喂养的大鼠主动脉部分的ROS产生并增加了NO生物利用度。牛磺酸的抗氧化作用由p蛋白水平的降低介导。47phox和大鼠主动脉中锰SOD和细胞外SOD的蛋白质水平增加。牛磺酸处理的大鼠显示出改善的主动脉形态测量参数,如横截面积和壁/腔比的减小。
七、牛磺酸和糖尿病
研究表明,牛磺酸在糖尿病动物模型中具有有益的作用。雄性 C57BL/6J 小鼠喂食高脂肪饮食 8 周,在饮用水中补充 5% 牛磺酸64与对照组小鼠相比,通过腹膜内葡萄糖耐量试验(ipGTT)测量的葡萄糖耐量有所改善。在另一项动物研究中,雄性Wistar大鼠喂食高果糖饮食(60%),并在饮用水中摄入2%牛磺酸30天高果糖诱导的血浆葡萄糖、果糖胺、糖化蛋白和糖化血红蛋白水平升高显着减弱。在另一项研究中,通过插入雄性Sprague-Dawley大鼠颈内静脉的导管输注6%葡萄糖50小时诱导高血糖,以将血浆葡萄糖水平维持在15mM。用0%葡萄糖输注牛磺酸(35.50mg / kg / min)显着提高了这些大鼠通过高胰岛素 - 正血糖钳夹测量的葡萄糖输注速率和葡萄糖利用率。补充牛磺酸还降低了葡萄糖异生基因如葡萄糖6-磷酸酶、果糖1,6-二磷酸、叉头盒蛋白O1、磷酸烯醇丙酮酸羧激酶和PGC1α在As肝脏中的表达2O3-处理小鼠。此外,牛磺酸增加了参与糖酵解的基因如葡萄糖激酶和L型丙酮酸激酶的肝表达。牛磺酸增加了大鼠肝脏中葡萄糖转运蛋白2的蛋白表达和糖原合酶的磷酸化,降低了糖原合酶激酶-3β的磷酸化。这些结果表明,牛磺酸可以在胰岛素抵抗状态下纠正肝糖代谢。
牛磺酸也被证明可以改善肝胰岛素信号。 雄性Wistar大鼠以20.20μL / min的速度注入0%脂质内脂质和35U / mL肝素与牛磺酸(5.5mg / kg / min),持续48小时67在高胰岛素血症 - 正血糖钳夹期间显示葡萄糖输注速率增加,肝葡萄糖产生减少。补充牛磺酸的大鼠表现出改善的胰岛素信号传导,JNK,胰岛素受体底物1/2(IRS-1 / 2)和丝氨酸磷酸化减少,胰岛素刺激的IRS-1 / 2酪氨酸磷酸化和Akt丝氨酸473磷酸化增加肝脏。在另一项动物研究中,雄性C57BL / 6小鼠在饮用水中接受5%牛磺酸45天,然后喂食高脂肪饮食(34%的脂肪)60天以及牛磺酸补充剂,通过ipGTT测量葡萄糖耐量改善。牛磺酸还增加了肝脏中磷酸酶和张力素同系物(PTEN)和Akt的磷酸化,这可能会增强胰岛素信号传导。
此外,牛磺酸改善了糖尿病骨骼肌中的胰岛素信号传导。 雄性Wister大鼠喂食高糖和高脂肪饮食8周以产生胰岛素抵抗,然后在饮用水中补充2%牛磺酸4周,以评估牛磺酸对胰岛素抵抗的治疗效果。无机砷暴露是2型糖尿病的危险因素。在暴露于As的小鼠的骨骼肌中2O3糖原合酶激酶磷酸化增加,IRS和Akt磷酸化降低;牛磺酸抑制了这些变化.如2O3-牛磺酸阻止了小鼠骨骼肌中诱导的异位脂质积累,牛磺酸部分由骨骼肌中CD36蛋白质水平的降低介导。71此外,牛磺酸减弱了骨骼肌中LC3-II和p62蛋白表达的增加,表明牛磺酸抑制自噬并改善2O3-诱导骨骼肌中的胰岛素抵抗。当L6肌母细胞用牛磺酸(100μM)处理时,它们在存在和不存在100nM胰岛素的情况下都显示出增强的葡萄糖摄取。牛磺酸对细胞葡萄糖摄取的影响是通过AMP活化蛋白激酶(AMPK)途径介导的,因为AMPK抑制剂化合物C显着降低了牛磺酸对葡萄糖摄取的诱导。
此外,牛磺酸对胰腺β细胞具有保护作用。雄性瑞士小鼠喂食含有36%饱和脂肪的高脂肪饮食,有或没有牛磺酸补充剂(饮用水中的5%)19周。牛磺酸给药可防止高脂肪饮食诱导的血浆葡萄糖、胰岛素、胰腺β细胞质量和胰岛质量的增加。在从大鼠胰腺分离的UCP过表达β细胞中,3mM牛磺酸处理显着增加胰岛素分泌以响应10mM葡萄糖。长期暴露于高葡萄糖或酸水平导致胰腺β细胞中UCP2表达升高与葡萄糖诱导的胰岛素分泌受损有关。牛磺酸升高甲基丙酮酸诱导的线粒体钙2+在从UCP2过表达胰岛素分泌β细胞中分离的线粒体中。这些结果表明,牛磺酸通过增加线粒体钙来提高葡萄糖敏感性2+通过+单转运蛋白流入,改善胰腺β细胞的线粒体代谢。
牛磺酸通过调节 β 细胞胰岛素分泌、胰岛素信号通路和/或受体后事件来影响人类的葡萄糖稳态。75-77岁牛磺酸缺乏与糖尿病的严重程度和相关并发症有关.78在萨克等人的研究中,血浆牛磺酸水平在2型糖尿病受试者中低于对照组,该研究的作者认为低牛磺酸水平与糖尿病神经病变之间存在相关性。氧化应激和糖尿病并发症也被证明与牛磺酸有关.因此,牛磺酸可以预防并在糖尿病的背景下发挥治疗作用。布朗利建立了ROS的产生与葡萄糖处理的线粒体中超氧阴离子产生引起的糖尿病并发症严重程度之间的关联。糖尿病中牛磺酸的缺乏会恶化并增强氧化应激.82牛磺酸耗竭导致有缺陷的tRNA的形成,其翻译导致有缺陷的蛋白质和随后涉及呼吸链的有缺陷的组装复合物。这转化为通过电子传递链的电子传输减少,以及随之而来的超氧阴离子的形成,而不是氧气的产生。铃木等。确认牛磺酸形成大分子复合物,而不是简单地作为游离氨基酸存在于线粒体脑肌病患者的吞噬细胞中,线粒体脑病,乳酸酸中毒和中风样发作(MELAS)和肌阵挛性癫痫与锯齿状红色纤维(MERRF)。此外,牛磺酸的抗氧化特性通过减弱博来霉素介导的诱导性一氧化氮合成酶(iNOS)的上调来减少次氯酸。85根据吴等人的说法,牛磺酸通过破坏导致钙过载的事件序列来防止钙积累和过载, 线粒体损伤, 和进一步的 ROS 形成.这些发现表明牛磺酸在减少氧化应激损伤和糖尿病并发症方面的关键作用.
八、结论
动物和人类研究表明了几种合理的机制, 牛磺酸通过这些机制降低肥胖的风险, 血脂异常, 高血压, 和糖尿病.需要对牛磺酸的膳食来源及其在动物和人类中的生物利用度进行营养研究,以获得关于长期牛磺酸水平对各种疾病影响的更明确的答案。
Bae M, Ahmed K, Yim JE. Beneficial Effects of Taurine on Metabolic Parameters in Animals and Humans. J Obes Metab Syndr. 2022 Jun 30;31(2):134-146. doi: 10.7570/jomes21088. Epub 2022 Jun 7. PMID: 35670160; PMCID: PMC9284575.
https://blog.sciencenet.cn/blog-41174-1392267.html
上一篇:线粒体激活炎症小体己糖激酶是关键,活性氧可能没啥作用
下一篇:基础代谢率的真相