博文
[转载]351.马里和冈比亚2-29岁人群中的脑膜炎球菌ACWYX结合疫苗
|||
马里和冈比亚2-29岁人群中的脑膜炎球菌ACWYX结合疫苗
背景
需要一种有效、可负担得起的多价脑膜炎球菌结合疫苗来预防非洲脑膜炎带的流行性脑膜炎。NmCV-5是一种针对A、C、W、Y和X血清群的五价疫苗,关于其安全性和免疫原性的数据有限。
方法
我们在马里和冈比亚进行了一项3期非劣效性试验,参与者为2-29岁的健康青少年。参与者以2:1的比例随机接受单次肌肉注射NmCV-5或四价疫苗MenACWY-D。免疫原性在第28天进行评估。NmCV-5相对于MenACWY-D的非劣效性根据血清反应参与者的百分比差异进行评估(定义为预先指定的滴度变化;裕度,高于10个百分点的96%置信区间[CI]的下限)或几何平均滴度(GMT)比率(裕度,98.98% CI >0.5的下限)。将NmCV-5组中的血清组X应答与MenACWY-D血清组中的最低应答进行比较。还评估了安全性。
结果
共有1800名参与者接受了NmCV-5或MenACWY-D。在NmCV-5组中,血清反应的参与者百分比从血清组A的70.5% (95% CI,67.8至73.2)到血清组W的98.5% (95% CI,97.6至99.2);血清组X反应的百分比为97.2% (95%可信区间为96.0至98.1)。两种疫苗在四个共有血清群的血清反应中的总体差异从血清群W的1.2个百分点(96% CI,0.3至3.1)到血清群A的20.5个百分点(96% CI,15.4至25.6)。四个共有血清群的总体GMT比率从血清群A的1.7 (98.98% CI,1.5至1.9)到2.8 (98.98% CI,2.3至3两组的全身不良事件发生率相似(NmCV-5组为11.1%,MenACWY-D组为9.2%)。
结论
对于与MenACWY-D疫苗相同的所有四种血清型,NmCV-5疫苗引发的免疫反应不劣于由MenACWY-D疫苗引发的免疫反应。NmCV-5也引发了对血清组x的免疫反应。没有明显的安全性问题。(由英国外交、联邦和发展办公室及其他机构资助;ClinicalTrials.gov号码,NCT03964012.)
2020年11月,世界卫生大会批准了到2030年战胜脑膜炎规划的全球路线图。该战略旨在消除流行性细菌性脑膜炎,并在本十年结束前将疫苗可预防疾病的发病率降低50%,死亡率降低70%。
2019年,全球估计有超过250万例脑膜炎,导致超过236,000人死亡。脑膜炎的最高发病率和死亡率发生在整个非洲脑膜炎带,从西部的冈比亚和塞内加尔延伸到东部的埃塞俄比亚脑膜炎奈瑟菌发生在地方病高发的背景下。尽管脑膜炎球菌的六个血清群(A、B、C、W、X和Y)可导致侵袭性疾病,但血清群A在历史上一直是脑膜炎地带最重要的致病原因。然而,在通过印度血清研究所、世界卫生组织(世WHO)和适宜卫生技术方案(以前称为适宜卫生技术方案)的合作开展了MenAfriVac(一种为解决这一负担而开发的结合疫苗)大规模疫苗接种运动后,血清A组疾病实际上已被消灭。
尽管如此,脑膜炎地带的国家由于其他血清群而继续记录高发病率。C群脑膜炎球菌引起的脑膜炎在尼日尔和尼日利亚西北部大规模流行,C群脑膜炎继续在布基纳法索、乍得、马里和多哥等有监测数据的国家占主导地位。加纳和多哥也报告了流行性血清群W疾病,血清群X疾病在脑膜炎地带和其他地方也出现了潜在的流行。
虽然四种四价脑膜炎球菌ACWY结合疫苗已获得世卫组织的许可和资格预审,但它们在非洲脑膜炎地带的使用受到供应和成本制约的限制。此外,目前没有针对脑膜炎球菌血清群X的许可疫苗。13,14因此,在脑膜炎疫苗项目(开发了MenAfriVac)成功的基础上,印度血清研究所和适宜卫生技术组织开发了五价脑膜炎球菌ACWYX结合疫苗(NmCV-5 ),目标是在撒哈拉以南非洲消除脑膜炎球菌疾病。在美国一项涉及18至45岁人群的1期试验和马里一项涉及12至16个月儿童的2期试验中,报告了NmCV-5安全性和免疫原性的支持性数据。
在此,我们报告了NmCV-5疫苗在马里和冈比亚2至29岁参与者(脑膜炎球菌爆发响应运动的目标年龄组)中的3期试验结果。该试验旨在显示NmCV-5疫苗的安全性和免疫非劣效性,并与获得许可的世卫组织资格预审的四价脑膜炎球菌结合疫苗(MenACWY-D[MENA tra,Sanofi Pasteur])进行比较。该试验旨在为疫苗的许可和世卫组织资格预审提供所需的数据,以用于未来的疫情控制。
结果
试验人群
第一批参与者于2019年8月招募。2021年6月完成疫苗接种后168天的安全性随访。为1869名参与者提供了知情同意书,其中1800名符合条件并接受了随机化和疫苗接种。在每个年龄组中,400名参与者接受NmCV-5,200名接受MenACWY-D(安全人群)。
表1.参与者的人口统计学和人体测量学特征,包括总人口和年龄组(安全人口)。
表1.参与者的人口统计学和人体测量学特征,包括总人口和年龄组(安全人口)。*
特性 | 总体而言,2至29岁 | 2至10年 | 11至17岁 | 18至29岁 | ||||
NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | |
年龄中位数(范围)—年 | 13 | 13 | 6 | 5 | 13 | 13 | 22 | 21 |
女性——无(%) | 606 (50.5) | 307 (51.2) | 179 (44.8) | 94 (47.0) | 187 (46.8) | 102 (51.0) | 240 (60.0) | 111 (55.5) |
黑人——人数(%)† | 1200 (100) | 600 (100) | 400 (100) | 200 (100) | 400 (100) | 200 (100) | 400 (100) | 200 (100) |
民族——数量(%)† | ||||||||
曼丁卡-马林克 | 523 (43.6) | 258 (43.0) | 174 (43.5) | 87 (43.5) | 167 (41.8) | 87 (43.5) | 182 (45.5) | 84 (42.0) |
班巴拉人 | 234 (19.5) | 123 (20.5) | 92 (23.0) | 41 (20.5) | 84 (21.0) | 42 (21.0) | 58 (14.5) | 40 (20.0) |
拉夫-颇尔 | 151 (12.6) | 78 (13.0) | 55 (13.8) | 30 (15.0) | 52 (13.0) | 26 (13.0) | 44 (11.0) | 22 (11.0) |
其他的 | 292 (24.3) | 141 (23.5) | 79 (19.8) | 42 (21.0) | 97 (24.2) | 45 (22.5) | 116 (29.0) | 54 (27.0) |
高度—厘米 | 145.3 26.5 | 144.4 27.0 | 113.5 17.3 | 111.3 16.4 | 154.9 11.6 | 155.0 11.5 | 167.4 8.9 | 166.9 8.7 |
重量—千克 | 41.9 20.5 | 41.5 20.6 | 19.4 6.8 | 18.5 5.8 | 44.4 12.8 | 44.2 12.1 | 61.8 12.0 | 61.7 12.5 |
* 正负数值是平均值±标准差。安全性人群包括接受一剂五价ACWYX脑膜炎球菌结合疫苗NmCV-5或四价脑膜炎球菌结合疫苗MENA wy-D的参与者,并提供任何安全性数据。由于四舍五入,百分比总和可能不等于100。 | ||||||||
† 18岁或以上的参与者报告了种族和民族,18岁以下的参与者由父母或监护人报告了种族和民族。 | ||||||||
总的来说,50.7%的参与者是女性,全部是非洲人,43.4%的参与者是曼丁卡-马林克族(表1)。在任何年龄组的参与者的人口统计学或人体测量学特征中没有显著的组间差异。试验参与者被认为是NmCV-5疫苗接种目标人群的代表(表S1)。
免疫原性
表2.基于血清反应和几何平均滴度的免疫原性非劣效性分析(符合方案人群)。
表2.基于血清反应和几何平均滴度的免疫原性非劣效性分析(符合方案人群)。*
分析和血清群 | 全面分析 | 血清反应差异(96%可信区间)或GMT比率(98.98%可信区间) | ||||
NmCV-5 | MenACWY-D | 全部的 | 2至10年 | 11至17岁 | 18至29岁 | |
血清反应 | ||||||
A | ||||||
有回应的数量/总数 | 814/1154 | 286/572 | ||||
有反应的百分比(95%置信区间) | 70.5 (67.8至73.2) | 50.0 (45.8至54.2) | 20.5 (15.4至25.6) | 13.2 (4.7至21.9) | 28.1 (19.2至36.7) | 20.6 (11.6至29.4) |
C | ||||||
有回应的数量/总数 | 1109/1133 | 531/556 | ||||
有反应的百分比(95%置信区间) | 97.9 (96.9至98.6) | 95.5 (93.4至97.1) | 2.4 (0.6至4.7) | 1.6(1.0至5.5) | 1.9(0.3至5.8) | 3.6(0.5至8.9) |
W | ||||||
有回应的数量/总数 | 1081/1097 | 520/534 | ||||
有反应的百分比(95%置信区间) | 98.5 (97.6至99.2) | 97.4 (95.6至98.6) | 1.2(0.3至3.1) | 0.2(2.0至2.5) | 1.7(0.3至5.5) | 2.0(1.4至6.7) |
Y | ||||||
有回应的数量/总数 | 1019/1051 | 494/537 | ||||
总体而言,在接种NmCV-5疫苗后28天,对血清组A、C、W和Y产生血清反应的参与者的百分比从血清组A的70.5% (95%可信区间[CI],67.8至73.2)到血清组W的98.5% (95% CI,97.6至99.2)(表2)。总共有97.2% (95% CI,96.0至98.1)的参与者出现了血清组X反应。对于四个包含的血清群,接种MenACWY-D疫苗后出现血清反应的参与者百分比从血清群A的50.0% (95% CI,45.8至54.2)到血清群w的97.4% (95% CI,95.6至98.6)。
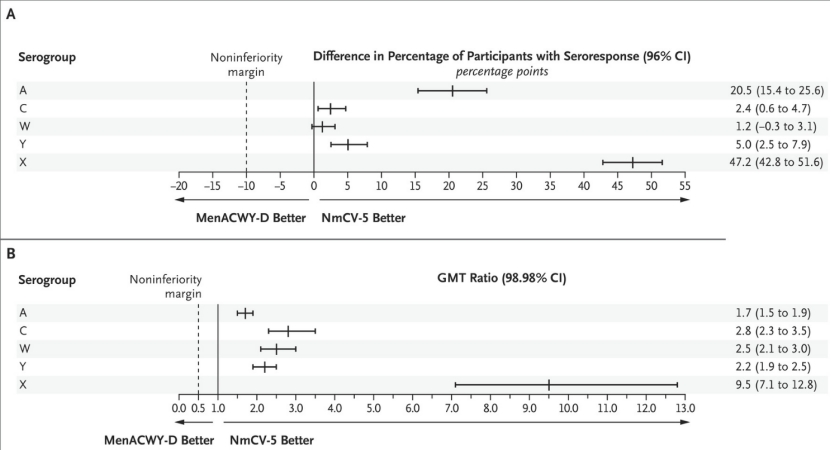
图1.基于疫苗接种后28天的血清反应和几何平均滴度的免疫原性总体非劣效性分析。显示了五价ACWYX脑膜炎球菌结合疫苗NmCV-5与四价脑膜炎球菌结合疫苗MenACWY-D在血清反应(图A)和几何平均滴度(GMT)方面的比较。血清反应定义为接种前血清杀菌抗体(SBA)滴度低于8的受试者接种后血清杀菌抗体(SBA)滴度至少为32,或接种前SBA滴度至少为8的受试者接种后SBA滴度比基线增加至少4倍。对于血清组X,显示了NmCV-5疫苗针对该血清组产生的血清反应和GMT与MenACWY-D疫苗针对其包含的四个血清组产生的最低血清反应和GMT之间的比较(血清组A针对血清反应,血清组C针对GMT)。这些分析是在符合方案的人群中进行的,其中包括所有接受随机化和疫苗接种的参与者,这些参与者具有可用的血清学结果,并且没有被认为可能影响免疫原性评估的方案偏差。
由于接种MenACWY-D疫苗后出现血清反应的参与者百分比最低的是血清组C,因此该血清组被用作NmCV-5组中血清组X的非劣效性分析的对照。四个共有血清群中出现血清反应的受试者百分比的组间差异从血清群W的1.2个百分点(96% CI,0.3至3.1)到血清群A的20.5个百分点(96% CI,15.4至25.6)。NmCV-5组中出现血清群X反应的受试者百分比与MenACWY-D组中出现血清群A反应的受试者百分比的组间差异为47.2个百分点(96% CI,4296%置信区间的下限高于所有血清组的10个百分点的非劣效性界限,包括总体人群(图1A)而且在各个年龄段。因此,NmCV-5疫苗与MenACWY-D疫苗相比的非劣效性是基于血清反应显示的。
接种NmCV-5疫苗后28天,血清组C的总体血清组特异性SBA GMT为5587.2 (95% CI,5123.7至6092.5),血清组X为31,290.4 (95% CI,29,222.2至33,505.1)表2)。在接种MenACWY-D疫苗后28天,四个血清组的血清组特异性SBA GMT范围从血清组C的1854.9 (95% CI,1619.6至2124.4)到血清组w的12,294.6 (95% CI,10,778.9至14,023.4)。
因为接种MenACWY-D疫苗后最低的SBA GMT是血清群C,我们使用该血清群作为对照,用于NmCV-5组中血清群X的非劣效性分析。四个共有血清组的调整后SBA GMT比率范围为血清组A的1.7 (98.98% CI,1.5至1.9)至血清组C的2.8 (98.98% CI,2.3至3.5)。NmCV-5组中血清组X与MenACWY-D组中血清组C比较的调整后GMT比率为9.5 (98.98% CI,7.1至12.8)。所有血清组的98.98%置信区间的下限均高于0.5的非劣效性界限,两者均在总体人群中(图1B)而且在各个年龄段。因此,NmCV-5疫苗与MenACWY-D疫苗相比的非劣效性是根据SBA GMTs显示的。因此,根据血清反应和GMT,每个年龄组都达到了试验的两个主要目标。
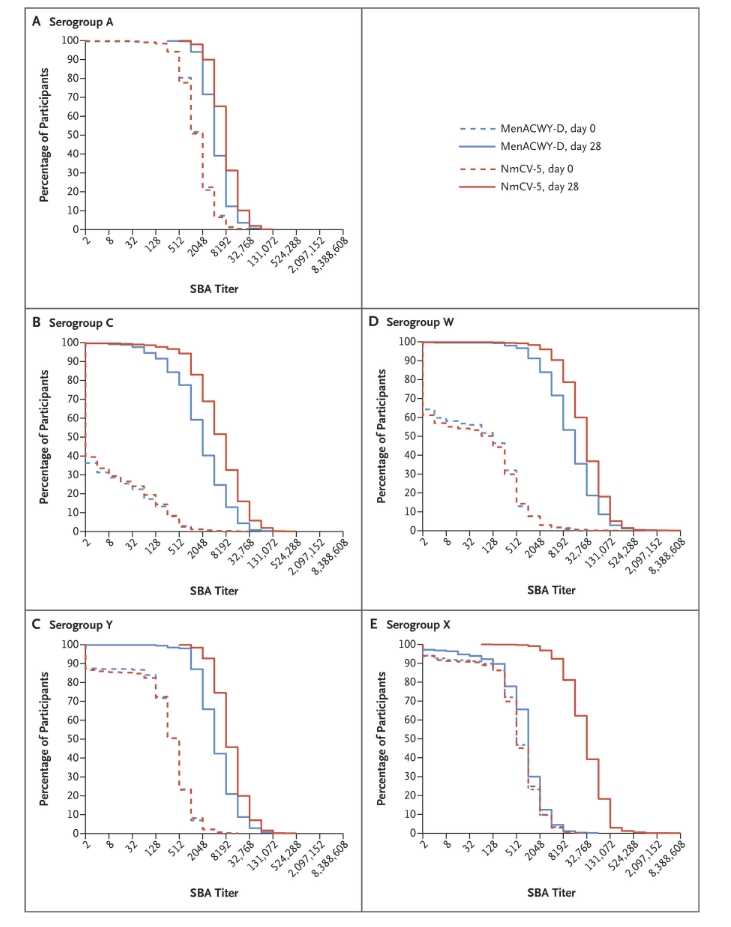
图2.根据脑膜炎球菌血清群,疫苗接种前和疫苗接种后28天的反向累积分布曲线。
S3表提供了基线和疫苗接种后血清群特异性SBA滴度至少为8和至少为128的参与者的百分比。对于所有血清组和所有年龄组,接种NmCV-5疫苗后的几何平均因子增加往往高于接种MenACWY-D疫苗后的几何平均因子增加(表S4)。尽管在基线时SBA滴度的分布没有显著差异,但在NmCV-5疫苗接种后,结果高于任何给定滴度的参与者的百分比倾向于高于在MENA kwy-D疫苗接种后(图2)。
安全
表3.根据年龄组(安全性人群)在总体人群中发现的主动和被动不良事件。
表3.根据年龄组(安全性人群)在总体人群中发现的主动和被动不良事件。
事件 | 全部的 | 2至10年 | 11至17岁 | 18至29岁 | ||||
NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | NmCV-5 | MenACWY-D | |
请求的不良事件* | ||||||||
注射部位不良事件—数量/总数量(%) | ||||||||
任何事件† | 312/1199 (26.0) | 115/599 (19.2) | 80/399 (20.1) | 19/200 (9.5) | 114/400 (28.5) | 45/200 (22.5) | 118/400 (29.5) | 51/199 (25.6) |
任何等级≥3的事件 | 0/1199 | 0/599 | 0/399 | 0/200 | 0/400 | 0/200 | 0/400 | 0/199 |
疼痛† | 311/1199 (25.9) | 115/599 (19.2) | 79/399 (19.8) | 19/200 (9.5) | 114/400 (28.5) | 45/200 (22.5) | 118/400 (29.5) | 51/199 (25.6) |
肿胀或硬化 | 4/1199 (0.3) | 2/599 (0.3) | 3/399 (0.8) | 1/200 (0.5) | 0/400 | 0/200 | 1/400 (0.2) | 1/199 (0.5) |
系统性不良事件—数量/总数量(%) | ||||||||
任何事件 | 133/1199 (11.1) | 55/599 (9.2) | 30/399 (7.5) | 8/200 (4.0) | 50/400 (12.5) | 24/200 (12.0) | 53/400 (13.2) | 23/199 (11.6) |
任何等级≥3的事件 | 0/1199 | 0/599 | 0/399 | 0/200 | 0/400 | 0/200 | 0/400 | 0/199 |
分配 | ||||||||
<6 Yr of age | ||||||||
发热 | 2/185 (1.1) | 1/110 (0.9) | 2/185 (1.1) | 1/110 (0.9) | — | — | — | — |
睡意 | 3/185 (1.6) | 0/110 | 3/185 (1.6) | 0/110 | — | — | — | — |
过敏性 | 4/185 (2.2) | 1/110 (0.9) | 4/185 (2.2) | 1/110 (0.9) | — | — | — | — |
厌食 | 2/185 (1.1) | 2/110 (1.8) | 2/185 (1.1) | 2/110 (1.8) | — | — | — | — |
腹泻 | 2/185 (1.1) | 1/110 (0.9) | 2/185 (1.1) | 1/110 (0.9) | — | — | — | — |
年龄≥6岁 | ||||||||
发热 | 13/1014 (1.3) | 4/489 (0.8) | 5/214 (2.3) | 0/90 | 7/400 (1.8) | 2/200 (1.0) | 1/400 (0.2) | 2/200 (1.0) |
乏力 | 38/1014 (3.7) | 16/489 (3.3) | 2/214 (0.9) | 0/90 | 11/400 (2.8) | 4/200 (2.0) | 25/400 (6.2) | 12/200 (6.0) |
头痛 | 73/1014 (7.2) | 29/489 (5.9) | 14/214 (6.5) | 2/90 (2) | 32/400 (8.0) | 17/200 (8.5) | 27/400 (6.8) | 10/200 (5.0) |
肌痛 | 22/1014 (2.2) | 13/489 (2.7) | 3/214 (1.4) | 1/90 (1) | 11/400 (2.8) | 3/200 (1.5) | 8/400 (2.0) | 9/200 (4.5) |
关节痛 | 13/1014 (1.3) | 3/489 (0.6) | 2/214 (0.9) | 0/90 | 5/400 (1.2) | 1/200 (0.5) | 6/400 (1.5) | 2/200 (1.0) |
厌食 | 13/1014 (1.3) | 7/489 (1.4) | 1/214 (0.5) | 1/90 (1) | 5/400 (1.2) | 1/200 (0.5) | 7/400 (1.8) | 5/200 (2.5) |
腹泻 | 8/1014 (0.8) | 1/489 (0.2) | 1/214 (0.5) | 0/90 | 4/400 (1.0) | 1/200 (0.5) | 3/400 (0.8) | 0/200 |
主动提供的不良事件‡ | ||||||||
任何事件—数量(%) | 189 (15.8) | 99 (16.5) | 81 (20.2) | 36 (18.0) | 44 (11.0) | 25 (12.5) | 64 (16.0) | 38 (19.0) |
任何等级≥3的事件—数量(%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
严重不良事件§ | ||||||||
任何事件—数量(%) | 3 (0.2) | 3 (0.5) | 0 | 2 (1.0) | 0 | 0 | 3 (0.8) | 1 (0.5) |
疫苗相关事件—数量(%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
* 在接种疫苗后7天内,收集关于请求注射部位和全身不良事件的数据。两个参与者的请求注射部位和全身不良事件的数据缺失:一个在2-10岁年龄组接受NmCV-5疫苗,一个在18-29岁年龄组接受MENA wy-D疫苗。 | ||||||||
† NmCV-5组的注射部位反应和注射部位疼痛的总发生率高于MENA kwy-D组(通过Fisher精确检验,两者的比较P=0.001)。 | ||||||||
‡ 在接种疫苗后的28天内收集主动提供的不良事件的数据。 | ||||||||
§ 在接种疫苗后的168天内收集严重不良事件的数据。 | ||||||||
总体而言,在NmCV-5组的1199名参与者和MenACWY-D组的599名参与者中评估了请求的不良事件。NmCV-5组中总共有312名参与者(26.0%)和MenACWY-D组中有115名参与者(19.2%)出现至少一次请求注射部位反应(P=0.001)(表3)。疼痛是最常见的反应,发生在NmCV-5组的311名参与者(25.9%)和MenACWY-D组的115名参与者(19.2%)中(P=0.001)。总体而言,NmCV-5组中的133名参与者(11.1%)和MenACWY-D组中的55名参与者(9.2%)出现了请求的系统性不良事件。所有被请求的事件都是轻度或中度的,仅通过简单的镇痛就解决了。
在1800名参与者的全安全性人群中评估了主动提供的不良事件。接种NmCV-5疫苗后,189名参与者(15.8%)出现了轻度或中度主动不良事件,相比之下,接种MenACWY-D疫苗后,有99名参与者(16.5%)出现了主动不良事件。研究者认为这些主动不良事件均与疫苗无关。总体而言,最常见的自发事件是上呼吸道感染、疟疾和咽炎,分别发生在4.6%、1.3%和0.8%的参与者中(表S5)。
每个疫苗组接种疫苗后都发生了三起严重的不良事件,其中没有一起被研究者认为与疫苗有关。MenACWY-D组的一名18岁参与者在与试验无关的创伤后死亡。
在试验随访期间,共报告了13例妊娠。11名妇女正常分娩,无先天性异常,2名妇女选择终止妊娠。
讨论
该3期试验显示了NmCV-5疫苗与许可的、世卫组织预审合格的四价脑膜炎球菌结合疫苗MenACWY-D相比的免疫非劣效性。根据血清反应和GMT,在所有三个年龄组中都显示了非劣效性。NmCV-5疫苗的安全性与许可疫苗相似。这些数据有望支持NmCV-5作为五价脑膜炎球菌结合疫苗的许可和世卫组织资格预审,包括血清组X。
脑膜炎球菌结合疫苗(包括针对新血清群的疫苗)的许可是基于免疫原性而非功效终点,这是一种成熟的方法。使用人补体测量的血清杀菌抗体最初被定义为美国新兵中抵抗侵袭性血清群C疾病的相关保护。然而,用兔补体进行的标准化检测随后被用于支持C血清群结合疫苗在英国的许可和引进。在英国,青少年中97%和幼儿中92%的短期单剂量疗效支持了这种方法的有效性,并且至少8的SBA滴度和至少4倍的滴度增加被确定为针对该血清群的疫苗诱导保护的标志。在英国和其他地方,接种疫苗后12个月内,所有年龄组的有效率在91%和96%之间,在婴儿期后接种疫苗的人群中,保护作用更加持续。
脑膜炎球菌血清群A结合疫苗MenAfriVac的许可也采用了类似的方法。在缺乏明确的保护相关性和高基线抗体滴度的情况下,SBA滴度增加4倍的要求被用作主要终点。根据在整个非洲脑膜炎地带推广疫苗之前和之后加强的监测,脑膜炎的发病率大幅下降,血清A群疾病几乎已经消失。在开展MenAfriVac运动后的一年里,布基纳法索的脑膜炎发病率下降了71%,血清A群脑膜炎发病率下降了99.8%。在乍得,接种疫苗后4至6个月内,脑膜炎发病率下降了94%。在脑膜炎地带的9个国家进行的一项研究显示,与大规模疫苗接种活动相关的疑似脑膜炎发病率降低了57%,血清A群脑膜炎发病率降低了99%以上。血清群C和A结合疫苗也产生群体保护,这表明对鼻咽携带和侵袭性疾病有影响。
现在有关于MenACWY-D疫苗和其他四价疫苗有效性的早期数据,这些疫苗也是根据免疫原性结果获得许可的。在对美国青少年进行单剂量MenACWY-D疫苗接种后血清群C和Y突破病例的分析中,疫苗有效性估计在80%至85%之间。在相同环境下进行的一项病例对照研究估计,疫苗接种后1年内的疫苗有效性为79 %, 1至3年间为69%。疫苗接种后8年内,针对血清群C的疫苗有效率为79%,针对血清群Y的疫苗有效率为51%。在英国青少年中引入主要使用MenACWY-TT(Nimenrix,辉瑞)的四价疫苗计划后,最近显示疫苗的总体有效性为94%,其中针对血清群W的有效性为94%,针对血清群Y的有效性为82%。该计划还被证明可减少脑膜炎球菌的咽部携带,并有望产生群体保护。
因此,强有力的实施后数据支持基于免疫原性而非疗效终点的脑膜炎球菌结合疫苗许可。这种有效性数据的可用性和MenACWY-D疫苗的广泛使用(这是第一个获得许可的四价结合疫苗,包括作为西非疫情响应的一部分),支持在本次试验中选择该疫苗作为对照疫苗。据报道,目前许可的四种四价疫苗的免疫原性存在一些差异。然而,缺乏数据表明这些免疫原性差异转化为有效性的差异。在这方面,对NmCV-5的普遍较高的免疫应答提供了进一步的保证。
这项试验有几个优点。马里和冈比亚都位于非洲脑膜炎带,因此是未来接种NmCV-5疫苗的关键目标人群的代表,该研究结果很可能转化为其他情况。各年龄组免疫反应的一致性也令人放心。最后,用于生产NmCV-5疫苗的技术基于载体蛋白生产、多糖发酵和纯化以及化学结合的成本有效的方法。因此,该疫苗有望以低于现有四价疫苗的成本上市。
基于免疫原性的产品许可的局限性是公认的,并且产生关于NmCV-5疫苗的有效性数据,特别是针对血清组X疾病的有效性数据将是重要的。关于6个月和12个月时免疫反应持久性的数据将是必要的,特别是考虑到NmCV-5在流行病反应之外的潜在未来常规使用。
此外,血清群A的高基线GMT反映了马里和冈比亚以前的MenAfriVac运动和常规免疫规划的结果,限制了血清群A反应的参与者的百分比。尽管如此,疫苗接种后的滴度比已经显示的针对该血清群提供保护的滴度高得多,并且超过95%的以前未接种疫苗的幼儿有血清群A反应。
在这项试验中,我们发现NmCV-5疫苗引发的免疫反应不劣于与MenACWY-D疫苗相同的所有四种血清型的免疫反应,也不劣于血清组X的免疫反应,没有明显的安全性问题。根据这些试验数据,NmCV-5可能成为支持脑膜炎球菌疾病控制的工具,特别是在撒哈拉以南非洲的脑膜炎地带,因此可能有助于消除流行病和2030年战胜脑膜炎全球路线图计划的其他目标。
Haidara FC, Umesi A, Sow SO, Ochoge M, Diallo F, Imam A, Traore Y, Affleck L, Doumbia MF, Daffeh B, Kodio M, Wariri O, Traoré A, Jallow E, Kampmann B, Kapse D, Kulkarni PS, Mallya A, Goel S, Sharma P, Sarma AD, Avalaskar N, LaForce FM, Alderson MR, Naficy A, Lamola S, Tang Y, Martellet L, Hosken N, Simeonidis E, Welsch JA, Tapia MD, Clarke E. Meningococcal ACWYX Conjugate Vaccine in 2-to-29-Year-Olds in Mali and Gambia. N Engl J Med. 2023 May 25;388(21):1942-1955. doi: 10.1056/NEJMoa2214924. PMID: 37224196.
https://blog.sciencenet.cn/blog-55647-1392327.html
上一篇:[转载]350.JYNNEOS对猴痘疾病的疫苗效力
下一篇:[转载]352.狂犬病mRNA疫苗引发高交叉中和抗体