博文
过继性T细胞疗法中T细胞扩增的优化
||
过继性T细胞疗法(Adoptive T cell therapy),通常包括:肿瘤浸润淋巴细胞(TILs),嵌合抗原受体T淋巴细胞(CAR-Ts),T细胞受体工程化T细胞(TCR-Ts)和抗原特异性细胞毒性T淋巴细胞(CTLs),这是T细胞免疫治疗进展迅速的领域。要想最大限度地发挥患者来源T细胞的治疗潜力,一个重要的课题就是,必须建立和优化T细胞的体外培养扩增体系和方案。通常,一次从患者体内采集的初始量淋巴细胞,特别是从肿瘤组织中分离的TILs, 数量往往各异,但总体数量并不是很多,而临床疗法可能需要数十亿到上百亿个扩增的T细胞。
大规模生产用于治疗的T细胞是个复杂的多步骤过程,在这个过程中有许多可优化的机会,从而有助于获得最大T细胞产量,同时保持具有临床疗效的T细胞最终表型。研究显示,将T细胞维持在恰当细胞密度可改善T细胞的生长和存活率,尤其是在细胞扩增的早期阶段。
目前的T细胞体外扩增体系中,最常用的是T细胞快速扩增方案(Rapid Expansion Protocol,REP)。通常REP方案分为两步:前REP(pre-Rapid Expansion Protocol,pre-REP)和REP。pre-REP就是T细胞培养扩增的早期阶段,主要是用在刺激启动T细胞激活和分化的处理措施,而后的REP则是快速扩增T细胞的主要阶段。
无论在pre-REP和REP阶段都存在各自优化的机会和方法。通过优化培养方案,在10-14天的静态培养过程中,人T细胞数量可扩增到数百倍-甚至上千倍,同时保持细胞存活率可以>85%。使用 Xuri™ W25(GE Healthcare)和Applikon ez2-Control BioBundle等细胞扩增设备的细胞培养方式,也能促进细胞的整体的快速生长。这些方法可在T细胞扩增工作流程中实施,通过具体的优化调整,确保最佳的T细胞存活率和最高的产率。
以STEMCELL-Tech培养体系为例,可以作为可参照的培养体系优化模型。
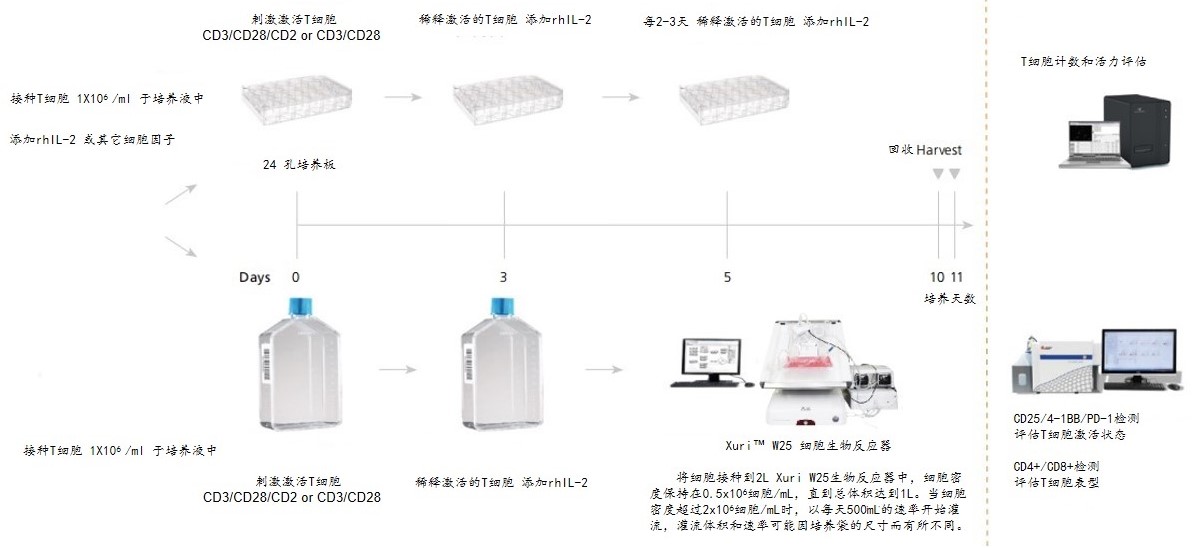
纯化的T细胞以1x106 细胞/ml接种在淋巴细胞培养液中,据不同培养体系添加相应浓度的rhIL-2。第0天加入25μL/mL CD3/CD28激活磁珠或激活抗体;第3、5、7和/或10天,按照图示对细胞进行传代,并对T细胞计数和活力进行评估。
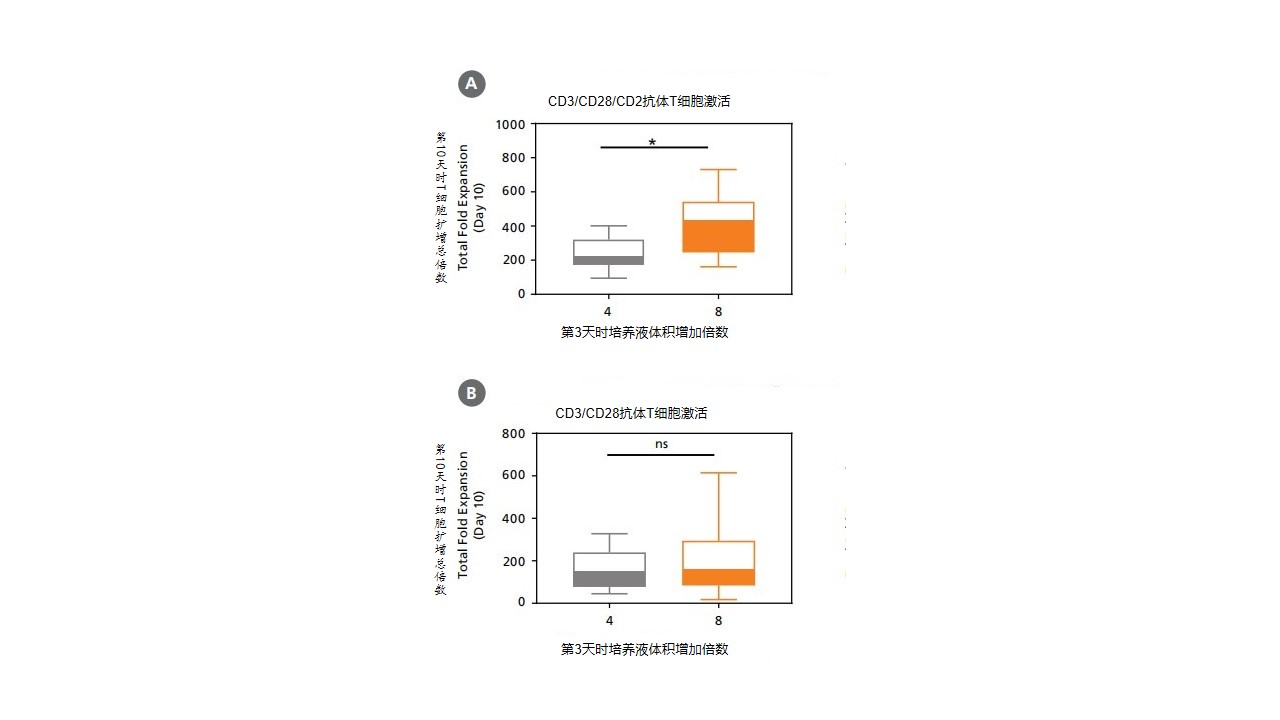
本培养系统的优化过程如下:在第0天使用CD3/CD28/CD2 抗体刺激T细胞,或使用CD3/CD28抗体刺激T细胞活化,同时在T细胞扩增培养基加入rhIL-2 进行静态培养。第3天使用新鲜培养基将总培养体积增加到4或8倍。第5天和第7天的总培养体积再增加4倍,直到培养第10天。分析了培养过程中的累积扩增倍数和培养第10天时的总扩增倍数。与初始细胞播种数量的比较。CD3/CD28/CD2抗体刺激T细胞活化,在第3天将培养体积增加8倍,可使细胞高速生长,在第10天时细胞的总扩增倍数为405±174。在第3天将培养基体积增加4倍,细胞的总扩增倍数为240±90; 使用CD3/CD28 抗体刺激T细胞活化,培养量增加8倍或4倍,总扩增倍数分别为分别为150±95和186±165。优化结果显示:用CD3/CD28/CD2抗体组合刺激T细胞效果优于CD3/CD28抗体组合。CD3/CD28/CD2抗体组合中,第3天将培养体积增加8倍组,T细胞的总扩增倍数最高。
要获得数10亿用于细胞疗法的T细胞,需要在受控环境中扩增大量细胞。上述优化的T细胞扩增程序,可与 Xuri™ W25生物发生器配合使用,在封闭系统中扩增T细胞用于细胞治疗。播种在细胞培养瓶中,经过前述培养过程,在第 5天时将细胞转移到2 L Xuri™ 生物反应器的培养袋中,可以收获总扩增量最高的T细胞产率。
优化T细胞的生产方法非常重要。T细胞激活和以后的扩增过程中,掌握好细胞密度是优化T细胞扩增的关键因素之一。在早期T细胞扩增过程中,维持在较低的细胞密度可改善T细胞的生长和存活率。在STEMCELL-Tech体系中,第3天是优化T细胞扩增方案时,调整培养体积的关键时间点。在T细胞活化后第3天,培养的T细胞显示高水平的细胞活性,但并没有显著扩增。此时降低细胞密度,可以在T细胞接收到激活信号后,增加每个细胞的可用营养和空间,将改善T细胞的扩增潜力。不过,过多降低细胞密度也可能会降低自分泌生长因子的浓度或细胞间接触机会,而这两个条件都是支持最佳扩增和细胞存活率所必需的。因此,在把握培养基体积和细胞密度方面,需要针对具体的培养体系进行仔细的优化,达到良好的可重复性。
此外,在优化细胞扩增方案时需要考虑的其它变量是基因修饰或细胞处理等。因为用于治疗的某些疗法,通常需要对T细胞进行基因修饰(比如:CAR-Ts,TCR-Ts)或抗原呈递(CTLs),这些特殊的情况需要通过额外的优化过程来实现。本文的优化方案只是一个T细胞培养扩增的基本框架平台,通过这个基本平台,可以测试可能对T细胞扩增其他变量所产生的影响,比如起始细胞群体数(T细胞亚群)及数量,和加入不同组合的细胞因子等。至于何为最佳培养体积和细胞密度,会因这些变量的不同而不同,因此,最终建立自己实验室所熟悉的,经过充分验证和充分优化的最佳T细胞激活和扩增方案,才能有助于解决T细胞疗法面临的一些许多挑战。
至于TILs的制备和扩增,显然与CAR-Ts,TCR-Ts和CTLs显著不同,后者的T细胞采集通常是通过细胞单采仪或抽取外周血获得的,血液中T细胞含量相对一致,可利用的T细胞数量比较多,因此,系统优化和控制比较容易。我们已经处理过的肿瘤组织已有几十例次,初步形成了自己特有的TILs细胞的分离扩增平台。这些瘤组织包括:肺癌,肝癌,肠癌,卵巢癌,宫颈癌,胸腹水和肿瘤穿刺物等,这些癌症组织的异质性极大,手术切除后能获得的肿瘤团块大小不等,而且瘤组织中肿瘤浸润淋巴细胞的空间分布和数量显著不同,种种因素都显著增加了优化与扩增体系的难度。许多标本中能获得的TILs数量极少,做流式细胞仪分析都不够数量,只能直接加入培养基激活和做初始培养,没有条件做到象其它T细胞培养那样的纯化T细胞初始培养。此外,由于肿瘤组织中TILs的高度异质性,能大量扩增到临床数量级TILs的所需时间也显著不同,特别是在pre-REP阶段激活与扩增所需时间更长。因此,获得初始阶段高质量TILs细胞和对pre-REP阶段激活与扩增过程的优化处理,是成功生产临床级别大量高质量TILs的关键。
https://blog.sciencenet.cn/blog-3302154-1407919.html
上一篇:人们对饮酒与癌症风险的相关性还有待深入了解
下一篇:什么是饲养层细胞?为什么使用和怎样使用饲养细胞?