博文
近红外驱动的氢气释放治疗阿尔茨海默病
||
近红外驱动的氢气释放治疗阿尔茨海默病
一种仿生上转换纳米反应器,用于近红外驱动的氢气释放以抑制阿尔茨海默病治疗中的tau病变
亮点
利用生物相容性交联囊泡(CVs)开发了用于在近红外(NIR)光下原位产生氢气(H2)的仿生上转换纳米反应器。
通过封装双光敏剂(Chla + Ind),模仿自然光合作用过程,展示了纳米反应器的高光催化效率。
实现了NIR控制和局部化的氢气释放,有效缓解氧化应激并显著抑制阿尔茨海默病(AD)小鼠模型中的tau过度磷酸化。
为NIR触发的氢气疗法作为神经退行性疾病如AD治疗的潜力提供了一种新的概念证明。
摘要
异常的tau蛋白过度磷酸化是神经退行性疾病发作的主要病理标志之一,如阿尔茨海默病(AD),这可由过量的活性氧物种(ROS)引发。作为一种抗氧化剂,氢气(H2)有潜力通过清除高度有害的ROS(如•OH)来减轻AD。然而,传统的氢气给药方法在按需控制氢气释放方面面临着重大挑战,并且未能在病变部位实现有效积累。在此,我们报道了一种人工纳米反应器,它模仿自然光合作用,实现了近红外(NIR)光驱动的光催化氢气现场释放。这些纳米反应器由封装抗坏血酸和两种光敏剂——叶绿素a(Chla)和吲哚染料(Ind)的生物相容性交联囊泡(CVs)构建而成。此外,铂纳米颗粒(Pt NPs)作为光催化剂,而上转换纳米颗粒(UCNP)作为光收集天线,两者都附着在CVs的表面。在NIR照射下,纳米反应器原位释放氢气以清除局部过量的ROS,并在AD小鼠模型中减弱tau过度磷酸化。这种NIR触发的纳米反应器为针对AD的氢气疗法的巨大潜力提供了一个概念验证设计。
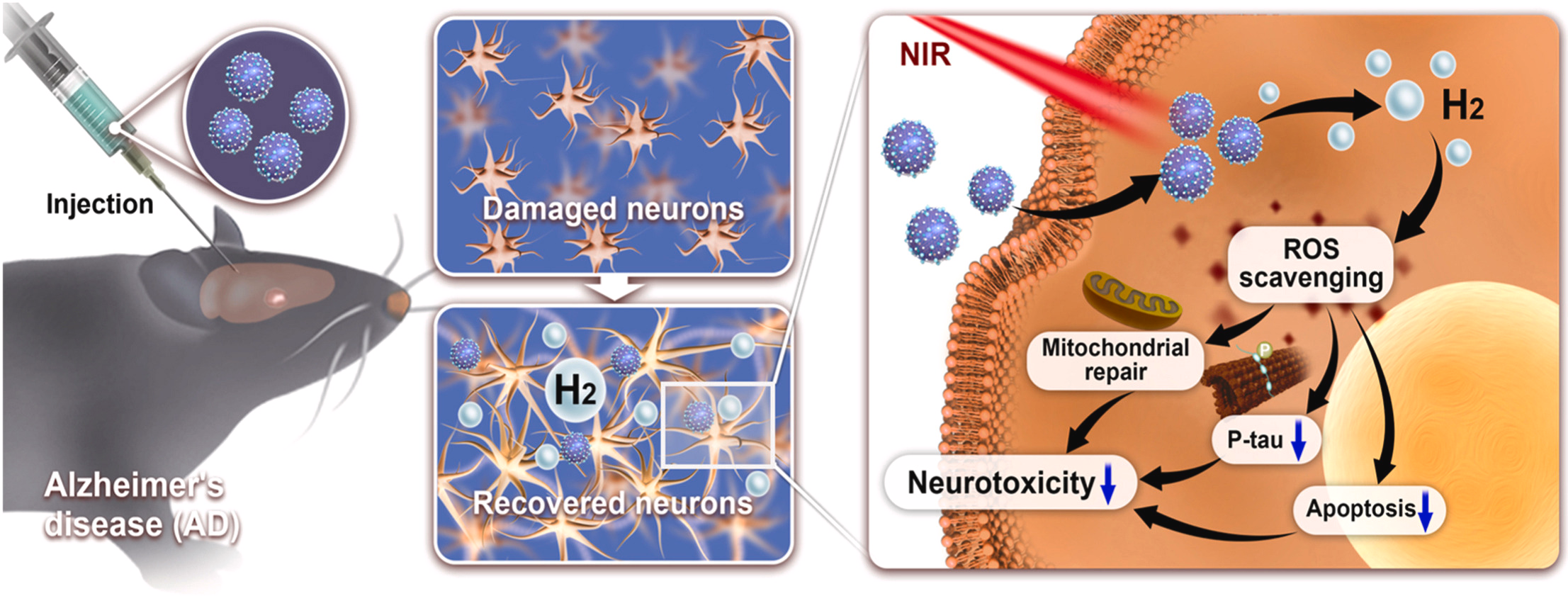
1. 引言
阿尔茨海默病(AD)是老年期痴呆的主要病因之一,被描述为一种持续和进行性的神经退行性疾病。其影响主要在海马体和皮层这两个与认知和记忆功能高度相关的大脑区域中表现出来。AD的病理标志特征是淀粉样β蛋白(Aβ)斑块和异常磷酸化tau(p-tau)蛋白的不溶性聚集物的形成,这些被称为细胞内神经原纤维缠结。尽管为针对这些标志物开发治疗方法做出了广泛努力,但由于这种疾病的复杂性和多面性,它仍然无法治愈。到目前为止,基于Aβ聚集机制的治疗方法在临床试验中被报道失败。越来越多的证据表明,通过过度磷酸化导致的tau聚集在AD的发病机制中至关重要。此外,AD也可能由一系列涉及氧化应激损伤的事件触发,这些事件可以导致tau超磷酸化。因此,旨在清除过量活性氧(ROS)以恢复大脑氧化还原平衡的抗氧化治疗策略已成为治疗AD的主要方法。
最近的研究显示,氢气(H2)具有强大的抗氧化特性,能够选择性地清除包括羟基自由基(•OH)、过氧亚硝酸盐(ONOO−)和过氧化氢(H2O2)在内的高细胞毒性ROS。氢气疗法与传统化疗相比具有显著优势,包括副作用最小,以及由于其小尺寸和非极性性质而在生物膜上的高扩散性。目前,氢气的给药可以通过三种常见途径实现,包括吸入氢气、口服富含氢气的水和注射溶解有氢气的盐水。然而,这些方法在将氢气输送到疾病病灶方面效果不佳,因为氢气在体液中的溶解度低(<1.6 ppm)。鉴于这些挑战,开发高效的输送策略以有效积累氢气于AD病灶处对于增强基于氢气的药物对神经退行性疾病的治疗潜力至关重要。
纳米技术的进步为构建智能控制的货物释放系统提供了多种策略。新兴的基于纳米材料氢气疗法在治疗各种炎症性疾病方面显示出了希望,与传统的抗氧化药物如维生素E和白藜芦醇相比,这些纳米材料具有良好的生理稳定性和生物利用度,而传统药物往往存在吸收不良、代谢迅速以及对脑病变目标不足的问题,限制了它们对神经退行性疾病的治疗效果。然而,当前的氢气纳米载体也面临着自己的一系列挑战。例如,像介孔纳米结构或纳米发生器这样的纳米载体可以介导持续的氢气积累,但可能缺乏主动靶向能力,导致细胞内信号传导失衡通过过度还原。因此,开发用于远程控制疾病部位原位氢气生成的纳米平台非常有助于解决这些限制。文献先例通常涉及金属氢化物的水解,包括钙镁或钯氢化物,作为这些纳米材料中氢气产生的来源。然而,这些化学品中的大多数通常在水溶液中不稳定,因此很难抑制非特异性反应,特别是在生理系统中。最近,受人工光合作用启发的纳米平台利用太阳能或光能光催化分解水产生氢气和氧气,为原位光催化氢气释放提供了一种创新方法。尽管一些研究已经报道了光催化纳米平台抑制AD中Aβ斑块的情况,但光合作用合成的氢气释放对病理性tau磷酸化的影响尚未探索(表S1)。
在此,我们设计了一种受光合作用启发的纳米反应器(NR),它能高效利用近红外(NIR)光进行光催化氢气生成,以抑制AD模型中氧化应激介导的tau病变(图1)。纳米反应系统的架构基于一个坚固交联的囊泡(CV)。这个CV为光催化化学反应提供了一个限定且稳定的微环境,并充当纳米载体以容纳NIR响应型光合系统所需的成分,包括上转换纳米粒子(UCNPs)、光敏剂、催化剂以及牺牲电子给体/质子给体(图1)。为了充分利用UCNPs从NIR转换来的可见光,我们创新性地将两种光敏剂,叶绿素a(Chla)和Indoline(Ind)染料,结合到纳米系统中。Chla是叶绿素的一种特定形式,是最常见的自然光合色素,它吸收来自紫罗兰蓝色和橙红色光的大部分光能以进行有氧光合作用,并且可以是人造光收集系统的一个良好组分。同样,Ind是一种在仿生太阳能电池中具有高转换效率的众所周知的合成分子,并在绿光区域显示出强吸收。因此,Chla可以与Ind结合在我们的纳米反应器中,以实现几乎全可见光谱吸收,显著提高光催化氢气产生的效率,使我们的纳米反应器与现有的人造光合氢气生产纳米系统区别开来(表S2)。为了启动氢气形成,我们的交联囊泡结合的UCNPs将NIR照射转换成可见光以激发光敏剂(Chla和Ind),这些光敏剂起到电子捐赠的双重作用,并随后被抗坏血酸(AA)还原,释放出脱氢抗坏血酸(DHA)和H+作为副产品。同时,交联囊泡结合的铂纳米颗粒(Pt NPs)通过结合激发的电子和H+快速催化氢气产生,从而在局部产生高浓度的治疗用氢气气体(图1和图S1)。在这项概念验证工作中,我们的结果显示,NIR控制的原位生产生物还原性氢气气体显著恢复了体外和体内AD模型的ROS稳态。通过中和过多的ROS,我们的纳米反应器触发了(1)线粒体异常的恢复,(2)通过Akt/GSK-3β信号通路减弱tau过度磷酸化,以及(3)在NIR照射下保护体外AD模型中的神经元免于凋亡。此外,这种在皮质和海马中的局部氢气生成挽救了神经元密度,并通过抑制p-tau病变改善了小鼠AD模型的认知功能。这些机制性发现强调了这种NIR介导的局部氢气输送的仿生策略,有潜力成为一种有前景的方法来平衡过多的ROS,以解决tau聚集并限制AD的发病机制。
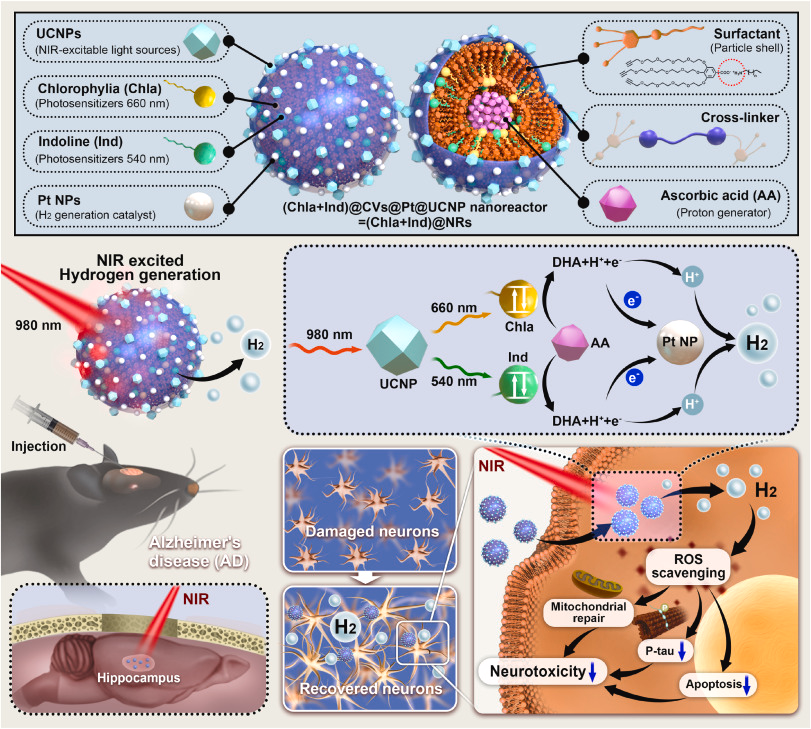
图1. 示意图展示了(Chla + Ind)@NR的制备以及NIR触发的(Chla + Ind)@NR原位氢气释放,用于清除局部过量ROS,减轻线粒体损伤,并减少AD治疗中的tau过度磷酸化。
结果与讨论
2.1. 阿尔茨海默病光催化纳米反应器的合成与表征
为了制备我们的纳米反应器,我们首先采用了两亲性表面活性剂和含硫醇的交联剂,根据我们之前的方法形成了交联囊泡作为一个稳定的隔室(图S2-3)。需要注意的是,这种表面活性剂由一个疏水尾(碳氢化合物)和一个亲水头(带有三炔基团的低聚乙二醇)组成(图1)。因此,我们将含有Chla和Ind的表面活性剂溶液装载到含有抗坏血酸的水溶液中,通过自组装形成纳米囊泡(图2a)。为了增强结构稳定性,我们进一步添加了乙二醇二硫醇作为交联剂和Irgacure 2959光引发剂,以实现光交联,形成了包含光敏剂的交联囊泡,称为[(Chla + Ind)@CV](图2a)。基于标准吸收曲线,Chla和Ind的装载效率(LE%)分别计算为67.7%和71.4%(图S4)。透射电子显微镜(TEM)显示了(Chla + Ind)@CV的球形形态和膜状结构,物理尺寸约为110 nm(图S5a-b)。通过在交联囊泡表面还原氯铂酸来掺杂Pt NPs,产生围绕交联囊泡的Pt纳米点,即(Chla + Ind)@CV@Pt(图2b)。能量色散X射线光谱与映射分析显示了(Chla + Ind)@CV@Pt纳米系统中Pt的存在(图2c和图S5c)。X射线光电子能谱进一步揭示了Pt 4f7/2和Pt 4f5/2双峰在结合能72.1和76.2 eV处的去卷积峰(图2d)。
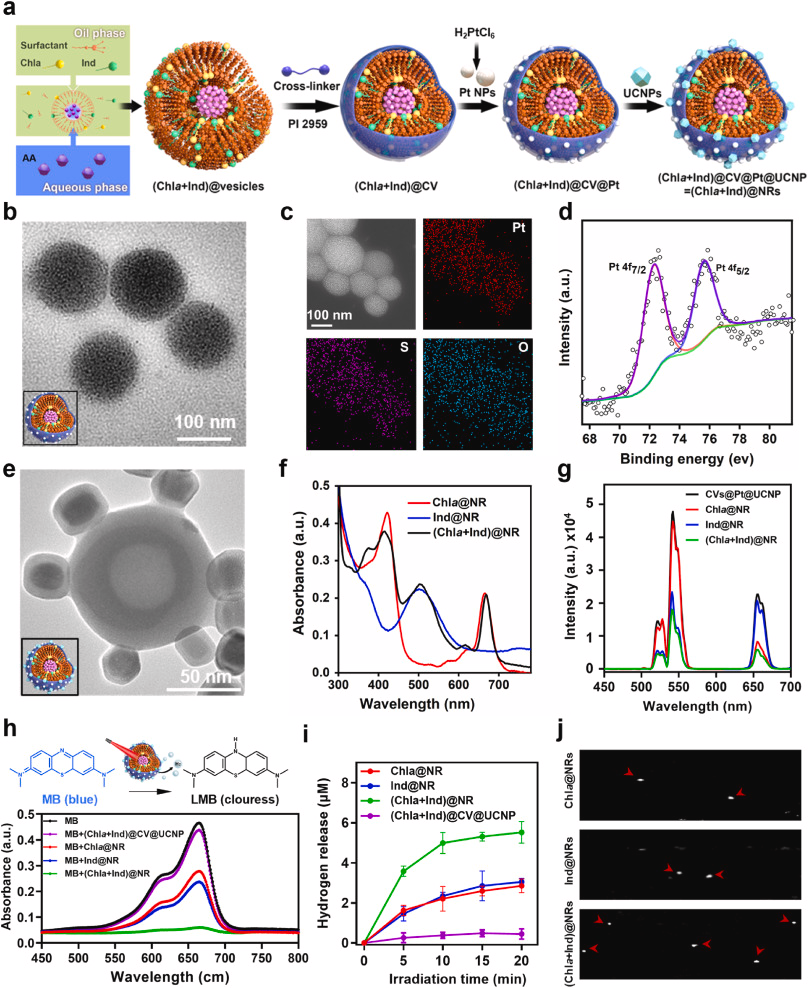
图2. (Chla + Ind)@NR的制备和材料表征。(a) (Chla + Ind)@NR的制备程序示意图。(b) (Chla + Ind)@CV@Pt的透射电子显微镜图像。(c) 对(Chla + Ind)@CV@Pt中Pt、O和S的透射电子显微镜元素映射分析。(d) (Chla + Ind)@CV@Pt中Pt 4f的X射线光电子能谱。(e) (Chla + Ind)@NR的透射电子显微镜图像。(f) Chla@NR、Ind@NR和(Chla + Ind)@NR的紫外-可见吸收光谱。(g) 在980 nm激发下,功率为0.5 W/cm2时,UCNPs、Chla@NR、Ind@NRs和(Chla + Ind)@NR的上转换发光光谱。(h) 顶部:MB氢化反应机制用于检测氢气。MB:亚甲基蓝。LMB:无色亚甲基蓝。底部:在980 nm激光照射下,(Chla + Ind)@CV@UCNP、Chla@NR、Ind@NR和(Chla + Ind)@NR在MB溶液中的紫外-可见吸收光谱。(i) 使用MB作为氢气探针,在980 nm激光照射不同时间后,从(Chla + Ind)@CV@UCNP、Chla@NR、Ind@NR和(Chla + Ind)@NR溶液中释放还原性氢气的定量分析。(j) 在980 nm激光(0.5 W/cm2)照射10分钟后,Chla@NR、Ind@NR和(Chla + Ind)@NR溶液中产生的氢气气泡的超声成像。
接下来,我们合成了核/壳结构的UCNPs,尺寸为15 nm,能够在980 nm辐射下将NIR转换为两个强峰的可见光致发光,分别为542 nm(绿色)和658 nm(红色)(图S6a–c)。上转换能量迁移过程展示在图S6d中。特别是,由于2F7/2 → 2F5/2跃迁,Yb3+是980 nm激发的理想敏化剂,这与Er3+的电子跃迁非常吻合。Er3+在542和658 nm处的上转换发射归因于2H11/2 → 4I15/2和4F9/2 → 4I15/2跃迁,然后传递并激发Chla和Ind (Chla*和Ind*),导致电子捐赠和电子-空穴对的产生。Chla*和Ind*随后与抗坏血酸和Pt NPs反应生成氢气,并返回基态进行下一轮反应(图S6d)。这两个发射峰与Ind和Chla的吸收峰高度重叠(图S7),可能增强了NIR光捕获效率。然后,我们通过强烈的硫醇-金属相互作用将UCNPs共价结合到(Chla + Ind)@CV@Pt上,形成了我们的光催化纳米反应器,以下简称为(Chla + Ind)@NR。透射电子显微镜成像证实UCNPs稳定附着在(Chla + Ind)@CV@Pt上,尺寸增加了约28 nm(图2e)。值得注意的是,(Chla + Ind)@NR展现了与Chla和Ind相似的特征吸收峰(图2f),而(Chla + Ind)@NR在658 nm(I658)和542 nm(I542)处的荧光强度分别比未负载光敏剂的原始CV@Pt@UCNP降低了68.9%和61.5%(图2g和图S8)。这一结果表明,上转换光子能量高效转移到两种光敏剂上。此外,(Chla + Ind)@NR在PBS缓冲液、盐水溶液和细胞培养基中的一致流体动力学直径长达4天,表明它们具有胶体稳定性和分散性(图S9),使其适合在复杂的生理环境中执行一系列高效的能量转移。
接下来,我们研究了由表面结合的Pt NPs赋予的(Chla + Ind)@NR的内在催化性能,通过H2O2分解测定。因此,含有光敏剂的NR [例如,Chla@NR、Ind@NR和(Chla + Ind)@NR]快速启动了这一分解过程,在10分钟内O2累积水平超过20 mg/L,不论NR中光敏剂的含量如何(图S10)。这一结果鼓励我们通过亚甲基蓝(MB)染料还原测试来探索我们NRs的整体光催化行为,以指示氢气生产。NIR激发的(Chla + Ind)@CV@UCNP并未触发氢气介导的MB还原显著效应(图2h和图S11),表明没有Pt NPs的纳米系统几乎不释放氢气。Chla@NR或Ind@NR将664 nm处的MB吸光度减少到未处理MB组的一半,而(Chla + Ind)@NR几乎将所有MB还原为无色亚甲基蓝(LMB)(图2h),这表明Pt NPs作为催化剂对于光催化氢气生产至关重要。值得注意的是,(Chla + Ind)@NR在10分钟内产生的氢气速度比Chla@NR和Ind@NR快约1.8倍(图2i和图S11)。这些结果显示,与单一光敏剂含量的纳米反应器相比,加入两种光敏剂通过更宽的光谱吸收(红色和绿色上转换发光)提供了双重效果的氢气生成效率。此外,我们采用超声成像系统观察反应过程中的氢气气泡。一致地,(Chla + Ind)@NR组在同一可视区域内显示了更多的气泡(图2j)。至此,我们的纳米反应器在NIR触发的光催化氢气生成方面表现出了显著的能力。在接下来的实验中,我们继续将Chla@NR和Ind@NR作为(Chla + Ind)@NR的比较组,以强调我们实验设计中双重光敏剂负载的重要性。
2.2 光控细胞内活性氧清除
我们首先评估了我们的纳米平台对PC12细胞(一种大鼠神经内分泌细胞系模型)的细胞毒性。这些细胞在暴露于浓度高达500 μg/mL(我们实验剂量的四倍)的纳米反应器时,保持了超过85%的存活率,表明它们具有很高的生物相容性(图S12a)。我们还评估了PC12细胞在与Chla@NR、Ind@NR和(Chla + Ind)@NR孵育后,在100 μg/mL浓度下进行近红外照射后的相对存活率。结果表明,所有组的存活率在照射后均保持在93%以上(图S12b),这表明这种近红外功率设置不会对神经细胞造成损伤。此外,我们的纳米反应器特别设计用于促进氢气产生,同时在近红外照射下尽量减少ROS的产生,尽管使用了光敏剂(Chla和Ind)来吸收上转换发光并为光催化氢气产生捐赠电子(图S13)。这些发现表明,我们的人工光合作用系统对神经元无毒。随后,我们评估了我们的纳米反应器被细胞摄取的效率。重要的是,所有组[Chla@NR、Ind@NR和(Chla + Ind)@NR]在摄取6小时后从胞浆中捕获到强烈的红色和绿色上转换发光信号,表明纳米反应器的良好细胞进入(图3a)。值得注意的是,用氯丙嗪预处理过的细胞中(Chla + Ind)@NR的荧光强度显著降低至未处理组的仅18.9%,而对于用制霉菌素预处理过的细胞没有观察到明显的荧光强度变化,表明这些NRs通过网格蛋白介导的内吞途径进入细胞(图S14)。为了证明细胞内氢气生成的能力,我们用MB染料染色PC12,然后将细胞与纳米反应器一起孵育。如预期那样,我们的体外结果显示MB还原的趋势与溶液测定中的相同(图2i),即在NIR控制下,经Chla@NR、Ind@NR和(Chla + Ind)@NR处理的组中MB染色的细胞蓝色显著消退,而在(Chla + Ind)@CV@UCNP组中没有明显变化(图3b)。同时,没有NIR照射的情况下,纳米反应器不影响MB染色,确保氢气仅通过光控在细胞内产生。
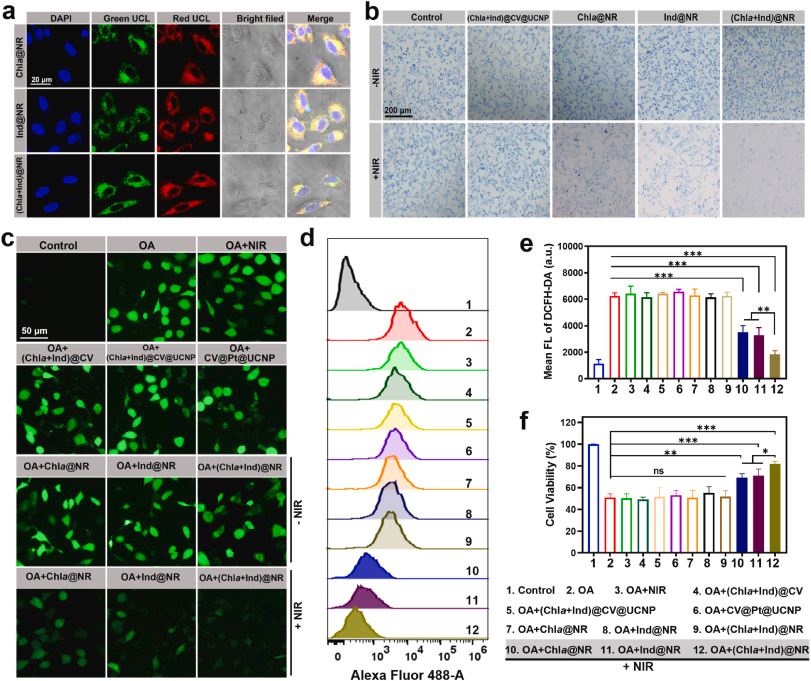
图3.(Chla+Ind)@NR的细胞内ROS清除能力研究。(a)与Chla@NR、Ind@NR和(Chla+Ind)@NR孵育后的PC12细胞的共聚焦显微镜图像。在980nm激发下捕获绿色上转换发光(UCL)和红色UCL的图像。比例尺:20μm。(b)MB染色的PC12细胞中(Chla+Ind)@CV@UCNP、Chla@NR、Ind@NR和(Chla+Ind)@NR释放氢气的定性调查。比例尺:200μm。(c)DCFH-DA代表的荧光图像显示细胞内ROS水平。用OA处理PC12细胞以诱导ROS过度产生,然后进行各种带或不带NIR激光照射的处理。(d)通过流式细胞术分析DCFH-DA探针的细胞内荧光强度。(e)通过流式细胞术测量的DCFH-DA细胞内荧光强度的统计结果。(f)通过MTT试验测量PC12细胞的相对细胞活力。数据以平均值±标准差(n=3)表示。显著性:无显著差异(ns),p<0.05,p<0.01和p<0.001。
为了评估(Chla+Ind)@NR的ROS清除能力,我们通过用冈田酸(OA)处理PC12细胞,诱导神经元ROS过度产生和Tau蛋白异常过度磷酸化,建立了体外AD模型(图S15)。我们使用绿色荧光染料DCFH-DA检测细胞内ROS。同样,与对照细胞相比,OA处理使ROS水平显著升高了5.2倍(图3c-e)。我们证实,单独的NIR刺激和具有不同含量(例如,不含UCNP的NR;不含Pt NPs作为光催化剂的NR;不含光敏剂的NR)的不完全构建的NR没有降低ROS水平(图3c-e)。相比之下,在Chla@NR、Ind@NR和(Chla+Ind)@NR组中,NIR介导的ROS过度产生的抑制作用取得了成功。特别是,(Chla+Ind)@NR组在清除ROS水平方面的表现优于其他两组,大约是它们的1.9倍,且该ROS水平比未处理对照组低约3.2倍(图3c-e),这证明了我们NR中氢气产生的远程控制功能。由于过量的ROS会导致神经元死亡,因此在OA损伤组中,只有51.6%的PC12细胞存活(图3f)。NIR刺激的Chla@NR、Ind@NR和(Chla+Ind)@NR组分别将细胞存活率有效提高到70.7%、73.1%和82.2%(图3f),而在非NIR照射组中,细胞存活率没有显著提高。这些发现表明,通过远程控制氢气的产生,可以有效地清除ROS,从而恢复OA模型中的神经元损伤。
2.3. NIR介导的Tau蛋白过度磷酸化和凋亡的减弱
线粒体在生物发生和呼吸中起着关键作用,这对于几乎所有哺乳动物细胞中的巨大生化过程都至关重要。线粒体功能障碍会影响AD的发病。线粒体形态可以反映其线粒体质量和稳态。我们的结果显示,OA损伤的神经元细胞显示出恶化和皱缩的线粒体形态,而在NIR照射下用(Chla+Ind)@NR处理后,这种形态得到了显著恢复(图4a)。同样,膜电位(ΔΨm)是线粒体生物能量特性之一。因此,我们使用JC-1染料来探测ΔΨm,该染料在低ΔΨm下形成绿色荧光单体,在高ΔΨm下形成红色荧光聚集体。OA处理的细胞显示出JC-1单体增加和聚集体减少,红绿荧光比率下降至对照组的31.2%,这与线粒体损伤的结果一致(图4b和图S16)。不完全的纳米反应器,如(Chla+Ind)@CV、(Chla+Ind)@CV@UCNP和CV@Pt@UCNP,在JC-1的红绿荧光比率上没有显著变化,表明ΔΨm几乎没有改善。相比之下,在NIR激活下,Chla@NR、Ind@NR和(Chla+Ind)@NR组成功恢复了ΔΨm,红绿比率分别为68.8%、71.0%和80.1%(图4b和图S16)。 结果表明,氢气的产生有效修复了神经细胞中的线粒体损伤。此外,我们对致病性p-tau蛋白的定量分析表明,在NIR照射下,Chla@NR、Ind@NR和(Chla+Ind)@NR组显著下调了OA诱导的Ser396、Ser199和Thr205表位的Tau蛋白过度磷酸化(图4c和d)。值得注意的是,(Chla+Ind)@NR组与Chla@NR和Ind@NR组相比,对p-tau的抑制作用最强,从而为治疗Tau病变提供了一种有前景的治疗策略。由于减少多余的ROS和减弱Tau蛋白过度磷酸化可以防止神经元死亡,我们通过流式细胞术对膜联蛋白V/碘化丙啶染色的细胞进行进一步评估细胞凋亡。不出所料,OA损伤细胞的凋亡率为45.8%。在NIR处理的(Chla+Ind)@NR组中,该比率急剧下降至14.8%,显著低于Chla@NR组(24.5%)和Ind@NR组(22.7%)的凋亡率(图4e和f)。这些结果强调了NIR介导的局部氢气产生在挽救神经元免于凋亡方面的高效率。
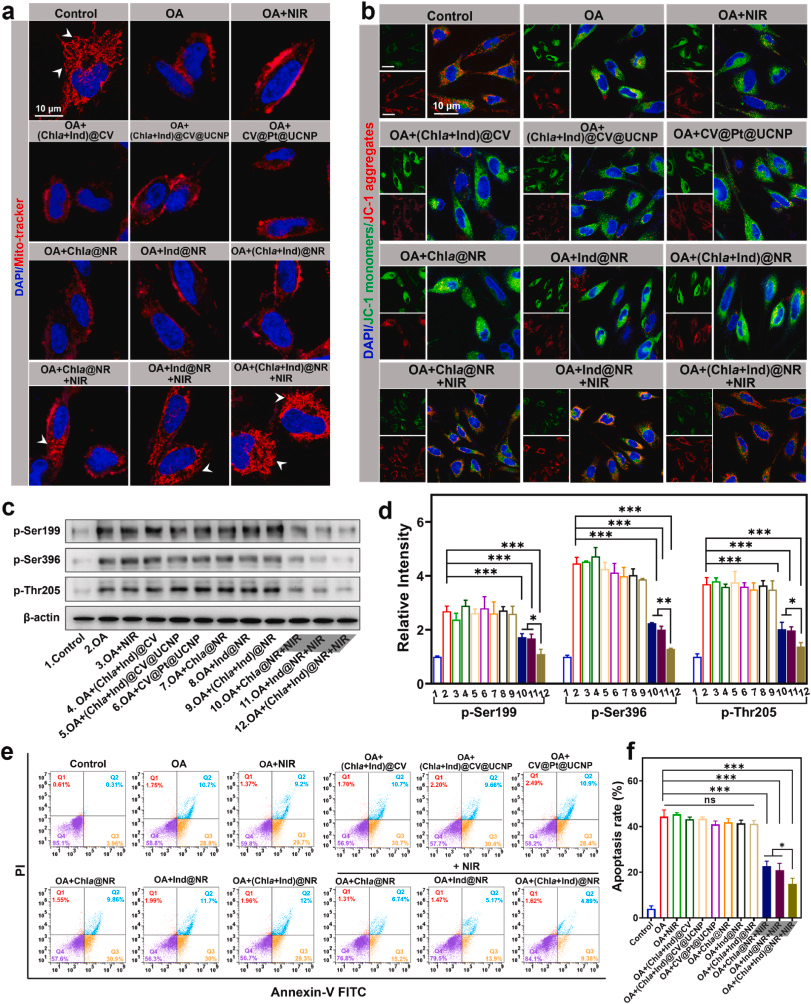
图4.(Chla+Ind)NR的体外治疗效果研究。(a)用Mito-tracker染色显示线粒体形态的各种处理后OA损伤的PC12细胞的代表性荧光图像。白色箭头表示形态正常的线粒体。比例尺:10μm。(b)用JC-1探针染色评估线粒体膜电位的各种处理后OA损伤的PC12细胞的代表性荧光图像。比例尺:10μm。(c)不同处理后PC12细胞中磷酸化ser199、ser396表位和thr205表位的p-tau蛋白的Western blot图像。(d)通过ImageJ软件对(e)中Western blot图像的相对条带强度进行量化。(e)通过流式细胞术测量与Chla@NR、Ind@NR以及(Chla+Ind)@NR(带或不带980nm激光照射)孵育后OA损伤的PC12细胞的凋亡结果。(f)(e)中早期和晚期凋亡率的量化结果。数据以平均值±标准差(n=3)表示。显著性:无显著差异(ns),p<0.05和**p<0.001。
2.4. 通过下调p-tau和凋亡信号抑制神经毒性
我们进一步探索了(Chla+Ind)@NR防止神经元凋亡和Tau蛋白过度磷酸化的潜在机制。众所周知,氧化应激可通过激活促凋亡蛋白BCL2相关X蛋白(Bax)和下游蛋白caspase 3来诱导凋亡。因此,Bax和caspase 3表达的上调可触发凋亡级联信号(图5a)。同样,在OA处理的细胞中,Bax和裂解caspase 3(c-Caspase 3)的蛋白表达水平升高(图5b和c),而在近红外(NIR)处理的(Chla+Ind)@NR组中,这种升高被显著抑制。除了凋亡外,AD中的Tau蛋白致病还涉及两种主要激酶:蛋白激酶B(Akt)及其下游激酶糖原合成酶激酶3β(GSK3β)。在正常的生理条件下,磷酸化Akt(p-Ser473)可触发GSK3β在Ser9残基处的磷酸化(图5a)。这一Akt/GSK3β信号轴可防止Tau蛋白过度磷酸化为p-Tau,而活性氧(ROS)可直接氧化并使Akt去磷酸化,从而破坏这一信号传导。在我们的结果中,OA处理的细胞显示出p-Akt和p-GSK3β的蛋白水平降低(图5b和d),这与体外AD模型中p-Tau表达的增强相一致(图4c)。另一方面,NIR刺激的(Chla+Ind)@NR组在NIR刺激下最有效地逆转了这一趋势,从而表明我们的NR通过恢复Akt/GSK3β信号通路来治疗Tau蛋白病变。总之,我们证明了在NIR光引导下,细胞内产生的生物还原性氢气显著下调p-Tau和凋亡信号,从而抑制神经毒性。
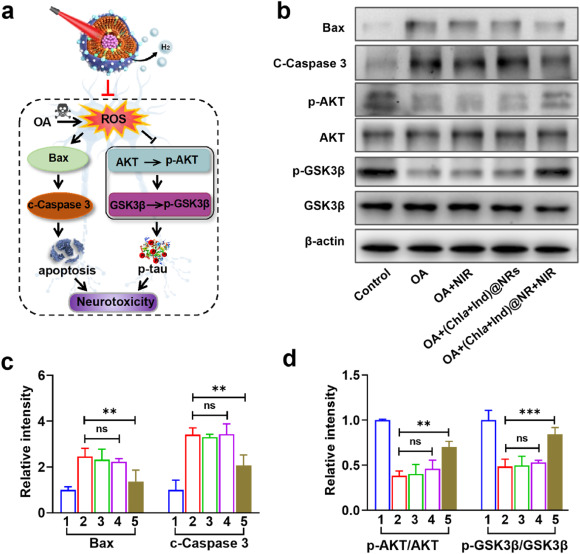
图5.(Chla+Ind)@NR的体外治疗机制。(a)提出的模型说明了(Chla+Ind)NR在抗凋亡和改善OA诱导的AD细胞模型中Tau蛋白过度磷酸化方面的机制。(b)PC12细胞和OA预刺激的PC12细胞在接受不同制剂处理后,Bax、c-caspase-3、p-Akt(p-Ser473)、Akt、p-GSK3β(p-Ser9)和GSK3β的Western blot图像。(c)Bax和caspase-3的定量结果,(d)p-Akt/Akt和p-GSK3β/GSK3的定量结果。Bax和c-caspase-3的水平以β-肌动蛋白为内参进行标准化。磷酸化Akt和磷酸化GSK3-β的水平分别以总Akt和GSK3-β为内参进行标准化。数据以平均值±标准差(n=3)表示。显著性:无显著差异(ns),p<0.01和*p<0.001,与OA组比较。
2.5. 用于小鼠AD模型治疗的原位氢气产生
我们通过在小鼠脑内注射OA,建立了体内AD模型,以诱导海马和皮质区域(AD病理影响的两个主要区域)的氧化应激和Tau蛋白过度磷酸化(图6a)。在AD模型建立14天后,我们将装载有IR780标记的NRs注射到海马中,通过定期监测荧光信号来追踪NRs的生物分布(图S17a)。值得注意的是,注射部位的荧光强度在注射后2-4小时左右达到峰值,并在24小时内保持较高水平,注射后24小时开始逐渐降低(图S17b-c)。我们在注射后3天收获的主要器官的体外荧光图像显示,肝脏和肾脏也含有IR780信号,但分别比大脑中少4.8倍和8.2倍(图S17d-e)。这一结果表明,注射的NRs的生物迁移过程最终通过血液循环在肝脏和肾脏中清除。
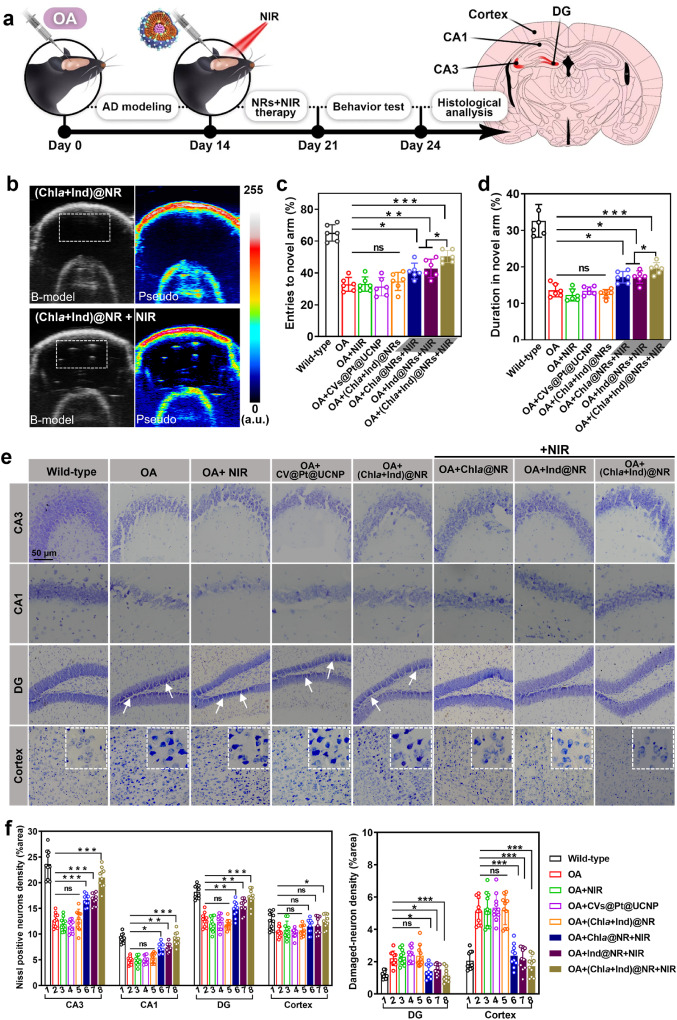
图6. 研究(Chla + Ind)@NR在AD小鼠模型中的治疗效果。(a) 动物实验流程图。(b) 在有无近红外照射的情况下,对小鼠施用(Chla + Ind)@NR后获得的体内超声图像。左侧列的图像使用超声成像系统的B模式捕捉。右侧列的图像代表B模式图像的伪彩色。感兴趣的区域(白色框)显示了在海马体中产生的氢气气泡的超声信号。对(c)进入新奇臂的次数和(d)新奇臂内的持续时间进行定量分析,在Y迷宫测试阶段(n = 6)。(e) 对小鼠大脑皮层和海马体(包括CA1、CA3和DG亚区)中神经元的密度和活性进行Nissl染色分析。Nissl染色的暗细胞由DG中的白箭头标记和皮层中的白框标记,代表受损神经元的典型形态变化。比例尺:50 μm。(f) 皮层和海马区域Nissl阳性神经元和Nissl染色暗神经元的定量结果。使用ImageJ软件对来自独立6次重复的随机选择的10个视野中的染色阳性细胞进行计数。显著性:无显著性(ns),*p < 0.05, **p < 0.01 和 ***p < 0.001。
为了评估体内的治疗效果,我们将NRs(Chla@NR, Ind@NR, 和 (Chla + Ind)@NR)立体定向注射到AD小鼠的单侧海马体中。注射后2小时,我们在颅窗上应用近红外激光照射以启动原位氢气气体释放。体内超声成像显示,施用(Chla + Ind)@NR并进行近红外照射后,海马区域出现了强烈的氢气气泡超声信号,表明我们的纳米反应器有效产生了原位氢气气体(图6b和图S18)。我们监测了被近红外激光照射覆盖的大脑区域的局部温度。由此产生的热像图表明,近红外照射仅在3°C增量内略微产生热效应,表明在整个NR激活过程中光热伤害最小(图S19)。AD的主要症状是进行性认知缺陷和记忆丧失。因此,我们引入了Y迷宫行为测试,通过记录新奇臂进入的频率和持续时间来探索AD小鼠的空间学习和记忆能力。与野生型对应物相比,OA损伤的AD小鼠进入新奇臂的次数几乎减少了一半,表明记忆功能显著受损和探索活动中断(图6c和d)。不含光敏剂的NR组(CVs@Pt@UCNP)和未经近红外照射的完整NR组[(Chla + Ind)@NR]均未改善AD小鼠的空间记忆表现。值得注意的是,经过近红外激发的(Chla + Ind)@NR组增强了AD小鼠的探索行为,如新奇臂中停留时间(从13.1%增加到19.5%)和进入次数(从31.8%增加到50.3%)的增加所示,与AD小鼠组相比,这表明学习和记忆功能得到恢复。这些发现强调了我们的仿生光合作用方法在大脑中高效生成氢气方面在缓解AD相关认知障碍方面的巨大潜力。
我们进一步进行了Nissl染色以检查皮层和海马体中神经元的病理形态,特别是在编码空间记忆和AD病理中tau病变的CA3、CA1和齿状回(DG)亚区。在未经任何治疗或仅用近红外照射处理的OA诱导AD小鼠中,Nissl小体呈现淡染,且与野生型小鼠相比,染色神经元萎缩(图6e)。相比之下,经过近红外照射后的(Chla + Ind)@NR组在CA3和CA1区域显示出增加的神经完整性和更紧密排列的细胞(图6e)。定量分析显示,与OA损伤的AD小鼠相比,(Chla + Ind)@NR处理的AD小鼠中Nissl阳性细胞密度在CA3和CA1分别增加到20.9%和9.1%,高于这些区域中的OA损伤AD小鼠(分别为12.7%和4.9%)(图6f)。此外,AD小鼠的DG和皮层切片显示出更多的Nissl染色暗细胞,代表了受损神经元的典型形态变化。在(Chla + Ind)@NR组有效产生氢气后,这些切片中的Nissl染色暗细胞显示出与野生型对照组相似的染色结果(图6e和f)。这些发现支持我们的纳米反应器减轻了体内的神经元损伤和神经毒性。
此外,我们使用DCFH-DA探针评估了大脑区域的ROS水平。引人注目的是,与野生型对应物相比,AD模型中的海马体和皮层的ROS水平分别增加了4.6倍和6.4倍(图7a和c)。施用CVs@Pt@UCNP和未经近红外激光的(Chla + Ind)@NR不影响ROS水平(图7a)。在接受NRs并有近红外照射的治疗组中发生了惊人的ROS清除,其效率顺序为:(Chla + Ind)@NR > Chla@NR ≈ Ind@NR(图7c)。这一ROS去除的趋势与体外研究的结果一致(图3c-e)。此外,我们进行了免疫荧光测定以评估大脑区域中p-tau的表达。结果显示,在野生型小鼠中几乎检测不到p-tau。然而,AD模型显示出强烈的p-tau点状染色,海马体和皮层区域的荧光强度分别比野生型高出4.1倍和2.6倍(图7b和d)。显然,我们的NRs(Chla@NR、Ind@NR和(Chla + Ind)@NR)的微注射以及随后的近红外激光照射显著减轻了p-tau表达。具体来说,NIR触发的(Chla + Ind)@NR组的海马体和皮层中的p-tau荧光信号仅约为野生型小鼠中的1.8倍和1.6倍(图7b和d)。总之,这些组织学分析强烈支持我们的NRs在近红外照射下有效中和神经元细胞中过量产生的ROS,以防止AD病理中的tau过度磷酸化。
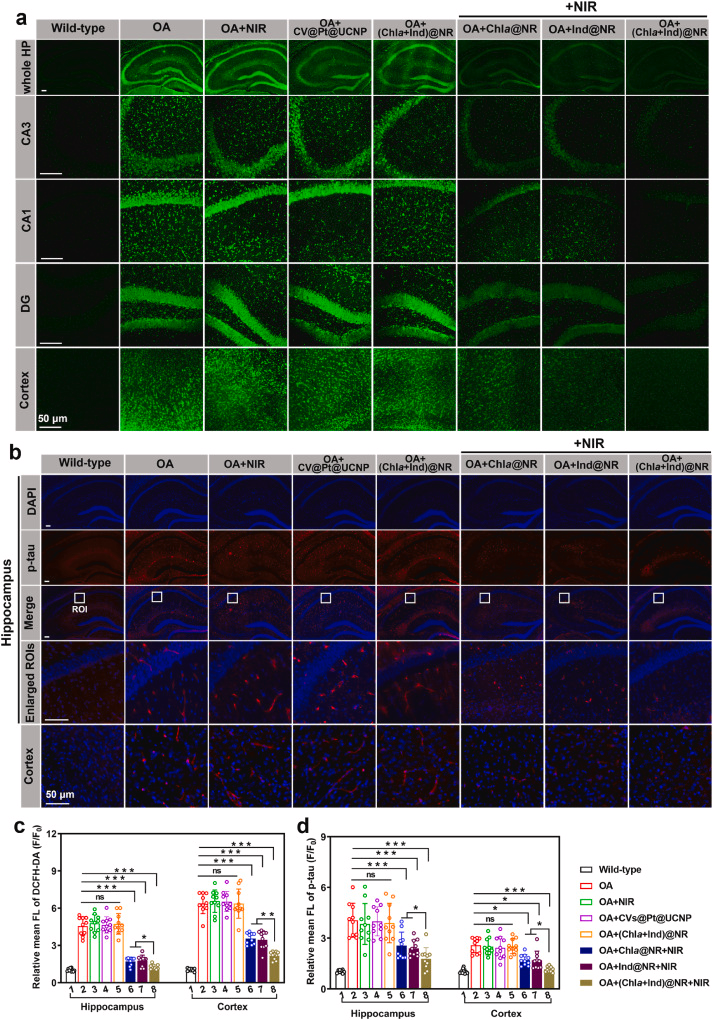
图7. (Chla + Ind)@NR治疗效果的离体评估。(a) 在野生型小鼠和OA诱导的AD模型小鼠的整个海马体(HP)以及CA1、CA3、DG和皮层区域的放大区域中,使用980 nm激光照射后,ROS指示剂DCFH-DA(绿色)的荧光染色结果。比例尺:50 μm。(b) 使用p-tau抗体(红色)和DAPI(蓝色)在海马体和皮层中的免疫荧光染色。比例尺:50 μm。使用ImageJ软件对(c) DCFH-DA和(d) p-tau水平的荧光强度进行量化。数据以平均值±标准差表示。显著性:无显著性(ns),*p < 0.05, **p < 0.01 和 ***p < 0.001。
最后,我们通过在给予Chla@NR、Ind@NR和(Chla + Ind)@NR的小鼠的主要器官(心脏、肝脏、脾脏、肺和肾脏)上进行苏木精/伊红(HE)染色来评估构建的纳米材料的体内生物安全性(图S20)。与野生型小鼠相比,注射NRs的小鼠没有显示出明显的组织病理学损伤。此外,溶血试验显示,纳米反应器共培养组未发生溶血现象,表明三种类型的纳米反应器具有出色的血液生物相容性(图S21)。总的来说,我们的光催化纳米反应器在体内应用中具有良好的生物安全性。然而,它们的脑室内给药方法未能满足非侵入性手术的要求。为了提高转化潜力,我们的目标是优化(Chla + Ind)@NR,以实现有效的血脑屏障穿透和第二窗口近红外光更好的组织/颅骨穿透,从而在我们的未来研究中引发原位氢气产生。
3. 结论
总之,我们已经开发了一种由近红外光驱动的人工纳米反应器,它模仿自然光合作用来实现原位氢气产生,用于清除活性氧物种以治疗AD。这种人工NR由具有优异生物相容性和稳定性的强交联纳米囊泡结构组成,为体外和体内的电子传递提供了理想的氧化还原活性隔室。作为刺激源,近红外光显示出低光损伤和深组织穿透,并被上转换为可见光以激发双光敏剂(Chla + Ind)进行人工光合氢生成。从机理上讲,局部氢气递送有效地清除了过量的ROS,通过抑制Bax/caspase3和恢复Akt/GSK3β信号传导来减少神经毒性,防止线粒体功能障碍/凋亡和tau蛋白过度磷酸化在OA诱导的AD模型中。通过这种神经保护功能,治疗强烈减轻了AD小鼠的学习记忆缺陷和神经元损失。我们相信,这一概念验证工作为NIR触发的光催化氢气在AD进程中对病理性tau磷酸化的影响提供了新的见解,为AD治疗提供了一种新的氢疗法方法以抑制tau病变。
https://blog.sciencenet.cn/blog-41174-1449308.html
上一篇:氢气多功能医学效应 2024年英学位论文第一章
下一篇:涂一下让皮肤透明的普通染料【梦幻】