博文
菊粉和氢气吸入抗肿瘤效应研究【法】
||
菊粉和氢气吸入抗肿瘤效应研究【法】
氢气医学发展的今天已经有18年了,世界主要学术研究强国都开展了相关研究,其中日本、中国、韩国、美国的贡献最多,部分欧洲国家如英国、德国、波兰和塞尔维亚也有少量研究,但作为强国的法国在这方面比较缺席,研究非常少且不深入。最近来自法国的学者开展了一项研究,观察了吸入氢气和服用菊粉都能通过影响抗肿瘤免疫细胞的功能,这一研究从一个角度再次证明氢气的抗肿瘤效应,且肠道菌群也能通过氢气实现这种效应。
在临床前模型以及临床试验中,摄入菊粉和使用氢气(H₂)均展现出了抗肿瘤的效果。由于氢气是肠道微生物群(GM)中的细菌发酵菊粉产生的主要副产物之一,我们假设氢气可以介导菊粉的抗肿瘤作用。为了为这一假设提供支持性证据,我们首先确定了小鼠在摄入菊粉后接触氢气的模式,并制定了一种可复制该模式的吸入式氢疗法(H₂T)方案。然后,我们将连续两周每天灌胃给予菊粉对循环免疫的影响,与相应的吸入式氢疗法的影响进行了比较。我们还比较了补充菊粉与相应的吸入式氢疗法,对植入的黑色素瘤生长以及T淋巴细胞浸润的影响。菊粉和吸入式氢疗法都能使循环中的CD4⁺和CD8⁺T细胞出现类似的增加。此外,两种治疗方式对黑色素瘤肿瘤的生长也有类似的抑制作用。这些结果支持了这样一种机制,即肠道微生物群发酵菊粉产生的氢气可穿过肠道屏障扩散,并刺激负责抗肿瘤作用的免疫监视功能。
Pascal-Moussellard V, Alcaraz JP, Tanguy S, Salomez-Ihl C, Cinquin P, Boucher F, Boucher E. Molecular hydrogen as a potential mediator of the antitumor effect of inulin consumption. Sci Rep. 2025 Apr 3;15(1):11482.
引言
癌症目前是全球第二大死亡原因,预计在未来25年内其致死率还会上升。最近发布的一项估计预测,到2050年,全球癌症病例数将增加76.6%,同时癌症死亡人数将增加89.7%。这凸显了迫切需要开发新的治疗方法,并调整我们的日常习惯,以应对这一日益严重的问题。
根据“癌症的标志”理论,免疫系统在癌症进展中起着重要作用。实际上,在免疫监视过程中,几种免疫细胞,如传统的αβT细胞受体阳性(αβTcR⁺)的CD8⁺和CD4⁺细胞,以及γδT细胞受体阳性(γδTcR⁺)的T淋巴细胞共同发挥作用,以癌细胞为靶点来预防肿瘤的形成。由于这一机制在预防癌症发展中至关重要,许多治疗策略(统称为免疫疗法)已被开发出来,以增强免疫系统的活性并对抗肿瘤的进展。到目前为止,免疫疗法已经彻底改变了癌症治疗方式,并改善了患有各种癌症的患者的预后。然而,这些治疗可能会产生严重的与炎症相关的副作用,如自身免疫或心脏并发症,而且一些患者对治疗没有反应。为了进一步改善癌症预后,人们正在探索刺激免疫系统的创新方法。其中一个有前景的策略是调节肠道微生物群(GM)。
肠道微生物群是指存在于人体消化道中的101⁴个微生物。研究表明,肠道微生物群中特定细菌的存在,如双歧杆菌或嗜黏蛋白阿克曼氏菌,可促进免疫监视,并增强对免疫疗法和化学疗法的反应。因此,调节微生物群并促进有益细菌生长的策略正在开发中,以改善癌症患者的治疗效果。在这些策略中,使用益生元是一种可行的方法,益生元是一种能够选择性地支持有益微生物生长并带来健康益处的底物。
菊粉是一种益生元,可促进肠道微生物群中双歧杆菌的生长。我们的团队和其他研究小组已经提供了临床前证据,证明了菊粉具有抗肿瘤作用。在这种情况下,补充菊粉已被证明可以抑制黑色素瘤、纤维肉瘤和异位结直肠癌小鼠模型中的肿瘤生长。这种抗肿瘤作用源于增强的免疫监视功能。在小鼠中,补充菊粉可增加传统的CD4⁺和CD8⁺T淋巴细胞以及γδ T细胞对肿瘤的浸润。此外,这些免疫细胞更倾向于抑制肿瘤生长,因为它们中有更高比例的细胞产生干扰素-γ(IFN-γ)。我们的团队还表明,γδ T细胞对于菊粉的抗肿瘤作用至关重要,因为抑制它们的激活会阻止补充菊粉所带来的有益效果。同样,我们已经证明,肠道微生物群的细菌成分对于菊粉的免疫刺激和抗肿瘤作用至关重要,因为使用广谱抗生素会消除这些作用。研究还表明,补充菊粉可增强血液中的循环免疫功能。除了其已被充分描述的抗肿瘤作用外,菊粉在特定情况下也可能产生负面影响,如肠道疾病结肠炎和结直肠癌。例如,在葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠模型中,补充菊粉会增加结肠炎症的严重程度,以及导致体重减轻和出血。另一项在小鼠中使用DSS联合氧化偶氮甲烷(AOM)的研究表明,补充菊粉不仅会加重炎症,还会促进结直肠肿瘤的发展。最后,一项关于自发发展为结直肠癌且与任何炎症过程无关的小鼠的研究表明,补充菊粉会增加肿瘤的生长。总之,这些数据表明,补充菊粉可能是治疗癌症患者的一个令人满意的解决方案,但这不适用于患有肠道癌症或相关肠道疾病的患者。最后,为了克服与菊粉有害影响相关的障碍,一种解决方案可能是直接给予菊粉抗肿瘤作用的介导物。
目前,菊粉刺激免疫和抗肿瘤作用的分子和细胞机制仍有待阐明。据推测,这可能是由于微生物群在发酵菊粉时产生的代谢物和/或其他元素所致。目前最受关注的候选物质是三种短链脂肪酸(SCFAs),即乙酸盐、丙酸盐和丁酸盐,在摄入菊粉后这些物质的产生会增加。此外,产生短链脂肪酸的细菌种类的丰度与通过补充菊粉使肿瘤缩小的程度相关。然而,在菊粉发酵过程中还会产生其他化合物。分子氢(H₂)就是其中之一,并且由于其多种生物学效应而特别有前景。虽然人们对其生物学效应的描述开始增多,但对其了解仍然较少且不完全。氢气是肠道中含量最丰富的气体,在正常饮食下,健康人体中肠道微生物群每天产生的氢气量可达1升。通过在饮食中添加纤维可以增加结肠中氢气的产生,我们的团队已经证实,小鼠自由摄入菊粉会在餐后短暂刺激氢气的产生。
肠道微生物群产生的氢气增加可能是补充菊粉具有抗肿瘤作用的原因。除了文献中广泛描述的抗氧化和抗炎特性外,氢气在癌症治疗方面也显示出潜在的益处。氢气的抗肿瘤作用似乎源于其改善免疫系统的能力。例如,在非小细胞肺癌患者中,吸入氢气增加了血液中细胞毒性T细胞和γδ T细胞的数量,同时减少了循环中细胞毒性T细胞的耗竭。同样,氢气可恢复结直肠癌患者血液中耗竭的CD8⁺ T细胞。此外,少数研究表明肠道微生物群产生的氢气具有治疗作用。在一项关于心脏缺血再灌注(IR)损伤的临床前研究中,抗生素治疗抑制微生物群会导致梗死面积增加。这一现象被解释为是由于肠道微生物群内源性氢气产生的抑制。此外,其他研究表明,菊粉等低聚果糖对肝脏和大脑的缺血再灌注损伤具有保护作用。同样,这归因于肠道中低聚果糖发酵产生的氢气。鉴于这些发现,增强肠道微生物群内源性氢气的产生似乎在各种病理生理情况下都可能具有重要的保护作用。然而,据我们所知,菊粉的免疫刺激抗肿瘤作用与氢气之间可能存在的联系从未被探索过。
菊粉和氢气都通过激活和刺激免疫系统表现出抗肿瘤作用。由于摄入菊粉会增加氢气的产生,我们假设氢气可能是菊粉抗肿瘤作用的介导物。证实这一假设的理想方法是在给予菊粉后特异性地阻断微生物群产生氢气,并观察抗肿瘤作用的消失。不幸的是,在不抑制菊粉产生的其他代谢物的情况下,这种策略在实验上是不可行的,因为这会使观察结果无法得出结论。因此,我们选择通过比较补充菊粉和氢气疗法(H₂T)的免疫抗肿瘤特征来提供间接证据。通过这种方式,我们首先表征了小鼠摄入菊粉后诱导的氢气产生情况。基于这些结果,我们能够开发出一种氢气疗法,该疗法可重现补充菊粉的小鼠对氢气的暴露情况。最后,我们比较了菊粉和氢气疗法对循环免疫的影响,以及在小鼠黑色素瘤模型中的作用。
结果
灌胃给予菊粉可短暂刺激肠道微生物群产生氢气
为了确定摄入菊粉后氢气的产生模式,将两批各6只小鼠在时间点T = 0(上午9点)时分别强制喂食水或菊粉(70毫克溶于150微升)。然后将这6只小鼠一起置于我们实验室开发的临床前设备中,以监测它们呼出的氢气总量。每次测量持续15分钟,以便在给予水或菊粉灌胃后,能够充分准确地测定小鼠的氢气产生速率(HPR)(图1a)。
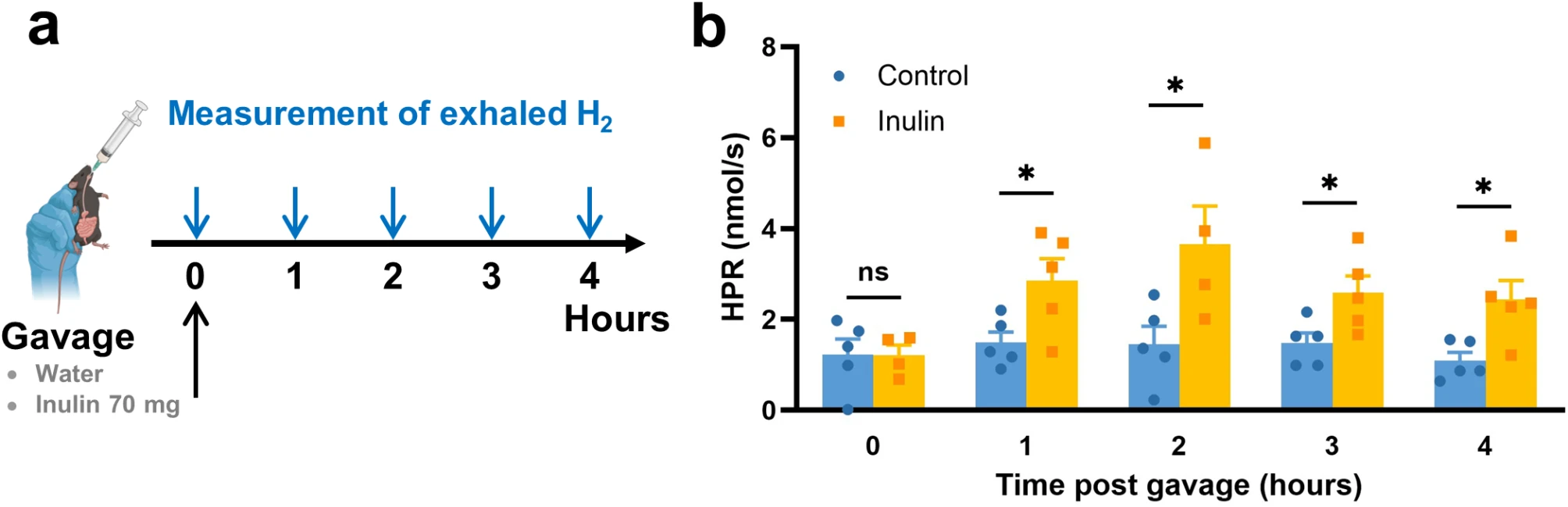
图1:摄入菊粉会诱导氢气产生达到峰值
(a) 实验安排。给C57BL/6小鼠强制喂食70毫克菊粉或水(每组n = 6只小鼠),并在T = 0、1、2、3和4小时测量呼出的氢气产生量。在5个不同的日子重复测量。(b) 根据(a),在灌胃后的不同时间点测量呼出的氢气产生量。4至5次独立的氢气产生速率测量的平均值±标准误,每次测量均在一组6只小鼠上进行。HPR:氢气产生速率。*p < 0.05;曼-惠特尼检验。

图2:菊粉灌胃和氢气疗法在血液中诱导出类似的免疫刺激作用
(a) 实验时间表。C57BL/6小鼠要么喂食标准饮食(对照组,n = 6),要么强制喂食70毫克菊粉(菊粉组,n = 6),要么接受2小时的氢气疗法(H₂T组,n = 6),每周5次。治疗15天后,通过流式细胞术分析它们的血液。(b) 在如(a)所述处理的小鼠的CD45⁺、CD3⁺细胞中,循环T淋巴细胞的频率。(c) 在如(a)所述处理的小鼠的CD45⁺CD3⁺细胞中,所有T淋巴细胞中循环的CD8⁺、CD4⁺和γδ TcR⁺T淋巴细胞的频率。(d) 如(a)所述处理的小鼠中产生IFN-γ的CD8⁺、CD4⁺和γδ TcR⁺ T淋巴细胞的频率。平均值±标准误。*p < 0.05,与对照组相比; p < 0.01,与对照组相比;ns:无显著性差异;曼-惠特尼检验。
在摄入菊粉1小时后,观察到氢气产生速率上升,几乎是同一时间对照组基础氢气产生速率的两倍。菊粉组的氢气产生速率进一步增加,在灌胃菊粉2小时后达到最大产生速率3.7±0.8纳摩尔/秒(图1b)。因此,灌胃给予菊粉会诱导氢气产生出现至少持续2小时的短暂峰值。尽管在3小时后氢气产生速率下降,但仍显著高于对照组的基础产生速率。实际上,在灌胃菊粉4小时后,菊粉组的氢气产生速率维持在对照组的两倍。基于灌胃菊粉后观察到的产生模式,我们决定让动物接受2小时的氢气疗法,这与70毫克菊粉灌胃诱导的氢气产生峰值相对应。
补充菊粉和氢气疗法在血液中诱导出类似的免疫刺激作用
为了比较菊粉和氢气疗法的免疫刺激作用,小鼠要么被强制喂食70毫克菊粉,要么暴露于3%的氢气中2小时,每周5次,持续2周。15天后,从这些小鼠身上采集血液样本,并使用流式细胞术分析它们的循环免疫功能(图2a)。菊粉增加了循环T淋巴细胞的水平(图2b)。此外,两种治疗方法都同样增加了循环CD8⁺和CD4⁺ T细胞的水平(图2c)。虽然补充菊粉和氢气疗法都略微增加了循环γδ T细胞的频率,但这在统计学上并不显著(图2c)。通过流式细胞术评估这些循环淋巴细胞分泌IFN-γ的能力。补充菊粉和氢气疗法都显著增加了产生IFN-γ的CD4⁺、CD8⁺和γδ T细胞的百分比(图2d)。此外,在该图所示的任何变量中,菊粉组和氢气疗法组之间均未观察到显著差异,这表明两种治疗方法具有共同的免疫学特征。值得注意的是,在流式细胞术分析中,未考虑或分析双阴性(DN)细胞(图S2)。
补充菊粉和氢气疗法倾向于诱导出类似的抗肿瘤作用
如前所述,菊粉和氢气疗法似乎在未处理的小鼠血液中发挥类似的免疫刺激作用。为了比较两种治疗方法的抗肿瘤潜力,小鼠接受为期2周的治疗,要么通过灌胃给予70毫克菊粉,要么每天暴露于3%的氢气中2小时,每周5次(氢气疗法)。15天后,所有小鼠都皮下注射了B16 OVA黑色素瘤细胞。在维持每日菊粉治疗或氢气疗法的同时,监测肿瘤生长情况15天(图3a)。
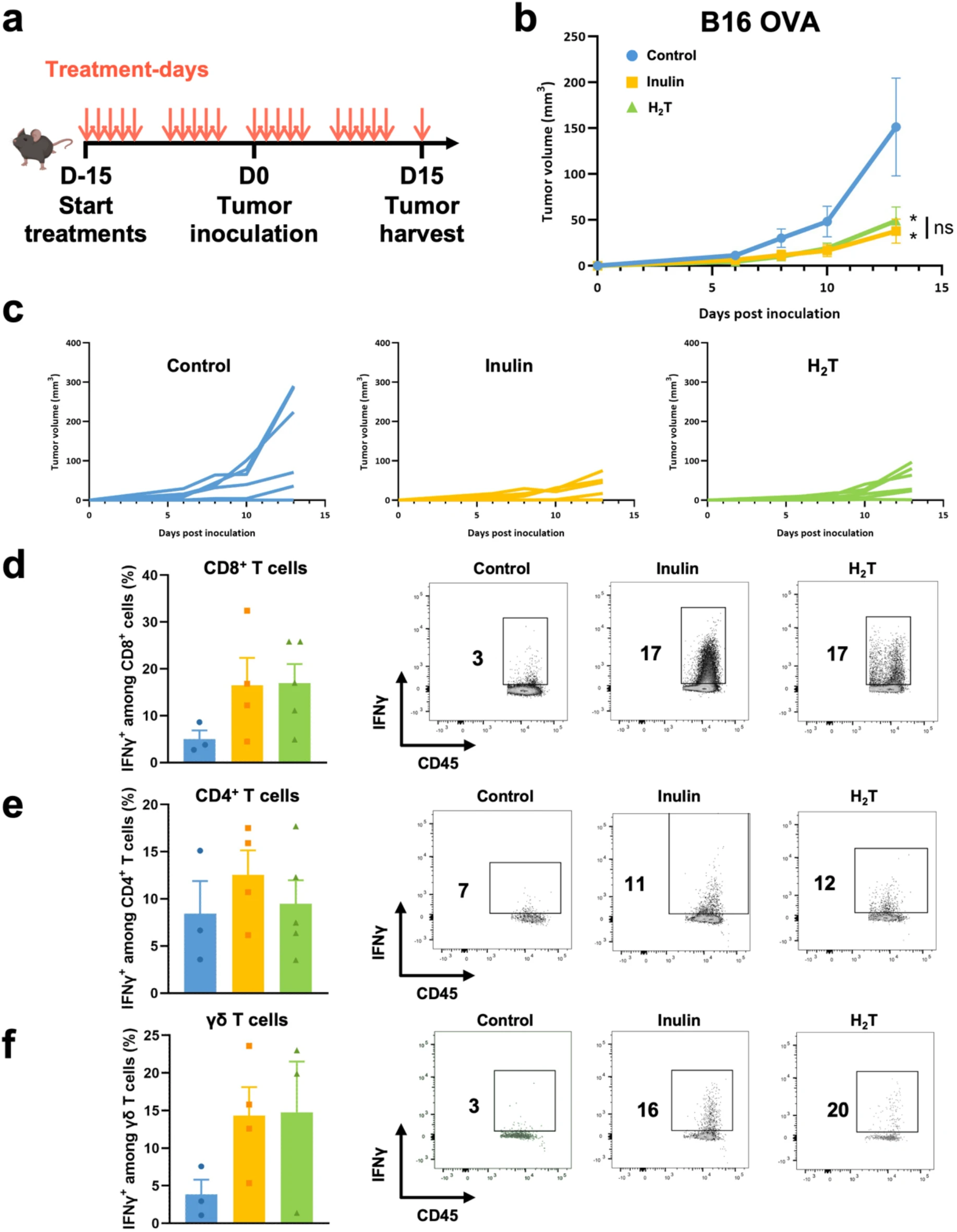
图3:菊粉灌胃和氢气疗法倾向于诱导出类似的抗肿瘤效果
(a) 实验时间表。C57BL/6小鼠要么喂食标准饮食(对照组,n = 6),要么强制喂食70毫克菊粉(菊粉组,n = 6),要么接受2小时的氢气疗法(H₂T组,n = 6),每周5次。在经过15天的治疗后,将2×10⁵个B16 OVA黑色素瘤细胞皮下注射到每只小鼠的右侧胁腹处。(b - c) 如(a)中所述处理的小鼠的肿瘤生长情况,以平均值±标准误表示(b)或个体生长情况表示(c)。(d - f) 如(a)中所述处理的小鼠的B16 OVA肿瘤浸润的产生IFN-γ的细胞的频率,圈门设为CD45⁺ CD3⁺(d)、CD8⁺(e)、CD4⁺或(f)γδ TcR⁺细胞。平均值±标准误(n = 3 - 6)。*p < 0.05,与对照组相比;双向方差分析和曼-惠特尼检验。
氢气疗法(H₂T)和补充菊粉都显著抑制了肿瘤的生长(图3b和c)。在肿瘤接种后的第13天,对照组的平均肿瘤体积为151.4±48.8立方毫米,而补充菊粉组的平均肿瘤体积为39.3±11.9立方毫米,氢气疗法组的平均肿瘤体积为56.4±13.2立方毫米(图3b)。补充菊粉组和氢气疗法组之间的肿瘤生长情况没有显著差异。
为了确定免疫在这些抗肿瘤效果中的作用,通过流式细胞术分析了CD8⁺、CD4⁺和γδ T淋巴细胞的肿瘤浸润情况。由于两个治疗组中一些肿瘤体积较小,无法对所有样本进行免疫浸润分析,这使得统计分析无法进行。尽管缺乏统计比较,但我们的结果表明,补充菊粉和氢气疗法都倾向于增加肿瘤中产生IFN-γ的CD8⁺、CD4⁺和γδ T细胞的比例(图3d、e和f)。这些结果表明,摄入菊粉和接触氢气通过刺激免疫监视诱导出类似的抗肿瘤效果。
讨论
摄入菊粉因其抗癌特性而广为人知,这与肠道微生物群(GM)的改变以及免疫刺激有关。然而,摄入菊粉导致免疫系统受到刺激的机制尚未阐明。在此,我们提出肠道微生物群在发酵菊粉过程中产生的氢气是这种效应的介导物,或者是介导物之一。为了支持这一假设,我们根据给小鼠灌胃菊粉后氢气的产生情况,制定了一种吸入式氢气疗法(H₂T)方案。补充菊粉和氢气疗法都同样增加了血液中CD4⁺、CD8⁺和γδ T淋巴细胞的循环和活化。此外,两种治疗方法都同样抑制了黑色素瘤肿瘤的生长,并促进了肿瘤浸润淋巴细胞的活化。
我们在本研究中开发的吸入式氢气疗法方案是基于观察到的小鼠灌胃菊粉后氢气的产生情况而设计的。氢气在组织中具有高扩散性,这使我们认为微生物群产生的氢气可以轻松穿过肠道屏障,一旦进入血液,就会分布到全身各处。此外,口服富含氢气的水和吸入氢气都会在动脉血中导致类似的氢气浓度。因此,可以合理地认为本研究中使用的两种治疗方法使小鼠接触到了类似浓度的氢气。
我们团队之前的研究表明,菊粉在小鼠中具有抗肿瘤作用,不仅对黑色素瘤有效,对纤维肉瘤和结直肠癌也有效。同样,氢气已被证明在细胞培养和异种移植小鼠模型中对治疗结直肠癌有效。吸入氢气还被证明可以通过减轻CD8⁺ T淋巴细胞的耗竭,增加IV期结直肠癌患者的无进展生存期(PFS)。此外,在纤维肉瘤小鼠模型中,一种创新的氢气治疗方法抑制了肿瘤的生长,该方法是将涂有碳酸钙纳米颗粒的镁棒植入肿瘤内,使其在肿瘤微环境中直接产生氢气。观察到的抗肿瘤效果伴随着肿瘤中CD4⁺和CD8⁺ T细胞的浸润。这些研究表明,氢气在纤维肉瘤和结直肠癌中诱导出的效果与本研究中在黑色素瘤中观察到的效果类似。因此,氢气可能是菊粉具有抗癌特性的原因。
氢气对癌症治疗的益处已得到充分证实。然而,其作用机制仍不清楚。一些研究表明,氢气通过特定的细胞途径直接作用于癌细胞。其他研究则表明,其抗癌效果是通过免疫调节介导的。在多个小鼠癌症模型中,氢气治疗已被证明可以增加肿瘤中CD4⁺和CD8⁺ T淋巴细胞的浸润,并增强TH1极化的T淋巴细胞。临床研究表明,无论是单独使用氢气还是与其他治疗方法联合使用,氢气都有助于恢复CD8⁺ T细胞的耗竭。此外,吸入氢气与免疫疗法的联合使用在肺癌患者中显示出协同效应。所有这些研究都支持免疫系统参与了氢气的抗肿瘤作用。这与我们的研究结果一致,即补充菊粉和氢气疗法在血液和肿瘤中诱导出了相当的免疫监视特征。因此,菊粉发酵产生的氢气可能会激活免疫系统并抑制肿瘤生长。
给予氢气所诱导的免疫系统刺激似乎与其被广泛描述的抗炎作用相矛盾。实际上,对各种患有急性或慢性炎症的动物模型的研究表明,氢气疗法可以降低组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-17(IL-17)的水平。此外,临床和临床前研究表明,氢气疗法还可以降低大鼠肺缺血再灌注后血液中的C反应蛋白(CRP)水平,以及患有类风湿性关节炎或风湿性多肌痛等不同炎症性疾病患者血液中的CRP水平。更有趣的是,在非感染性情况下,如怀孕或同种异体移植中,氢气疗法被证明可以减少产生IFN-γ的T淋巴细胞数量。这与我们在健康小鼠和癌症情况下的研究结果相矛盾。一般来说,似乎氢气在炎症过度的情况下发挥抗炎作用,而在生理或癌症环境中,它促进免疫系统向TH1极化反应的激活。
本研究旨在强调菊粉和氢气的抗肿瘤和免疫刺激作用之间的联系。然而,这种关系背后的机制仍然未知。我们团队之前的研究表明,菊粉治疗的效果取决于γδT细胞受体(γδTcR)的激活。γδT细胞受体可以识别多种分子,并被主要组织相容性复合体(MHC)分子(I类和II类)、MHC样分子、由嗜乳脂蛋白呈递的磷酸抗原以及未结合的抗原激活。值得注意的是,抗原识别并非γδT细胞受体激活的必要条件,仅MHC或嗜乳脂蛋白分子的构象变化可能就足够了。我们提出,菊粉发酵产生的氢气可能会诱导这种构象变化,从而导致γδ T细胞的激活。需要进一步的体外实验来阐明其中涉及的机制,并确定氢气在这一过程中的作用。此外,其他免疫细胞群体可能也对观察到的菊粉和氢气的效果有贡献。在本研究中,流式细胞术分析未考虑自然杀伤T细胞(NKT细胞)、调节性T细胞(Tregs)和双阴性T细胞(DN T细胞),这些细胞加起来在小鼠循环免疫细胞中占比高达5%。此外,干扰素-γ(Ifng)基因的表观遗传调控可能也起作用。该基因可以通过H3K27甲基化在表观遗传上被沉默,而氢气已被证明可以通过诱导H3K27去甲基化酶来降低这种甲基化水平。因此,分析循环和浸润的CD4⁺、CD8⁺和γδ T细胞中Ifng基因的H3K27甲基化状态,可以深入了解摄入菊粉产生的氢气如何刺激IFN-γ的产生。这两个假设并非相互排斥,可能在介导菊粉的抗肿瘤作用中协同发挥作用。然而,这后两个假设尚未经过实验验证。对它们进行研究对于阐明菊粉抗肿瘤作用的潜在机制至关重要。
如前所述,菊粉的细菌发酵会产生各种代谢物。本研究重点关注氢气的作用,不过其他代谢物也可能与氢气相互作用,以增强抗肿瘤免疫力。短链脂肪酸(SCFAs)是菊粉发酵的知名副产物,已被证明与肿瘤体积减小有关。此外,短链脂肪酸支持T细胞向TH1极化,正如我们在本研究中所观察到的。在短链脂肪酸中,丁酸因其抗肿瘤特性而受到认可。值得注意的是,已证明细菌产生氢气可以在相同环境中刺激丁酸的产生,这表明菊粉可能通过提高氢气水平来增强丁酸的分泌。反过来,丁酸可以介导免疫刺激并有助于抑制肿瘤生长。然而,短链脂肪酸在癌症中的作用仍然不确定。虽然临床前研究表明短链脂肪酸可以通过激活CD8⁺T细胞抑制肿瘤进展,但它们对癌症治疗的影响仍然存在争议。一些研究报告称,血液中丁酸和丙酸水平升高与对抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)免疫疗法的耐药性以及循环中调节性T细胞比例增加有关。此外,在体内给予丁酸已被证明会抵消放疗和万古霉素对B16黑色素瘤小鼠的抗肿瘤作用。总体而言,现有文献表明短链脂肪酸在菊粉的抗肿瘤作用中可能发挥潜在作用。然而,相互矛盾的研究结果凸显了它们在癌症背景下影响的复杂性。
尽管本文呈现的结果令人信服,但我们也意识到本研究存在局限性。要完全证明氢气是菊粉抗肿瘤作用的介导物,就需要阻止微生物群产生氢气,或者专门且完全地捕获由菊粉发酵产生的氢气。我们已经证明,当使用广谱抗生素耗尽微生物群时,菊粉的抗肿瘤作用会完全消失。然而,除了氢气之外,肠道微生物群发酵菊粉还会产生许多其他代谢物和副产物。因此,即使特异性抑制或灭活负责细菌产生氢气的脱氢酶,也会对菊粉的其他分解代谢物产生影响,并且会使结果无法确定。除了无法专门捕获由肠道发酵菊粉产生的氢气之外,我们的研究中还出现了一个方法学上的困难,这与治疗的抗肿瘤功效直接相关。在接受菊粉或氢气疗法的组中,小鼠产生的肿瘤非常小,即大约39.3和56.4立方毫米。此外,对照组中有两只小鼠因肿瘤模型(在尸检时观察到严重的肠道转移)而死亡,它们的肿瘤浸润免疫情况无法进行分析。结果,收集到的生物材料量很少,导致用于流式细胞术分析的标记的浸润淋巴细胞数量有限。由于细胞数量过少无法进行分析,相应的样本不得不从我们的研究中剔除。因此,每组的样本量从n = 6限制为n = 3,这就解释了在分析浸润免疫情况时各组之间没有显著差异的原因。此外,在治疗组中,观察到了高度的个体差异,有些动物对治疗完全没有反应。这种个体差异显然对统计比较产生了影响。总之,最终的每组样本量和个体间差异解释了在分析肿瘤浸润情况时实验组之间无法进行统计比较的原因。基于本研究中所展示的个体间差异,现在可以确定检测统计差异所需的样本量,进一步的研究可以针对这个问题展开。
人们普遍认为,菊粉和不可消化的膳食纤维可以调节微生物群,刺激免疫系统,与免疫疗法协同发挥作用,并促进肠道微生物群产生氢气。本研究结果表明,肠道微生物群发酵菊粉产生的氢气可能会进入血液并刺激T淋巴细胞。由于氢气具有高溶解性,它也可能扩散到周围组织中,比如皮肤。包括γδ T细胞在内的各种免疫细胞存在于皮肤中,并且在免疫监视中起着关键作用。因此,在补充菊粉或进行氢气疗法两周后观察到的免疫监视增强,可能源自皮肤或任何其他含有常驻γδ T细胞的组织。
关于这些治疗方法的临床适用性,补充菊粉已被证明没有急性或慢性毒性。同样,氢气也未被观察到具有细胞毒性或遗传毒性。然而,补充菊粉型纤维可能并不适合患有某些疾病的患者,比如结直肠癌(CRC)或结肠炎。研究表明,在两种类似的小鼠模型中,富含纤维的饮食——尤其是富含菊粉的饮食——可以促进结肠肿瘤的发生和生长。在第一个模型中,Apcmin/+转基因小鼠会自发产生结肠肿瘤;而在第二个模型中,给Apcmin/+转基因小鼠注射氧化偶氮甲烷以诱导结直肠癌。此外,研究发现,在葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠模型中,补充菊粉会加剧结肠炎症。相比之下,氢气在这些病理情况下的作用似乎是有益的。吸入氢气和补充富含氢气的水都已被证明可以抑制小鼠结直肠癌异种移植模型中的肿瘤生长。此外,人们发现氢气可以抑制DSS诱导的小鼠结肠炎症。目前只有极少数的临床研究评估了氢气治疗对人类癌症进展的影响。这些研究报告称,无论是单独使用氢气还是将其与免疫疗法或化学疗法结合使用,氢气疗法都可以延长结直肠癌患者和非小细胞肺癌患者的无进展生存期。此外,一项最终的临床试验表明,氢气可以使57.5%的不同类型晚期癌症(III期和IV期)患者的癌症进展得到控制。鉴于这些发现,对于那些无法耐受菊粉的患者来说,一种潜在的替代方法可能是直接给予负责菊粉抗肿瘤作用的介导物,这提供了一种很有前景的治疗策略。
作为我们提出的介导物,氢气可以通过多种方式给予,比如吸入或摄入富含氢气的水。对于皮肤癌的治疗,开发一种富含氢气的药膏可能是一种直接增强皮肤肿瘤内免疫反应的解决方案。这些方法将为每位患者及其需求提供个性化的治疗方案。它们还可以预防传统免疫疗法、化学疗法和放射疗法所引起的副作用。
方法
实验动物和菊粉处理
雌性C57BL/6小鼠(5至6周龄)由Janvier Labs公司(法国勒热内-圣伊勒)提供,并饲养在法国格勒诺布尔的“动物高科技平台(PHTA)”UGA核心设施中(欧盟认证编号EU0197,许可证编号#C38-51610006),饲养环境为无特定病原体条件,温度可控,光照/黑暗周期为12小时/12小时,小鼠可自由获取水和标准食物(Altromin LASQCdiet® Rod16)。动物饲养和操作程序均按照兽医服务部门和法国研究部的建议进行,符合欧洲指令2010/63/EU以及欧洲实验动物科学协会联合会发布的健康监测建议。涉及动物的实验方案均经过当地伦理委员会“Comité d’Ethique pour l’Expérimentation Animale #12, ComEth-Grenoble”的审查,并得到了法国研究部的批准(APAFIS#39565-2022112413525573.v2)。菊粉组的小鼠每周5次被强制喂食70毫克溶于150微升水(浓度为450克/升)的菊粉(Inulin Orafti® GR,比利时Beneo公司)。为确保强制喂食不会引入实验偏差,其他组的小鼠在相同的时间点被强制喂食150微升水。在实验结束时,或者当小鼠的肿瘤大小达到伦理规定的极限而在后续观察中被排除时,所有动物均通过颈椎脱臼法进行安乐死。最后,作者确认本研究是按照ARRIVE指南进行报告的。
呼出氢气的评估
将小鼠置于先前描述过的临床前设备中,该设备可以在一个密闭的小室中监测氢气的产生情况,小室内的环境参数(氧气、二氧化碳、湿度和温度)会持续受到控制。小室内的空气通过ATO SKY 100(测量范围0至100 ppm,精度±0.01)持续泵送,以分析其中的氢气含量,然后再将空气重新送回小室(分流流速 = 375毫升/分钟)。氢气产生速率(HPR)的测定方法如前所述,并以每秒纳摩尔氢气(nmol/s)为单位表示。测量时每次使用6只小鼠为一组,测量持续15分钟,并在灌胃菊粉或水后的T = 0(上午9点)、1小时、2小时、3小时和4小时重复进行测量。在每次测量期间,小鼠无法获取食物和水。两次测量之间,小鼠被放回它们通常的饲养环境中,可以自由获取食物和水。
氢气疗法(H₂T)
氢气通过吸入的方式给予,使用的是实验室自行开发的一种原创设备(图S1)。该设备可以产生由3%氢气、76%氮气和21%氧气组成的混合气体。一个装有氮气/氢气混合气体(96.4%/3.6%)的钢瓶通过聚氨酯管连接到第一个流量计上。氧气由一台Devilbliss®制氧机产生,并通过聚氨酯管连接到第二个流量计上。通过将两个流量计下游的软管连接起来,将氧气流与氮气/氢气混合气流混合。调节两个流量计,使最终的混合气体以1.27升/分钟的流速直接输送到一个气密的NexGen Mouse 500(美国阿伦敦市)笼中,该笼子适用于通风架,这样可以让动物在接受氢气疗法期间保持在它们通常的环境中。气体出口设置在笼子的盖子上,以保持笼子内的气压为大气压。氢气疗法每天持续2小时,每周进行5次。在给予氢气期间,使用Quintron Breath Tracker定期检测笼子内的氢气浓度,检测时从笼子中抽取空气样本。

细胞系
表达卵清蛋白的B16黑色素瘤细胞(B16-OVA)由法国国家卫生与医学研究院(Inserm)U1209的C. Fournier慷慨提供。B16-OVA细胞在完全培养基中培养,该培养基由10%胎牛血清(FBS)(Gibco公司)、杜氏改良伊格尔培养基(DMEM)(Gibco公司)组成,并添加了1%非必需氨基酸、1毫摩尔/升丙酮酸钠、50单位/毫升青霉素和50微克/毫升链霉素(均来自Gibco公司)。为了进行质粒筛选,在培养物中添加了遗传霉素选择性抗生素(500微克/毫升,Sigma公司)。该细胞系经过检测,不含支原体。
肿瘤植入
将2×10⁵个B16-OVA细胞悬浮在100微升磷酸盐缓冲液(PBS)中,皮下注射到小鼠的右侧胁腹处。一旦肿瘤可以触摸到,每天使用卡尺测量肿瘤大小,肿瘤体积通过以下公式计算:Vtumor = 0.5 ×(宽度×长度2)。最大的符合伦理的肿瘤大小计算为:宽度×长度 = 150平方毫米。
肿瘤消化
将肿瘤收集在完全的罗斯威尔公园纪念研究所(RPMI)培养基(Gibco公司)中,用手术刀切碎,然后用2.5毫克/毫升的分散酶(Liberase™,罗氏公司)进行消化。最后,将肿瘤轻轻通过70微米的细胞筛网压碎,洗涤后重悬于含有10%胎牛血清的完全RPMI培养基中。
血液样本制备
在小鼠安乐死前,在异氟烷麻醉下通过眶后采血法采集血液样本。样本储存在K2E管(BD医疗公司)中。离心后,将血液沉淀重悬于1毫升1倍浓度的红细胞裂解缓冲液(Sigma公司)中,然后用含有10%胎牛血清的完全RPMI培养基洗涤。
流式细胞术
为了对细胞因子进行细胞内标记,将细胞悬液在37°C下用50纳克/毫升佛波酯12-肉豆蔻酸13-乙酸酯(PMA)(Sigma公司)、1微克/毫升离子霉素(Sigma公司)和高尔基体阻断剂(Golgi Stop™,BD生物科学公司)刺激4小时。对于细胞外标记,将细胞与每种抗体200纳克一起孵育,使用可固定的黄色死活细胞染色试剂盒(Live/Dead™ Fixable Yellow Dead Cell Stain kit,适用于405纳米激发,赛默飞世尔科技公司)对死细胞进行标记,孵育时间为40分钟。使用的抗体用于靶向细胞外蛋白CD45(30-F11)、CD3(17A2或145-2C11)、CD4(GK1.5)、γδ-T细胞受体(γδ-TcR)(eBioGL3(GL-3,GL3)(Biolegend公司和eBiosciences公司)(表S1)。为了进行细胞内标记,首先使用FoxP3染色缓冲液试剂盒(eBioscience公司)对细胞进行通透处理。使用的抗体用于靶向细胞内细胞因子干扰素-γ(IFN-γ)(XMG1.2)(Biolegend公司)(表S1)。细胞内标记完成后,使用1倍浓度的流式细胞术裂解液(FACS Lysing Solution 1X,BD生物科学公司)固定细胞并储存。所有数据均使用BD生物科学公司的FACS Lyric流式细胞仪收集,并使用FlowJo软件进行分析。设门策略详见图S2。简而言之,T细胞被选择为CD45⁺ CD3⁺细胞。γδ T细胞被选择为CD45⁺ CD3⁺ γδTcR⁺细胞。CD4⁺ T细胞被选择为CD45⁺ CD3⁺ γδTcR⁻ CD4⁺细胞。CD8⁺ T细胞被选择为CD45⁺ CD3⁺ γδTcR⁻ CD4⁻细胞。这种设门策略忽略了CD45⁺ CD3⁺ γδTcR⁻ CD4⁻ CD8⁻细胞,在未处理的C57BL/6小鼠中,双阴性(DN)细胞在血液T淋巴细胞中所占比例不到1% 。其他免疫细胞,如自然杀伤T细胞(NKT细胞)和调节性T细胞(Tregs)在分析中也未被考虑。
https://blog.sciencenet.cn/blog-41174-1480781.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:需氧微生物早于大氧化事件!