博文
编辑修改错误mRNA疗法取得突破  精选
精选
|
莫妮卡·科恩拉德承认,作为一个没有太多与孩子相处经验的新手家长,她对女儿切尔西出现的问题反应迟钝。然而,当切尔西1岁时,她的发展显然停滞甚至开始倒退。她只学会了说一个词,很快就不再说话了。只有在有人扶着的情况下切尔西才能走路。她失去了抓握的能力,反而开始“用手做出重复的动作”,比如拍手,科恩拉德说,当时她们一家住在弗吉尼亚州。
“我迫切希望得到一个诊断,”科恩拉德说。但当她终于得到诊断时,切尔西2岁了,“这是一个双重打击。”不仅切尔西患有雷特综合征,这是一种无法治愈的神经系统疾病,而且科学家们对这种病症所知甚少。他们明白它主要影响女孩,可能是由于基因突变引起的,但他们还没有确定遗传元凶。
那是在1998年。今天,科恩拉德和她的丈夫仍在照顾着现年28岁、无法说话、行走或使用双手的切尔西。她需要服用药物来控制癫痫发作、减轻焦虑并帮助睡眠。现在已知的疾病背后的基因缺陷通常是MECP2基因的突变,该基因控制包括大脑在内的许多器官中的基因活动。像其他雷特综合征儿童的父母一样,科恩拉德希望科学家能加快开发治疗方法。但作为雷特综合征研究信托基金会的创始人兼CEO,她有能力做些什么。
除了资助一系列策略来纠正或替换有缺陷的DNA外,她的组织还在支持一种非传统方法。该信托基金已经投入了850万美元——超过其为研究分配资金的10%——用于编辑由突变MECP2编码的RNA链的工作。通过这样做,他们正在增强治疗疾病的一个新兴但有前景的方法:编辑蛋白质的RNA蓝图。“我们的目标是为这个领域注入活力,”科恩拉德说。
她并不是唯一对RNA编辑潜力充满热情的人。这种替代CRISPR和其他DNA修饰疗法的方法“正成为焦点”,伊利诺伊大学厄巴纳-香槟分校的生物工程师托马斯·加杰说。与基于DNA的治疗相比,编辑过的RNA可能更容易被细胞接受,并且这种方法可能也更安全。
到目前为止,还没有针对雷特综合征的RNA编辑疗法出现。但在该领域的一个潜在里程碑中,Wave Life Sciences上周在一份新闻稿中宣布,其RNA编辑方法提高了一种生命威胁性遗传疾病患者的正常蛋白产量,这种疾病会损害他们的肝脏和肺部。
除了Wave外,还有三家生物技术公司——Ascidian Therapeutics、Rznomics和HuidaGene——已经开始在患有眼病或癌症的患者中测试治疗方法。更多的公司正在竞相开发自己的疗法,通常与大型制药公司合作,而学术实验室则深入探究编辑机制。
RNA编辑“不是CRISPR的替代品。它是对抗疾病的另一种武器,”哈佛大学医学院的生物工程师乔纳森·古滕堡说,他的实验室已经开发出修改RNA的新方法。研究人员仍在多个方面努力完善技术:提高其效率和精确性,改善传递所需分子的方式,以及减少副作用。选择合适的疾病进行靶向也是至关重要的,杜克大学医学院的生物工程师阿拉文德·阿索坎说。“一切都归结为应用的谨慎选择。”
对许多人来说,依赖RNA的新型COVID-19疫苗唤起了他们在高中生物课上学到的关于双链DNA仅存储制造蛋白质指令的模糊记忆。为了实际组装一个蛋白质,细胞会将基因转录成信使RNA(mRNA);它将蛋白质的蓝图传达给称为核糖体的小分子工厂,这些工厂将氨基酸连接起来制成蛋白质。COVID-19疫苗中的合成mRNA利用这一生物学原理,诱骗细胞制造病毒蛋白以激发免疫反应。
至少已有十几种针对遗传性疾病的获批疗法,包括一种依赖CRISPR改变个人DNA的治疗方法。这些治疗针对镰状细胞性贫血、一种类型的肌营养不良症以及其他几种疾病。针对许多其他状况的DNA修饰疗法正在开发中——仅基于CRISPR的策略就有40多项临床试验正在进行。然而,芝加哥大学海洋生物实验室的分子生物学家约书亚·罗森塔尔说:“在RNA而不是DNA中进行基因改变有一些巨大的优势”,他共同创立了一家RNA编辑公司Korro Bio。
首先,编辑mRNA不涉及错误改变一个人基因的风险,这种改变可能是永久性的。相比之下,因为修改后的RNA在体内很快分解,编辑的结果只是暂时的,这使得结束治疗和减少副作用变得更容易。这使得RNA编辑更像是其他药物。“大多数治疗都不是永久性的,”罗森塔尔说。“你不会永久地服用一片阿司匹林。”
这无疑是RNA编辑领域的一个里程碑。
普拉尚特·马利
加利福尼亚大学圣地亚哥分校
此外,CRISPR依赖于细菌酶,如Cas9,来切割DNA,它们可能会引发免疫系统的反应。“你正在将一个外来蛋白放入人体细胞中,”加利福尼亚大学(UC)圣地亚哥分校的生物工程师普拉尚特·马利说。一些研究人员正在开发的RNA编辑方法(见下图)避免了这种风险。
RNA编辑自然发生在细胞中。例如,mRNA最初是更长的草稿,称为前体mRNA,在细胞修剪不编码蛋白质部分的序列之前。科学家们首次在1990年代中期提出利用这些RNA修饰机制来对抗疾病,尽管他们缺乏这样做的工具。现在,经过20年的遗传技术和基于其他RNA的治疗进展,如小干扰RNA(siRNA)和反义RNA,这些可以降低有害蛋白质的产生,RNA编辑可能即将起飞。
许多目前正在开发的治疗方法招募了一种细胞机制,以微调RNA,使其不会引起我们的免疫系统反应。虽然我们的mRNA开始时是单链的,“所有的RNA都会折叠起来,它们无法避免,”犹他大学的生化学家布伦达·巴斯说。当这些分子重叠时,它们可能会触发针对病毒的细胞警报——这些病毒也经常携带双链RNA——并释放炎症。
正如巴斯和一位同事在1980年代末发现的,细胞通常会用另一个分子称为肌苷代替其mRNA分子中的一个构建块腺苷。这种交换将细胞RNA标记为无害。
因为这些A到I的转换,科学家称之为,经常发生在mRNA分子的不编码蛋白质部分,因此它们通常不会影响最终的氨基酸序列。然而,“没有它们,每个人都会患有自身免疫性疾病,”巴斯说。
被称为ADARs(作用于RNA的腺苷脱氨酶)的酶执行A到I的转换。激活这些酶的RNA编辑治疗是有希望的,因为许多遗传疾病源于基因突变,在mRNA分子的特定位置将另一个构建块鸟苷替换为腺苷。通过将腺苷替换为肌苷,ADARs本质上可以纠正错误,因为细胞的蛋白质制造机制将mRNA中的肌苷读作鸟苷。为了招募ADAR,研究人员设计了一个导向RNA,这是一个短链,其序列与他们想要靶向的mRNA部分的序列互补。这个定制的合成序列,被称为寡核苷酸,识别并结合到携带要被替换腺苷的mRNA部分,形成一个双链结构,吸引矫正酶。
三种编辑方式
RNA编辑修复由缺陷基因产生的有缺陷的信使RNA(mRNA),恢复功能性蛋白的合成。该策略比直接针对DNA的治疗更安全、更通用。A. Mastin/Science
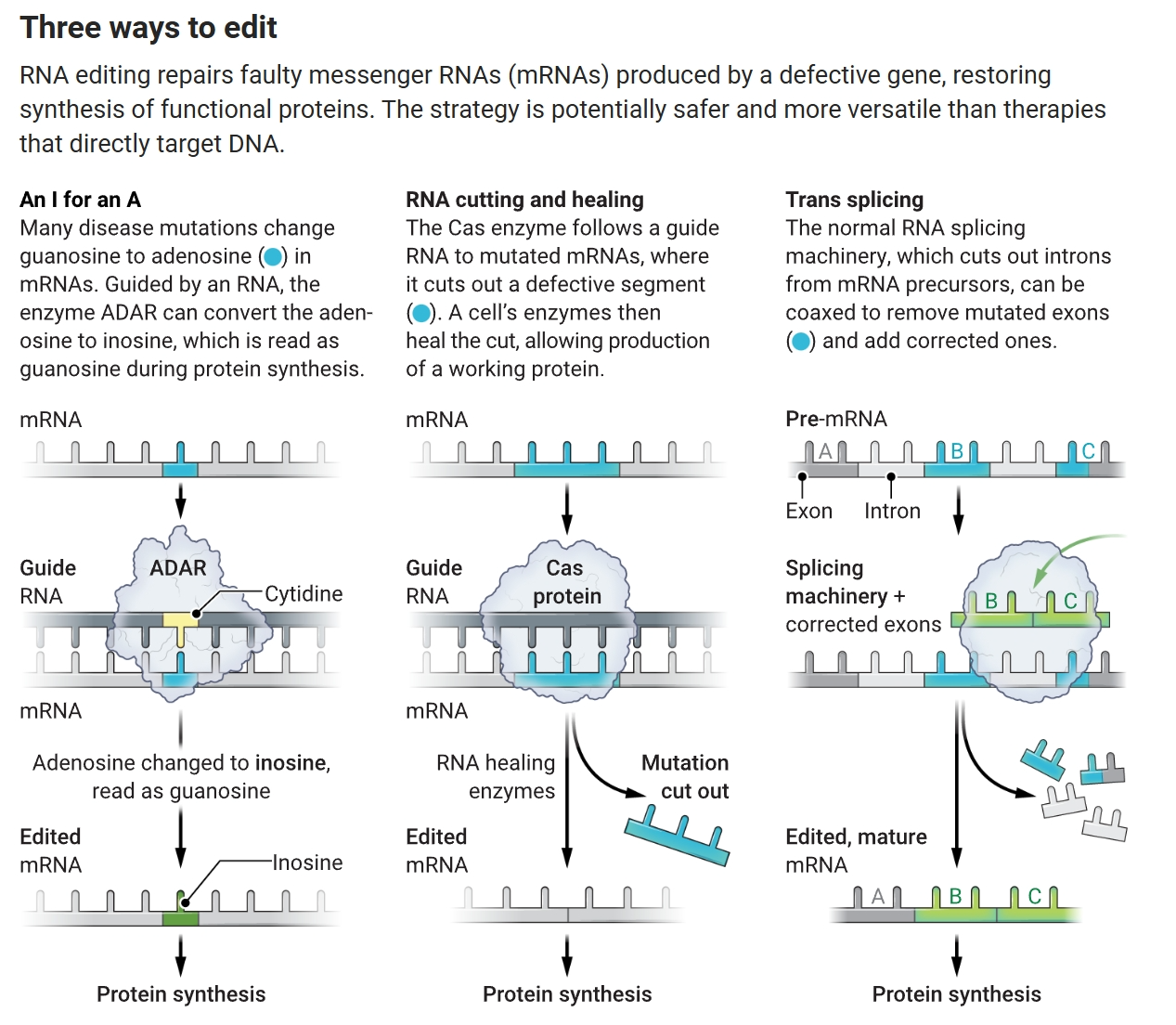
除了修复突变,研究人员还希望利用ADARs修改蛋白质的功能。通过替换mRNA中的腺苷,可以使产生的蛋白质开启或关闭,改变其与其他蛋白质的相互作用方式,改变其在细胞中的位置,以及加快或减慢其分解速度。生物技术公司ProQR Therapeutics计划采用这种方法治疗胆汁淤积性疾病,这是一组相关疾病,其中由肝脏制造的称为胆酸的分子在器官内积累,造成损害。
ProQR专注于允许胆酸进入肝细胞(肝脏中最多的细胞)的受体。研究人员设计了一种引导RNA,针对受体mRNA中一个包含关键腺苷的部分。然后,一个ADAR将其改为肌苷,这会削弱受体,“可以缓解肝细胞因胆酸过载或泛滥而受到的压力”,ProQR首席科学官Gerard Platenburg说。Platenburg表示,该公司计划在今年晚些时候或2025年初开始对其寡核苷酸进行临床试验。
上周带来好消息的临床试验也涉及一种A-to-I编辑疗法。公司Wave正在针对AAT缺乏症进行治疗,这种病症的特征是α-1抗胰蛋白酶稀少或缺陷,这是一种中和免疫细胞释放的有害酶的蛋白质。这种分子的缺乏使肺部容易受到破坏性免疫酶的伤害。AAT缺乏症可以在人们20多岁时就损害肺部,并且有缺陷的AAT会滞留在肝细胞中,导致肝硬化和其他类型的肝损伤。如果不治疗症状,这种疾病可能导致早死。新疗法是一种注射用的寡核苷酸,针对在近95%严重AAT缺乏症患者中发生突变的mRNA片段。
Wave从去年开始在健康人群中测试其治疗的安全性,然后转向那些继承了两份ATT基因坏拷贝且不产生任何正常版本蛋白的个体。该公司报告称,在接受其一剂治疗后的两名患者中,血液中超过60%的AAT蛋白是正常的版本,治疗后第57天仍在他们的血液中存在。“我们观察到的单剂量mRNA编辑水平超出了我们的预期,我们预计[正常蛋白]水平将继续随着重复给药而增加,”公司总裁兼首席执行官Paul Bolno在一份声明中说。
该领域的科学家们对这一原理验证结果表示欢迎,尽管还需要更多时间——以及更多数据——来全面评估这种疗法。“这无疑是RNA编辑领域的一个里程碑——确认了ADAR介导的RNA编辑可用于治疗应用,”Mali说。
即使在Wave的消息之前,Rosenthal对于哪种RNA编辑治疗将首先获得食品和药物管理局的批准也持类似乐观态度。“如果我必须预测,我会说是A-to-I。”
但研究人员仍在研究如何提高ADAR效率并减少可能导致副作用的错误变化。例如,他们发现化学调整引导RNA可以提高编辑效率。Wave的寡核苷酸携带了修饰版的碱基尿嘧啶,其他修改也可能带来好处。Mali及其同事在2022年的一项研究中显示,末端连接形成环状的引导RNA可以提高在培养的人细胞和模拟人类代谢疾病的突变小鼠中的编辑效率。这些环状RNA在细胞中也更持久,可能是因为它们不太容易受到自然RNA降解酶的攻击。
研究人员还在尝试减少非目标编辑,即ADAR错过预定的腺苷而改变附近的腺苷。由加州大学戴维斯分校的化学家Peter Beal领导的团队展示了,在引导RNA的特定位置放置某些核苷酸可以为“无辜”的腺苷提供保护。他们已经发现,被称为锁定核酸的持久分子是腺苷的有效保镖。“我们可以通过对锁定核酸进行战略性定位来控制反应的选择性,”Beal说。
理论上,ADAR可以纠正大约20,000种导致遗传疾病的鸟嘌呤到腺苷的突变。Coenraads说,这个数字包括大约三分之一雷特综合征病例的原因。但这种方法的一个限制是,研究人员必须为每个突变设计和测试一个引导RNA。“你怎么能治疗所有这些呢?”哈佛大学医学院的生物工程师Omar Abudayyeh问道。此外,ADAR对于超过100,000个其他导致疾病的遗传缺陷帮助不大,这些缺陷可能涉及单个核苷酸变化,而这些酶无法修复,或者更大的缺陷,如整个DNA片段的增加或丢失。
为了解决这个更广泛的突变问题,Abudayyeh、他的合作者Gootenberg以及其他科学家正在尝试招募一种不同的RNA改变机制,称为剪接,这是一种自然发生的过程。在这个过程中,细胞编辑前mRNA分子,去除不需要的部分,称为内含子,并将剩余序列缝合在一起,称为外显子。大多数情况下,细胞将同一前RNA分子中的外显子连接起来以制造mRNA。然而,偶尔剪接机制会引入另一个蛋白质的前mRNA分子的一部分,这种操作称为转录剪接,产生复合mRNA。
研究人员希望通过触发转录剪接,可以用校正后的序列替换较大部分有缺陷的mRNA。这样,一次RNA编辑就可以治疗由多种突变引起的疾病。Abudayyeh说:“有可能用一种药物就能涵盖所有带有该基因突变的人。”Ascidian是一家以广泛存在于海洋生物体中的转录剪接命名的公司,它在今年夏天启动了临床试验,以测试这种机制是否可以减缓Stargardt病的进展,这是一种由ABCA4基因缺陷引起的遗传性黄斑变性形式,该基因的蛋白质有助于保护眼睛免受毒素侵害。
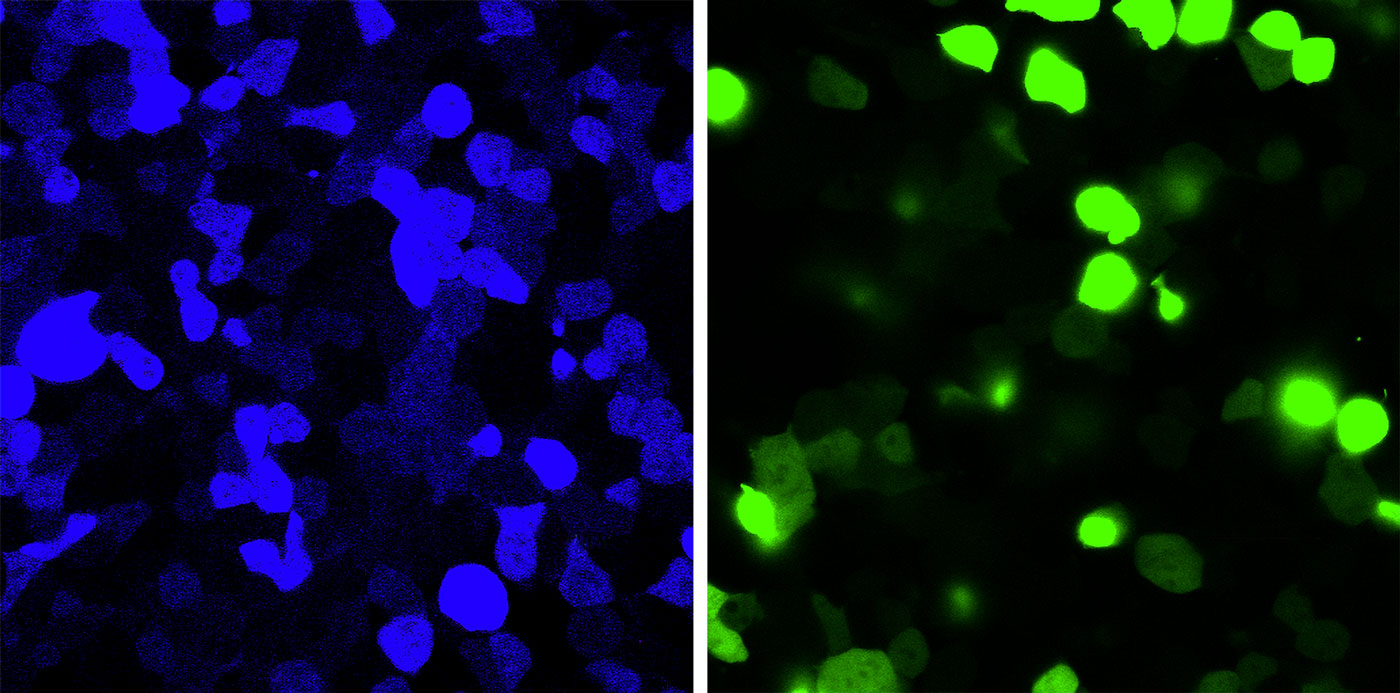
在一项细胞实验中,一个突变使得通常为绿色的荧光蛋白变成了蓝色(第一幅图片)。通过编辑这种蛋白质的信使RNA,可以恢复其正常颜色(第二幅图片)。TOSHIFUMI TSUKAHARA/JAPAN ADVANCED INSTITUTE OF SCIENCE AND TECHNOLOGY
超过1000种突变可导致Stargardt病,Ascidian公司总裁Michael Ehlers表示,该治疗方法“能够解决大约75%的患者”。在早期研究中,这种策略提高了猴子眼睛和人类视网膜组织样本中正常ABCA4蛋白的水平。Ehlers说,确定这种方法是否对人有效可能需要大约2年时间,因为这种疾病恶化得非常缓慢。
韩国公司Rznomics也在进行两项临床试验,研究转录剪接作为治疗肝癌和脑癌的方法。明年,它将开始一项针对遗传性眼病色素性视网膜炎的疗法研究,在这种病症中,患者由于视网膜细胞退化而逐渐失去视力。
转录剪接存在效率问题:在一些研究中,该程序修复的错误mRNA不到1%。为了提高这一数字,研究人员正在探索几种策略,包括采用细菌Cas蛋白,尽管这有触发免疫反应的风险。例如,Asokan及其同事转向使用一种名为Cas13的酶,它切割RNA而不是DNA。他们调整了这种蛋白质,使其不能进行切割,将其转变为一个连接器,将准备好剪接的自然前体mRNA与携带替代外显子的引入RNA分子连接起来。研究人员在3月份的《自然通讯》上报告称,这种方法在培养细胞中的效率比依赖引导RNA将修正序列定位到正确位置的替代方法高出40倍。
相比之下,Abudayyeh、Gootenberg及其同事利用了另一种Cas蛋白的RNA切割能力。他们假设,通过在特定的剪接位点切断前体mRNA分子,Cas7-11酶将更容易添加替代RNA外显子。研究人员在多种细胞中测试了这种技术,包括携带致病突变的细胞系。他们在今年早些时候在bioRxiv预印本中揭示,这种方法将转录剪接效率提高到5%至50%之间。
Cas蛋白还可以通过简单地切割突变的mRNA来编辑它们,这通常导致它们降解,减少驱动疾病的异常蛋白质水平。由中国生物技术公司HuidaGene赞助的临床试验将评估这种策略是否对患有与年龄相关的黄斑变性或MECP2重复综合症的人有益,这是一种神经发育障碍,是Rett综合症的反面——MECP2水平过高。
然而,被Cas切割并不总是意味着一个RNA分子的终结。有时细胞会拯救断裂的RNA并重新连接两端。蒙大拿州立大学的分子生物学家Blake Wiedenheft及其同事正试图利用这种自然的RNA修复过程,他们认为可以使用Cas蛋白切除mRNA中的麻烦部分。然后细胞将修复这个分子,留下一个稍微短一些但功能正常的mRNA。
研究人员在携带导致囊性纤维化的突变之一的细胞中评估了这种策略。这种变异在CFTR蛋白的mRNA中创造了一个提前的“停止”信号,导致细胞制造出一个快速退化的截短分子版本。结果,患者的CFTR不足,CFTR调节肺部的盐分和液体。与培养细胞一起工作,研究人员使用一个Cas蛋白和一个针对RNA停止信号的引导RNA,从CFTR mRNA中切除突变部分。虽然大多数编辑后的mRNA分解了,但有些被修复了,并且细胞开始产生几乎全尺寸的CFTR,团队在5月17日的《科学》杂志上报告。
Wiedenheft表示,这种方法不适用于一些没有删除部分就无法正常工作的蛋白质。但其他可能完全没问题。他成立了一家公司,试图将这些成果转化为治疗方法。他说,囊性纤维化可能不是这种疗法的好目标,原因有很多,但至少有45种遗传性疾病是。
Gaj表示,RNA编辑领域“还处于初期阶段”,它“可能会遇到成长的烦恼”。研究人员正在争论的一个问题是,如何将RNA编辑分子送达正确的器官和细胞——这也是标准基因疗法和DNA编辑面临的挑战。“传递是RNA编辑最大的障碍,”Mali说。
为了将RNA编辑器送达目标,研究人员经常将它们包装在腺相关病毒内,这种病毒已经被用来传递整个基因或CRISPR治疗。他们还部署用于mRNA疫苗的相同类型的脂质纳米颗粒。这是Ascidian公司治疗Stargardt病的策略。相比之下,Wave的寡核苷酸被包裹在仅能进入肝细胞的糖中注入体内。这些方法各有利弊,可能还需要更多策略。
研究人员还担心RNA编辑方法的低效率会阻碍治疗。但是像CRISPR这样的DNA编辑器在其早期同样效率低下。Beal指出,即使只有一小部分mRNA被修复,治疗也可能对患者有益。“你可能只需要几个百分点就能获得治疗效果。”
RNA编辑方法不仅面临来自成熟的基于DNA的遗传药物的竞争,还面临涉及RNA的其他疗法的竞争。已经有六种获批的siRNA疗法和18种基于寡核苷酸的药物,所有这些都降低了突变mRNA的水平而不是修复分子。尽管如此,研究人员认为RNA编辑治疗可以找到一席之地。如果他们做到了,接受这些治疗的人不会在乎它们是影响DNA还是RNA,Gootenberg说。“对于大多数患者来说,疾病是如何被治愈的并不重要。重要的是它被治愈了。”
https://blog.sciencenet.cn/blog-41174-1456882.html
上一篇:细胞药厂在患者体内按需生产药物
下一篇:给《科学》杂志这一做法点赞:作者署名用中文备注