博文
产氢硅材料对小肠缺血再灌注损伤的作用
|
产氢硅材料对小肠缺血再灌注损伤的作用
摘要
小肠缺血再灌注(IR)损伤的进展会导致肠道细胞坏死,需要手术切除,这可能导致肠道功能丧失。因此,开发能够在早期预防 IR 损伤并抑制其进展的治疗剂势在必行。由于IR损伤可能与氧化应激密切相关,抗氧化剂可以成为有效的治疗剂。
硅基(Si)基试剂是一种抗氧化剂,在口服给药后长时间在肠道中产生大量氢气。由于它对皮瓣移植期间的溃疡性结肠炎、肾功能衰竭和IR损伤有效,因此对小肠IR损伤可能有效。在此,我们研究了硅基药物在小肠IR损伤小鼠模型中的疗效。Si基试剂通过减少IR损伤诱导的氧化应激来抑制小肠上皮细胞的凋亡。此外,硅基制剂给药组小肠黏膜层厚度明显高于未治疗组,表明硅基制剂对小肠IR损伤有效。未来,硅基药物可能会提高小肠移植的成功率。
前言
小肠除了吸收氨基酸、葡萄糖、脂肪酸等必需营养素外,还具有多种功能,包括吸收参与其新陈代谢的维生素和微量元素,并起着维持体内平衡的作用。此外,小肠一直受到各种外部因素的影响,包括消化酶和肠道细菌,使其容易受到持续暴露的影响。因此,小肠使用两种机制来维持稳定的肠道环境。一种是由小肠上皮细胞的粘蛋白和细胞粘附组成的粘液的物理防御,另一种是小肠上皮细胞产生的乳铁蛋白和溶菌酶等抗菌肽的化学防御1.相比之下,最近的研究表明,类风湿性关节炎等全身性炎症性疾病2和系统性红斑狼疮3当肠道菌群的组成由于肠道环境的紊乱而发生变化时,发展或恶化。因此,维持肠道功能的重要性已得到证实。
然而,小肠被认为是许多器官中最脆弱的器官之一。即使在器官移植技术发展的今天,小肠移植仍然困难重重,小肠移植的病例数明显低于其他器官。与小肠脆弱相关的因素包括器官移植后的排斥反应和缺血再灌注 (IR) 损伤导致的对器官坏死的抵抗力低4.组织对小肠IR损伤的脆弱性不仅在器官移植中是一个问题,而且在临床环境中发生率相对较高的疾病中也是一个问题,例如急性肠系膜动脉闭塞和绞窄性肠梗阻5.当这些疾病治疗后进行血运重建手术时,IR 损伤是不可避免的并发症。在最坏的情况下,会发生肠坏死,导致预后不良。一旦发生肠坏死,手术切除肠道是唯一可用的治疗选择。因此,及早预防IR损伤的进展是一个紧迫的问题。
IR 损伤的主要原因是由各种机制(包括线粒体呼吸链损伤)产生的活性氧 (ROS) 引起的氧化应激。抗氧化剂通过清除 ROS 来减少 IR 损伤,是抑制肠坏死的有效治疗剂。
先前的研究表明,抗氧化剂如氢气可减轻IR损伤。氢气是一种极好的抗氧化剂,可以特异性地清除有害的ROS,如剧毒的羟基自由基12.
我们的硅基(Si)基试剂与水反应生成大量氢气13.当它与弱碱性溶液反应时,产生的氢气比与中性溶液反应时产生的氢气更多。此外,它有望成为一种有效的新型抗氧化剂,对抗与氧化应激相关的疾病,因为它在口服给药后在肠道中稳定地产生大量氢气.。实上,硅基药物已被证明可以缓解溃疡性结肠炎等疾病的症状、肠道疾病、皮瓣移植过程中的IR损伤和肾 IR 损伤。因此,硅基药物可以抑制红外对小肠的损伤。在这项研究中,我们使用肠系膜上动脉闭塞的 IR 损伤小鼠模型研究了硅基药物对小肠 IR 损伤的疗效。
结果硅基药物减轻了IR损伤对小肠上皮的损害为了研究硅基药物是否能减少 IR 引起的小肠组织损伤,我们对 IR 损伤后的小肠进行了病理学分析,然后使用 Swiss-Roll 法研究了由细胞凋亡、坏死和物理损伤引起的上皮细胞的整个受损区域小肠标本。在硅处理组(Si组)和未处理的对照组(Con组)中,许多突出到管腔的绒毛尖端的上皮细胞脱落;然而,沼泽仅限于绒毛。此外,未观察到损害粘膜下层的溃疡。首先,比较两组绒毛受损区域的宽度。在Con组中,从空肠到回肠的范围内都不存在绒毛,并且在许多区域观察到绒毛结构的破坏(图1 a,b)。相比之下,Si组显示出更局部的绒毛缺陷(图1 c,d)。肠腔中的黑色物质是硅基物质。对两组损伤区扩散差异的统计分析表明,Si组的组织损伤区明显小于Con组(图1e)。

图1使用HE染色标本对小鼠小肠进行病理学分析。(a-d)对照组 (Con) 组 (a, b) 和硅处理 (Si) 组 (c, d) 中苏木精和伊红 (HE) 染色的小肠的代表性显微照片。(一、三)整个小肠和(b,d)小肠的病变部位。红括号:病变部位。比例尺:200μm(a,c),40μm(b,d)。 (e) 小肠病变区域的测量结果。
随后,使用组织学 Giemsa 染色详细观察小肠的结构变化。吉姆萨染色是一种用于血涂片和骨髓标本的染色方法,但它具有对细胞核和退化液泡进行清晰染色的特点,揭示了它们的形态,也适用于组织标本(图12 a,b)18.组织 Giemsa 染色显示,吸收性上皮细胞的核和液泡变性绒毛损伤区域比苏木精和伊红 (HE) 染色更清晰。许多腔内细胞未染色或被HE轻度染色的区域被Giemsa染色证实为空泡化(图12 c,d)。此外,即使在细胞质被HE染色到管腔侧的区域,这些细胞的细胞核也未被Giemsa溶液染色(图12 e,f)。与HE染色不同,Giemsa染色检测到失去细胞功能的上皮细胞,尽管绒毛的结构仍然存在。因此,上皮细胞的核变性和空泡化被用作使用组织Giemsa染色进行分析的指标。测定了经历核变性和空泡化的上皮细胞的长度与小肠总长度的比率(图12,h)。统计分析表明,与Con组相比,Si组的空泡化和核变性均显著降低。
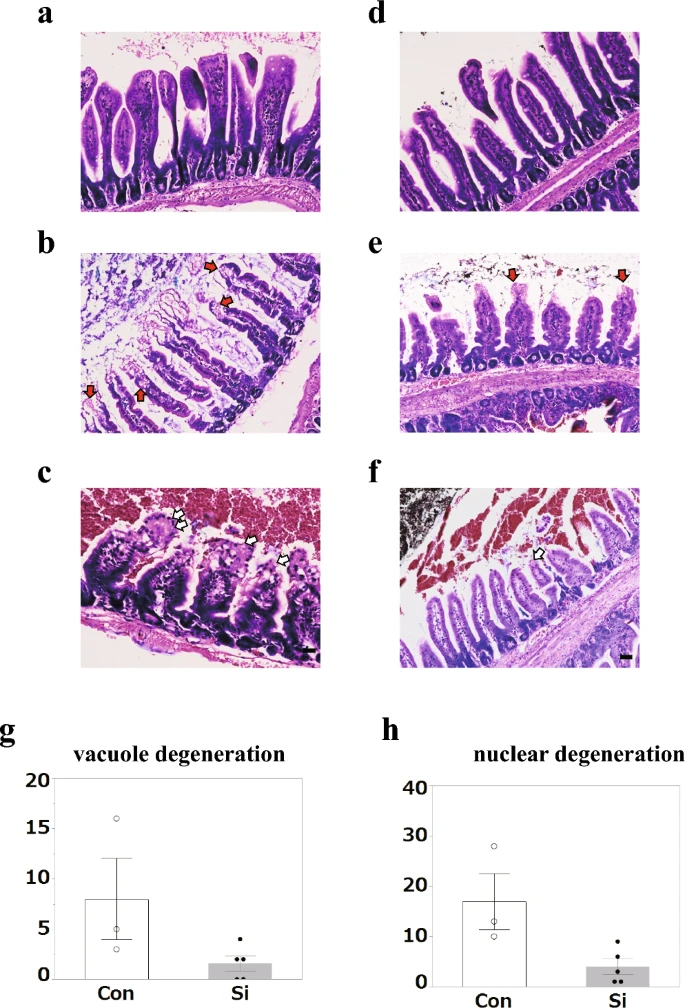
图2使用Giemsa染色标本对小鼠小肠进行病理学分析。(A-F)对照组 (Con) (a–c) 和硅处理 (Si) 组 (d–f) 中 Giemsa 染色小肠的代表性显微照片。(一、四)正常部位,(b,e)液泡变性和(c,f)核变性。红色箭头:液泡变性;白色箭头:核变性。比例尺:40 μm (a–f)。(g,h)小肠液泡变性面积(g)或核变性面积(h)的测量结果。
硅基试剂可减少小肠杯状细胞因IR损伤而脱落
接下来,我们检查了 IR 后幸存的非受伤区域是否持续存在粘液分泌。两种类型的粘蛋白染色,高碘酸-希夫 (PAS) 染色(图 13a, b)和阿尔新蓝染色(图13c,d),在负责肠上皮细胞中粘蛋白分泌的杯状细胞上进行。PAS染色中性粘蛋白,阿尔新蓝染色酸性粘蛋白。在正常小鼠的小肠组织中,主要对散布在肠上皮细胞中的杯状细胞的分泌囊泡进行染色以填充杯状细胞。形态学分析显示,Con组的阳性杯状细胞数量低于Si组(图13a-d)。统计分析表明,在两种染色标本中,Si组的阳性杯状细胞数量均显著高于Con组(图13e, f)。
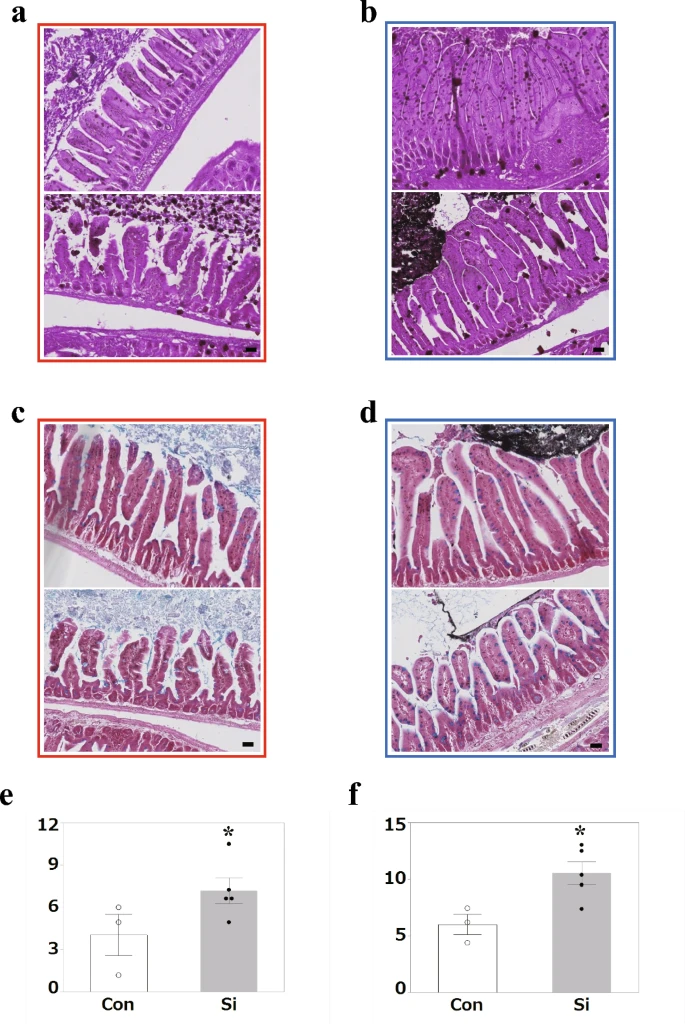
图3通过粘蛋白染色检查杯状细胞。(a-d)高碘酸希夫(PAS)染色(a,b)或阿尔新蓝染(c,d)或小肠对照(Con)(a,c)和Si(b,d)中的代表性显微照片。 比例尺:40 μm (a–d)。(e、f)阿尔新蓝染 (e) 或 PAS 染色 (f) 小肠中受损区域杯状细胞数的测量结果。
硅基试剂通过抑制氧化应激来防止与IR损伤相关的小肠绒毛的细胞死亡
此外,为了研究硅基药物是否通过其抗氧化作用减轻上皮细胞损伤,我们分析了每组小肠中的脂质过氧化物。使用抗丙二醛 (MDA) 抗体进行蛋白质印迹,并比较整个小肠中脂质过氧化物的含量。MDA是ROS氧化多不饱和脂肪酸的最终产物,反映了氧化应激的程度。与Con组相比,Si组MDA的表达水平受到显著抑制(图14a、b)。随后,为了研究脂质过氧化物在细胞中的积累,我们使用脂质过氧化物链反应的标志物4-HNE抗体进行了免疫染色。在Con组中,在绒毛管腔侧的细胞质中观察到阳性信号;然而,在Si组中,观察到的阳性信号很少(图14c, d)。
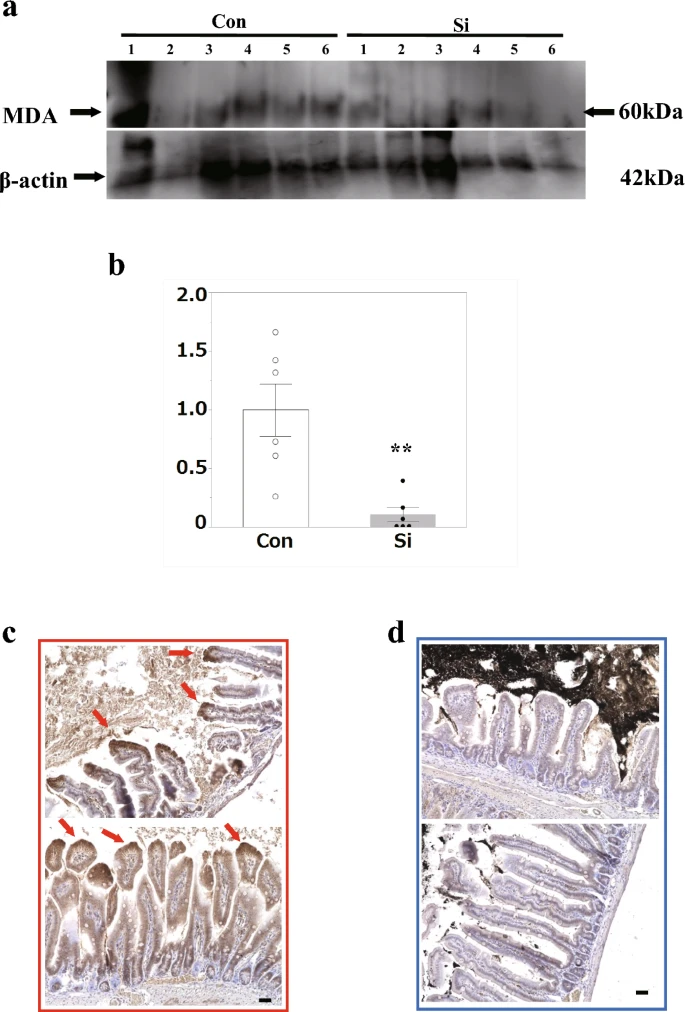
图4小肠IR损伤的氧化应激分析。(a) 小肠中丙二醛 (MDA)(上)和 β-肌动蛋白(下)的蛋白质印迹分析。(b)表示波段密度定量的条形图。数据表示为平均值。每组 6 只小鼠的平均值(SEM)的标准误差。**p < 0.01 与对照组(Con)相比,由学生的配对 t 检验确定。(c、d)4-羟基壬烯醛(4-HNE)的免疫荧光染色。小肠IR损伤小鼠模型中小肠的代表性显微照片。(c)Con基团,(d)硅处理(Si)基团。
最后,考虑到IR损伤引起的组织损伤是氧化应激诱导的细胞死亡的结果,我们使用TUNEL染色分析了凋亡细胞。在Con组中,检测到广泛的阳性信号(图5 a、b)。相比之下,在Si组中几乎没有检测到阳性信号(图5 c,d)。与Con组相比,Si组的细胞凋亡面积显著降低(图5 e)。
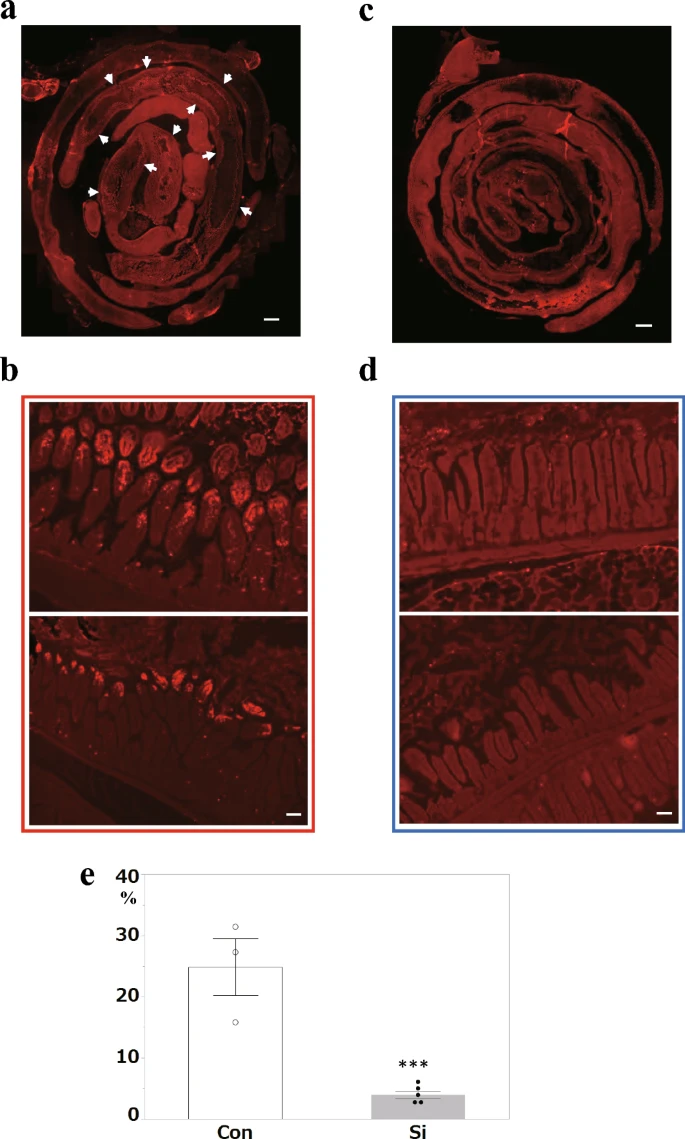
图5小肠IR损伤的细胞凋亡分析。(a-d)对照组(Con)组(a, b)和硅处理(Si)组(c,d)中苏木精和伊红(HE)染色的小肠的代表性显微照片。(a、c):整个小肠;(b、d):小肠病变部位。(e)小肠病变区域的测量结果。
总之,这些结果表明,硅基药物可减少与小肠IR损伤相关的上皮细胞的死亡,并通过抗氧化作用显着减少组织损伤。
讨论
小肠 IR 损伤,一种由于血栓形成/栓塞或小肠移植导致肠系膜动脉闭塞而发生的病理状况。如果病情恶化,可能会导致肠道功能丧失。因此,迫切需要开发能够在早期预防 IR 损伤并抑制其进展的治疗剂。本研究表明,一种硅基药物可显著抑制由杯状细胞和吸收性上皮细胞组成的小肠上皮细胞的细胞损伤,如细胞凋亡,从而维持杯状细胞的粘液分泌能力。这些发现表明,硅基药物可能是治疗小肠IR损伤的有效药物。
在小肠中,绒毛的长度通常会随着从喙状空肠到尾回肠的进展而缩短。因此,即使在正常小鼠中也可以看到小肠绒毛长度的巨大差异,具体取决于标本选择的部位。因此,缩短超过一定长度的绒毛区域不应被明确确定为受伤区域。与相邻绒毛相比,观察到肠上皮细胞的细胞质未染色和细胞之间的不连续性。绒毛缩短和结构被破坏的区域被定义为受损区域。此外,由于小肠各区域绒毛结构的差异,不应仅使用小肠的一部分进行比较分析。为了分析小肠的整个结构,使用Swiss-Roll方法制备的小肠标本进行了形态学分析。综上所述,我们的结果准确地反映了整个小肠的病理变化和硅基药物的有效性。
在肠道疾病中,如急性肠系膜动脉阻塞和小肠移植,其中血流暂时受阻,血运重建过程中发生的IR损伤是不可避免的并发症。IR损伤的主要原因是由ROS引起的氧化应激,这是在血运重建过程中向缺氧缺血区域供应大量氧气时产生的。ROS损害细胞中的线粒体功能,诱导细胞凋亡,并导致器官损伤。此外,ROS通过氧化构成细胞膜的磷脂和其他多不饱和脂肪酸等脂质来产生脂质过氧化物。近年来,过氧化脂已被证明对器官有直接的不良影响。IR 引起的脂质过氧化物被认为通过激活炎症反应机制(例如干扰素基因刺激因子 STING通路)来加剧 IR 损伤。此外,脂质过氧化物水平升高不仅会损害受影响的小肠,还会损害远处器官(如心脏)的功能,这是一种继发性疾病20,对全身造成重大不良影响。因此,抑制脂质过氧化物的产生对治疗小肠IR损伤具有重要意义。
用抗氧化剂治疗,可有效去除对身体有害的氧化剂,如过氧化脂。因此,已经进行了各种研究,通过减少与 IR 相关的 ROS(尤其是脂质过氧化物)来抑制再灌注损伤。具体而言,超氧化物歧化酶 (SOD) 给药可减少 IR 损伤21,过表达Nrf-2的小鼠的细胞活力得到改善,这增加了抗氧化酶的表达以响应氧化应激22.除了活化体内抗氧化系统外,抗氧化剂的施用也可有效抑制IR损伤。特别是多酚如染料木黄酮的给药9、白藜芦醇10和橄榄苦苷配元11是有效的。然而,许多多酚的结构与雌激素(一种女性性激素)的结构相似,并且担心高剂量给药时会产生副作用23.特别是,考虑到引起IR损伤的急性肠系膜动脉闭塞经常发生在有动脉硬化和心房颤动等心脏病病史的老年人中,因此需要开发副作用较少的抗氧化剂。
相比之下,氢气特异性清除羟基自由基,是一种极好的抗氧化剂,没有报告的不良反应。据报道,它具有抗炎作用。然而,对生物体施用氢气是一个值得关注的问题。当以足以在体内表现出抗氧化作用的浓度给药时,传统的给药途径,口服或鼻腔吸入,由于氢气的可燃性而存在爆炸的风险。此外,当口服氢溶解水时,溶解浓度非常低,由于其优异的渗透性而无法维持;因此,它不适合长期储存。我们的硅基试剂可以解决这些问题。硅基试剂可以与水反应,连续生成大量氢气13.在小鼠口服给药时,观察到小鼠肠道中氢浓度的增加。因此,硅基试剂可以稳定安全地向人体供应氢气,氢气是一种极好的抗氧化剂。除了对与氧化应激相关的各种疾病有效,如溃疡性结肠炎、慢性肾功能衰竭、间质性肺炎和帕金森病。据报道,硅基药物对再灌注损伤有抑制症状的作用,例如皮瓣 IR 损伤和肾 IR 损伤。
在这项研究中,我们通过预先施用硅基试剂以不断用氢气填充肠道,成功地减轻了小肠 IR 引起的氧化应激。如上所述,在小肠IR损伤期间抑制脂质过氧化物的产生是很重要的。4-HNE和MDA分别是脂质过氧化链反应和脂质过氧化终产物的标志物。由于硅基试剂显着抑制两种脂质过氧化物的产生,因此它们被认为可以抑制脂质过氧化物的链式反应,从而减少脂质过氧化物的最终积累并减轻氧化应激。硅基药物可抑制氧化应激引起的小肠上皮细胞(包括杯状细胞)的凋亡。总之,我们认为硅基药物可能是治疗小肠 IR 损伤的有效药物。
分泌型粘蛋白是粘液的主要成分,由各器官的上皮细胞分泌,大致分为酸性和中性粘蛋白。一般来说,这两种粘蛋白的分布因器官而异。中性粘蛋白存在于胃粘膜中和十二指肠的布鲁纳腺,而酸性粘蛋白存在于结肠粘膜中(尤其是远端结肠)和支气管索。然而,这两种粘蛋白在小肠中的分布并不明确。近端小肠中的杯状细胞分泌高比例的中性粘蛋白,而远端小肠中的杯状细胞分泌高比例的酸性粘蛋白29.然而,人们普遍认为中性和酸性粘蛋白在小肠中共存。含有这些粘蛋白的粘液层在物理防御消化酶和肠道细菌的入侵中起着作用,维持粘液层以维持肠道环境的稳态非常重要。然而,在早期缺血期间,预先存在的粘液层被破坏30.因此,当血流动力学重建时,保持可分泌新粘蛋白的杯状细胞的储备能力对于治疗小肠IR损伤非常重要。本研究采用中性粘蛋白的PAS染色和酸性粘蛋白的阿尔新蓝染色来评估小肠杯状细胞的粘液分泌储备。与Con组相比,Si组PAS染色阳性细胞数量较多,阿尔新蓝染色阳性细胞数量显著增加。据报道,正常小鼠中每个绒毛的杯状细胞数约为10个;因此,施用硅基药物几乎完全抑制了由于IR损伤引起的杯状细胞损失。因此,有人认为,硅基药物通过抑制杯状细胞功能障碍和保护小肠上皮细胞免受进一步损伤来维持其粘液分泌能力。此外,抑制杯状细胞减少可及早恢复缺血条件下丢失的粘蛋白粘膜层;因此,也有人认为硅基药物可以保护器官免受晚期并发症,如感染和溃疡。
由于肺、心脏和肾脏等器官移植与 IR 损伤密切相关,因此移植的成功率取决于 IR 损伤被抑制的程度。根据先前的报道,氢气的施用已被证明可有效抑制肝肺移植后的 IR 损伤,氢气对器官移植的成功非常有效。用氢气填充管腔还可以保护移植后肠道免受 IR 损伤。考虑到这些发现,硅基药物可能是改善移植结果的治疗药物,并且预计硅基药物的未来前景。
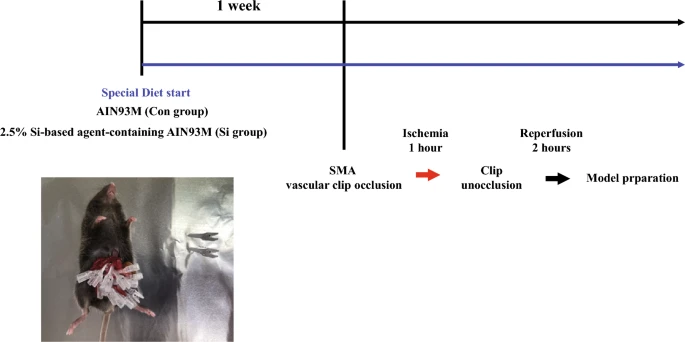
材料和方法小肠IR损伤小鼠模型和饮食本研究使用7周龄的C57Bl / 6 J雄性小鼠(日本SLC,日本静冈)。将小鼠饲养在23-25°C,并随意喂食特殊目的啮齿动物食物和水。如前所述,制备了两种定制的啮齿动物日粮(Oriental Yeast Co., Ltd.,东京,日本),AIN93M(对照日粮)和含有2.5%Si基剂剂的AIN93M(含Si基剂剂日粮)13、14、15 .研究设计如图所示。6.我们在IR治疗前一周喂食小鼠。将小鼠随机分为以下两组(每组12只小鼠):Con组,对照饮食喂养的肠IR损伤小鼠模型;和Si组,基于Si的药物饮食喂养的小肠IR损伤小鼠模型。按照 Ekaterina 等人的描述制备小肠 IR 损伤小鼠模型。使用联合麻醉剂(0.3 mg/kg 美托咪定、4.0 mg/kg 咪达唑仑和 5.0 mg/kg 布托啡诺)进行深度麻醉,使用手术剪刀在中线约 4 cm 处进行剖腹手术,用镊子抓住回肠,然后将其拉出体外,从而暴露空肠。切除肠系膜,并使用微血管夹无干扰地识别肠系膜上动脉(Bear Medic Co.,茨城县,日本)。肠系膜上动脉的所有主要分支均被剪断,次要分支被小心地夹住。在确认涉及肠系膜上动脉的区域的血流完全阻塞后,将肠道维持在缺血状态1小时。此后,释放所有血管夹,再灌注血液2 h,诱发小肠IR损伤。我们做了一个初步测试和两个主要测试(3只小鼠/组/测试)。在初步测试(12 只小鼠)中,我们检查了缺血期间微血管夹的数量和位置,以便IR引起的损伤程度保持不变,并为制备小肠 IR 损伤小鼠模型建立了条件。进行了两项主要测试:各种形态学分析和蛋白质印迹。在小鼠饲养中,由于使用了3只小鼠/笼子,因此将一次测试分为2次,结果每组6只小鼠。包括初步测试在内,实验中使用的小鼠总数为36只。在两个主要测试中,每组使用12只小鼠进行分析。再灌注后死亡的小鼠被排除在分析之外(Con:3,Si:1)。
试验设计。左下图:SMA夹子闭塞治疗的代表性照片。SMA:肠系膜上动脉。
https://blog.sciencenet.cn/blog-41174-1422795.html
上一篇:美国开展多发性硬化细胞治疗临床试验
下一篇:生成式AI脖子竟卡在能源