博文
抗氧化剂在健康与疾病中的作用机制【自然综述】
|
抗氧化剂在健康与疾病中的作用机制
本文作者巴里哈利韦尔教授是科睿唯安(Clarivate)2021年3位化学引文桂冠奖获得者之一。获奖原因是在自由基化学方面的开创性研究,包括自由基和抗氧化剂在人类疾病中的作用。哈利韦尔主编《自由基生物医学》,对于自由基生物医学的系统知识推广发挥了重要作用。他这次关于自由基的最新综述,是我们了解世界顶级学者对自由基生物医学的最新观点和这一领域的最新进展,都是非常有帮助的。

新加坡国立大学Barry Halliwell近日发表综述,阐述了以活性氧(ROS)为代表的促氧化剂与抗氧化剂(antioxidant)在体的平衡,及其在正常生理与病理中发挥的作用;突出强调了目前相关知识与研究的空缺。Halliwell B. Understanding mechanisms of antioxidant action in health and disease. Nat Rev Mol Cell Biol. 2024 Jan;25(1):13-33. 作者从ROS产生的机制与调节、正常生理作用、拮抗其过度活跃的抗氧化原理、内源产生/外源(来自食物或者合成药物)补充的抗氧化剂种类与工作机制等出发,细致梳理了该活性氧类分子与“抗氧化剂抵抗网络(antioxidant defence network)”的平衡。
作者很有批判性地提到:虽然人们在上百种疾病发现ROS等的异常变化,但是活性氧并不一定起驱动作用,有些时候还通过触发内源机体保护机制等途径来发挥积极作用;目前也很少有抗氧化药物展示积极的临床效果,即使有效果的几种也没有充分证据支持就是通过抗氧化发挥功能,后续需要进一步的临床试验。
另外,作者提示关注抗氧化剂潜在通过消化道发挥的功能;以及健康的生活方式(避免肥胖、控制血糖/胆固醇、适量运动、健康食物(水果、蔬菜、谷物等))潜在通过提高机体抗氧化能力发挥的积极作用。
该项工作2024年1月3日发表在Nature Reviews Molecular Cell Biology。
背景介绍
一、自由基活性氧概述
体内产生的几种活性氧(ROS)被广泛定义为含有氧原子但比氧气本身更具反应性的分子。一些ROS是自由基,含有一个或多个未配对电子的原子或分子,即单独占据原子或分子轨道的电子;而另一些是非自由基,其所有电子都成对。一些ROS是偶然产生的,例如,通过自动氧化反应和电子传输链中电子的泄漏;而另一些ROS则是生物细胞主动产生的,以支持防御病原体(框1)和信号转导(图1)等重要过程。
一个重要的信号分子活性氧是非自由基过氧化氢(H2O2)。另一个是自由基一氧化氮NO•,其上标点表示含有自由电子的自由基,一氧化氮具有多种生理作用;NO•的自由基化学性质可解释了其许多生理学效应。事实上,ROS密切参与需氧生命过程的各个方面,从精子功能和卵子受精到胎盘的形成、胚胎发育/组织重塑、出生以及器官包括大脑的生长和发展。特别指出,婴儿从宫腔低氧过渡到空气环境中21%氧气时发生的超氧应激,导致ROS产生增加。
当两个自由基相遇时,它们的未配对电子可以相互结合形成一个共价键(共享一对电子)。例如,NO•与一些氨基酸衍生自由基结合。NO•与O2•−的反应形成过亚硝酸盐,具有潜在的有害影响(表1)。当一个自由基与一个非自由基反应时,则会发生链式反应,即一系列自由基反应发生。
ROS中的“反应性”一词涵盖了广泛的范围。诸如超氧阴离子自由基(O2•−)和H2O2这样的物种反应性有限(表1),而羟自由基(OH•)的反应性非常可怕,以扩散控制速率攻击所有生物分子,并经常引发链式反应。一个重要的链式反应是脂质过氧化,其中一种ROS会导致膜和脂蛋白中多不饱和脂肪酸(PUFA)侧链的多个分子氧化。OH•通常通过从膜或脂蛋白中PUFA侧链的C−H基团中提取一个氢原子来启动脂质过氧化。
氢原子(H•)只含有一个电子,是一个典型的自由基,因此从C–H共价键中提取它会在碳上留下一个未配对的电子:
PUFA−H + OH• →PUFA• + H2O (1)
PUFA碳(C•)自由基迅速与O2反应生成过氧基自由基(PUFA-O2•):
PUFA• + O2 → PUFA−O2• (2)
其反应性足以从另一PUFA侧链(有时在同一条链上)上的C−H上提取H•以继续链式反应:
PUFA−O2•+ PUFA−H → PUFA−O2H + PUFA• (3)
由PUFA衍生的过氧化物(PUFA−O2H)破坏膜结构,也可以分解产生更多的自由基和细胞毒素醛,如4-羟基壬烯醛。质子化的O2•−形式(HO2 •)(表1)也可以启动脂质过氧化,但其生物学意义尚不确定。
此外,OH•攻击所有其他生物分子,包括所有DNA四种碱基和脱氧核糖,生成多种DNA损伤产物。事实上,OH•在体内DNA损伤中发挥作用的最佳证据之一就是观察到OH•引起的这种独特的氧化DNA损伤模式。其他ROS如过氧基自由基(例如,PUFA-O2 •)、单线态氧(1 O2)和非自由基次氯酸(HOCl)(框1)和过亚硝酸盐(ONOO−)[表1]的反应性介于中间,它们与许多但不是所有的生物分子反应,速度比OH•慢。1 O2是O2的一种形式,其电子构型通过输入能量重新排列以使其更具反应性。与正常O2不同,1 O2可以直接将PUFA残基氧化为过氧化物。氧化损伤一词用于描述ROS对生物分子造成的损害,它涉及几种(但绝不是所有)人类疾病,尤其是癌症(框2)、心血管疾病、眼部和神经退行性疾病(请参阅“使用抗氧化剂预防或治疗人类疾病”)。几种ROS(OH• 、1 O2、HOCl、ONOOH和某些过氧基自由基)可以攻击DNA(产生诱变碱基氧化产物)(框2)、RNA、蛋白质、碳水化合物和脂质。1 O2引起的氧化损伤在几种疾病中起作用,例如卟啉病,这是由血红素合成缺陷引起的疾病。卟啉病患者皮肤中的异常色素作为光敏剂,它们吸收光能并将能量传递给O2以产生1 O2,从而导致严重的皮肤损伤。相比之下,由治疗性光敏剂故意产生的1 O2用于治疗某些癌症,即所谓的光动力疗法(框2)。
本综述重点介绍了抵消ROS的抗氧化剂(图1)。它探讨了“抗氧化剂”一词的含义、存在的不同类型、它们的机制、它们在生理学中的重要性(例如,防止感染)(框1)和病理学中的重要性、我们对这些知识的差距以及如何填补这些差距。抗氧化剂,无论是天然还是合成的,在治疗或预防疾病方面的成功和失败以及这些成功和失败背后的原因也被讨论。
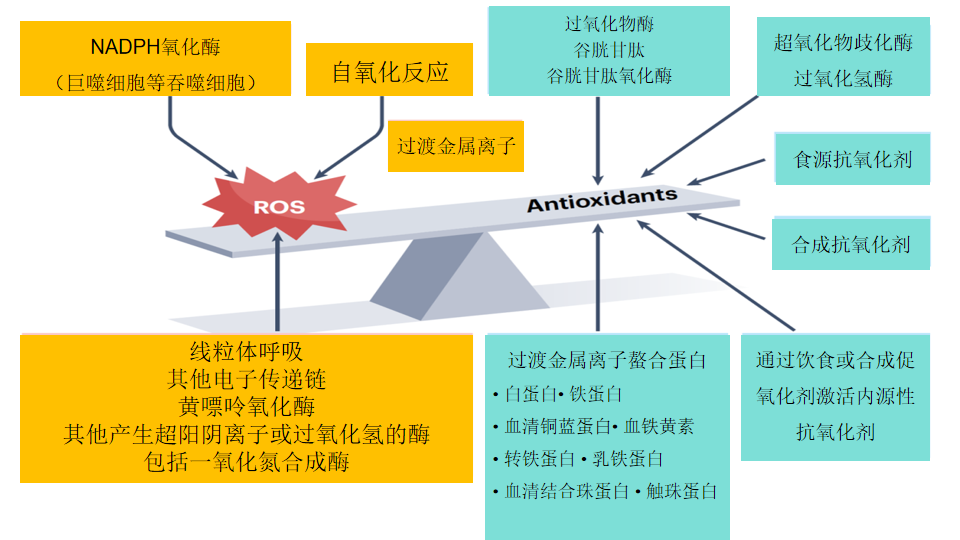
图1 活性氧和抗氧化剂平衡。
活性氧物质(ROS)在体内通过多种机制产生,包括黄嘌呤氧化酶(当其将黄嘌呤和次黄嘌呤氧化为尿酸时,会产生超氧自由基(O2•−)和过氧化氢(H2O2))和单胺氧化酶酶(当其氧化单胺时,会产生H2O2),一氧化氮合酶(如果它们变得“解偶联”,通常是由于缺乏它们的辅因子四氢生物喋呤,使得电子逃逸到O2形成O2•−而不是NO•)和NADPH氧化酶家族(框1)。另一个重要的ROS来源是在电子通过电子传递链时,特别是线粒体中的电子逃逸到O2上生成O2•−。电子也可以从血浆、核和内质网膜的电子传递链中逃逸,但这些似乎不如线粒体是O2•−的重要来源。线粒体ROS的产生不应仅被视为意外泄漏,因为它也可能在细胞内信号传导中发挥重要作用。然而,线粒体ROS无法控制可能导致危及生命的后果。此外,ROS还可以通过不稳定的生物分子如多巴胺、肾上腺素、还原型黄素、去甲肾上腺素和四氢生物喋呤等的O2依赖性氧化而产生。这种生物分子的O2依赖性氧化通常被称为“自氧化”,但在没有过渡金属离子的情况下非常缓慢,这些过渡金属离子催化许多这样的“自氧化”反应(表1描述了过渡金属的促氧化作用以及上述螯合剂如何控制这一点)。ROS水平受到抗氧化防御网络的调节,其主要组成部分是内源性酶(表1),并得到饮食衍生的抗氧化剂的帮助(表2)。轻微的倾斜表明抗氧化防御网络并不能消除所有的ROS,因为其中一些具有有用的作用。因此,氧化损伤会持续发生,受损的分子必须被修复或替换。
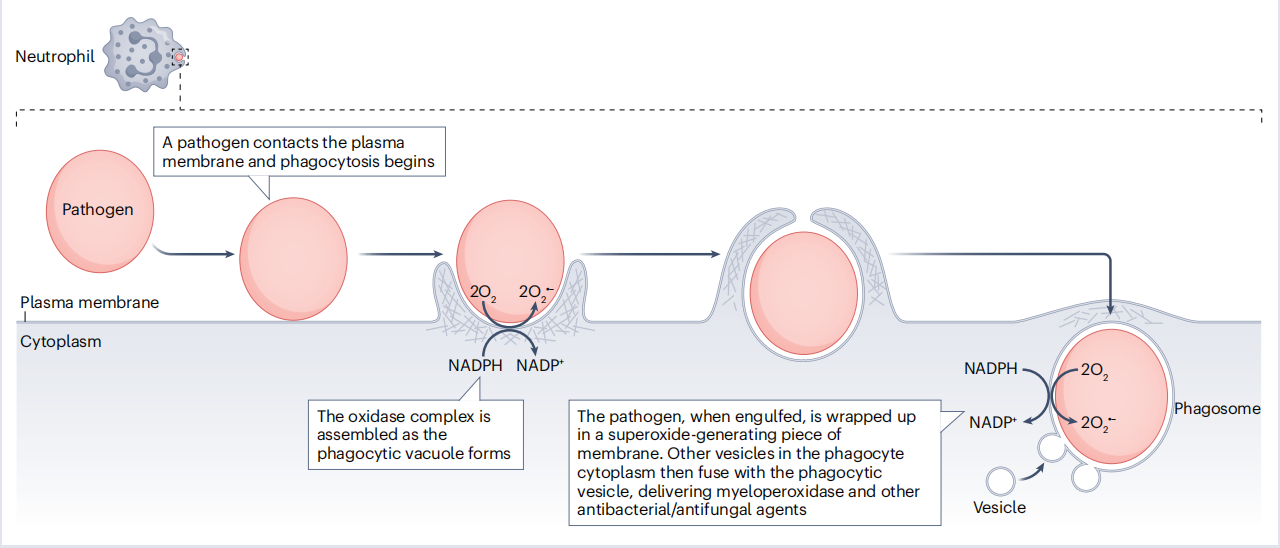
框1 吞噬细胞产生活性氧抵抗病原体
• 当吞噬细胞(中性粒细胞、单核细胞、嗜酸性粒细胞和巨噬细胞)遇到病原体时,它们会激活一种增加氧气消耗的“呼吸爆发”。这种氧气被NADPH氧化酶复合物(NOX2)利用来生成超氧自由基(O2•−)。为了在血浆膜和吞噬泡中组装活性氧化酶,来自血浆膜和细胞质的多个组分必须结合在一起(见图)。
NADPH +2O2 →NADP++H+ +2O2•−
• 防止吞噬细胞中O2•−的产生(例如,通过先天性遗传缺陷降低NOX2组件的活性或阻止它们的组装)会导致持续和多重感染的综合征,称为慢性肉芽肿病,这表明O2•−的产生对于杀死几种(但并非所有)病原体很重要。
• O2•−如何实现杀死作用尚不完全清楚。大部分O2•−经历歧化反应(表1)以生成过氧化氢(H2O2)。一些病原体会被H2O2杀死,这取决于它们的H2O2去除酶活性以及它们胞内的催化铁离子含量(表1),从而产生细胞毒性OH•。中性粒细胞中的酶髓过氧化物酶也会利用H2O2生成次氯酸(HOCl),这是一种强大的抗菌和抗真菌剂。
H2O2+Cl−+H+ →HOCl+H2O
• 一些活化的吞噬细胞会产生一氧化氮(NO•),它与O2•−反应生成过氧亚硝酸盐(ONOO−)(表1),这有助于杀死病原体。
• B细胞、T细胞和自然杀伤细胞在受到刺激时也会产生O2•−,但其水平低于吞噬细胞。这在免疫应答中起作用,可能也在嵌合抗原受体T细胞治疗(框2)中起作用。ROS,活性氧物种。
二、抗氧化剂的定义和特性
本节描述了抗氧化剂的定义、存在的类型及其作用机制。
2.1抗氧化剂的定义
什么是抗氧化剂?这个问题已经讨论了几十年(详见其他文献)。2022年的一个共识声明得出了两个可能的定义,即: (1)“任何延迟、预防或消除目标分子氧化损伤的物质”或 (2)“一种与氧化剂反应的物质,以调节其与其他目标的反应,从而影响氧化还原依赖的生物信号传导途径和/或氧化损伤”。
第一个定义包括清除氧化损伤分子的系统,而第二个不包括。第二个定义更好地强调了ROS的生理作用,如受抗氧化剂的影响,似乎更全面可取,尽管修复氧化损伤或替换氧化损伤分子,在维持健康方面非常重要。然而,尽管ROS通常作为氧化剂,但它们并不总是如此。例如,O2•−就具有还原性,可以还原三价铁离子,这有助于减少铁离子的细胞毒性(表1):
Fe3+ + O2•− → Fe2+ + O2 (4)
因此,在第二个定义中或许应该用“ROS”取代“氧化剂”才合理。对抗氧化剂这个词的更广泛的定义已经被提出;其中一个将在下面探讨,参见“生活方式作为一种‘抗氧化疗法”。并不存在“最好的”抗氧化剂,不同的抗氧化剂以不同的速率与不同的ROS反应,在不同的细胞、亚细胞和细胞器内特别是在线粒体中(表1)分别发挥作用,并保护不同的分子靶标(表1和表2)。另一个经常使用的术语是“促氧化剂”,它指的是在所研究的反应条件下刺激目标分子氧化损伤的化合物。
2.2 抗氧化剂的类型
抗氧化剂可以在人体内产生(表1和图1),可以从饮食中获得(表2和图1),也可以是合成分子,通常用于治疗人类疾病。前两种类型构成了一个“抗氧化防御网络”,这个术语是由已故的自由基生物学家Lester Packer引入的。ROS具有有用的生理作用,尤其是在信号传导和抵御病原体方面(方框1),但其中一些会损伤生物分子。因此,抗氧化防御网络的功能是在一分钟内(甚至可能是一秒钟)调节ROS水平,以允许有用的作用继续进行,同时最大限度地减少氧化损伤(图1)。这需要对ROS生成和抗氧化防御的精细调控,特别是对过氧化物酶的调控,H2O2是一种主要的信号传导ROS,过氧化物酶是能在生理范围内调节H2O2水平的主要物质(表1)。抗氧化防御水平在个人、组织、细胞类型、同一组织中的同种细胞类型(例如,受到O2浓度变化的影响)、细胞外到细胞内、以及不同亚细胞器官如线粒体之间都存在差异。
另一个考虑因素是性别差异;例如,雌性哺乳动物的某些内源性抗氧化剂水平高于雄性。事实上,有人建议,女性比男性寿命更长的原因可能与抗氧化酶水平较高和体内铁储存量较低有关(由于月经导致),因为铁具有促氧化性质(表1)。然而,经过数十年的研究,ROS和抗氧化剂在决定寿命方面的作用仍然不清楚,因此我在这里不再进一步探讨。
由于某些ROS具有重要生理作用,抗氧化防御网络并不能完全去除它们。因此,生物分子的氧化损伤程度会持续发生,正如通过这种损伤的生物标志物所揭示的那样,并在图1中以轻微的倾斜表示。必须处理氧化损伤的分子——修复氧化DNA对于阻止癌症(框2)和其他疾病的发展成为至关重要,而氧化脂质、RNA和蛋白质通常被破坏并被替换。后者通常通过泛素-蛋白酶体系统和20S蛋白酶体发生。如果这些修复系统的效率降低,就像在衰老和某些疾病如痴呆症中可能发生的那样,氧化损伤水平将增加。蛋白质中的甲硫氨酸残基,多个ROS如HOCl和ONOO−可以将其中的硫氧化为亚砜,通过甲硫氨酸亚砜还原酶酶可以把亚砜重新转化为甲硫氨酸。这种甲硫氨酸氧化和还原的循环可能参与信号传导,甚至可能是消除某些ROS的方法。甲硫氨酸残基清除它们,然后被再生。
2.3、抗氧化活性机制
抗氧化剂的作用机制包括以下几个方面:
(1)催化去除ROS的酶,如超氧化物歧化酶(SOD)等(表1)。
(2)通过结合或以非氧化还原活性形式储存铁离子、铜离子、血红素和含血红素蛋白质,减少氧化剂的可用性。这些金属离子是氧化损伤的强催化剂(表1)。
(3)物理性的ROS“猝灭剂”,例如类胡萝卜素对单线态氧的猝灭作用(表2)。它们从单线态氧中移除多余的能量,并将单线态氧转化回正常氧分子。
(4)“牺牲剂”优先与ROS反应,阻止它们攻击更重要的生物分子。例如谷胱甘肽(GSH)、泛醌、α-生育酚、一些类胡萝卜素(类胡萝卜素既可以猝灭也可以与单线态氧发生化学反应。它们还可以清除其他几种ROS)、抗坏血酸(也称为维生素C)、白蛋白、黏液和神经酰胺(表1和表2)。有时,牺牲剂的氧化形式可以回收为原始化合物,例如通过谷胱甘肽还原酶将氧化型谷胱甘肽(GSSG)还原为谷胱甘肽(表1),通过多种酶将抗坏血酸自由基还原为抗坏血酸,以及通过抗坏血酸或泛醌将α-生育酚自由基还原为α-生育酚(表1)。否则,它们将被破坏并重新合成(如果体内合成),或者从饮食中补充。
(5)亚细胞定位过渡金属离子氧化剂。细胞或组织结构的破坏会加速氧化损伤(尤其是在大脑中),部分原因是金属离子从其正常的受限位置释放到细胞的其他部分。例如,溶酶体中金属蛋白的降解会导致这些器官内高浓度的过渡金属离子(尤其是铁和铜)。溶酶体膜的破裂会释放这些离子,并在细胞的其他部分促进氧化损伤。
(6)生活方式的改变也会产生抗氧化作用(参见“生活方式作为抗氧化‘疗法’”)。
生物体还使用其他策略来减少ROS的产生,有些作者将这些策略归类为抗氧化剂。例如,线粒体中的解偶联蛋白(如UCP1、UCP2和UCP3)通过防止质子动力势过高,从而防止电子从电子传递链泄漏生成O2•−,调节ROS的产生。尽管线粒体产生的一些ROS似乎是偶然的,但它似乎也参与了线粒体向细胞其他部分的氧化还原信号传导。将线粒体电子载体组装成复合物(I、II、III、IV)和超级复合物,通过促进电子从一个载体流向下一个载体(而不是逃逸到O2形成O2•−),从而减少电子泄漏。由于下一个载体的接近,胞内O2浓度也被保持在较低水平,进一步降低O2•−的产生。事实上,一个通用的抗氧化策略是尽量减少暴露于O2,正如其他地方所解释的那样。例如,昆虫似乎通过打开和关闭它们的气孔来维持低但恒定的内部O2水平。人类的血管系统似乎已经进化到为我们的身体提供适量的氧气,既不会太少(冒着由线粒体氧化磷酸化引起的能量生产受损的风险),也不会太多(冒着氧化损伤增加的风险)。此外,一些干细胞可能居住在缺氧的环境中,以保持它们的氧化损伤水平较低,直到氧气被需要时才出现。一些细胞通过改变其膜脂质的成分使其更能抵抗过氧化作用,或者用ROS耐受酶取代ROS敏感酶,例如大肠杆菌中的反丁烯二酸酶C,与其他大肠杆菌反丁烯二酸酶不同,它不会被ROS失活。
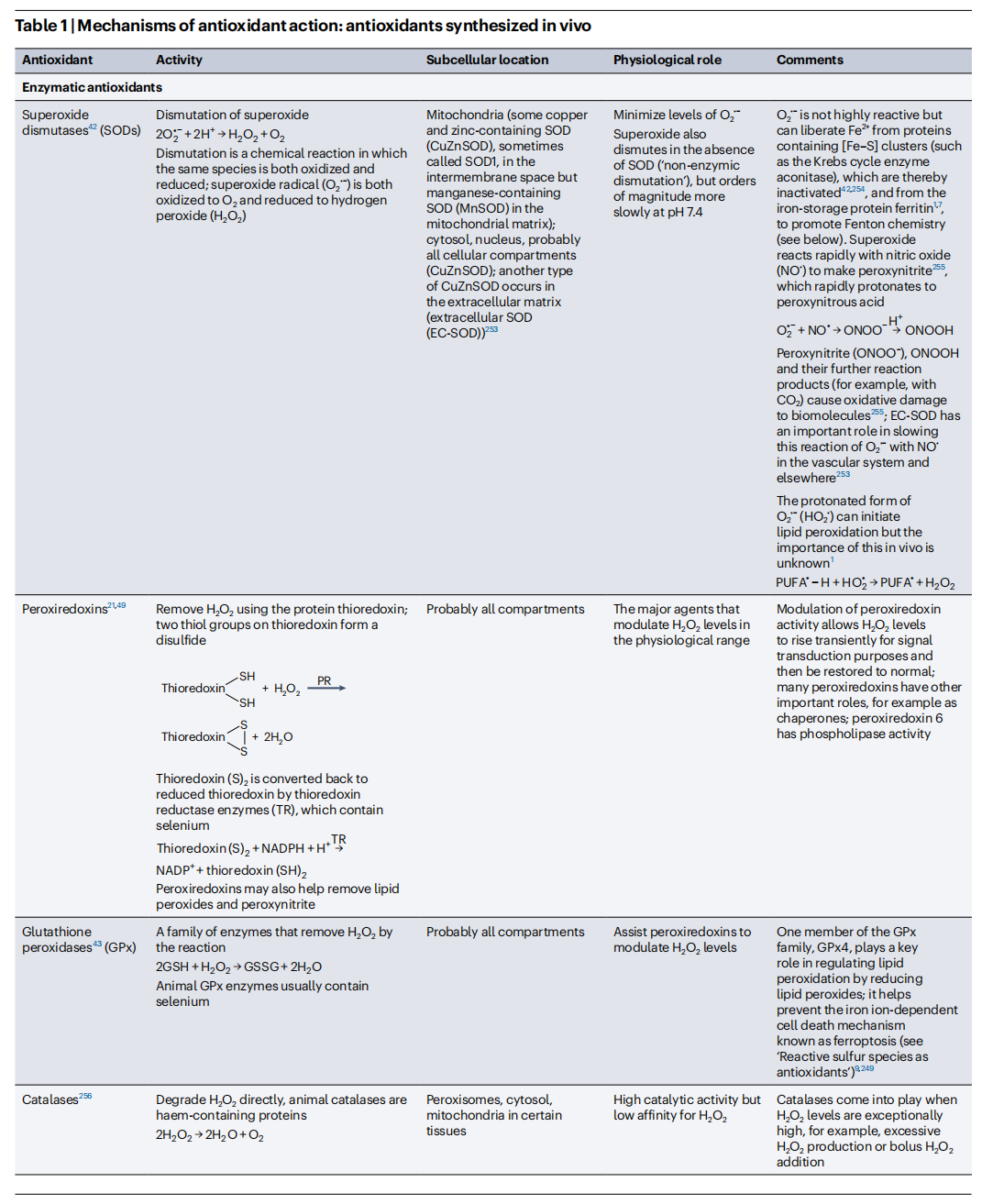
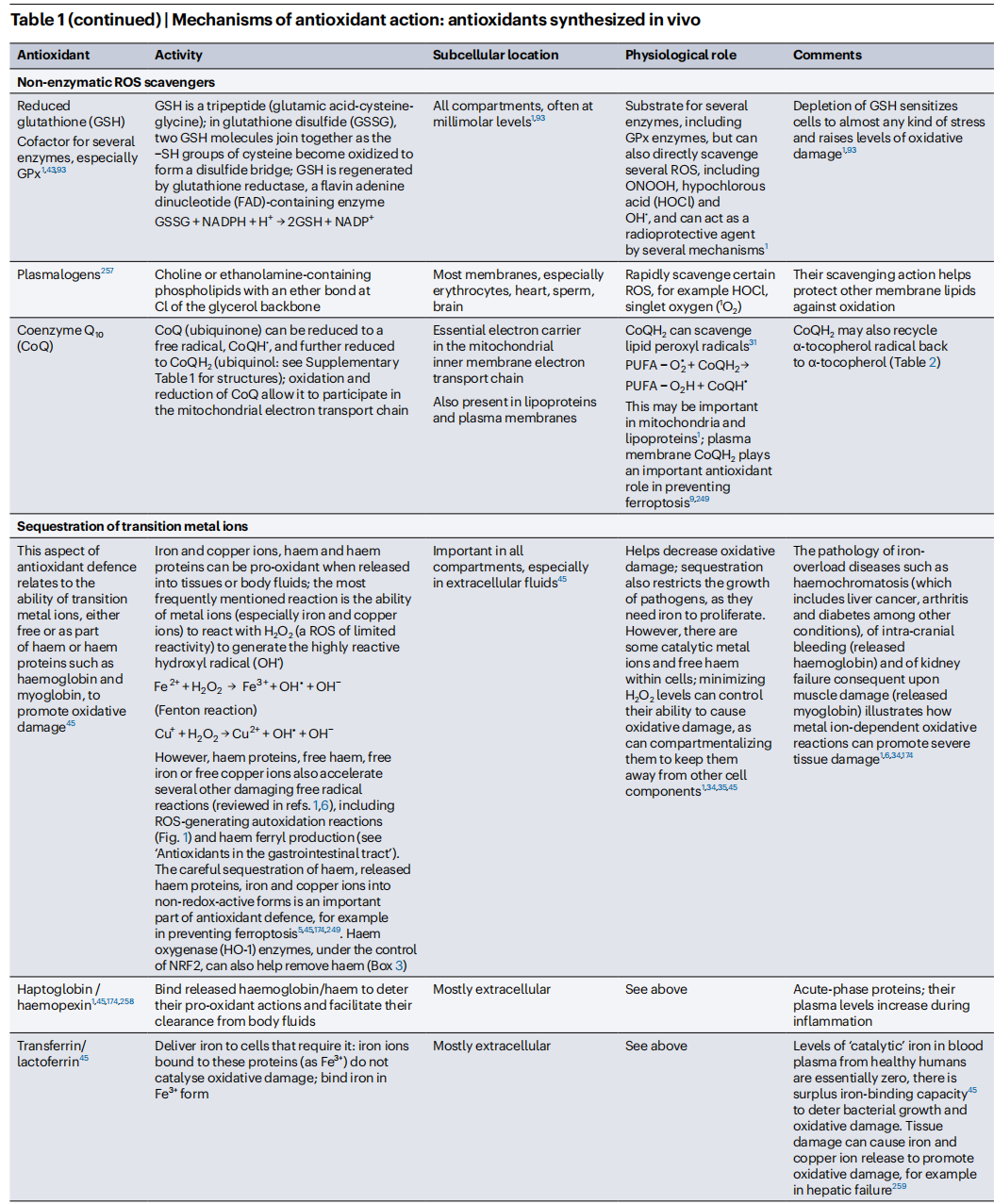

2.4内源性抗氧化剂的产生
我們的抗氧化劑防禦網絡的主要部分是酶,它們催化地去除ROS。表1解釋了它們的作用機制、生理意義和相互關係。每個酶分子處理多個ROS底物的分子。通過檢查酶表達降低(例如通過敲除或siRNA)或增加的生物體的表型,已經充分確定了它們在體內的重要角色。例如,通過對齧齒動物中最重要的去除O2•−的酶(特別是線粒體含錳SOD(MnSOD))進行敲除,會產生嚴重的表型。這說明了即使在較小的水平上,過多的線粒體中O2•−的產生也會造成損害,儘管它在適度水平上具有生理信號傳導作用。
此外,一些在體內產生的特定分子通過存儲过渡金属离子(例如鐵質蛋白質鐵蛋白或血紅素蛋白質)或將其結合為氧化還原無活性形式以允許它們在體內安全運輸(例如鐵運輸蛋白轉鐵蛋白),幫助隔離過渡金屬離子促氧化劑(表1)。其他分子作為“犧牲性抗氧化劑”起作用(見“抗氧化劑的作用機制”),包括白蛋白、血小板和尤其是GSH,它不僅是穀胱甘肽過氧化物酶(GPx)酶的底物,還可以清除多種ROS(例如,高速率清除OH• 、HOCl和ONOOH,但僅以低速率且生物學上不顯著的速度清除O2•−或H2O2)(表1)。與酶不同,當犧牲性抗氧化劑與ROS反應時自身會被消耗,必須被替換补充(例如,氧化白蛋白的蛋白水解及其由肝臟重新合成)或回收利用(例如,谷胱甘肽還原酶將GSSG轉化回GSH)(表1)。
內源性抗氧化劑的活性受到多層次調節的控制,包括基因轉錄水平和後轉譯修飾。它們的水平隨時間而變化,尤其是對於GSH和過氧化氫酶。細胞外液與細胞內環境具有不同的抗氧化劑組成。當生物體暴露於較高水平的ROS時,體內抗氧化劑防禦水平往往會增加(見“增加內源性抗氧化劑水平”)。
2.5 饮食来源的抗氧化剂
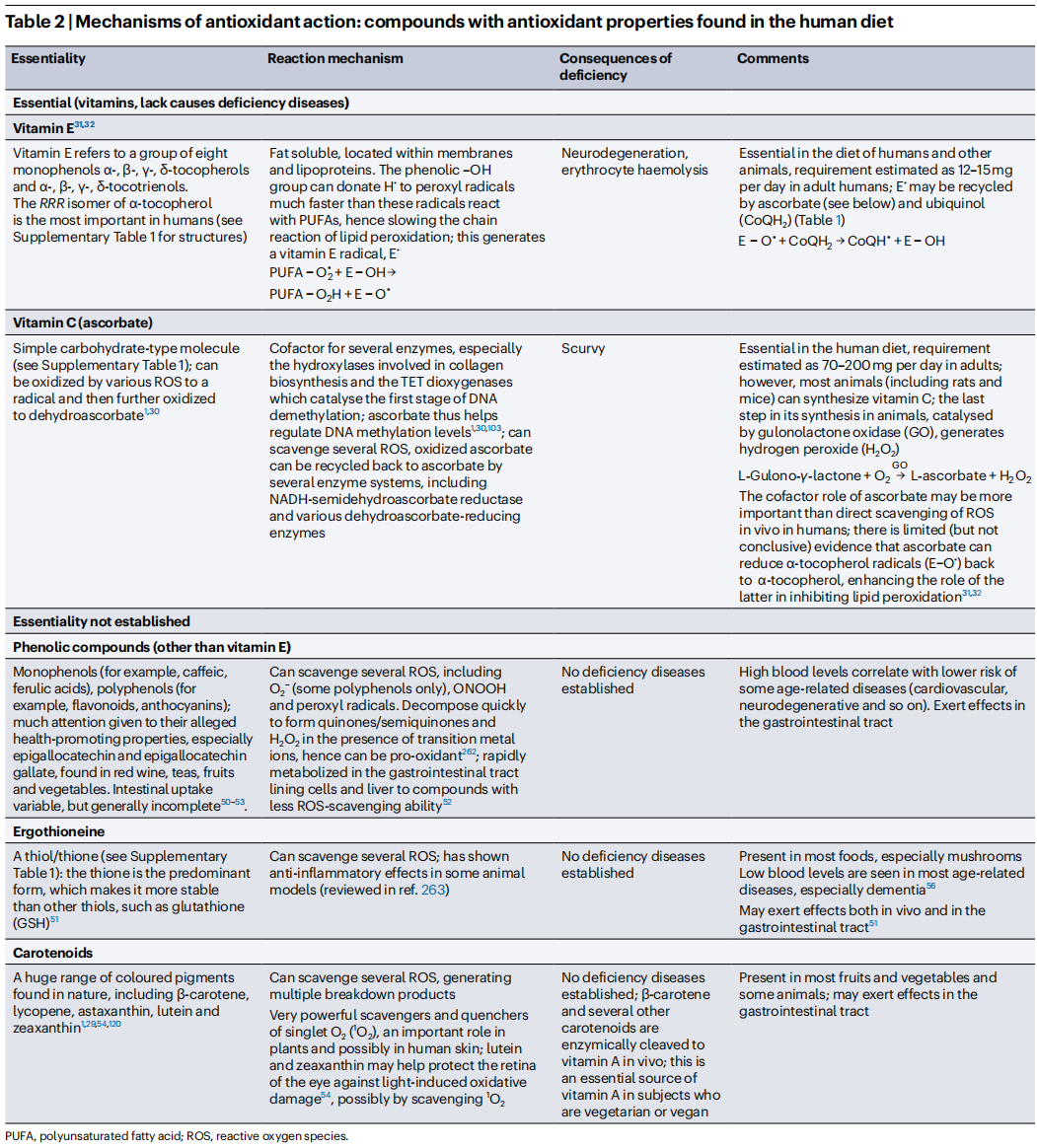
许多在体外具有抗氧化剂性质的饮食分子通常被认为是体内重要的抗氧化剂,包括常被统称为维生素E的8个单酚(4个生育酚和4个生育三烯醇)(表2),其他单酚、抗坏血酸、类胡萝卜素、多酚,如类黄酮和麦角硫因(表2)。人类流行病学研究表明,血液中这些化合物的高浓度与发生氧化损伤导致病理的疾病的风险较低有关,包括心血管疾病、糖尿病、神经退行性疾病、眼部疾病(白内障、黄斑变性)和某些类型的癌症(框2)。抗坏血酸和维生素E,尤其是α-生育酚(表2),对人类是必需的。但不同国家每日需求量不一样,估计为每天60-200毫克和约15毫克。低摄入量的维生素E或抗坏血酸(低于推荐的日常摄入量)与氧化损伤水平的增加有关(其他地方综述),但在大多数人类研究中,高摄入量似乎不会进一步降低氧化损伤水平。然而,含有高水平的维生素E、抗坏血酸、类胡萝卜素如番茄红素或β-胡萝卜素和多酚的“抗氧化健康补充剂”已经变得流行,包括绿茶或红酒提取物,或纯多酚(如表没食子儿茶素没食子酸酯)。它们在维持健康方面的价值尚不确定。
框2 活性氧、抗氧化剂和癌症的关系
A. 抗氧化剂可以预防癌症的发展
ROS的作用
一些活性氧物质(ROS)(OH•,单态氧(1 O2),过氧化自由基,ONOOH和次氯酸(HOCl),但不包括过氧化氢(H2O2)或超氧阴离子自由基(O2•−))可以将DNA碱基氧化为诱变产物,如8-羟基脱氧鸟苷(8OHdG),这可以引发癌症的发展。ROS(尤其是H2O2)可以刺激恶性细胞的增殖和转移。
抗氧化剂的作用 抗氧化酶和谷胱甘肽(GSH)(表1)可以降低ROS水平,保护DNA并降低癌症发病率。P53可以促进这一点(见“增加内源性抗氧化剂水平”)。实验室动物中抗氧化酶的缺失(尤其是超氧化物歧化酶(SOD),过氧化氢酶和谷胱甘肽过氧化物酶(GPx))通常会增加癌症的发病率。饮食中的抗氧化剂可以帮助保护胃肠道免受癌症发展的影响(见“胃肠道中的抗氧化剂”)。
B. 抗氧化剂可能干扰癌症治疗
ROS的作用
高水平的ROS可以在恶性细胞中停止细胞周期或触发凋亡,坏死或铁死亡(见“活性硫物种作为抗氧化剂”)在恶性细胞中。激活p53可以促进这一点(见“增加内源性抗氧化剂水平”)作为一种抗癌机制。许多,如果不是所有的,化疗药物进一步增加ROS的产生,以杀死恶性细胞,就像放射疗法(产生OH•)和光动力疗法(产生1 O2)一样。肿瘤环境中的吞噬细胞(中性粒细胞,巨噬细胞)和淋巴细胞对肿瘤的攻击也可以提高ROS水平(框1)。
抗氧化剂的作用
恶性细胞产生更多的ROS来帮助增殖和转移,因此容易受到额外的ROS通过p53或癌症治疗造成的损害,使ROS水平上升如此之多以至于细胞死亡。恶性肿瘤通常会增加抗氧化剂的水平来保护自己,通常是通过核因子红细胞2相关因子2(NRF2)(框3),它在许多癌症中被激活。在动物模型中,维生素E、抗坏血酸或N-乙酰半胱氨酸(NAC)的给药有时会促进肿瘤的发展,因为它们将ROS水平保持在低于肿瘤细胞停滞/毒性的阈值。静脉注射抗坏血酸已被建议(但尚未确定)是一种抗癌药物,但其作用是促氧化剂(生成H2O2)而不是抗氧化剂。抑制GPx4(表1)以触发铁死亡已被提议作为癌症治疗的一种方法,抑制含铜和锌的SOD(CuZnSOD)或过氧化氢酶也是如此。
C. 抗氧化剂可以辅助癌症治疗
ROS的作用
嵌合抗原受体T细胞疗法是一种癌症治疗方法,其中T细胞在实验室中进行修改以鼓励它们攻击恶性细胞,然后注入患者体内。肿瘤细胞环境通常是促氧化的,这可能会阻碍T细胞疗法,因为这些细胞对氧化损伤敏感(见“饮食抗氧化剂作为治疗药物”和“影响NRF2的饮食化合物”)。这种促氧化状态可能是由于恶性细胞产生的增加的ROS(见上文B部分)以及肿瘤环境中的中性粒细胞和巨噬细胞(框1)引起的。
抗氧化剂的作用
有建议说,选择性地增加嵌合抗原受体T细胞中的抗氧化剂水平可能有益于增加它们对肿瘤细胞环境中的ROS的抵抗力,从而改善它们攻击肿瘤的能力
2.6胃肠道内抗氧化剂
膳食中的抗氧化剂可以在胃肠道中发挥作用,从而影响身体的其他部位,尤其是大脑。在胃内饮食成分和胃液中都存在高水平的抗坏血酸。如果摄入富含水果、蔬菜和谷物的饮食,体内就会出现高水平的类胡萝卜素、生育酚、生育三烯酚、谷胱甘肽、黄酮和其他酚类化合物。所有这些化合物都可以清除ROS并保护胃肠道免受饮食中存在的促氧化剂(如防止可能引发胃肠道癌症发展的DNA损伤)的损害(框2)。例如,人类唾液、许多蔬菜和加工肉类富含亚硝酸盐(NO2−),它与胃酸反应产生HNO2和氮氧化物,这些物质会产生诱变DNA脱氨产物。几种膳食抗氧化剂(例如黄酮类和类胡萝卜素)可以清除这些HNO2衍生物。饮食中也含有过渡金属离子,而某些饮料(尤其是咖啡)富含过氧化氢,它们会与这些离子反应生成OH•(表1)。这是由于抗坏血酸的作用(在这种情况下,抗坏血酸作为促氧化剂),它将Fe3+离子还原为Fe2+,将Cu2+离子还原为Cu+,从而进一步生成OH•。然而,这种OH•可以被膳食抗氧化剂以及胃肠道内壁的黏液层清除。此外,黏液和一些多酚类物质可以结合Fe2+和Cu2+,降低这些离子生成OH•的能力。肉中含有血红蛋白和肌红蛋白等血红素蛋白质(即使是一些素食汉堡也含有植物来源的血红素蛋白——植物血红蛋白)。所有这些血红素蛋白质都可以作为促氧化剂(表1)。当它们与过氧化物反应时,会产生高度活性的高价铁(铁IV)物种,这些物种可以氧化蛋白质和脂质。幸运的是,抗坏血酸、多酚类物质和谷胱甘肽可以清除高价铁物种。食物通常含有细胞毒性脂质氧化产物(脂质过氧化物、异前列腺素、醛等)。饮食中的脂质、蛋白质和DNA可以在胃肠道中进一步氧化,由金属离子和血红素蛋白质催化,生成更多对细胞有毒的物质。这都可以通过膳食抗氧化剂来阻止。引用Gorelik等人的话说:“当含有促氧化剂血红素蛋白质的红肉遇到具有抗氧化剂作用的类黄酮类物质的红酒”。一些ROS(O2•−和H2O2)也是由胃肠道中的NADPH氧化酶和相关的双氧化酶(DUOX2)酶产生的,以帮助协调那里的免疫细胞的功能并阻止病原菌的生长。来自饮食的抗氧化剂/促氧化剂可以以几种方式与这些ROS相互作用。
在十二指肠和小肠中,抗坏血酸、谷胱甘肽和所有形式的维生素E(表2)大部分被吸收,肝脏在体内保留某些α-生育酚异构体,但通过胆汁将其他生育酚的某些异构体排回胃肠道。相比之下,类胡萝卜素和多酚类的吸收通常远未完成。因此,结肠中含有一些抗坏血酸和谷胱甘肽,但还有大量的未吸收的黄酮类化合物、其他酚类化合物、类胡萝卜素以及β-、γ-和δ-生育酚(如果饮食中富含它们)。这些化合物会在结肠微生物群落中发生广泛的代谢,特别是多酚类化合物,以生成其他分子(包括尿石素、雌马酚、戊酸和4-羟基苯乙酸等单酚类物质),这些分子被人体吸收后似乎能改善大脑和血管系统的功能。多酚类化合物和类胡萝卜素还会影响肠道菌群的组成,并对健康产生潜在的积极影响。酚类和其他抗氧化剂的作用可能会对外周结肠/直肠上皮产生保护作用,例如抑制脂氧合酶、环氧合酶2、血管生成和脂质过氧化等。多酚类化合物和类胡萝卜素以及几种其他饮食成分的降解产物可以激活NRF2系统(框3),增加胃肠道上皮细胞中的抗氧化剂水平。谷胱甘肽会被几种肠道细菌大量吸收和代谢,这可能会与人类肠粘膜谷胱甘肽转运蛋白OCTN1竞争谷胱甘肽的摄取。这种摄取对细菌(以及宿主)的重要性尚不确定,但它可能有助于保护细菌免受胃肠道中的ROS的影响。还有迹象表明谷胱甘肽可以预防结肠癌的发生。胃肠道还可能向身体提供抗氧化剂活性的反应性硫物质(见“反应性硫物质作为抗氧化剂”)。
框3 Keap1–NRF2–ARE 系统 Keap1-NRF2-ARE通路是对抗氧化应激的重要防御机制。NRF2是一种广泛表达在动物组织中的转录因子。大多数NRF2通过与keap1蛋白质结合而被保持在无活性状态,主要位于细胞质中,这促进了NRF2被蛋白酶体快速降解。许多外来化合物(“异生物质”)会引发氧化应激,并且是或可以形成亲电剂——能够与蛋白质、DNA或脂质的高电子密度位点发生反应的试剂(如不饱和醛类,脂质过氧化过程中形成的4-羟基壬烯醛)。增加的ROS产生激活了磷酸化NRF2的蛋白激酶,导致其与keap1分离。然后,NRF2进入细胞核并与特殊的基因序列ARE结合,启动基因转录。此外,keap1富含半胱氨酸残基,它们的直接修饰也可以通过ROS和亲电剂来阻止NRF2的蛋白酶降解,导致其积累并结合到ARE上。NRF2控制超过250个编码参与异生物质代谢和抗氧化防御的酶的基因的表达,包括GSH合成、NADPH的产生(对抗氧化防御系统所需的(图1))、金属离子储存蛋白(例如铁蛋白),这些蛋白能最小化氧化还原活性过渡金属水平、GPx和血红素氧合酶-1(HO-1;一种具有细胞保护性质的酶,通过降解促氧化剂血红素来降低氧化应激)(表1)。它降解血红素为胆绿素和一氧化碳,但也释放铁离子,这些铁离子通过同时升高铁蛋白水平来安全储存,以减轻其促氧化效应。总体而言,提高游离NRF2的水平会增加广泛的内源性抗氧化防御。例如,在嵌合抗原受体T细胞和自然杀伤细胞中激活NRF2可能增强它们攻击恶性肿瘤的能力(框2,C部分)。另一方面,恶性细胞往往因突变或致癌信号而表现出NRF2活性升高,这可为癌细胞生存、生长和转移提供优势(框2)。 |
2.7作为药物的合成抗氧化剂
为了治疗疾病,已经开发了许多具有体外抗氧化活性的合成化合物。它们包括重组SOD和过氧化氢酶酶、氮氧自由基/氮氧化物、铁离子螯合剂、氘化的PUFAs(通过将氘替代PUFAs中的C−H键中的氢原子使其更难被提取出来,从而减缓脂质过氧化)、硫醇(包括GSH的前体)以及ROS生成酶抑制剂,如NADPH氧化酶、黄嘌呤氧化酶、单胺氧化酶或产生HOCl的酶髓过氧化物酶(图1和框1)。
针对疾病病理学的其他机制开发的药物往往被认为在体内也能发挥抗氧化作用(四环素、水杨酸、普罗布考、丙泊酚、吡哆醇胺和曲格列酮等药物被建议具有这种作用)。支持这些建议的证据有限,因此我不再进一步讨论它们。
2.8 建立体内抗氧化能力
在评估声称具有抗氧化特性的合成或膳食化合物在体内也具有抗氧化作用的说法时,首先值得询问的问题是,该化合物在体内可达到的水平上能否与具有生物学意义的活性氧反应得足够快。存在几种方法来确定反应速率常数(在其他地方进行了综述)。因此,如果该化合物在体外需要毫摩尔水平才能有效地清除活性氧,但在体内只能以微摩尔水平存在,那么它可能产生的效果不能归因于直接的抗氧化活性。一个例子是硫化氢(见“作为抗氧化剂的反应性硫物种”)。另一个例子是褪黑激素。多篇论文描述了褪黑激素在体外清除活性氧的特性,但在正常体内褪黑激素水平下是不可行的。相比之下,人体体液和组织中抗坏血酸的含量及其与某些活性氧的反应速率,可以使它能够在体内清除多种活性氧。
然而,抗坏血酸或其他任何化合物似乎能够在体内清除某些活性氧并不意味着它实际上可以(例如,它可能不在适当的位置),或者清除是有益的(例如,反应可能产生有毒的终产物,如损伤性自由基)。关键问题是该化合物是否能够减少体内的氧化损伤。这通过使用氧化损伤的生物标志物来评估,这些生物标志物通常在血液、尿液和有时在组织活检中测量。2022年的共识声明确定了目前被认为是DNA、RNA、蛋白质和脂质氧化损伤的良好生物标志物,因此我不在这里进一步描述它们。报道对氧化损伤生物标志物的影响的研究表明,推荐膳食水平的α-生育酚可以防止体内脂质过氧化,这可能是其最重要(如果不是唯一)的生物学作用,尽管还提出了其他作用。相比之下,即使长期高剂量服用,抗坏血酸(在推荐量以上)、多酚或麦角硫因在体内发挥全身抗氧化作用的证据也很薄弱(减少氧化损伤的生物标志物)。抗坏血酸作为几种酶的辅因子的成熟作用在体内可能比ROS清除更重要(表2)。事实上,当在细胞培养中添加到细胞中或输注到癌症患者体内时(方框2),胃肠道中的抗坏血酸可以通过减少Fe3+和/或产生H2O2而成为促氧化剂。
使用生物标志物有一些注意事项。在人类中,它们只能在体液或少数组织的活组织检查中测量,而在大多数组织/器官中无法测量。因此,在体内特定部位发挥抗氧化作用的物质可能不会导致全身生物标志物水平发生可检测的变化。例如,抗坏血酸可以在呼吸道清除吸入的氧化性空气污染物(如臭氧和自由基二氧化氮(NO2•)),而血浆或尿液中的生物标志物不一定能检测到这种效果。组织损伤可通过上调麦角硫因转运蛋白,导致麦角硫因在损伤部位积聚,可能是为了尽量减少氧化损伤。这种效应同样不太可能通过全身氧化损伤生物标志物检测出来。在胃肠道中发挥的抗氧化或促氧化作用也可能无法通过血液或尿液中测量的氧化损伤生物标志物检测到。
2.9 总抗氧化能力
在测量化合物清除ROS的速度时,最好使用体内存在的ROS。可在实验室中生成超氧自由基、过氧化氢、次氯酸、过氧亚硝酸盐和羟基自由基,以测量它们与假定抗氧化剂的反应速率常数(见其他文献)。然而,已开发出多种用于食品或体液的检测系统,声称测量其“总抗氧化能力”(TAC),即测量其清除合成自由基(如有机过氧自由基、ABTS•+、galvinoxyl或DPPH)的能力。例如,使用这些方法测量健康和疾病状态下体液中TAC的变化,或者比较不同水果、蔬菜和饮料(葡萄酒、茶、甚至啤酒)之间的TAC。人们往往(经常是令人怀疑的)认为TAC更高意味着更有益于健康的食品和饮料。然而,体液或食品中抗氧化防御酶的贡献并不能通过TAC检测来捕捉。这些检测通常会检测到体内抗氧化作用不确定的分子(例如尿酸),而且体外抗氧化作用往往不能转化为体内作用,正如已经讨论过的。更糟糕的是,不同的方法可能会产生不同的结果。此外,一些分子(如己烯雌酚和药用植物黄牛木提取物)在这种检测中表现出抗氧化作用,但最终证明是有毒的。无论如何,清除合成自由基的能力不能等同于清除体内发生的ROS。因此,我和其他人(包括美国农业部)不建议使用这种方法。然而,TAC检测在筛选材料(例如植物提取物、新药)方面是有价值的,可以用于鉴定潜在的新型抗氧化剂作为治疗剂、食品防腐剂甚至化妆品。
三、用抗氧化剂预防和治疗人类疾病
本节检视了抗氧化剂在疾病治疗中的成功与失败,以及背后的原因。
3.1ROS在人类健康和疾病中的作用
使用抗氧化剂,无论是合成的还是天然的,来预防或治疗疾病存在一个问题,那就是ROS在疾病中的作用复杂且与它们的有益作用相交。例如,框2展示了ROS和抗氧化剂在癌症中的双方面作用。冒着过度简化的风险,可以总结如下:抗氧化防御有助于保护你不患癌症;然而,用抗氧化剂治疗患有癌症的患者可能不仅无益,甚至可能加剧疾病(框2,B部分)。实际上,旨在抑制而不是促进肿瘤中抗氧化剂的方法——例如,通过防止NRF2激活(框3),耗尽GSH或抑制酶类如GPx4、SOD1或过氧化物酶——已被建议作为癌症的疗法(框2,B部分)。使用抗氧化剂治疗神经退行性疾病是有潜力的,但应该记住ROS(包括NO•)在大脑中有其有用的作用,类似于所有器官,必须仔细平衡O2水平、ROS产生、抗氧化防御和清除氧化损伤分子(图1)。大脑ROS参与血压调节、疼痛感知、学习和记忆,以及可能在海马体中的神经发生。事实上,由于慢性肉芽肿病(框1)导致ROS生成受损的患者或慢性肉芽肿病的动物模型显示出涉及突触可塑性缺陷的记忆障碍。同样,尽管过量的ROS产生在心肌梗死期间会导致心脏损伤,但ROS在正常心脏功能中具有重要的生理作用,特别是在调节Ca2+信号传导方面。
3.2膳食抗氧化剂作为治疗剂
已经进行了许多临床试验,使用高剂量的膳食抗氧化剂,最常见的是抗坏血酸、维生素E(通常是α-生育酚)和β-胡萝卜素,有时还有其他类胡萝卜素如番茄红素、虾青素或叶黄素来尝试延迟或减缓诸如痴呆症、白内障、黄斑变性、自身免疫性疾病、败血症、癌症、糖尿病和心血管疾病等疾病的发作或进展。结果令人失望,大多研究是负面的。例如,早期研究表明高剂量的α-生育酚适度减缓了痴呆症的进展,但后来的研究并未证实这一点,甚至表明有害效应。然而,对于心血管疾病,尽管结果通常不太令人满意,但一组糖尿病患者中的一个亚组可能从α-生育酚补充中获益更多。Hp2–2型血红蛋白是一种抗氧化剂;它结合血红蛋白,减少其促氧化活性并帮助清除它。Hp2–2型血红蛋白的效果较差,其较差的抗氧化活性可能与α-生育酚在体内减少由血红蛋白刺激的脂质过氧化的效果有关。关于有癌症风险的人是否应该摄入抗氧化补充剂存在广泛的争论(作者个人不建议补充),但除了吸烟者应避免β-胡萝卜素补充剂因为它们可能加速肺癌的发展之外,没有明确的答案是清楚的。由于p53的激活和许多癌症治疗方法通过增加氧化损伤来帮助杀死恶性肿瘤细胞(框2),有理由保持谨慎。事实上,动物研究揭示抗坏血酸、维生素E或N-乙酰半胱氨酸(NAC)有时会加速癌症进程。
框4 维生素E等抗氧化剂临床试验无效的可能原因
1. 氧化损伤在疾病病理中并不重要。 2. 补充剂并未增加组织/器官的抗氧化剂水平;例如,补充α-生育酚可以进入大脑,但尚不清楚补充剂如何提高人脑水平。如果饮食充足,抗坏血酸补充剂似乎不会提高大脑水平。大脑中的多酚和类胡萝卜素水平太低,无法发挥直接的抗氧化活性。 3. 抗氧化剂进入了组织/器官,但未能到达氧化损伤的部位。 4. 抗氧化剂到达了正确的位置,但未能减少氧化损伤。例如,维生素E抑制脂质过氧化,但可能无法防止阿尔茨海默病中观察到的氧化DNA、RNA和蛋白质损伤的增加。 5. 活性氧物质(ROS)具有一些重要的生理功能,可能会受到干扰。 6. 试验研究的是疾病的进展而不是疾病的发生(例如,给已经处于肺癌高风险的重度吸烟者服用抗氧化剂,这太晚了,无法有效)。 7. 试验使用了过高的剂量;体外研究表明,某些抗氧化剂的高剂量,包括抗坏血酸和维生素E,可能是促氧化剂。 8. 试验使用了高剂量的单一药物,这可能影响其他可能具有重要代谢作用的药物的摄取/分布(例如,高剂量的α-生育酚可以降低体内其他生育酚的水平,高剂量的β-胡萝卜素可以降低其他类胡萝卜素的摄取)。 9. 抗氧化剂的给予时间太晚,在氧化损伤已经发生之后;例如,这可能是许多抗氧化剂无法改善中风患者预后的原因。 |
3.3 抗氧化剂无效的原因
为什么结果如此令人失望?盒子4列出了可能的解释。一个显而易见的原因是,如果氧化损伤在疾病病理学中不重要,抗氧化剂就不会起作用。历史表明,每当发现潜在的组织损伤新介质时,例如过量的NO•、白三烯或细胞因子如白细胞介素或TNF,许多科学家都会急忙测量它们在他们‘喜欢’的疾病中的含量,发现它们升高,并得出结论认为这种介质在疾病病理学中很重要。探索ROS在疾病病理学中的作用在1970年代(继SOD酶发现之后)成为一个热门话题,并且遵循相同的模式:ROS被声称在200多种疾病中都很重要,范围从HIV到囊性纤维化甚至男性型秃顶。然而,由疾病(或其他机制如创伤、过度运动、缺血、热伤或冷伤)本身引起的组织损伤会提高氧化损伤水平。解释这一现象的机制包括招募产生ROS的吞噬细胞到受伤组织(盒子1),激活促进氧化损伤的酶(例如,磷脂酶、钙蛋白酶、脂氧合酶、黄嘌呤氧化酶),释放促进氧化的过渡金属离子和血红蛋白(表1),稀释抗氧化剂,破坏电子载体在电子传递链中的组织(导致更多的电子泄漏形成O2•−)以及通过诱导型一氧化氮合酶(iNOS)酶增加NO•的产生,常常导致ONOO−的增加(表1)。因此,证明氧化损伤增加并不等同于证明它对疾病有贡献,这就像检测到更多的NO•或TNF一样(两者在某些疾病中很重要,但在其他疾病中则不是)。由于组织损伤导致的ROS产生增加可能会进一步损害组织(原则上,抗氧化剂可能会有所帮助;受到盒子4中列出的警告的影响),或者额外的ROS可能不会有所贡献(抗氧化剂将没有效果)。然而,ROS有时可以触发内源性抗氧化剂水平的增加(参见“增加内源性抗氧化剂水平”)和/或其他防御措施(如热休克蛋白),以保护受损组织。如果发生这种情况,清除ROS可能会恶化病理过程。这是小剂量毒性激活效应的一个例子,指的是低至中等压力的保护作用,以防止随后更大的压力。例如,动物心脏短暂缺血-再灌注产生OH•,当心脏重新氧合时会损害收缩功能。清除ROS改善了收缩功能,但也阻止了心脏反复短暂缺血期预适应。在一些关节炎和其他自身免疫疾病的动物模型中,减少吞噬细胞产生的ROS使疾病恶化,因为ROS不仅损害关节(负面效应),而且还氧化性地损害加剧疾病的淋巴细胞,抑制它们的行动,这也与癌症治疗有关(盒子2,部分C)和二甲基富马酸(DMF)的治疗作用(参见“影响NRF2的合成化合物”)。这些ROS的积极和消极效应对人类的意义由慢性肉芽肿病(盒子1)说明。患者因ROS在杀灭病原体方面很重要而遭受严重感染。然而,他们也遭受慢性炎症,因为ROS有助于调节炎症。因此,真正有效的抗氧化疗法可能会导致副作用,例如增加感染风险和破坏依赖ROS的信号转导。另一个与人类高度相关的例子是运动。适度运动众所周知可以促进健康。在收缩的骨骼肌中产生ROS(O2•−、H2O2、NO•和OH•),太多会导致肌肉损伤(过度运动就是这样),但适度运动触发适应性反应,包括抗氧化防御酶的增加,允许后续更大的肌肉活动而不损伤。几篇论文声称用维生素E或抗坏血酸补充人体会削弱这些适应性反应,但其他人并没有确认这一点。当然,如果这些补充剂未能降低体内氧化损伤水平(参见“具有抗氧化特性的饮食衍生物”),预测不会有任何效果。然而,似乎有一个共识,即摄入抗氧化补充剂的人在良好的饮食下并不能改善运动表现。
3.4 活性氧和抗氧化剂在痴呆中的作用
尽管有上述的警示,但有充分的证据表明ROS在几种疾病的病理过程中起着重要作用,包括辐射损伤、铁过载(表1) 、 α-生育酚耗竭、白内障和黄斑变性、高血压、糖尿病、心血管疾病、某些癌症(框2)和神经退行性疾病,特别是痴呆。大脑容易受到氧化损伤,原因有多个。但是,我们如何证明ROS在导致或加重这些疾病中的关键作用呢?必须满足以下几个标准:i. ROS (或由其引起的氧化损伤)必须在损伤部位可检测到。由于难以定量地捕获ROS,因此通常测量氧化损伤。这是合乎逻辑的,因为导致疾病的是氧化损伤而不是产生的总ROS量(其中一些是有用的)。ii. 组织损伤的时间过程与氧化损伤的形成时间过程一致,先于或伴随其后。iii. 将ROS直接应用于相关时间过程(见标准ii )的组织,以类似于体内发现的速度/浓度,应再现组织损伤和氧化损伤。iv. 清除ROS或抑制其形成应该减少组织损伤,程度与抑制氧化损伤的程度相对应。让我们将这些标准应用于痴呆症,特别是阿尔茨海默病。大量证据表明受影响的大脑区域中RNA、 DNA、脂质和蛋白质的氧化损伤水平升高。这种上升发生在疾病过程的早期,无论是人类还是实验动物,都发生在认知开始受损且未完全痴呆时。增加的氧化损伤既来自多种机制(包括β-淀粉样蛋白产生ROS和巨噬细胞的不适当激活)导致的ROS产量增加,也来自受损分子(尤其是氧化蛋白)清除受损。因此,满足了标准i和ii 。标准iv已在动物模型中得到解决,显示β-淀粉样蛋白诱导的氧化应激导致脑部病变,而给予的抗氧化剂,包括α-生育酚和麦角硫因,减缓了疾病的进展。不幸的是,由于在框4中探讨的原因,α-生育酚在人类中效果不佳。鉴于老年人群中痴呆症发病率的增加,开发能够穿过血脑屏障并减少关键分子靶点的氧化损伤的抗氧化剂(可能麦角硫因就是其中之一)值得紧急关注。即使这些化合物在临床上成功,也必须研究它们是否作为抗氧化剂起作用和/或其他机制。
四、人工合成抗氧化剂
本节描述了为治疗人类疾病而开发的合成抗氧化剂,以及它们的成功和失败。
4.1合成抗氧化剂简介
许多具有抗氧化特性的合成物质已经进入临床实验阶段。已经进行了髓过氧化物酶抑制剂、GSH前体、NADPH氧化酶抑制剂、“线粒体靶向抗氧化剂”、氘化脂肪酸、铁离子螯合剂“SOD模拟物”(小分子被认为能模仿SOD活性,尽管它们并不是特异性的O2•−清除剂)以及血红素结合蛋白血红素氧解酶(表1)等的临床试验。当然,关键问题是它们是否具有治疗效果。一些试验未能显示出治疗效果,有些试验表明有益处但需要更多数据(例如与mitoQ相关的研究,mitoQ是一种线粒体靶向形式的辅酶Q10 (CoQ)),还有许多其他试验仍在进行中。即使合成抗氧化剂有效,下一个问题是它们是通过减少氧化损伤(标准iv,见‘ROS和抗氧化剂在痴呆症中的作用’)还是通过其他机制起作用。让我们就三种在临床上证明有用的合成抗氧化剂,即依布硒ebselen(2-苯基-1,2-苯并异硒唑-3(2H)-酮)、衣达拉奉edaravone和NAC来讨论这个问题。
4.2依布硒
依布硒是一种酶模拟物,最初是为了模拟GPx(表1)在还原过氧化物方面的作用而开发的。不久后,人们发现它具有额外的作用,包括提高NRF2水平、清除过氧亚硝酸盐、抑制Fe2+运输和与蛋白质硫醇基团结合,有时还会抑制酶活性。依布硒的临床试验(大多数来自日本的研究)表明,它可以在一定程度上改善中风患者的结果。一个依布硒类似物ALT-2074正在临床试验中用于糖尿病和冠状动脉疾病。依布硒的治疗效果是由于其抗氧化活性还是由于其他机制尚不确定,因为迄今为止报告的临床试验很少测量氧化损伤的生物标志物。一项确实检测到的试验没有检测到抗氧化效应。
4.3衣达拉奉
衣达拉奉用于治疗中风和肌萎缩侧索硬化症患者,临床上效果适中。衣达拉奉最初是作为OH•等ROS的清除剂开发出来的,但在体内不太可能以这种方式起作用,已经提出了其他作用机制(见‘NRF2系统的激活’)。由于OH•在其形成位置反应,只有能够在至少毫摩尔范围内存在的化合物(这高于体内可达到的衣达拉奉水平)才能与生物分子竞争拦截OH•并防止损害。衣达拉奉的化学结构(见补充表1)并没有表明它为什么与其他芳香化合物相比具有特别高的ROS清除活性的原因。我找不到用衣达拉奉治疗的患者氧化损伤的测量数据,因此其作用机制仍然是一个开放的问题。衣达拉奉与右旋龙脑醇的组合似乎比单独使用衣达拉奉在中风的II期和III期临床试验中更有效。
4.4 N-乙酰半胱氨酸
NAC在临床上用于治疗对乙酰氨基酚中毒和作为粘液溶解剂。此外,数百篇论文,其中许多发表在领先的期刊上,描述了它作为抗氧化‘ROS清除剂’的使用,以‘确立’ROS在不同系统中的作用(在其他地方进行了综述)。实际上,‘NAC’和‘抗氧化剂’似乎是文献中的互换词。这些论文中的许多描述了保护效应,但很少有具体描述NAC的分子靶点和作用机制;它是通过清除ROS、提供半胱氨酸以提高GSH水平还是通过其他机制起作用?很少有研究提供证据表明NAC降低了氧化损伤。事实上,在一些人类研究中它并没有这样做。NAC在某些动物模型中加剧了癌症的发展。实际上,NAC只是对常见的ROS(H2O2, O2•−)的一个差劲清除剂,与大多数硫醇类似,其主要抗氧化作用可能在于通过提供半胱氨酸来维持细胞GSH水平。这可能解释了它对对乙酰氨基酚毒性的保护作用,以及讽刺的是,它在动物中促进癌症发展的作用,通过激活p53、吞噬细胞来源的ROS、光动力疗法、放疗或化疗使肿瘤更耐受攻击(框2部分B)。NAC的作用机制不仅仅是作为ROS清除剂或GSH的前体;它可能干扰TNF诱导的信号传导,通过还原二硫键改变细胞表面蛋白,与脂质过氧化的醛末端产物如羟基壬烯酸反应,并发挥直接的抗菌作用。NAC还可以产生硫化氢(H2S),一种越来越多地被认为是扮演重要代谢角色的分子。因此,除非氧化损伤成比例地减少(标准iv),否则不应得出通过NAC抑制生物学现象证明了ROS的作用的结论。
五、提高内源性抗氧化水平
由于抗氧化酶及其辅因子(例如,GSH)在最小化氧化损伤方面尤其重要(表1和图1),另一种抗氧化疗法是使用能够增加体内它们活性的试剂。
5.1调节内源性抗氧化剂活性的机制
体内有多种系统调节抗氧化剂水平,它们相互影响彼此的功能。例如,NF-κB响应压力增加多种基因的转录。一个后果是iNOS水平增加,从而产生更多的NO•和ONOO−。NF-κB在大多数(如果不是所有)炎症性疾病中被激活,导致细胞因子水平增加(其中一些,如TNF,促进ROS的产生)。NF-κB的激活总体上增加了ROS的产生,但也增加了某些急性期蛋白的水平(即动物对感染和炎症通常呈血浆水平增加或减少的蛋白质);一些急性期蛋白具有抗氧化特性(表1)。MnSOD水平也增加,可能是为了确保线粒体O2•−水平不会过高,否则可能会灾难性地发生。AP-1(激活蛋白1)是一种转录因子家族,也参与应激反应,受氧化还原调控,可以增加某些抗氧化剂的水平,如GSH、过氧化氢酶和含铜和锌的SOD(CuZnSOD)。AP-1与主要调节抗氧化剂水平的通路之间可能存在正负交叉通讯,由NRF2介导(见下一节)。p53蛋白由p53肿瘤抑制基因编码,与ROS之间存在复杂的关系。正常的低p53活性有助于防止癌症的发展,部分原因是通过帮助维持GSH、GPx和SOD等抗氧化防御水平(框2,A部分)。恶性肿瘤中的p53进一步激活可以将其转变为促氧化剂模式,增加编码增强ROS产生的蛋白质基因的转录,如脯氨酸氧化酶(一种在将脯氨酸转化为吡咯啉-5-羧酸时产生H2O2的酶复合物),并降低NADPH的产生(几种抗氧化酶所需的辅因子;图1)和GSH水平,目的可能是促进肿瘤细胞死亡。更复杂的是,ROS有时可以激活p53功能,而过多的ROS则可能抑制它。广泛分布在组织中的叉头框O(FOXO)转录因子有助于调节代谢、抗应激和细胞死亡。它们可以增加MnSOD、过氧化氢酶、GPx、铜蓝蛋白、过氧化物酶和20S蛋白酶体的表达。FOXOs本身受到其–SH残基氧化的氧化还原调控。过氧化物酶体增殖物激活受体γ共激活因子PGC-1α有助于控制线粒体的生物发生和功能,包括响应运动增加MnSOD、过氧化物酶和硫氧还蛋白还原酶的表达,尤其是在肌肉中。它的作用与FOXO蛋白密切相关。此外,包括GPx、过氧化氢酶以及尤其是过氧化物酶在内的抗氧化防御酶的活性受到翻译后修饰的影响。例如,MnSOD赖氨酸残基上的乙酰化降低了这种酶的O2•−清除活性,而SIRT酶的去乙酰化作用则增加了它的活性。因此,激活线粒体SIRT酶的试剂可以增加MnSOD活性并调节线粒体O2•−水平。SIRT酶激动剂已被证明可以延长模型生物的寿命,并且一些已被推广为补充剂,特别是作为SIRT酶激动剂的饮食酚类化合物白藜芦醇(存在于葡萄、其他水果、葡萄汁和红酒中)。然而,它在人类中的生物利用度很低,并且用它进行的临床试验在治疗疾病方面给出了可变(有些有希望,有些负面)但通常不确定的结果。
5.2 激活NRF2系统
描述在框3中的NRF2通路是在体内控制抗氧化防御最重要的系统。事实上,已经提出NRF2信号传导的进化对于允许海洋脊椎动物适应陆地生活至关重要,因为它们需要耐受更高的大气O2水平和阳光暴露引起的更大ROS产生。NRF2与PGC-1α、FOXOs、p53和NF-κB之间存在广泛的相互作用。例如,NF-κB的激活可以减少NRF2的作用,反之亦然,减少的NRF2可以增强NF-κB诱导的炎症。因此,一个生物体对ROS的增加抗氧化活性涉及影响基因转录和翻译后修饰的多个途径,尽管NRF2起着主要作用。增加NRF2依赖性基因转录甚至可能被视为氧化应激的标志物,尽管其他机制也可能导致它(框3)。阿尔茨海默病患者脑组织核中NRF2的水平降低,这导致了该疾病中观察到的增加氧化损伤。与此一致的是,使用萝卜硫素(见“影响NRF2的饮食化合物”)增加小鼠阿尔茨海默病模型中的NRF2水平减少了氧化损伤和淀粉样物质积累并增加了认知功能。依达拉奉可以激活NRF2通路,原则上这可以更好地解释其治疗效果而不是仅仅清除ROS。据报道还有Ebselen和ergothioneine也能增加NRF2的水平。然而,对于这些化合物中没有一个有足够的证据表明它们能降低体内氧化损伤水平(见“Ebselen”和“Edaravone”)。
5.3影响NRF2的饮食化合物
几种饮食化合物在细胞培养中增加NRF2依赖性基因转录并且在动物中以高剂量给予时也是如此;这些包括姜黄素(存在于姜黄中)、十字花科蔬菜中的olitipraz、西兰花中的sulforaphane和大蒜中的allicin。这些化合物与Kelch样ECH相关蛋白1(keap1)中的–SH基团结合以使其失活。至于在通常的饮食水平下是否有足够的这些化合物被吸收以影响体内的NRF2活性尚不确定;上述化合物吸收不良且迅速代谢成不能激活NRF2的产物。然而,它们可能影响胃肠道上皮细胞中的NRF2,有助于保护它们免受饮食促氧化剂的影响(见“胃肠道中的抗氧化剂”)。已经在临床试验中测试了高剂量的sulforaphane、姜黄素、olitipraz、姜黄提取物和西兰花用于治疗多种疾病(包括癌症、糖尿病、肝损伤和蛛网膜下腔出血):它们的有效性尚不清楚。
5.4合成化合物影响NRF2
一个主要的临床成功故事是二甲基呋喃甲酰胺(DMF),BG12,被批准为复发性多发性硬化症的首选治疗方法。它通过与其巯基反应来失活keap1,从而提高NRF2的水平。
然而,二甲基富马酸(DMF)与硫醇基团的其他反应能力(例如在淋巴细胞上)可能会导致治疗的副作用,并可能有助于其治疗效果(例如通过减少多发性硬化症中淋巴细胞造成的损伤)。患有多发性硬化症的患者神经系统病变和血浆中的氧化损伤水平增加,但我未能找到发表的文章表明DMF减少了这种氧化损伤或在人类中增加了GSH水平,因此其作用机制仍然是一个开放的问题。然而,在患有多发性硬化症的患者外周血细胞中,已经证明了DMF激活了NRF2途径,与其通过NRF2起作用一致。实际上,在小鼠模型的多发性硬化症中,DMF增加了神经系统中的NRF2,与疾病改善相关;这种效应在缺乏NRF2的小鼠中未见到。然而,即使在缺乏NRF2的小鼠中,DMF也可能调节免疫系统。一种针对NRF2的药物目标较少成功,即合成三萜类化合物bardoxolone methyl,它经历了临床试验用于治疗慢性肾脏病和2型糖尿病。不幸的是,尽管肾功能有所改善,但心血管安全问题导致试验停止。正在评估更安全的衍生物,以及通过不同机制干扰NRF2-keap1相互作用的化合物,例如促进keap1降解或直接抑制NRF2-keap1相互作用——这些作用应该比针对-SH基团的试剂更具特异性,并且在治疗痴呆方面具有潜力。尽管如此,另一种三萜类化合物omaveloxolone被美国食品药品监督管理局(FDA)批准用于治疗弗里德赖希共济失调症,尽管其治疗效果似乎有限。
5.5与增加NRF2活性相关的一些注意事项
人们不希望通过NRF2增加抗氧化防御到足以干扰ROS的生理作用的程度。缺乏keap1的小鼠有持续活跃的NRF2并且由于胃肠功能障碍而在出生后不久死亡,尽管这些影响是否涉及‘减少的ROS’尚未报告。在使用增强NRF2的试剂(饮食来源或合成)时也应该小心(例如吸烟者或有癌症风险的受试者),因为恶性肿瘤处于氧化应激下,p53、吞噬细胞和各种治疗方法可以通过增加这种压力来杀死它们(框2)。因此,提高NRF2水平可以保护肿瘤,尤其是肺癌。
六、结论和未来展望
氧化损伤会导致多种疾病,尤其是随着年龄增长发病率增加的疾病,如痴呆、眼疾、多种癌症和心血管疾病。让我们通过回顾我们在使用抗氧化剂治疗或预防这些疾病方面所取得的进展来结束本文,并提出未来可以采取的一些方法。
6.1抗氧化剂在疾病预防中的应用
尽管氧化损伤在上述疾病中发挥作用,但根据现有数据,补充饮食来源的抗氧化剂或合成抗氧化剂似乎对预防或治疗这些疾病帮助不大,尽管许多试验仍在进行中。框4提供了一些解释。DMF、依布硒和衣达拉奉具有一定的治疗效果,但尚不清楚这是否归因于抗氧化作用(通过NRF2或其他机制),还是由其他机制介导。一个关键问题是我们是否可以开发能够减少特定生物分子特定部位氧化损伤的抗氧化剂(特别是大脑),同时不会过多干扰ROS的生理作用。
表3 各种影响活性氧和氧化剂水平的生活方式 | |
干预方法 | 特点 |
运动 | 运动促进人体健康,部分原因是氧化应激激活并提高内源性抗氧化能力。 |
减肥 | 肥胖提高氧化损伤,部分因为是脂肪组织内巨噬细胞产生更多ROS和释放更多细胞因子。减肥可以降低氧化损伤。 |
控制胆固醇水平 | 高胆固醇血症提高氧化损伤,他汀能纠正这一趋势。通过降低胆固醇,影响低密度脂蛋白水平,他汀也被当成具有间接抗氧化作用。 |
控制高血糖 | 高血糖提高患者脂质过氧化水平,高水平葡萄糖具有促氧化效应。 |
健康饮食 | 健康饮食有利于摄取许多构建抗氧化网络的营养素。 |
避免接触高活性氧毒素,特别是戒烟 | 香烟对人具有强促氧化效应,可提高氧化损伤水平,也含有多种致癌物。 |
6.2生活方式作为抗氧化“疗法”
已知有几种活动可以促进健康,包括运动、避免肥胖、控制血糖和胆固醇以及食用富含水果、蔬菜和谷物的高质量饮食,这些活动至少在一定程度上可能通过抗氧化剂类型的机制起作用(例如,降低导致ROS产生增加的化合物水平,如葡萄糖)。表3解释了其中的原理。然而,令人奇怪的是,许多体外具有抗氧化性质的饮食来源化合物在体内似乎没有发挥系统抗氧化作用。这就引出了一个问题:我们如何解释流行病学研究显示它们有益的结果。它们可能只在特定部位发挥抗氧化作用(在血液或尿液中测量的氧化损伤生物标志物无法检测到这些作用),或者通过胃肠道的作用促进健康(参见“胃肠道中的抗氧化剂”)。其中许多化合物还会产生其他代谢效应,尤其是作为酶辅因子的抗坏血酸,以及可能是各种形式的维生素E(表2)。富含水果、谷物和蔬菜的饮食可以降低患上多种疾病的风险,包括心血管疾病、痴呆、其他神经退行性疾病、中风、糖尿病、白内障、黄斑变性和多种癌症。这样的饮食富含抗氧化剂,如果您食用这些饮食,您的血液中的抗氧化剂水平会上升。并不一定是抗氧化剂导致了这些有益效果,它们可能是由于许多其他饮食成分,包括提高NRF2水平的物质。事实上,良好的饮食习惯还有另一个重要方面,即许多通常不被视为抗氧化剂的饮食成分有助于抗氧化防御网络,尤其是内源性抗氧化剂(表1)。例如,锰需要锰超氧化物歧化酶;铁需要过氧化氢酶;铜需要铜锌超氧化物歧化酶、细胞外超氧化物歧化酶和血清铜蛋白;锌需要铜锌超氧化物歧化酶;含硫氨基酸(甲硫氨酸、半胱氨酸)用于生成GSH;核黄素是谷胱甘肽还原酶的黄素腺嘌呤二核苷酸辅因子;烟酰胺用于生成NAD(H)和NADP(H);硒是GPx酶、硫氧还蛋白还原酶和甲硫氨酸亚砜还原酶所需的活性物质1。因此,如果饮食缺乏这些营养素中的任何一种或全部,抗氧化防御网络可能会以多种方式受损。补充高水平的抗坏血酸、维生素E、类胡萝卜素、多酚等可能不太可能纠正这种情况;需要多种饮食成分以正确的平衡存在。尽管如此,几项生物标志物研究表明,多吃水果和蔬菜(甚至黑酱油)可以降低全身氧化损伤水平,尽管其他研究并未发现这一点。总体而言,不能得出结论认为良好饮食的好处是由于氧化损伤减少所致,尽管这可能是其中一个原因。目前,促进健康的生活方式(表3)是避免疾病最有效的策略;按照表3中的建议似乎更有可能降低氧化损伤水平,而不是摄入超过正常剂量的饮食来源抗氧化剂。事实上,有人试图扩大抗氧化剂一词的定义,以包含饮食和生活方式的这种作用,即“抗氧化剂是指任何生理学、营养学或药理学操作,激活编码抗氧化酶基因的表达,从而增强细胞对活性氧或氮物种氧化的抵抗力”。
6.3活性氧和抗氧化剂反应的个体差异
个体之间的氧化损伤水平和抗氧化剂水平差异很大,他们对促氧化剂的反应、组织损伤引起的氧化损伤增加或补充抗氧化剂的反应也是如此。这有多种原因,包括饮食和遗传学,一个例子是触珠蛋白类型(参见“膳食抗氧化剂作为治疗剂”)。例如,吸烟会增加几种氧化损伤生物标志物的浓度,尤其是F2-异前列腺素。然而,仔细检查数据发现,一些吸烟者这些生物标志物的浓度处于“正常”范围,而一些非吸烟者的浓度则在“吸烟者”范围内。也许只有那些基础氧化损伤水平较高的人才会因疾病引起的额外氧化损伤而受到影响,并对给予的抗氧化剂做出反应。有些作者称他们为“腐臭的人”(在其他地方进行了综述),指的是油脂腐臭是由于脂质过氧化1所致。
6.4如何进一步推进
正如最近讨论的那样,关于抗氧化剂对疾病影响的研究很少定义涉及哪些ROS、它们来自哪里、它们如何到达目标以及哪些特定的分子目标受到影响以及为什么会受到影响。
“氧化损伤”一词通常被解释为对广泛的生物分子的随机、不加区别的损害,例如由OH•引起的损害。然而,真实的病理过程往往出奇地具有特异性。因此,在帕金森病中,增加的氧化DNA损伤似乎只影响鸟嘌呤。在阿尔茨海默病中,蛋白质组学显示只有某些蛋白质受到氧化损伤。大多数情况下,这种选择性背后的机制尚未确定。很少有关于给予的抗氧化剂(无论是膳食还是合成的)如何在组织、细胞、器官和内质网室(例如线粒体基质或膜间空间)中分布的数据,而且对于牺牲性抗氧化剂来说,氧化产物的生物学效应和命运是什么也鲜有报道。例如,类胡萝卜素、药物和多酚的氧化产物可能同时具有有益的和有害的生物学效应。我们大致了解内源性抗氧化防御的组织分布以及细胞和亚细胞定位(表1),但我们不知道膳食来源的抗氧化剂如抗坏血酸、麦角硫因、类胡萝卜素、黄酮类化合物、生育酚、生育三烯醇及其代谢物在器官、内质网室、细胞、组织和器官中的正常位置,以及这些水平如何随着补充而改变。因此,我们不知道在这些部位清除ROS是否可行(参见“体内抗氧化活性的建立”)。因此,我们必须朝着阐明这些外源性抗氧化剂在分子水平上的作用机制的方向前进。另一个需要注意的因素是动物研究可能会产生误导性的结果。例如,将抗氧化剂用于痴呆或中风的啮齿动物模型可以改善其结果并减少氧化损伤,这在人类中通常不会观察到(参见“ROS和抗氧化剂在痴呆中的作用”)。许多研究将抗坏血酸作为抗氧化剂给予大鼠和小鼠,而不考虑这些动物自己会合成它30;很少测量补充额外抗坏血酸对内源性抗坏血酸合成(以及随之产生的H2O2,表2)和组织抗坏血酸水平的实际影响。
6.5活性硫作为抗氧化剂
本综述关注的是处理ROS的抗氧化剂。其他活性类别的自由基也存在,例如活性氮和卤素物种,尽管它们的主要成员(HOCl、NO• 、ONOO− 、ONOOH和NO2 • )也被归类为ROS。一个日益增长的研究领域是活性硫物种(RSS):其中一种H2S在体内发挥重要作用。H2S至少可以在体外清除ONOO− /ONOOH。然而,尽管尚未完全确立,但H2S在体内的水平似乎远低于其他能够与ONOO− /ONOOH反应的抗氧化剂的水平,如GSH(表1),因此这种能力在体内可能无关紧要。氢过硫化物(RSSH)和多硫化物(RSSnR)可以抑制脂质过氧化并保护细胞免受铁离子和脂质过氧化有关的铁死亡的影响,后者通过控制铁离子供应和通过泛醌和GPx4介导的脂质过氧化速率来实现(表1)。然而,RSSH和RSSnR在体内的水平也没有得到充分确立,需要建立抗氧化活性是否在体内可行(参见“体内抗氧化活性的建立”)。尽管如此,RSS仍然是值得进一步研究的物种。甚至有人提出肠道微生物群向身体提供RSS作为抗氧化防御。
https://blog.sciencenet.cn/blog-41174-1416798.html
上一篇:氢水改善小鼠睡眠的研究【美国】
下一篇:健康记录显示,流行的减肥药与自杀念头之间没有联系