博文
氩气对猪肺缺血再灌注损伤的治疗作用【吸入惰性气体治疗疾病?】
||
氩气吸入对CLAWN小型猪肺缺血再灌注损伤的治疗作用
背景:氩气等惰性气体已被证实具有细胞保护作用。氩气无麻醉效应、储量丰富且性价比高,具备临床应用潜力。尽管在细胞及小动物模型中,氩气减轻缺血再灌注损伤的疗效已得到验证,但关于其在大动物模型中作用的数据仍较为匮乏。本研究旨在探讨氩气吸入对小型猪肺缺血再灌注损伤的影响,为其在肺移植领域的应用提供实验依据。
方法:选取10头CLAWN小型猪,夹闭其左侧支气管、肺动脉及肺静脉90分钟后松开夹闭装置,构建肺缺血再灌注损伤模型。氩气组(*n*=5)吸入70%氩气与30%氧气的混合气体,持续360分钟;对照组(*n*=5)则吸入同等时长的70%氮气与30%氧气混合气体。通过胸部X光片、肺组织活检及血气分析评估肺功能。
结果:再灌注后2小时,对照组动脉血氧分压/吸入氧浓度比值(PaO₂/FiO₂)显著下降,由568±12 mmHg降至272±39 mmHg;而氩气组该指标下降幅度更小,由562±17 mmHg降至430±48 mmHg,肺氧合功能得到更好维持。氩气组肺静脉血氧分压/吸入氧浓度比值(PvO₂/FiO₂)显著高于对照组:再灌注后2小时,两组比值分别为331±17 mmHg和186±17 mmHg;再灌注后2天,两组比值分别为519±19 mmHg和292±33 mmHg。胸部X光片显示,氩气组左侧肺部浸润程度减轻。再灌注后2小时及2天的肺组织活检病理评分结果显示,氩气组损伤程度更轻。血清超氧化物歧化酶活性检测及末端脱氧核苷酸转移酶介导的缺口末端标记法(TUNEL)检测结果提示,氩气的保护作用可能分别与抗氧化及抗凋亡机制相关。
结论:围手术期吸入氩气可减轻小型猪肺缺血再灌注损伤,其作用机制可能与抗氧化及抗凋亡效应有关。
Iwanaga, T.; Okumi, M.; Ariyoshi, Y.; Takeuchi, K.; Kondo, A.; Sekijima, M.; Ichinari, Y.; Shimizu, A.; Sahara, H. Therapeutic Effects of Argon Inhalation on Lung Ischemia–Reperfusion Injury in CLAWN Miniature Swine. J. Clin. Med. 2025, 14, 8821.
1 引言
器官移植是治疗终末期器官衰竭的公认有效手段。然而,供体器官短缺问题长期存在,仍是制约器官移植发展的主要障碍[1]。据全球器官捐献与移植观察站统计,2023年全球共完成172409例实体器官移植手术,器官来源为45861例逝世捐献者,包括脑死亡捐献者及心死亡捐献者[2]。但器官移植的临床需求仍持续高于供体器官的供应总量[3]。
为扩大供体器官库,边缘供体来源的器官(如取自老年供体、高血压或糖尿病供体的器官)的利用率正逐步提高[4]。除传统脑死亡供体和活体供体外,心死亡捐献者(DCD)已成为器官移植的重要供体来源,这一策略为缓解供体短缺问题提供了可行路径[5]。但心死亡捐献者因循环骤停,不可避免地会经历一段温热型缺血过程,这会显著增加器官缺血再灌注损伤(IRI)的发生风险[6,7]。缺血再灌注损伤是指器官血流暂时中断后恢复灌注时,引发的炎症反应、氧化应激及组织损伤等一系列病理生理过程[8]。该损伤不仅会导致移植后原发性移植物功能障碍(PGD),还会激活免疫反应,进而诱发移植物排斥反应及慢性肺移植物功能障碍(CLAD)[9]。尽管相关研究已广泛开展,但目前可应用于临床、能有效减轻缺血再灌注损伤的药物治疗方案仍十分有限。
基于这一未被满足的临床需求,研究人员将目光投向了具有细胞保护作用的制剂,惰性气体便是其中之一。氦气、氩气(Ar)、氙气均为化学性质惰性的元素,属于惰性气体,在大气中含量极低[10],且已在工业及医学领域开展应用探索[11,12]。在这三种惰性气体中,氩气储量相对丰富、无麻醉效应且性价比高,因此在治疗应用方面具有突出优势。相比之下,氦气储量稀少,氙气价格昂贵且具有麻醉作用[13]。
小动物模型的实验研究表明,氩气的生物学效应具有器官特异性。在心脏领域,氩气干预可缩小心肌梗死面积,改善缺血后心肌功能恢复[14,15];在肾脏领域,含氩气的饱和器官保存液可减轻移植模型中的缺血再灌注损伤[16]。与之相反,肝脏相关研究则未取得理想效果:在部分肝切除及温热型缺血再灌注损伤模型中,吸入氩气既未能减轻肝损伤,也未促进肝组织再生[17,18]。大动物模型的研究同样显示,氩气的保护作用存在器官差异性。已有研究证实,氩气可减少猪脑缺血模型中的神经元死亡[19],改善猪肾灌注模型中的肾功能[20];但在猪离体肺灌注模型中,氩气未表现出任何保护效果[21]。综上,小动物模型中观察到的氩气器官特异性效应同样存在于大动物模型中,且氩气在不同器官系统中的整体疗效仍不明确。值得注意的是,在具有临床指导意义的大动物模型中,证实氩气对肺缺血再灌注损伤具有保护作用的证据仍十分匮乏。
因此,本研究旨在利用CLAWN小型猪构建温热型肺缺血再灌注损伤模型,评估围手术期吸入氩气的有效性及安全性。通过检测肺氧合功能、影像学及组织学损伤程度、细胞凋亡水平及氧化应激标志物,明确氩气吸入是否可减轻缺血再灌注损伤后的急性肺损伤。
2 材料与方法
2.1 实验动物
选取10头CLAWN小型猪(5~6月龄,体重11.9~16.9 kg),购自日本鹿儿岛小型猪研究中心。所有实验操作均遵循3R原则(替代、减少、优化),注重实验动物福利及饲养环境的适宜性。为最大限度减少实验动物使用数量,本研究方案经严格设计,并获得鹿儿岛大学动物实验伦理委员会批准(批准号:MD20016)。所有动物处理及实验操作均符合《鹿儿岛大学动物实验指南》、国际公认标准(美国国立卫生研究院出版物第86-23号,1985年修订版)及《动物研究报告体内实验指南》(ARRIVE指南,2020年修订版)的要求。
2.2 实验分组及气体吸入方案
将实验动物随机分为两组:氩气吸入组(Ar组,*n*=5)和对照组(*n*=5)。氩气组吸入70%氩气与30%氧气的混合气体;对照组吸入70%氮气与30%氧气的混合气体。选择70%作为氩气浓度,是因为该浓度是在维持吸入氧浓度(FiO₂)为0.30的前提下,可安全使用的最高浓度。两组动物的气体吸入时长均为360分钟,覆盖整个围再灌注期,吸入时间从手术开始持续至再灌注后2小时,该方案参考本团队既往建立的猪肺缺血再灌注损伤模型[22]。
2.3 手术操作流程
通过肌内注射氯胺酮、咪达唑仑及美托咪定诱导麻醉,随后进行气管插管并实施机械通气(吸入100%氧气,潮气量12~15 mL/kg,呼吸频率12~15次/分钟)。术中采用1%~3%异氟醚维持麻醉状态。分别于颈内动脉及颈外静脉置入导管,前者用于监测血压及血气分析,后者用于采血。将呼吸机供气切换为各组对应的实验混合气体。
实施左侧开胸手术,切口位于第5肋间,暴露肺门结构。气体吸入开始150分钟后,夹闭左侧肺动脉、肺静脉及主支气管,持续90分钟后松开夹闭装置,启动再灌注程序,构建温热型缺血再灌注损伤模型(图1)。
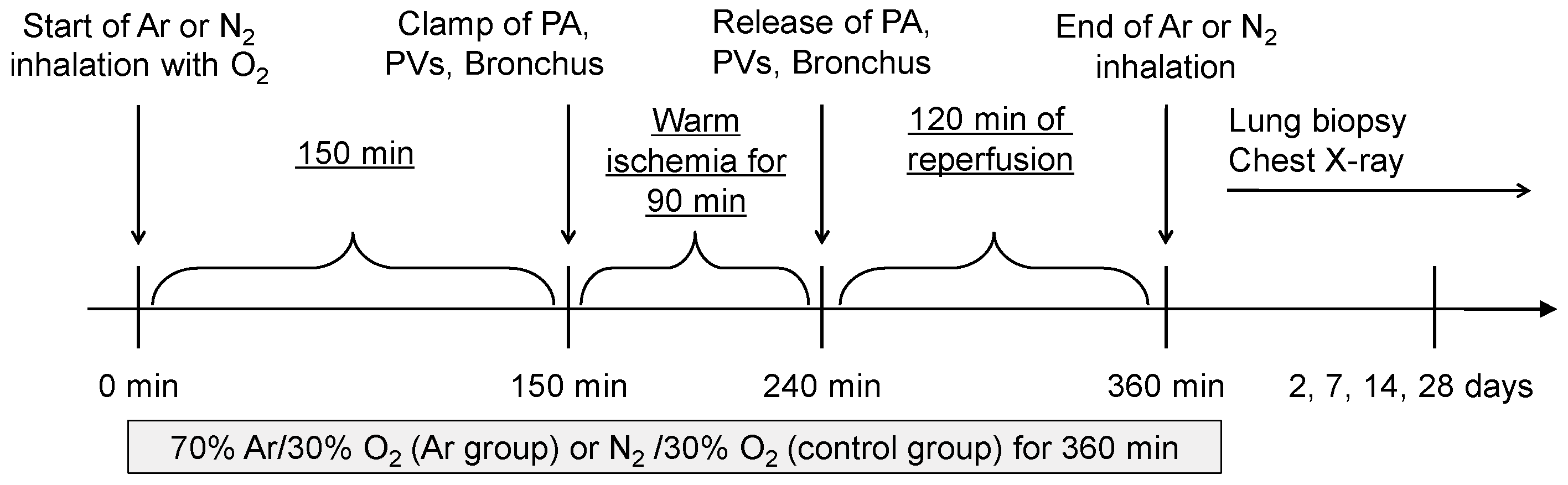
图1 实验方案流程图 手术开始时即启动氩气(70%Ar/30%O₂)或对照气体(70%N₂/30%O₂)吸入,持续360分钟。吸入开始150分钟时,夹闭左侧肺动脉(PA)、肺静脉(PVs)及主支气管,持续90分钟以诱导温热型缺血。吸入开始240分钟时松开夹闭装置,启动再灌注程序,再灌注持续2小时。吸入开始360分钟时停止气体吸入。分别于再灌注后第2、7、14、28天进行肺组织活检及胸部X光片检查。
2.4 血气分析
为评估肺功能,分别于术前及再灌注后2小时采集颈动脉血样进行动脉血气分析;于再灌注后2小时及2天采集左侧肺静脉血样进行静脉血气分析。血气分析采用血气分析仪(日本东京,IL公司)完成。
选择左侧肺静脉采血,是因为其血液直接来自再灌注后的左侧肺组织,可准确反映局部肺组织的氧交换功能,且不会受到对侧肺组织血液的稀释影响。因此,本研究计算肺静脉氧合指数(PvO₂/FiO₂比值,简称Pv/F比值) 以评估局部肺组织的氧合功能。
2.5 胸部X光片检查
分别于再灌注后第2、7、14、28天,在动物全身麻醉状态下拍摄胸部X光片,监测肺部损伤的恢复情况。
2.6 组织学评估
分别于再灌注后2小时及第2、7、14、28天采集肺组织样本,经10%中性缓冲福尔马林固定、石蜡包埋后制备组织切片。采用苏木精-伊红染色(H&E)及弹力纤维-马松-戈尔德纳染色(EMG)进行组织病理学观察。采用半定量评分系统评估肺组织损伤程度,该评分系统参考本团队既往研究[22],并基于米勒等人描述的标准改良[23]。具体评分指标包括细胞浸润、肺泡内水肿、纤维蛋白渗出及出血,各指标评分等级为0(正常)至3(重度损伤)。采用末端脱氧核苷酸转移酶介导的UTP-生物素缺口末端标记法(TUNEL)检测凋亡细胞。所有组织学评估均由一名对实验分组情况不知情的肾脏病理科医生(A.S.)完成。
2.7 肝肾功能检测
为评估氩气对全身器官功能的影响,分别于缺血前基线水平及再灌注后第2、7、14、28天检测血清肌酐(Cre)及丙氨酸转氨酶(ALT)水平。
2.8 炎症及氧化应激标志物检测
为评估全身炎症反应及氧化应激水平,检测血清白细胞介素-6(IL-6)及超氧化物歧化酶(SOD)浓度。分别于缺血前及再灌注后1、2、6小时采集颈静脉血样用于检测。检测采用酶联免疫吸附试验(ELISA)试剂盒:IL-6试剂盒购自美国明尼苏达州明尼阿波利斯市R&D系统公司;SOD试剂盒购自美国密歇根州安阿伯市凯曼化学公司。为定量评估细胞凋亡水平,在再灌注后2天采集的肺组织切片中,随机选取高倍视野(400倍)计数TUNEL阳性细胞核数量,计算每个视野的阳性细胞平均数,并进行组间统计学比较。
2.9 基因表达分析
为检测凋亡相关基因半胱氨酸天冬氨酸蛋白酶-3(Caspase-3) 及炎症细胞因子基因白细胞介素-6(IL-6) 的表达水平,分别于再灌注后2小时和2天采集肺活检样本。采用RNeasy中型试剂盒(德国希尔登,凯杰公司),严格按照试剂盒说明书提取样本中的总RNA。使用PrimeScript 反转录试剂盒(含DNA酶)(日本草津,宝生物工程有限公司)合成互补DNA(cDNA)。
实时荧光定量聚合酶链式反应(qPCR)采用SYBR Premix Ex Taq 试剂盒(宝生物工程有限公司),并在荧光定量PCR仪(Thermal Cycler Dice Real-Time System II)(宝生物工程有限公司)上完成扩增反应。以核糖体蛋白L4(RPL4)作为内参基因进行相对定量分析,数据分析采用Multiplate RQ 软件 6.0.1 版本(宝生物工程有限公司)。基因相对表达量以RPL4的表达水平进行标准化校正,最终结果以缺血前的表达量为参照,计算表达倍数变化。
引物序列如下:
- Caspase-3 正向引物:5′-AAGTTTCTTCAGAGGGGACTGC-3′;反向引物:5′-ACTGCTACCTTTCGGTTAACCC-3′
- IL-6 正向引物:5′-AAGCACTGATCCAGACCCTGAG-3′;反向引物:5′-TCAGGTGCCCCAGCTACATTAT-3′
- RPL4 正向引物:5′-TTTGTGGTAGGCTATGCCCTTG-3′;反向引物:5′-CAATGGGACTCCAGATGTTTCC-3′
2.10 统计学分析
实验数据以均值±均值标准误(mean ± SEM) 表示。同一时间点两组间比较采用非配对学生氏t检验;组内缺血前基线与再灌注后各时间点的比较采用配对t检验。统计学分析通过GraphPad Prism 6 软件(美国加利福尼亚州拉霍亚,GraphPad软件公司)完成。*p*值<0.05 被认为差异具有统计学意义。
3 实验结果
3.1 吸入氩气可改善肺缺血再灌注损伤后的全身及肺局部氧合功能
为评估全身氧合水平,采集颈动脉血样进行动脉血气分析,并计算动脉血氧分压/吸入氧浓度比值(P/F比值)。对照组大鼠的P/F比值由缺血前的568±12 mmHg,显著下降至再灌注后2小时的272±39 mmHg(*p*<0.05);而氩气处理组大鼠的P/F比值仅由缺血前的562±17 mmHg小幅下降至430±48 mmHg,降幅无统计学意义(图2)。
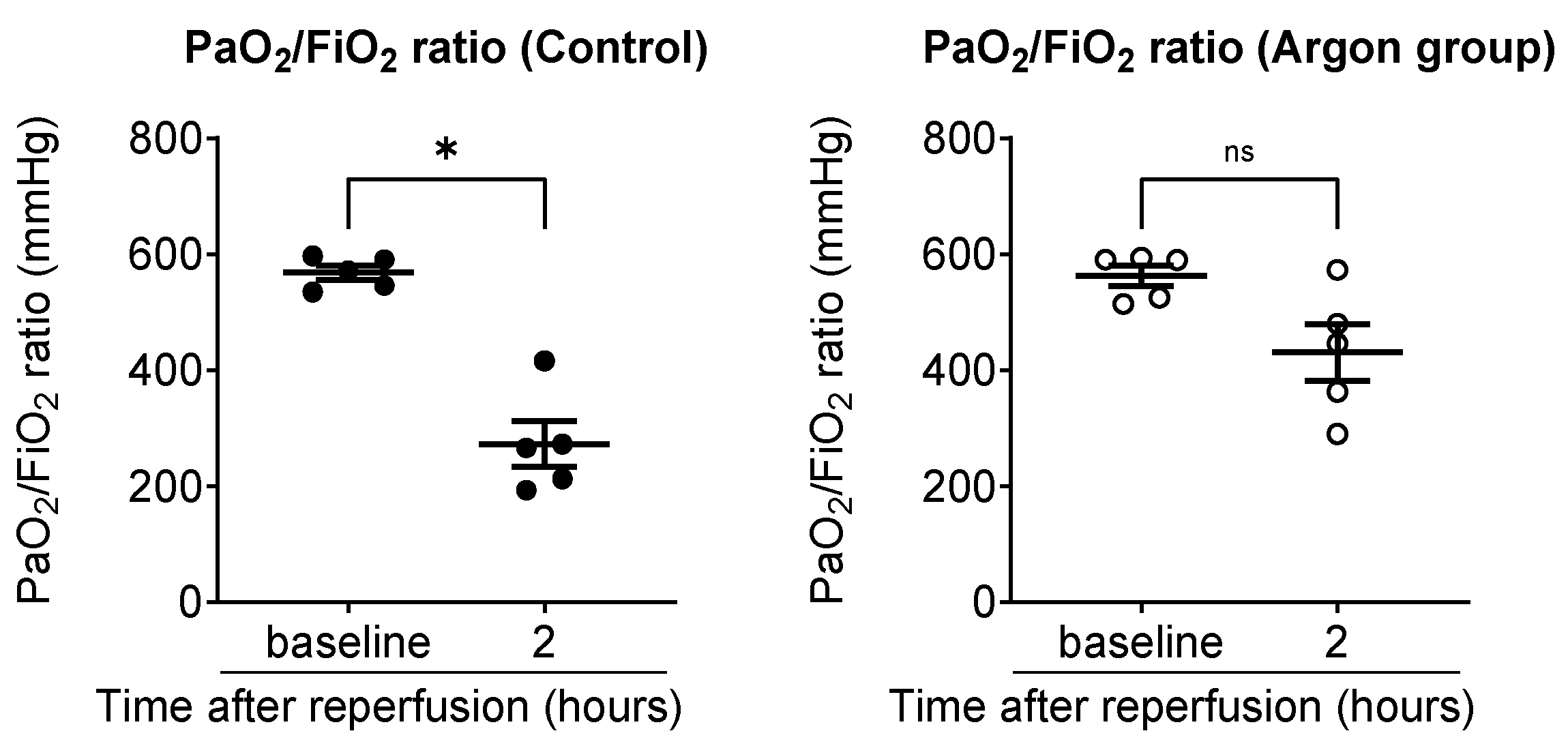
图2 对照组与氩气(Ar)处理组大鼠动脉氧合功能对比(黑点代表对照组;空心圆代表氩气处理组)
采集颈动脉血样并计算动脉血氧分压/吸入氧浓度比值(P/F比值),以此评估全身氧合功能。对照组大鼠的P/F比值自基线水平至再灌注后2小时显著下降,而氩气处理组仅出现小幅下降,且差异无统计学意义。数据以单个样本值及均值±均值标准误表示。*p*<0.05;ns:无统计学意义。
采用肺静脉氧合指数(Pv/F比值) 评估再灌注后左肺的氧合功能,具体检测方法详见实验方法部分。再灌注后2小时,氩气处理组的Pv/F比值为331±40 mmHg,显著高于对照组的186±17 mmHg(*p*<0.01)。再灌注后2天仍观察到相似趋势:氩气处理组的Pv/F比值为519±19 mmHg,对照组为292±33 mmHg(*p*<0.01),提示氩气处理组的肺氧合功能已接近完全恢复(图3)。
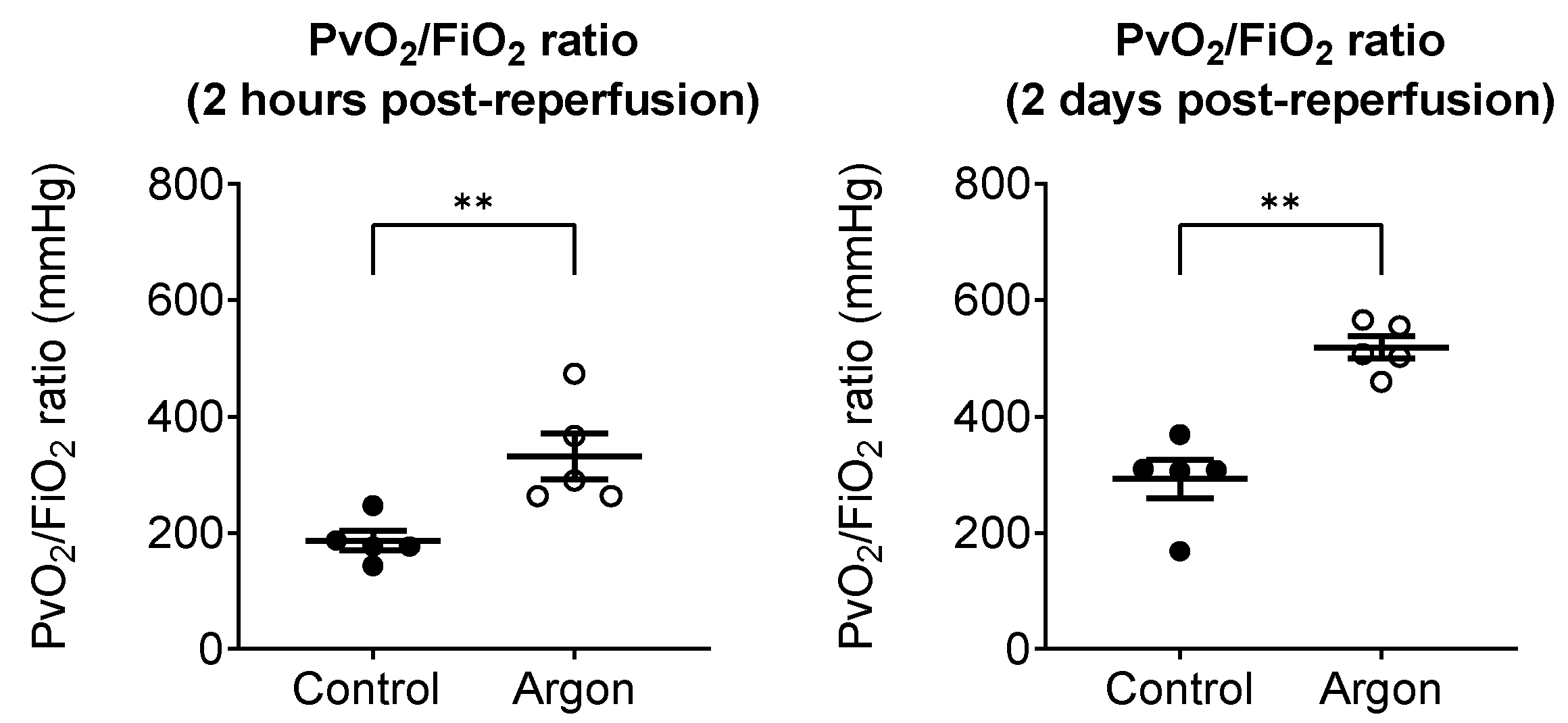
图3 再灌注后左肺的肺静脉氧合功能评估
通过采集左肺静脉血样计算肺静脉血氧分压/吸入氧浓度比值(Pv/F比值),以此评估再灌注后左肺的氧合功能。再灌注后2小时,氩气处理组的Pv/F比值显著高于对照组(黑点代表对照组;空心圆代表氩气处理组)。再灌注后2天,氩气处理组维持了更优的氧合水平,且氧合功能接近完全恢复,而对照组的氧合功能仍持续受损。数据以单个样本值及均值±均值标准误表示。p<0.01。
3.2 吸入氩气可减轻缺血再灌注损伤后的肺部浸润
再灌注后2天的胸部X光片显示,对照组大鼠肺部出现明显浸润影,且肺扩张程度降低;而氩气处理组大鼠的肺扩张功能得以维持,仅见轻微肺部浸润影(图4)。再灌注后7天,两组大鼠均出现恢复迹象,且组间无明显差异;再灌注后14天和28天的影像学结果显示,两组大鼠的肺部均已完全恢复,因此未展示这两个时间点的影像图片。
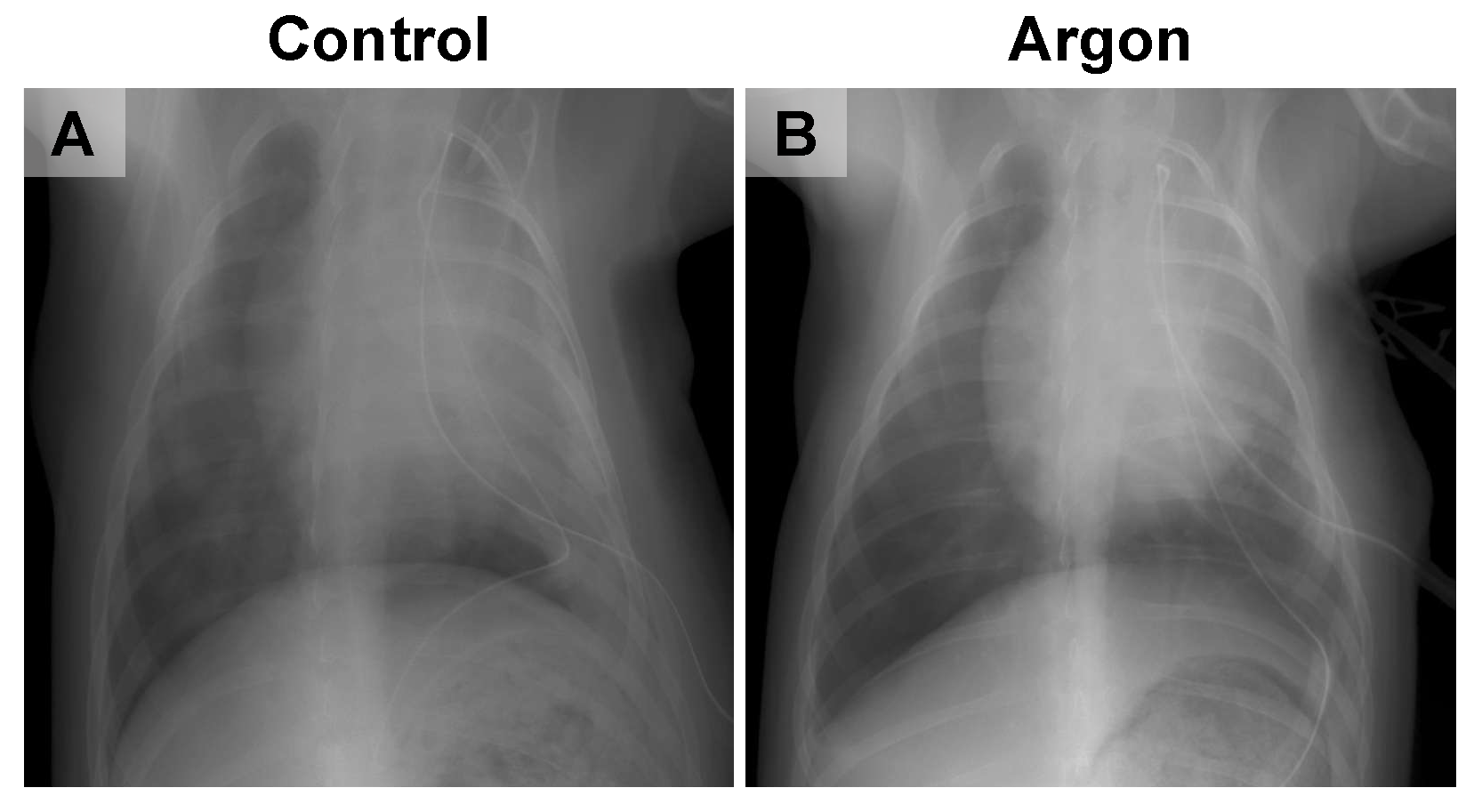
图4 对照组(A)与氩气(Ar)处理组(B)大鼠的代表性胸部X光片
对照组大鼠肺部出现明显浸润影,且肺扩张程度降低;而氩气处理组大鼠的肺扩张功能得以维持,仅见轻微肺部浸润影。
3.3 吸入氩气可减轻肺缺血再灌注损伤的组织病理学改变
对照组大鼠再灌注后2小时的肺活检组织病理分析显示:肺组织内出现中性粒细胞浸润、肺泡水肿、出血及纤维蛋白沉积(图5A)。上述病理改变于再灌注后2天进一步加重,肺泡毛细血管及肺小动脉内出现显著水肿、出血及中性粒细胞浸润(图5B、C);再灌注后7天,由于肺泡壁损伤持续存在,纤维蛋白沉积现象仍未消退(图5D)。
与之相反,氩气处理组大鼠再灌注后2小时的肺组织形态接近正常(图5E);再灌注后2天仅见轻度水肿及少量炎性细胞浸润(图5F、G);再灌注后7天,大部分病理异常已消退,仅残留少量纤维蛋白沉积(图5H)。再灌注后14天和28天,两组大鼠的肺组织均接近完全恢复,因此未展示这两个时间点的组织切片图片。肺活检组织的病理学评分详见表1。

图5 对照组与氩气(Ar)处理组大鼠再灌注后2小时、2天及7天的代表性肺组织切片
对照组(A-D)的弹力纤维-马松-戈尔德纳染色(EMG)及苏木精-伊红染色(H&E)结果显示:早期出现中性粒细胞浸润、水肿、出血及纤维蛋白沉积,且上述病变于再灌注后2天进一步加重;至再灌注后7天,肺组织仍存在残留纤维蛋白沉积及肺泡壁损伤。氩气处理组(E-H)再灌注后2小时的肺组织结构基本完整;再灌注后2天仅见轻度水肿及少量炎性细胞浸润;至再灌注后7天,大部分病理异常已显著改善。(染色方法:苏木精-伊红染色(H&E)、弹力纤维-马松-戈尔德纳染色(EMG))
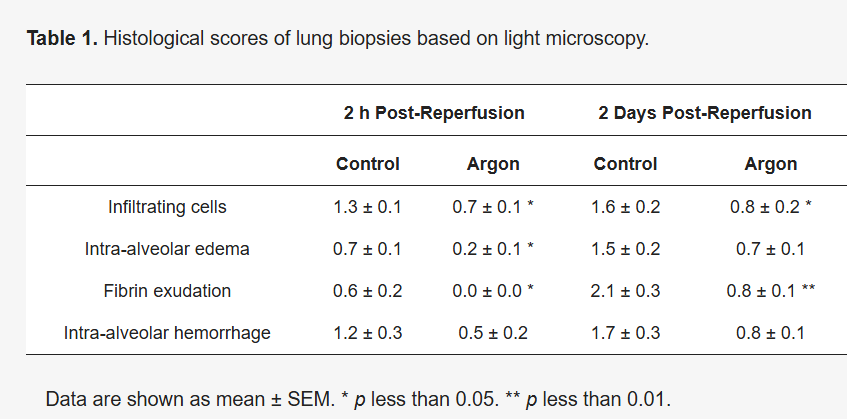
表1 基于光学显微镜观察的肺活检组织病理学评分
3.4 吸入氩气可抑制缺血肺组织的细胞凋亡
通过检测Caspase-3基因的mRNA表达水平分析肺组织细胞凋亡情况。对照组大鼠再灌注后2小时和2天的Caspase-3 mRNA表达量分别升高至1.37±0.10和1.70±0.36;氩气处理组大鼠的Caspase-3 mRNA表达量虽也呈上升趋势,但升高幅度显著低于对照组(图6A)。
再灌注后2天的TUNEL染色结果显示,氩气处理组的TUNEL阳性细胞数显著减少(图6B)。对再灌注后2天肺组织中TUNEL阳性细胞核的定量分析结果显示:氩气处理组的阳性细胞数为1.7±0.3个/高倍视野(400倍),显著低于对照组的6.6±0.6个/高倍视野(*p*<0.01),为氩气在本模型中发挥的抗凋亡作用提供了定量依据。
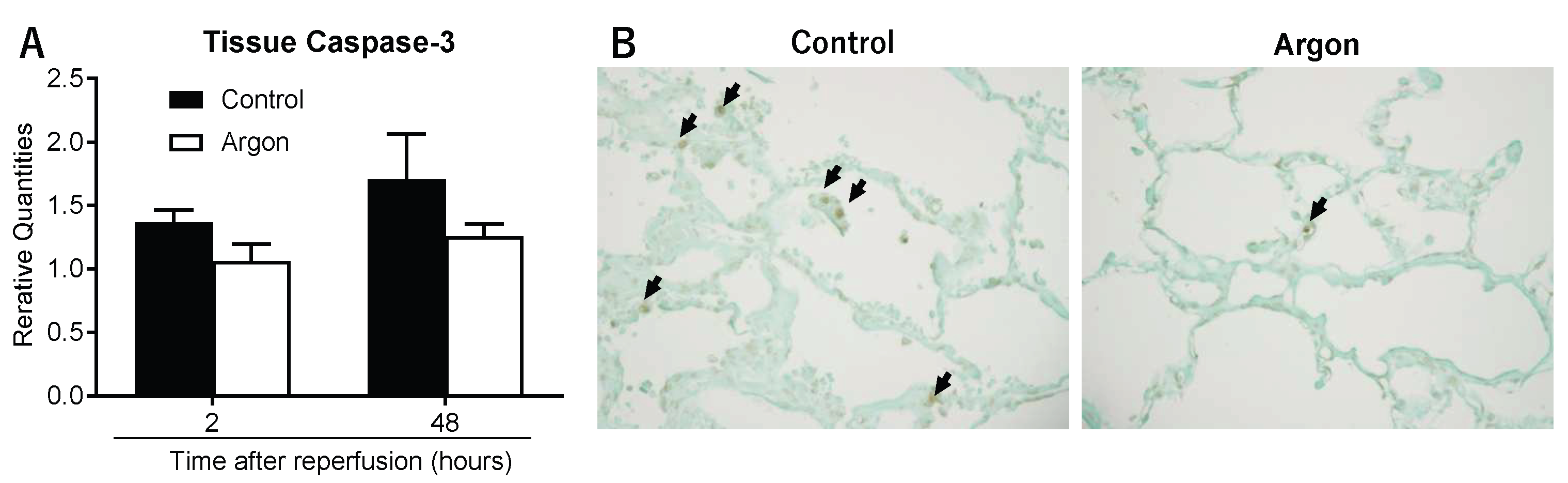
图6 肺组织细胞凋亡检测结果
(A)再灌注后2小时和2天的Caspase-3 mRNA表达水平。两组大鼠的Caspase-3 mRNA表达量均升高,但氩气(Ar)处理组的升高幅度显著更低。(B)再灌注后2天的代表性TUNEL染色图片。氩气处理组的凋亡细胞数(箭头所示)显著少于对照组,具体为1.7±0.3个/高倍视野 vs 6.6±0.6个/高倍视野(400倍),p<0.01。
3.5 吸入氩气可增强机体的抗氧化应答
通过检测血清中超氧化物歧化酶(SOD)的活性评估氩气的抗氧化作用。再灌注后1小时、2小时及6小时的检测结果显示,氩气处理组的血清SOD活性持续高于对照组,且在再灌注后1小时和6小时的差异具有统计学意义(*p*<0.05),证实氩气具有抗氧化作用(图7)。
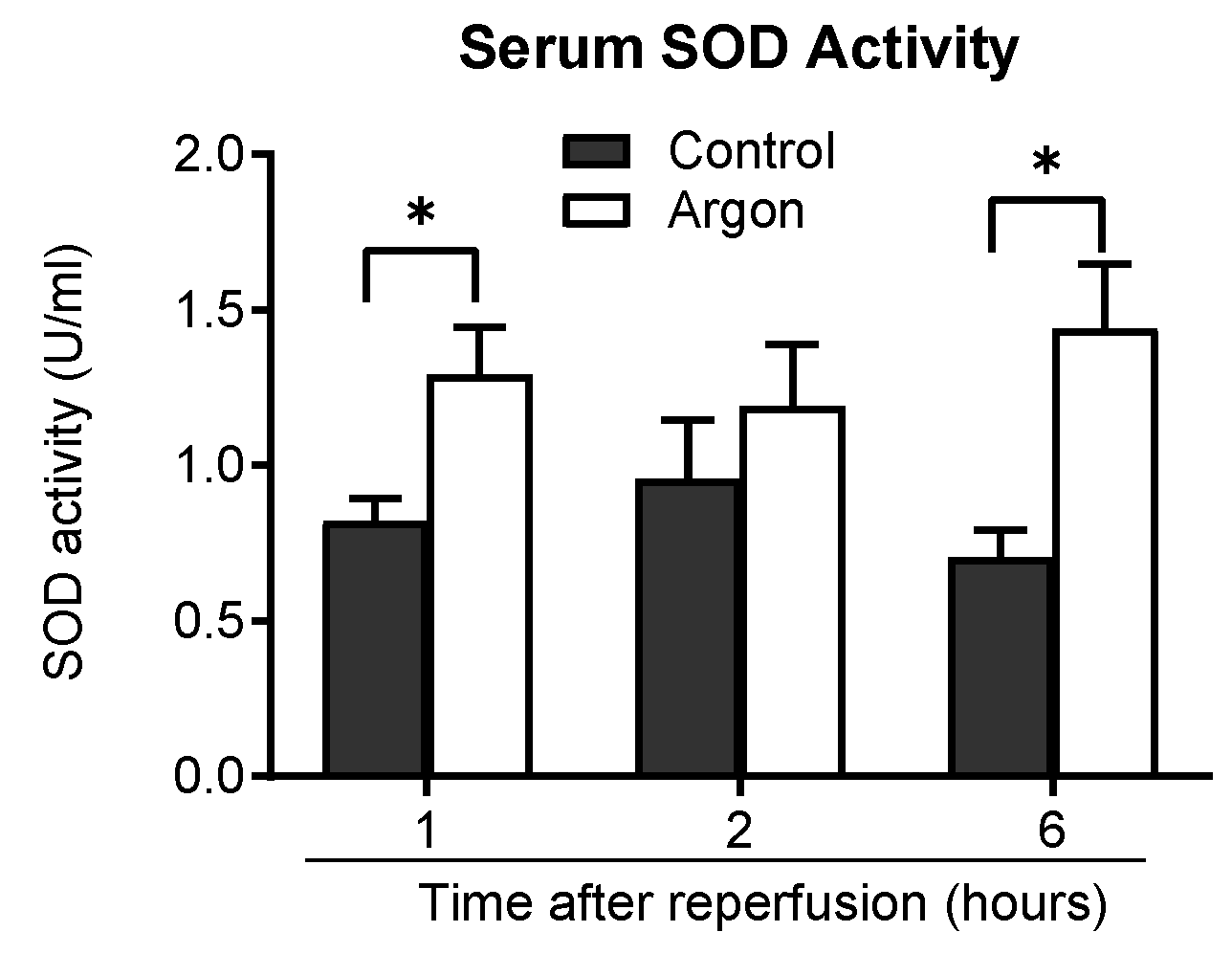
图7 对照组与氩气(Ar)处理组大鼠再灌注后1小时、2小时及6小时的血清超氧化物歧化酶(SOD)活性
氩气处理组大鼠在各检测时间点的血清SOD活性均持续高于对照组,且在再灌注后1小时和6小时的差异具有统计学意义(*p*<0.05)。数据以均值±均值标准误表示。
3.6 吸入氩气的抗炎作用有限
两组大鼠肺组织中的IL-6 mRNA表达量均于再灌注后2小时升高,并于再灌注后2天下降(图8A);血清IL-6浓度也均随时间延长呈上升趋势(图8B)。值得注意的是,再灌注后1小时和2小时,对照组的血清IL-6水平显著低于氩气处理组。上述结果提示,在本实验条件下,吸入氩气未发挥明显的抗炎作用。
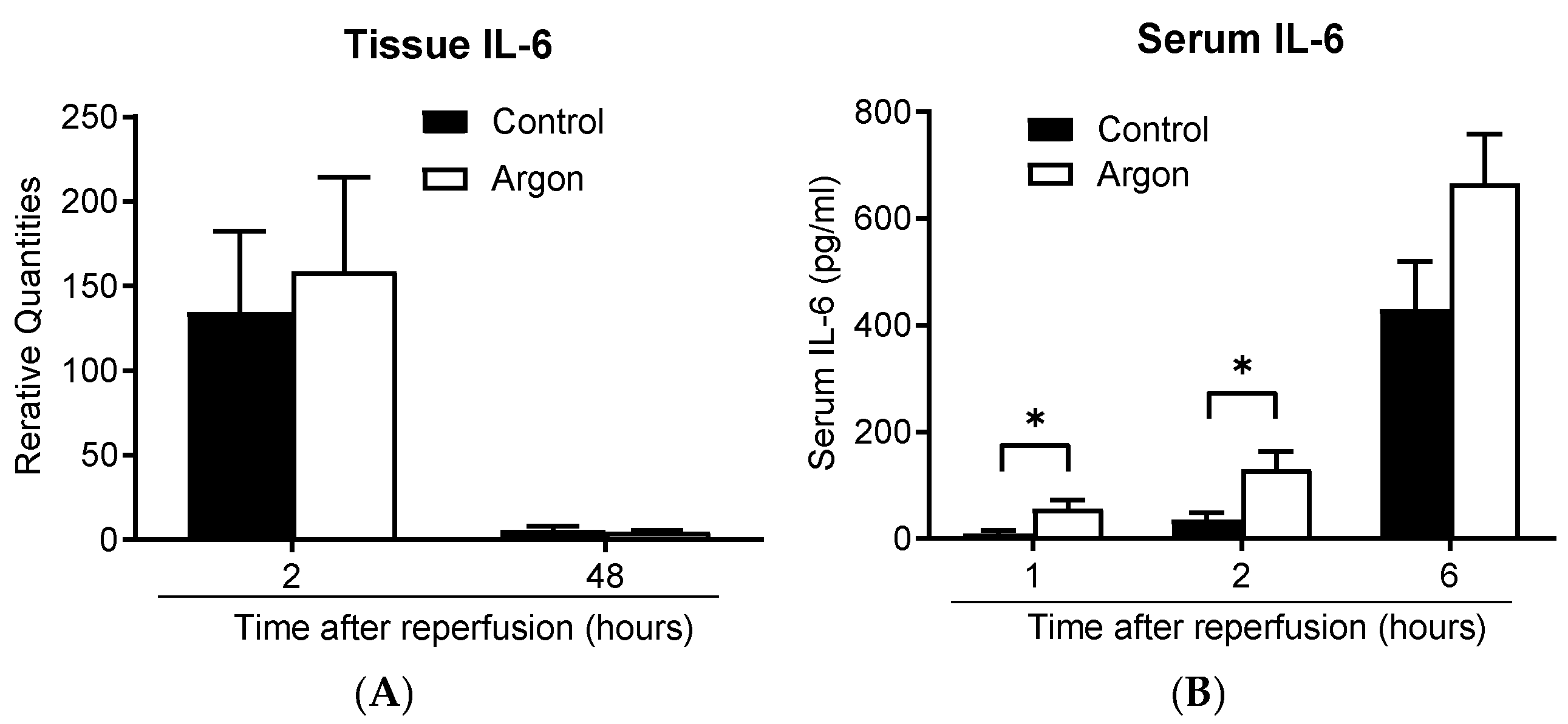
图8 肺组织IL-6 mRNA及血清IL-6蛋白的表达水平
(A)两组大鼠的肺组织IL-6 mRNA表达量均于再灌注后2小时升高,并于再灌注后48小时下降。(B)两组大鼠的血清IL-6浓度均随时间延长呈上升趋势;再灌注后1小时和2小时,对照组的血清IL-6水平显著低于氩气处理组(*p*<0.05)。数据以均值±均值标准误表示。
3.7 吸入氩气未观察到明显不良反应
为评估长时间吸入氩气(总时长360分钟)可能产生的全身毒性,检测了大鼠血清中的肌酐(Cre)和丙氨酸转氨酶(ALT)水平。结果显示,整个实验周期内两组大鼠的上述指标均无显著差异,且未观察到明显不良反应(表2)。
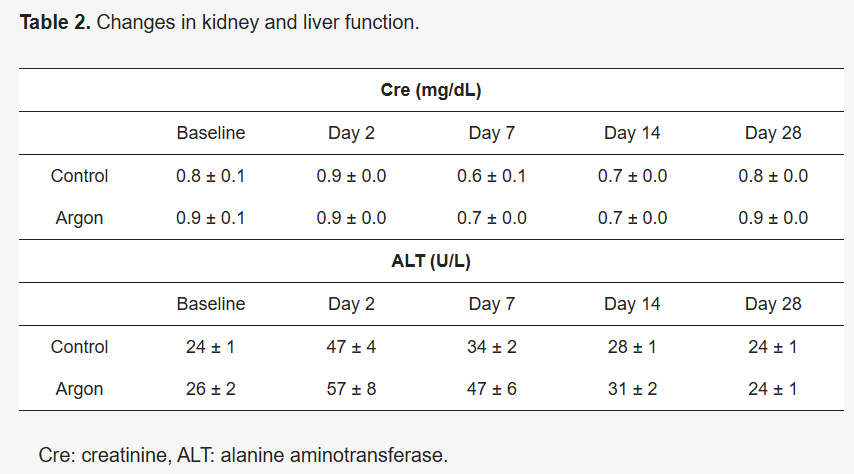
表2 大鼠肝肾功能指标变化
4 讨论
在本研究构建的具有临床指导意义的猪温热型肺缺血再灌注损伤(IRI)模型中,围手术期吸入体积分数为70%氩气(Ar)与30%氧气(O₂)的混合气体,可显著减轻急性肺损伤程度并维持肺功能稳定。氩气处理组实验动物的全身氧合水平得到改善,反映局部气体交换功能的静脉血-肺泡气氧分压差比(Pv/F)显著升高,同时肺部影像学及组织学损伤表现均有所减轻。细胞凋亡水平降低与抗氧化应答增强的实验结果,进一步佐证了氩气的肺保护作用。综上,本研究证实氩气在再灌注阶段可发挥强效细胞保护作用——而该阶段正是当前肺移植治疗中尚未得到有效干预的核心靶点。
温热型缺血会迅速耗尽细胞内三磷酸腺苷(ATP)储备,导致次黄嘌呤大量蓄积。再灌注发生后,黄嘌呤氧化酶会催化次黄嘌呤生成超氧阴离子自由基,引发剧烈的氧化应激反应,进而破坏肺泡-毛细血管屏障的完整性[8]。这一病理过程是移植后肺功能障碍(PGD)发生的关键驱动因素,同时也是慢性肺移植物功能障碍(CLAD)的重要诱因[9]。目前,用于缓解肺缺血再灌注损伤的药物治疗手段仍十分有限。
医用气体近年来备受关注,其优势在于可通过吸入方式靶向作用于肺泡-毛细血管界面,且全身毒性极低[24]。惰性气体曾被认为不具备生物活性,而近年来研究证实其具有明确的器官保护作用,具体机制包括抗凋亡与抗氧化等[25]。已有研究表明,氩气对多器官缺血再灌注损伤均有保护效果:可改善脑缺血再灌注损伤的预后[26,27,28];间歇性吸入70%氩气能够减轻心肌梗死面积[14];氩气饱和灌注液可缓解肾缺血再灌注损伤[16];在大动物脑缺血模型中,氩气可降低神经元损伤程度[27];猪肾脏灌注实验也证实了氩气的保护作用[20]。
既往关于氩气肺保护作用的实验研究,大多得出阴性结论。Martens等人的研究发现,尽管在猪离体肺灌注(EVLP)模型中采用了高浓度氩气干预,但未观察到任何保护效果[21,29]。这种研究结论的差异,很可能源于离体肺灌注模型与在体模型的本质区别,尤其是在氧浓度、再灌注时间节点,以及完整血管系统和炎症应答是否存在等方面。本研究结果提示,只有在保留上述生理条件的在体环境中,氩气的肺保护作用才能充分显现。
目前缓解缺血再灌注损伤的策略众多,包括供体筛选[30]、器官保存液优化[31]以及药物干预[32]等。离体肺灌注技术在边缘供肺修复领域的效果尤为显著[33,34,35],可降低肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)等促炎细胞因子水平,并减少损伤相关分子模式(DAMP)的释放。但需注意的是,离体肺灌注仅作用于移植前阶段,无法干预受体体内发生的再灌注损伤。与之不同的是,氩气既可在离体肺灌注过程中使用,也可在再灌注阶段给药——而这两个阶段恰好是氧化应激爆发、线粒体功能障碍及细胞凋亡的高峰期。因此,氩气可作为一种围手术期辅助治疗手段,与离体肺灌注技术形成互补,而非替代关系。
氩气已知的细胞保护作用涵盖抗凋亡与抗氧化双重机制,本研究结果与这些已报道的作用通路高度吻合。已有研究证实,氩气可抑制半胱氨酸天冬氨酸蛋白酶-3(caspase-3)活化[27]、下调Toll样受体2/4(TLR2/4)表达[36]、激活细胞外信号调节激酶1/2(ERK1/2)[28]。进一步研究发现,氩气可诱导巨噬细胞向M2型表型极化[37]、抑制应激活化蛋白激酶/氨基末端激酶(SAPK/JNK)信号通路并减少高迁移率族蛋白B1(HMGB1)释放[15,38]、下调IL-8表达以减轻早期中性粒细胞募集[39,40]。此外,氩气可能通过磷脂酰肌醇3激酶-细胞外信号调节激酶1/2-哺乳动物雷帕霉素靶蛋白(PI3K–ERK1/2–mTOR)信号通路,以及核因子E2相关因子2(Nrf2)依赖性基因诱导(包括NAD(P)H醌脱氢酶1(NQO1)与超氧化物歧化酶1(SOD-1)),进一步增强机体抗氧化防御能力[41]。本研究中,氩气处理组的超氧化物歧化酶(SOD)水平持续升高,为氩气在再灌注早期增强抗氧化活性提供了直接实验证据。由于肺泡上皮细胞与血管内皮细胞凋亡是早期肺缺血再灌注损伤的核心病理环节,因此氩气对上述通路的调控作用,从机制层面解释了本研究中观察到的肺泡-毛细血管屏障完整性维持及Pv/F比值改善现象。
与氩气的抗凋亡、抗氧化作用不同,本研究发现吸入氩气并未降低IL-6水平,反而导致早期全身IL-6水平出现一过性升高。这提示在本研究模型中,氩气的肺保护作用主要依赖抗氧化与抗凋亡机制,而非对炎症细胞因子的广谱抑制效应。氩气处理后IL-6的一过性升高,与既往研究报道一致——即尽管氩气整体表现为细胞保护作用,但其可轻度激活TLR2/4依赖性信号通路[39]。因此,这种早期细胞因子水平升高,可能反映的是一种具有场景依赖性的应激信号,而非有害的炎症反应。
尽管氩气处理组的早期全身IL-6水平一过性升高,但各组动物肺组织中IL-6的mRNA表达水平无显著差异,这表明上述IL-6水平的差异源于全身应答,而非肺组织局部的特异性反应。需要强调的是,尽管存在这种细胞因子表达模式的变化,氩气的保护作用(改善氧合、减少凋亡、增强抗氧化活性)依然得以维持,这进一步证实氩气在温热型肺缺血再灌注损伤中的保护作用,主要由抗凋亡与抗氧化通路介导。既往报道的氩气抗炎作用,均基于视网膜[36]或神经元[40]等局部炎症模型,且炎症反应受到组织屏障的限制;而本研究采用的大动物肺缺血再灌注损伤模型,会引发更广泛的全身性炎症激活。这种器官与模型的特异性差异,很可能是本研究观察到独特IL-6变化规律的原因。
已有研究表明,氩气的保护作用具有剂量与时间依赖性。在心脏骤停模型中,70%浓度氩气的神经保护效果优于40%浓度[42]。与之类似,25%~75%浓度的氩气对视网膜的保护作用呈现时间与剂量依赖性[43];在小鼠大脑中动脉短暂闭塞模型中,氩气给药的时机与持续时间对神经保护效果至关重要[44]。上述研究提示,优化氩气的吸入浓度与时间参数,对于推动其临床转化应用具有重要意义。
本研究选择70%作为氩气吸入浓度,原因在于该浓度是在维持吸入氧浓度(FiO₂)为0.30的前提下,可安全使用的最高浓度。360分钟的吸入时长设定,旨在覆盖整个再灌注前后窗口期,这一参数的确定基于本团队既往的大动物实验结果——即吸入360分钟一氧化碳(CO)可有效减轻肺缺血再灌注损伤[22]。由于引发早期再灌注损伤的氧化应激爆发,在再灌注后数分钟至数小时内达到峰值[8,9],因此在该窗口期内持续吸入氩气被认为至关重要。本研究中,再灌注后2小时与2天的检测结果均显示,氩气的抗氧化与抗凋亡作用显著,这证实所选的给药时长足以有效抑制活性氧(ROS)介导的组织损伤。尽管如此,氩气的最佳浓度与治疗时长组合仍有待探索,未来研究需对更多给药方案进行评估。
本研究的一大优势在于,采用了具有临床指导意义的大动物模型,并开展了长达28天的随访观察——而既往多数氩气相关研究仅检测早期时间节点。此外,本研究采用常氧条件给药,进一步提升了该方案的临床可行性。氩气的化学惰性使其相比一氧化氮、一氧化碳、氢气、硫化氢等气体具有显著优势,后几种气体的临床应用均需严格的安全管控措施[45,46,47,48,49]。氩气无毒、不易燃且给药方式简便,适用于围手术期应用,且有望与离体肺灌注系统兼容。目前,氩气与其他医用气体的协同联用方案也已成为研究热点[50]。
本研究存在一定局限性。首先,未对低温保存条件下氩气的作用效果进行评估[51]——尽管目前标准的移植物保存方案,是采用基于右旋糖酐的保存液结合充氧低温冷藏[52,53]。温热型与寒冷型缺血再灌注损伤在炎症模式与代谢抑制程度上存在显著差异[54,55],因此氩气在低温保存条件下的作用效果,仍需进一步研究明确。其次,本研究仅评估了再灌注后早期(2小时)与晚期(48小时)的细胞凋亡变化,增设中间时间节点检测,或可更清晰地揭示细胞凋亡的时间动态变化规律。此外,本研究的样本量相对有限,仅评估了一种氩气浓度与给药时长,且未开展转录组学分析或慢性肺移植物功能障碍样病变的长期评估。
5 结论
围手术期吸入氩气,可通过减少细胞凋亡、增强抗氧化应答、维持肺氧合功能,显著减轻小型猪的温热型肺缺血再灌注损伤。氩气靶向作用于再灌注阶段——而该阶段恰是离体肺灌注等供体侧干预策略的盲区,因此氩气有望成为一种实用且安全的肺移植辅助治疗手段。未来需开展进一步的机制研究与转化医学研究,包括在大动物移植模型中验证其疗效,以确定氩气的最佳给药浓度与时机,推动其临床转化应用。这些研究工作,或将助力优化移植物质量改善策略的开发,并最终扩大可移植器官的供体库。
https://blog.sciencenet.cn/blog-41174-1515803.html
上一篇:短期摄入果糖会提高免疫炎症反应
下一篇:纤连蛋白研究有望为“肠漏症”与重度抑郁症治疗提供新方向