博文
衰老的肿瘤细胞是玩弄免疫的高手
|
衰老细胞在衰老研究领域已经成为热点,选择性清除衰老细胞也成为抗衰老工具的一种类型,研究发现利用复方药物清除衰老细胞有利于缓解组织衰老相关疾病,如动脉硬化、糖尿病、骨质疏松、关节炎、慢性肾病等。一种强有力的疗法是“senolytic”,这是一类针对衰老细胞的药物。包括达沙替尼和槲皮素(D+Q)、漆黄素等。
肿瘤细胞也可以衰老,这些衰老的肿瘤细胞具有双面效应,能促进抗肿瘤免疫功能,也能抑制抗肿瘤作用,这再次体现了肿瘤的复杂性,这种特征不仅让免疫系统对付肿瘤非常困难,也给我们寻找治疗肿瘤策略带来了复杂性。
肿瘤发生是一个由许多关键生物活动驱动的多步骤过程,包括逃避免疫系统介导的破坏。肿瘤细胞获得几种逃避消除的机制,首先是抑制性免疫检查点蛋白的表达和抗原呈递机制的调节(1)。靶向这些肿瘤诱导的免疫抑制途径来利用抗肿瘤免疫已成为对抗癌症的重要治疗策略。这种免疫疗法对一部分肿瘤类型非常有效,但对大多数恶性肿瘤无效(1)。为了设计有效的新治疗干预措施,必须更深入地了解抗肿瘤免疫应答的分子基础以及肿瘤对这些反应的耐药性(1)。
虽然在健康组织中通常很少见,但衰老细胞在肿瘤微环境中的许多肿瘤发生阶段都很常见。尽管我们对衰老细胞在组织中的病理生理作用的大部分理解是基于实验小鼠模型,但衰老细胞在人类健康和疾病中的证据正在出现。衰老细胞的几个亚群可能在人类和小鼠肿瘤发生过程中相关,例如癌基因诱导的衰老(由癌基因突变激活或肿瘤抑制因子丢失引起)或治疗诱导的衰老(在化疗干预或放射治疗期间产生)。基于其促进肿瘤的特性,衰老细胞最近被认为是“癌症的标志”(2)。最近的研究更详细地探索了衰老细胞如何调节抗肿瘤免疫反应。Chen等人(3)、Marin等人(4)和Shabandi 等人(5)发现衰老的肿瘤细胞精通诱导抗原呈递机制。通过增加对干扰素信号传导的敏感性,衰老肿瘤细胞招募先天性和适应性免疫细胞来支持肿瘤消退(3,4)。相反,衰老细胞也参与强大的免疫抑制机制来抑制抗癌免疫反应(5),突出了衰老细胞所起的复杂和双重作用。
一、衰老的肿瘤细胞加热肿瘤微环境
尽管衰老细胞的表型和功能可能有很大差异,但它们的核心特征包括持久的细胞周期停滞和通常包括免疫调节成分的生物活性分泌组。这种与衰老相关的分泌表型起着与疾病相关但微环境依赖性的作用(2),被认为可以促进衰老细胞的免疫监视。例如,通过致癌KRAS诱导衰老的小鼠肝细胞G12V经历细胞周期停滞,产生分泌组,促使巨噬细胞和T细胞接合,并最终被细胞毒性CD8 T细胞消除(6)。同样,已建立的小鼠肝细胞癌中的p53恢复导致衰老和肿瘤消退,这取决于各种免疫细胞(7)。考虑到这些和其他研究所证明的衰老细胞的免疫原性潜力,更深入地了解免疫系统如何清除或忽略衰老的肿瘤细胞可能有助于开发额外的癌症治疗策略。
最近的两项补充研究描述了衰老癌细胞对免疫细胞可见的重要特征(3,4)。在允许p53抑制或恢复的肝肿瘤小鼠模型中,诱导p53介导的衰老适度降低了髓源性抑制细胞和中性粒细胞的比例,同时增加了巨噬细胞和淋巴细胞的数量,表明从免疫“冷”到免疫“热”微环境的转变(3).衰老细胞在其细胞表面蛋白质组中经历了重大重塑,这至少产生了两个重要后果。首先,由于IFN-γ受体IFNGR1的诱导,衰老细胞对II型干扰素(IFN-γ)信号传导变得过敏。其次,衰老细胞增强了主要组织相容性复合体(MHC)I类分子的表达,IFN-γ信号传导进一步增强,以提高其抗原呈递能力(3,4)。有趣的是,衰老肿瘤细胞的抗原加工也可能与非衰老细胞的抗原处理不同。因此,在p1介导的衰老诱导后,肿瘤消退需要IFNGR8和CD53 T细胞(3)。基于衰老细胞的免疫原性潜力,Marin等人(4)探索了衰老肿瘤细胞的预处理是否可以保护小鼠免受肿瘤发展。提供的证据表明,衰老的肿瘤细胞使组织或免疫系统转向肿瘤控制,在减缓肿瘤生长方面提供适度的作用。
总的来说,这些研究阐明了衰老的肿瘤细胞如何控制它们的清除与持久性,这似乎至少部分是由IFN-γ信号传导的完整性决定的。需要更多的研究来了解免疫和抗癌治疗中衰老细胞功能的全部谱。预计这种强调将揭示其他衰老细胞介导的途径,无论是有益的还是有害的,以在肿瘤发生期间调节免疫系统的各个部分。
二、为恒温器而战
如果衰老细胞表现出促进T细胞参与和抗肿瘤免疫的有效特征,那么为什么一些具有高比例衰老细胞的肿瘤没有被根除呢?最近的一项研究开始使用p53野生型乳腺肿瘤来回答这个问题(5)。p53野生型肿瘤患者的生存率低于p53突变型肿瘤患者,并且这些肿瘤对化疗的反应较差。此类肿瘤的化疗可激活 p53 依赖性衰老反应,从而防止有丝分裂灾难。在这种情况下,细胞具有典型的衰老特征,包括理想的免疫原性特征,以潜在地促进免疫介导的肿瘤消除。此外,它们诱导含有免疫调节因子的分泌组,上调抗原呈递机制,并表达CD137L,OX40L和其他支持T细胞活化和效应功能的共刺激受体。然而,这些肿瘤并没有被T细胞消除。一个重要原因是化疗后的肿瘤细胞同时表达有效的免疫抑制信号,例如检查点蛋白程序性细胞死亡配体1(PD-L1)和CD80。当与 T 细胞上各自的受体、程序性细胞死亡蛋白 1 (PD-1) 和细胞毒性 T 淋巴细胞抗原-4 (CTLA-4) 接触时,这些蛋白质会抑制 T 细胞活性、扩增和细胞毒性活性。结果的不幸结果是没有抗肿瘤T细胞活性,最终导致肿瘤复发。
从免疫介导的清除中逃避衰老细胞已被广泛描述,超出了癌症背景。事实上,免疫逃避已被假定为慢性病(包括衰老或疾病)中衰老细胞积累的主要原因(8,9)。最近,在衰老细胞上诱导检查点蛋白PD-L1或PD-L2与衰老细胞免疫监视有因果关系(8,9),这表明T细胞抑制是慢性衰老细胞的保守特征。考虑到检查点抑制在癌症免疫治疗中取得了巨大进展,这些发现可能为在各种环境中靶向有害衰老细胞提供了机会。
有趣的是,PD-L1和CD80主要被发现在小鼠p53中相互排斥表达。文晔化疗后的乳腺肿瘤细胞(5),表明可以产生具有不同性质的衰老肿瘤细胞亚群。由于IFN-γ敏感性,一个亚群诱导PD-L1,而表达CD80的亚群依赖于p53信号传导。在小鼠乳腺肿瘤移植模型中,化疗后用抗体阻断PD-L1或CD80的免疫检查点阻断比单独化疗提供了实质性的益处。T细胞,尤其是CD8效应T细胞,能够浸润肿瘤,导致肿瘤复发的持续延迟,一部分肿瘤永远不会复发。然而,大多数肿瘤最终复发,即使在PD-L1-PD-1和CD80-CTLA-4通路的组合免疫检查点阻断条件下也是如此。这些观察表明,其他信号,无论是衰老细胞依赖性还是独立信号,使肿瘤细胞逃避和p53复发+文晔肿瘤。
三、从寒冷到寒冷
上述和其他研究强调了衰老细胞和T细胞之间的有效串扰,这有助于塑造肿瘤发生和肿瘤微环境(图1)。虽然即时 - 早期衰老细胞反应促进T细胞募集和肿瘤细胞的清除(3,4,6),衰老肿瘤细胞可能在衰老诱导后的后期阶段获得T细胞抑制特性(5,8,9).除了作为变量的时间依赖性动力学之外,根据细胞或肿瘤类型、化疗和衰老诱导模式以及潜在的性别和物种相关依赖性,可以预期额外的复杂性。
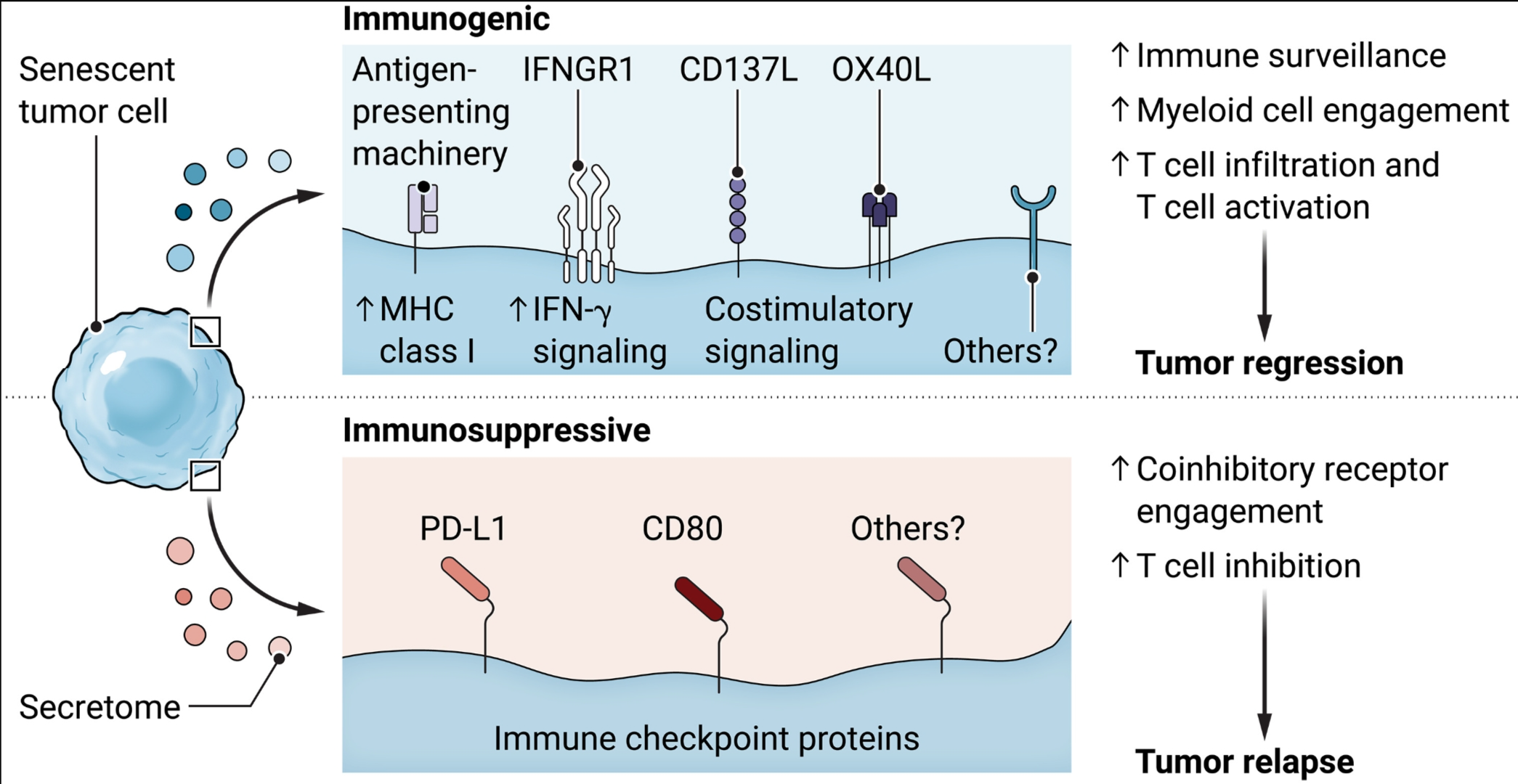
图 1.衰老的肿瘤细胞调节抗肿瘤免疫力。
衰老的肿瘤细胞在癌症中起着双重和相反的作用。衰老的急性诱导重塑其细胞表面蛋白质组以表达抗原呈递机制和共刺激分子。这增加了免疫细胞的参与,并且可以促进免疫介导的肿瘤细胞杀伤。然而,在某些癌症中,衰老肿瘤细胞亚群表达免疫检查点蛋白,例如PD-L1和CD80;它们参与免疫细胞上的共抑制受体,并可能抑制抗肿瘤免疫。
因此,需要对细胞衰老有一个整体的看法,以便仔细考虑衰老细胞在抗肿瘤治疗期间何时可能有益。在这方面,重要的是要补充一点,证据表明癌前衰老细胞具有额外的免疫抑制,促肿瘤性特性,这些细胞也精通吸引各种骨髓细胞类型。虽然衰老细胞募集的单核细胞和巨噬细胞最初似乎有利于促进肿瘤细胞清除(6,7,10),衰老细胞也可以使未成熟的髓系细胞偏向抑制表型(3,8,10).这种特性似乎依赖于肿瘤微环境和背景下的衰老细胞负荷。尽管如此,这种抑制性骨髓亚群不仅擅长抑制T细胞浸润和扩增,还擅长抑制自然杀伤细胞介导的细胞毒性。总的来说,这有利于允许肿瘤生长和进展的肿瘤允许环境(8,10)。
四、结论
细胞衰老是一种复杂的细胞命运,其表型和功能特性可能有很大差异。衰老细胞异质性的原因和后果越来越明显,它们在衰老和疾病中的病理生理效应也越来越明显。同样,抗肿瘤免疫和肿瘤进化领域也具有相当大的复杂性,导致细胞衰老,免疫以及肿瘤发生和发展的交叉点异常复杂。尽管需要付出很多额外的努力才能将发现转化为人类癌症治疗,但越来越明显的是,衰老细胞具有免疫原性潜力,可用于引发抗肿瘤免疫并可能补充抗癌疗法。然而,需要谨慎地发挥这种潜力,以避免衰老细胞的免疫抑制、促肿瘤能力。
https://blog.sciencenet.cn/blog-41174-1391021.html
上一篇:新冠病毒能让细胞融合,可能是脑雾的病理基础
下一篇:缺乏牛磺酸加速衰老,运动可提高这种氨基酸《科学》