博文
氢气吸入用于男子橄榄球运动员训练
||
氢气吸入用于男子橄榄球运动员训练
高强度训练前吸入氢气可降低男子橄榄球运动员一氧化氮生物利用度的衰减
背景: 吸入氢气 (H2) 作为一种抗氧化补充剂,可以减轻运动引起的氧化损伤并保护运动后的过氧化氢信号,这可能有助于介导有益的运动适应。本研究的目的是确定 H 的影响2吸入血浆一氧化氮 (NO) 水平及其合成前体在专业运动员中的作用。
方法: 对职业男子橄榄球运动员进行了一项为期 3 周的随机、安慰剂对照、双盲、交叉试验。参与者接受了 1 周的 H2在每天进行高强度运动训练之前补充和 1 周的安慰剂治疗,间隔 1 周的低强度训练作为清除。
结果: 双向 (补充和时间) 重复测量方差分析显示,H2吸入组运动后 (D6) 显著高于安慰剂组,休息 24 h 后 (D7) 仍高于安慰剂组。H 中羟基脱氧鸟苷和白细胞介素 6 的水平较低2吸入周比安慰剂周在 D6 和 D7 上。此外,总抗氧化水平与 H 显著升高2吸入比与安慰剂相比。
意义: 这些结果表明 H2吸入有助于在运动后维持 NO 信号传导,并缓解专业运动员高强度运动训练引起的炎症和氧化应激。
本研究论文作者来自南京体育学院运动与健康学院等多家单位。
Zhao Y, Li C, Zhou S, Xu Z, Huang X, Wen L. Hydrogen gas inhalation prior to high-intensity training reduces attenuation of nitric oxide bioavailability in male rugby players. PeerJ. 2024 Dec 16;12:e18503.

引言
在体育运动和运动训练中,提高体能表现的一项关键策略基于超负荷原则。然而,超负荷训练往往伴随着炎症和氧化应激,这可能导致组织损伤和疲劳。帮助运动员保持高水平体能表现、减轻疲劳和降低受伤风险的一种方法是补充抗氧化剂。据文献报道,补充维生素C和E可减弱耐力训练诱导的线粒体蛋白增加量,从而削弱对运动的适应性。据报道,补充抗氧化剂别嘌呤醇可减轻氧化应激,但会损害大鼠有益的细胞防御能力以及对运动的适应性。不过,外源性抗氧化剂会钝化有利于运动适应性的细胞信号传导反应,因而可能阻碍训练效果。
先前研究表明,运动诱导产生的超氧阴离子(O₂⁻)、一氧化氮(NO)和过氧化氢(H₂O₂)增加,能够刺激细胞间黏附、细胞信号传导、血管调节和成纤维细胞增殖,以及抗氧化酶的表达。尽管补充维生素C可抑制超氧化物生成并减少活性氧(ROS)总量以减轻氧化损伤,但它也会阻止诸如NO和H₂O₂等运动信号的传递。必须平衡运动适应性与消除运动诱导的氧化应激这两方面相互矛盾的影响,以优化运动训练效果。
我们的研究小组此前在啮齿动物模型中研究了运动前补充各种抗氧化剂(包括维生素C和氢气(H₂))的效果。我们发现吸入氢气在维持骨骼肌抗氧化能力的同时,能促进有益的运动适应性的生物合成。氢气与其他抗氧化补充剂的不同之处在于,它能降低过羟基自由基(OH⁻)和过氧亚硝酸盐(ONOO⁻)水平,同时保留作为细胞生理信号的超氧阴离子水平。大泽等人(2007年)已表明,氢气可以快速捕获并减少这些自由基。通常在运动过程中,骨骼肌收缩会通过激活一氧化氮合酶异构体诱导一氧化氮生成量增加。超氧阴离子(O₂⁻)与一氧化氮(NO)反应生成过氧亚硝酸盐(ONOO⁻)的速度比超氧阴离子(O₂⁻)歧化生成过氧化氢(H₂O₂)的速度大约快三倍。这就是运动过程中产生的过氧亚硝酸盐(ONOO⁻)会降低一氧化氮生物利用度的关键原因。然而,与此同时,运动过程中产生的过氧亚硝酸盐(ONOO⁻)会降低一氧化氮水平。苏尔等人(2009年)报道,在冰球运动员进行两次急性训练后,内皮型一氧化氮合酶(eNOS)含量、活性以及一氧化氮生成量均有所下降。出现这些降低情况是因为在应激条件下,活性氧(ROS)和一氧化氮结合生成过氧亚硝酸盐(ONOO⁻),这加剧了内皮型一氧化氮合酶(eNOS)的解偶联,而且过氧亚硝酸盐(ONOO⁻)会氧化辅因子四氢生物蝶呤(BH₄)。
鉴于所有这些研究发现,我们假设补充氢气会产生抗氧化作用,从而保护一氧化氮信号以应对运动训练。为验证这一假设,我们设计了一项为期3周、随机、双盲、对照且采用交叉设计的研究,旨在探究运动前吸入富氢气体对一组职业橄榄球运动员运动后一氧化氮信号传导的影响。为追踪一氧化氮水平的变化,我们评估了一氧化氮合成前体L - 精氨酸(L - Arg)和辅因子四氢生物蝶呤(BH₄)的水平。我们进一步假设补充氢气会减轻氧化损伤和炎症,这将在高强度运动后带来有益的血管适应性。为检验补充氢气是否会减轻氧化应激和炎症,我们测量了氧化损伤标志物和炎症因子的水平。
方法
参与者
共有24名男性运动员自愿参与本研究,平均年龄为23 ± 2.65岁,体重为88.32 ± 6.53千克,身高为183.73 ± 5.88厘米。参与者均为高水平职业橄榄球运动员,且至少接受过6年的专业训练。所有参与者在训练期间都住在运动员宿舍,由运动员食堂提供饮食,饮食情况相似。他们未服用任何膳食补充剂。在实验期间,没有参与者有重大伤病情况,在每次测试前24小时内既未饮酒,也未饮用含高咖啡因的饮料,亦未摄入任何已知会改变激素反应的物质。
本研究已获得南京体育学院人体实验伦理委员会批准(RT - 2023 - 10),并按照《赫尔辛基宣言》关于人体实验的规定开展。在招募参与者之前,本研究已在中国临床试验注册中心注册(注册号:ChiCTR2300071589)。所有参与者在研究开始前均提供了书面知情同意书。
研究设置与设计
本研究采用随机、双盲、安慰剂对照、交叉设计。使用G*Power 3.1.9.6版本估算达到所需统计功效的最小样本量,在采用双向重复测量方差分析(ANOVA)、设定一类错误为0.05、二类错误为0.20以及效应量为0.30的假设条件下,确定所需参与者数量为20名。招募的24名参与者被随机分配到两组中的一组(先接受氢气补充组,或先接受安慰剂组),由研究团队之外且不认识研究人员及参与者的人员进行等数量分配。随机分组序列通过Microsoft Excel创建,随机区组大小为2、4和6。氢气和安慰剂由第三方(未参与实验)在每次干预前准备。制造氢气和安慰剂的设备通过定制的盒子对参与者完全设盲。参与者和研究人员只能看到设备的软管,而不知道里面的内容。两条气体输出软管在形状和颜色上完全相同。研究人员按照研究团队负责人给出的时间表来实施富氢空气或安慰剂空气的吸入操作。
在实验期间,运动员的教练将训练周期设置为正常训练周后接调整周,每周有6天训练(第1天 - 第6天)和1天休息(第7天)。所有参与者遵循相同的训练计划。训练周的训练计划强度高于调整周。日常训练计划通常包括90 - 120分钟的体能锻炼、30 - 45分钟的高强度间歇训练、90 - 120分钟的团队技战术训练、60 - 90分钟的个人技术训练以及60 - 90分钟的包括拉伸和理疗在内的恢复训练。每次测试前一周的训练计划受到控制,并且日常训练计划都有记录。第三周的训练计划与第一周完全相同(见附录S1)。调整周的训练计划与训练周相同,但运动强度较低,重点在于恢复。
在第一个训练周,每组参与者在每个训练日训练前1小时开始吸入指定补充剂(氢气或安慰剂),时长为20分钟。每周的第7天为休息日,无训练计划安排,也不进行氢气或安慰剂干预。在第二个被视为洗脱期的周内,没有参与者接受补充剂,但参与低强度训练。在第三个训练周,每组参与者在参与与第一周相同的高强度训练的同时,接受他们在第一周未接受过的补充剂(交叉设计)。在第一周和第三周的第1天训练前、第6天训练后以及非训练日的第7天采集血液样本。
富氢气体
氢气可直接吸入肺部,并迅速通过血液输送到组织。据报道,相较于摄入富氢水,参与者在短时间内能够吸入更多的氢气。为了不干扰运动员的训练常规,我们选择通过吸入的方式进行氢气补充。
富氢气体由氢氧呼吸机(五朵云企业管理科技有限公司,X9型)产生,已知氢气和氧气浓度分别为66.7%和33.3%。安慰剂为压缩的普通空气。参与者通过面罩呼吸气体。面罩通过软管与混合室相连。无论是实施气体供给的人员还是参与者,都不清楚所给的是何种气体。(药物试验最重要的是给药剂量,原文没有给出吸入气体的流量)
血液样本采集
由采血员从肘前静脉采集血液样本。在第一周采集三次血液样本,第三周采集三次血液样本,在第二周(休息/洗脱期)不采集血液样本。血液在第1天训练前1小时(在吸入氢气或安慰剂之前)、第6天训练后1小时以及第7天训练前1小时(与第1天同一时间)采集。在运动后1小时进行采血,目的是评估运动诱导产生的峰值生理反应。
血液样本在4℃下以1000×g离心15分钟(使用Sigma公司的3K15型离心机),然后将血清转移至离心管中,并在分析前储存于 - 80℃环境下。
检测的血液指标
我们检测了一氧化氮合成前体L - 精氨酸(L - Arg)及其辅助因子四氢生物蝶呤(BH₄),以追踪一氧化氮水平的变化。采用酶联免疫吸附测定(ELISA)试剂盒来评估血清一氧化氮(BC1475)、内皮型一氧化氮合酶(eNOS)(CSB - E08322h)、L - 精氨酸(K749;美国百奇生物公司)和四氢生物蝶呤(BH₄)(OKEH02612)。操作过程严格按照试剂盒说明书进行。
鉴于氢气本身具有抗氧化和抗炎特性,以及超负荷训练产生的过氧亚硝酸盐(ONOO⁻)不仅会降低一氧化氮的利用,还会导致DNA断裂、脂质氧化和蛋白质硝化,我们检测了氧化损伤标志物和炎症因子,以确定氢气对氧化损伤和炎症的影响。采用酶联免疫吸附测定(ELISA)试剂盒来评估血清8 - 羟基 - 2′ - 脱氧鸟苷(8 - OHdG)、蛋白质羰基化(DTJ - 1 - G;)、脂质丙二醛(BC0025)、总抗氧化能力、白细胞介素 - 6(IL - 6)和白细胞介素 - 10。操作过程严格按照试剂盒说明书进行。
统计分析
所有实验数据均使用SPSS统计软件(适用于Windows系统的IBM SPSS 25版本)进行处理。呈现所有测量变量的均值和标准差(SD)。采用双向重复测量方差分析来确定补充剂(氢气和安慰剂)、时间(每个训练周的第1天、第6天和第7天)以及补充剂×时间交互作用的影响。使用夏皮罗 - 威尔克检验来评估数据的正态分布情况。当数据集不符合正态分布时(例如四氢生物蝶呤(BH₄)和丙二醛),则应用非参数曼 - 惠特尼检验。使用球形度的马氏检验来确定方差齐性。如果违背该假设,则进行格林豪斯 - 盖泽尔校正。当双向重复测量方差分析存在显著的交互作用或主效应时,采用邦费罗尼校正进行事后分析,以对基线与各时间点之间的变化进行两两比较。
结果
在训练期间,有两名参与者因受伤退出了研究。对两组的数据进行了合并,最终分析纳入了完成氢气和安慰剂两种干预措施的22名参与者的数据。
一氧化氮的生成
一氧化氮
双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在一氧化氮水平上存在具有统计学意义的交互作用(F(2, 41) = 6.075,p = 0.003,η² = 0.126)。简单主效应分析显示,时间确实有显著影响(F(2, 41) = 31.798,p < 0.001,η² = 0.431)。
组间简单效应检验结果表明,运动后(第6天:氢气干预组为27.15 ± 11.40 μmol/mL,安慰剂组为20.94 ± 7.78 μmol/mL;F = 4.445,p = 0.041)以及休息后(第7天:氢气干预组为38.48 ± 11.24 μmol/mL,安慰剂组为29.79 ± 9.05 μmol/mL;F = 7.963,p = 0.007),氢气干预下的一氧化氮水平显著高于安慰剂干预下的一氧化氮水平。
事后比较显示,在氢气补充干预下,休息后的一氧化氮水平显著高于基线水平(第7天,38.48 ± 11.24 μmol/mL对比第1天,30.44 ± 12.88 μmol/mL,p < 0.001),也显著高于运动后水平(第7天,38.48 ± 11.24 μmol/mL对比第6天,27.15 ± 11.40 μmol/mL,p < 0.001)。在安慰剂处理下,运动后的一氧化氮水平显著低于基线水平(第6天,20.94 ± 7.78 μmol/mL对比第1天,30.42 ± 8.62 μmol/mL,p < 0.001),也显著低于休息后水平(第6天,20.94 ± 7.78 μmol/mL对比第7天,29.79 ± 9.05 μmol/mL,p < 0.001)。图1展示了接受安慰剂或氢气补充后不同时间点的血清一氧化氮水平。
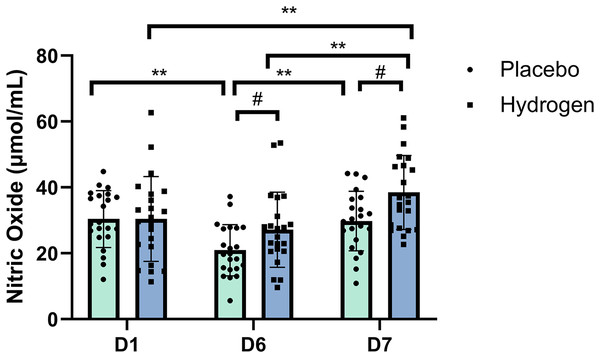
图1:一氧化氮水平相对于基线的变化情况。 变化情况是在运动前分别给予补充氢气与安慰剂,经过1周高强度训练后出现的。**p < 0.01表示在安慰剂或氢气处理下不同时间点之间存在显著差异;#p < 0.05表示在同一时间点安慰剂和氢气处理之间存在显著差异。D1代表基线;D6代表训练1周后;D7代表休息日。 一氧化氮合酶(NOS) 双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在一氧化氮合酶(NOS)水平上不存在具有统计学意义的交互作用(F(2, 41) = 0.091,p = 0.913,η² = 0.002)。 图2A展示了在安慰剂和氢气处理下,不同时间点一氧化氮合酶(NOS)的水平情况。
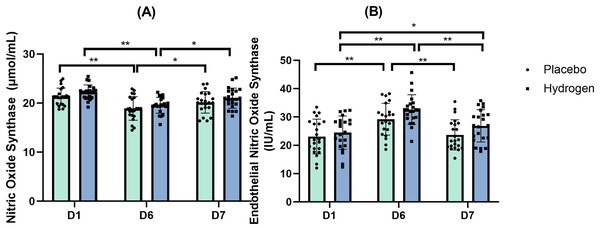
图2:一氧化氮合酶(A)和内皮型一氧化氮合酶(B)相对于基线的变化情况。 水平变化情况是在运动前1小时分别给予补充氢气与安慰剂,经过1周高强度运动训练后出现的。*p < 0.05以及**p < 0.01表示在安慰剂或氢气处理下不同时间点之间存在显著差异。D1代表基线;D6代表训练1周后;D7代表休息日。 内皮型一氧化氮合酶(eNOS) 双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在内皮型一氧化氮合酶(eNOS)水平上不存在具有统计学意义的交互作用(F(2, 41) = 0.811,p = 0.428,η² = 0.019)。简单主效应分析显示,时间对其有统计学上的显著影响(F(2, 41) = 37.388,p < 0.001,η² = 0.471)。 事后比较显示,在补充氢气的情况下,运动后的内皮型一氧化氮合酶(eNOS)水平显著高于基线水平(D6,32.61 ± 5.32 IU/mL对比D1,24.47 ± 5.89 IU/mL,p < 0.001),且运动后水平也显著高于休息后水平(D6,32.61 ± 5.32 IU/mL对比D7,26.87 ± 5.69 IU/mL,p < 0.001)。此外,休息后的血清内皮型一氧化氮合酶(eNOS)水平也显著高于基线水平(D7,26.87 ± 5.69 IU/mL对比D1,24.47 ± 5.89 IU/mL,p = 0.039)。在安慰剂处理下,运动后的内皮型一氧化氮合酶(eNOS)水平也显著高于基线水平(D6,29.22 ± 5.61 IU/mL对比D1,23.10 ± 6.13 IU/mL,p < 0.001),且运动后水平也显著高于休息后水平(D6,29.22 ± 5.61 IU/mL对比D7,23.70 ± 5.33 IU/mL,p < 0.001)。图2B展示了在安慰剂和氢气处理下,不同时间点内皮型一氧化氮合酶(eNOS)的水平情况。 四氢生物蝶呤(BH4) 曼 - 惠特尼检验的结果显示,在第1天(基线)时,补充氢气和安慰剂在四氢生物蝶呤(BH4)水平上没有显著差异(Z = -1.844,p = 0.065),但在第6天(运动后)(Z = -3.574,p < 0.001)以及第7天(休息后)(Z = -2.679,p = 0.007)存在显著差异。 运动后(D6),补充氢气组和安慰剂组之间的四氢生物蝶呤(BH4)水平存在显著差异(氢气组:0.922 ± 0.003 ng/mL,安慰剂组:0.917 ± 0.004 ng/mL,p < 0.001)。休息后(D7),补充氢气组和安慰剂组之间的四氢生物蝶呤(BH4)水平也存在显著差异(氢气组:0.922 ± 0.004 ng/mL,安慰剂组:0.918 ± 0.004 ng/mL,p < 0.001)。 在补充氢气的情况下,四氢生物蝶呤(BH4)水平在基线时显著低于运动后(D1,0.919 ± 0.004 ng/mL对比D6,0.922 ± 0.003 nmol/mL,p = 0.007)以及休息后(D1,0.919 ± 0.004 ng/mL对比D7,0.922 ± 0.004 nmol/mL,p = 0.022)的水平。在安慰剂处理下,运动后的四氢生物蝶呤(BH4)水平显著低于基线水平(D6,0.917 ± 0.004 ng/mL对比D1,0.920 ± 0.002 ng/mL,p < 0.001)(图3A)。
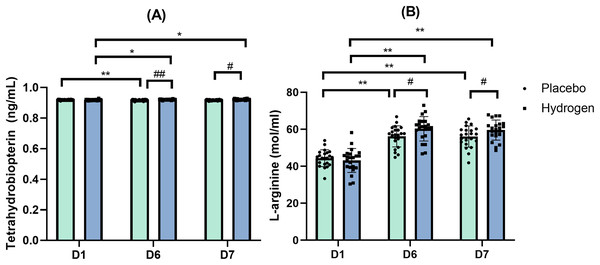
图3:四氢生物蝶呤(A)和L - 精氨酸(B)相对于基线的水平变化情况。
变化情况是在运动前1小时给予补充氢气或安慰剂,经过1周高强度运动训练后出现的。*p < 0.05以及**p < 0.01表示不同时间点之间存在显著差异;#p < 0.05以及##p < 0.01表示在同一时间点安慰剂和氢气处理之间存在显著差异。D1代表基线;D6代表训练1周后;D7代表休息日。
L - 精氨酸
双向重复测量方差分析的结果表明,补充剂和时间在L - 精氨酸水平方面存在具有统计学意义的交互作用(F(2, 41) = 3.383,p = 0.039,η² = 0.075)。简单主效应分析显示,时间对L - 精氨酸水平确实有统计学上的显著影响(F(2, 41) = 108.822,p < 0.001,η² = 0.722)。
简单效应检验结果显示,运动后,补充氢气组的L - 精氨酸水平显著高于安慰剂组(氢气组:60.30 ± 6.60 mol/mL,安慰剂组:56.23 ± 5.70 mol/mL,p = 0.034)。休息后(D7),补充氢气时的L - 精氨酸水平也显著高于使用安慰剂时的水平(氢气组:59.62 ± 5.44 mol/mL,安慰剂组:56.09 ± 5.73 mol/mL,p = 0.042)(图3B)。
事后比较显示,在补充氢气的情况下,L - 精氨酸水平在基线时显著低于运动后(D6,60.30 ± 6.60 mol/mL对比D1,43.19 ± 6.48 mol/mL,p = 0.030)以及休息后(D7,59.62 ± 5.44 mol/mL对比D1,43.19 ± 6.48 mol/mL,p < 0.001)的水平。同样,在使用安慰剂的情况下,L - 精氨酸水平在基线时也显著低于运动后(D6,56.23 ± 5.70 mol/mL对比D1,44.40 ± 4.54 mol/mL,p < 0.001)以及休息后(D7,56.09 ± 5.73 mol/mL对比D1,44.40 ± 4.54 mol/mL,p < 0.001)的水平。
氧化损伤与抗氧化能力
8 - 羟基脱氧鸟苷(8 - OHdG)
双向重复测量方差分析的结果表明,补充剂和时间在8 - 羟基脱氧鸟苷水平方面存在具有统计学意义的交互作用(F(2, 41) = 3.906,p = 0.024,η² = 0.085)。简单主效应分析显示,补充剂(F(1, 42) = 11.620,p = 0.001,η² = 0.217)和时间(F(2, 41) = 85.475,p < 0.001,η² = 0.671)对作为氧化应激所致DNA损伤常用标志物的8 - 羟基脱氧鸟苷水平均有显著影响。
运动后(D6)及休息后(D7),补充氢气时的8 - 羟基脱氧鸟苷水平显著低于使用安慰剂时的水平(运动后:氢气组为219.77 ± 43.37 ng/mL,安慰剂组为258.81 ± 43.23 ng/mL,p = 0.005;休息后:氢气组为130.46 ± 33.39 ng/mL,安慰剂组为170.73 ± 36.58 ng/mL,p < 0.001)。
事后比较显示,在补充氢气的情况下,运动后的8 - 羟基脱氧鸟苷水平显著高于基线水平(D6,219.77 ± 43.37 ng/mL对比D1,148.65 ± 40.46 ng/mL,p < 0.001),且运动后水平也显著高于休息后水平(D6,219.77 ± 43.37 ng/mL对比D7,130.46 ± 33.39 ng/mL,p < 0.001)。在使用安慰剂处理的情况下,运动后的8 - 羟基脱氧鸟苷水平显著高于基线水平(D6,258.81 ± 43.23 ng/mL对比D1,150.14 ± 41.87 mol/mL,p < 0.001),且运动后水平也显著高于休息后水平(D6,258.81 ± 43.23 ng/mL对比D7,170.73 ± 36.58 ng/mL,p < 0.001)(图4A)。
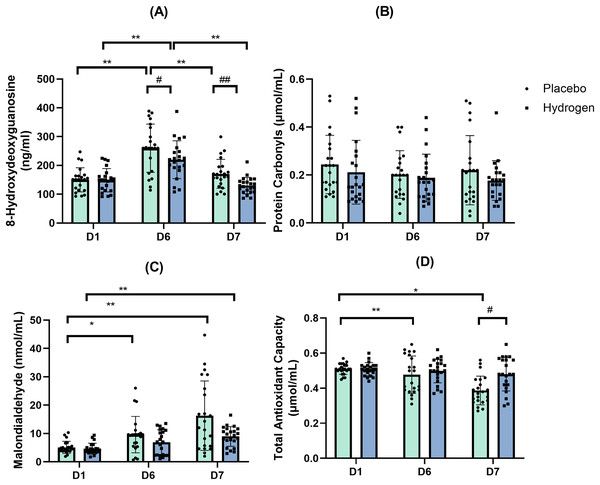
图4:8 - 羟基脱氧鸟苷(A)、蛋白质羰基(B)、丙二醛(C)和总抗氧化能力(D)水平的变化情况。
变化情况是在运动前1小时给予补充氢气或安慰剂,经过1周高强度运动训练后相对于基线的变化。*p < 0.05以及**p < 0.01表示在安慰剂或氢气处理下不同时间点之间存在显著差异;#p < 0.05以及##p < 0.01表示在同一时间点安慰剂和氢气处理之间存在显著差异。D1代表基线;D6代表训练1周后;D7代表休息日。
蛋白质羰基
双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在蛋白质羰基水平上不存在具有统计学意义的交互作用(F(2, 41) = 0.349,p = 0.707,η² = 0.349)(图4B)。
丙二醛
在安慰剂处理下,基线时的丙二醛水平显著低于运动后(D1,5.07 ± 2.14 nmol/mL对比D6,9.60 ± 2.41 nmol/mL,p = 0.015)以及休息后(D1,5.07 ± 2.14 nmol/mL对比D7,16.27 ± 12.25 nmol/mL,p < 0.001)的水平。相比之下,在补充氢气后,休息后的丙二醛水平显著高于基线水平(D7,8.96 ± 3.49 nmol/mL对比D1,4.61 ± 1.94 nmol/mL,p < 0.001)(图4C)。
总抗氧化能力
双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在总抗氧化能力方面存在具有统计学意义的交互作用(F(2, 41) = 5.574,p = 0.008,η² = 0.117)。简单主效应分析显示,补充剂(F(1, 42) = 6.518,p = 0.014,η² = 0.134)和时间(F(2, 41) = 14.037,p < 0.001,η² = 0.250)对总抗氧化能力均有显著影响。
简单效应检验显示,在休息时,补充氢气后的总抗氧化能力高于安慰剂组(氢气组为0.48 ± 0.10 μmol/mL,安慰剂组为0.39 ± 0.08 μmol/mL,p = 0.001)。
在安慰剂处理下,休息后的总抗氧化能力显著低于基线水平(D7,0.38 ± 0.08 μmol/mL对比D1,0.39 ± 0.08 μmol/mL,p < 0.001),也显著低于运动后水平(D7,0.38 ± 0.08 μmol/mL对比D6,0.48 ± 0.11 μmol/mL,p = 0.002)(图4D)。
炎症因子
白细胞介素-1β
双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在白细胞介素-1β水平上不存在具有统计学意义的交互作用(F(2, 41) = 1.616,p = 0.211,η² = 0.037)。简单主效应分析显示,补充剂对白细胞介素-1β水平没有显著影响(F(1, 42) = 1.000,p = 0.323,η² = 0.023),而时间有显著影响(F(2, 41) = 11.813,p < 0.001,η² = 0.220)。
在安慰剂处理下,血清白细胞介素-1β水平在基线(D1)时显著低于运动后(D6:69.37 ± 43.68 pg/mL对比D1,51.20 ± 34.22 pg/mL,p = 0.022)以及休息后(D7,93.30 ± 71.84 pg/mL对比D1,51.20 ± 34.22 pg/mL;p = 0.000)的水平。在补充氢气后,运动后(D6)和休息后(D7)的值与D1相比没有显著差异(图5A)。
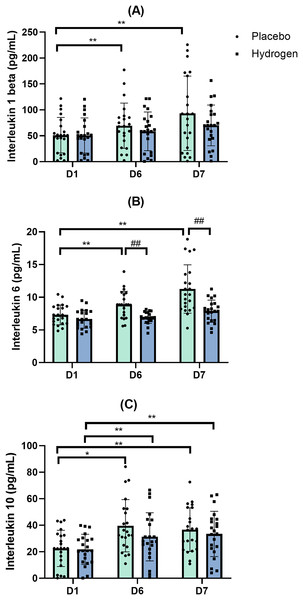
图5:白细胞介素-1β(A)、白细胞介素-6(B)和白细胞介素-10(C)相对于基线的血清水平变化情况。
变化情况是在运动前1小时给予安慰剂或补充氢气,经过1周高强度运动训练后出现的。*p < 0.05以及**p < 0.01表示在安慰剂或氢气处理下不同时间点之间存在显著差异;##p < 0.01表示在同一时间点安慰剂和氢气处理之间存在显著差异。D1代表基线;D6代表训练1周后;D7代表休息日。
白细胞介素-6(IL-6)
双向重复测量方差分析的结果表明,补充剂和时间这两个主效应在白细胞介素-6水平上存在具有统计学意义的交互作用(F(2, 41) = 8.488,p = 0.001,η² = 0.168)。简单主效应分析显示,补充剂(F(1, 42) = 16.762,p < 0.001,η² = 0.285)和时间(F(2, 41) = 31.662,p < 0.001,η² = 0.430)对白细胞介素-6水平均有显著影响。
在运动后(D6)及休息后(D7),补充氢气后的白细胞介素-6水平显著低于安慰剂干预后的水平(运动后:氢气组为6.87 ± 0.87 pg/mL,安慰剂组为8.87 ± 2.04 pg/mL,p < 0.001;休息后:氢气组为7.87 ± 1.69 pg/mL,安慰剂组为11.26 ± 3.69 pg/mL,p < 0.001)。
事后比较显示,在安慰剂处理下,休息后的白细胞介素-6水平显著高于基线水平(D7,11.26 ± 3.69 pg/mL对比D1,7.31 ± 1.52 pg/mL,p < 0.001),也显著高于运动后水平(D7,11.26 ± 3.69 pg/mL对比D6,8.87 ± 2.04 pg/mL,p < 0.001)(图5B)。
白细胞介素-10(IL-10)
双向重复测量方差分析的结果表明,补充剂和时间这两个因素对白细胞介素-10水平的影响不存在具有统计学意义的交互作用(F(2, 41) = 1.201,p = 0.306,η² = 0.028)。简单主效应分析显示,补充剂对白细胞介素-10水平没有统计学上的显著影响(F(1, 42) = 1.071,p = 0.307,η² = 0.025),而时间(F(2, 41) = 18.121,p < 0.001,η² = 0.301)对白细胞介素-10水平有统计学上的显著影响。
在安慰剂处理下,运动后(D6)的血清白细胞介素-10水平显著高于基线水平(D1,22.55 ± 13.65 pg/mL对比D6,39.65 ± 19.69 pg/mL,p < 0.001),且休息后(D7)仍高于基线水平(D1,22.55 ± 13.65 pg/mL对比D7,36.69 ± 16.41 pg/mL,p = 0.001)。同样,在补充氢气的情况下,运动后的白细胞介素-10水平也显著高于基线水平(D1,21.82 ± 11.36 pg/mL对比D6,31.28 ± 18.19 pg/mL,p = 0.009),休息后仍显著高于基线水平(D1,21.82 ± 11.36 pg/mL对比D7,33.47 ± 17.06 pg/mL,p = 0.008)(图5C)。
讨论
据我们所知,这项为期3周、随机、双盲、对照且采用交叉设计的研究首次报道了运动前吸入富氢气体能够减轻氧化损伤和炎症,同时维持血液中一氧化氮的水平。先前研究表明,运动过程中动脉血氧饱和度会下降。这种缺氧情况会在氧气可利用性降低时增加活性氧(ROS)的产生,降低一氧化氮的生物利用度,不利于对运动和训练产生适应性反应。先前研究还显示,剧烈运动会降低小鼠血液中的一氧化氮水平,这限制了其对心血管系统的积极作用。剧烈运动时一氧化氮水平之所以降低,是因为会形成过氧亚硝酸盐(ONOO⁻)。我们的研究结果显示,在经过1周的运动训练后(最后一次训练结束1小时后),运动员在运动前吸入富氢气体时,血液中的一氧化氮水平有所升高。因此,补充氢气似乎有助于在运动和训练后维持一氧化氮水平,保护一氧化氮生成途径,并使一氧化氮的抗氧化作用得以发挥。维持血液中一氧化氮的最佳水平对血流有益,可增加氧气的可利用性(以及最大摄氧量),并减少活性氧(ROS)的产生。
提高一氧化氮的生物利用度
文献中大多数相关研究聚焦于长期训练后一氧化氮的血管舒张作用,却忽视了剧烈运动引发的氧化应激对一氧化氮的消耗。在我们这项研究的安慰剂处理组中,运动后的一氧化氮水平显著低于基线水平。我们的研究结果首次表明,当氢气发挥针对性抗氧化作用时,一氧化氮的生物利用度能够进一步提高。补充氢气1周后,血液中的一氧化氮水平高于基线水平。我们的研究结果还显示,经过一晚休息后,接受氢气补充的运动员血液中的一氧化氮水平仍高于安慰剂处理后的水平。研究表明,血液中的一氧化氮通过环鸟苷酸(cGMP)依赖的信号传导,影响细胞膜的流动性和变形能力,这对其通过微循环以及向运动所用肌肉输送氧气非常重要。造成这一结果可能有两个因素。首先,在为期一周的运动期间,运动员的一氧化氮生成途径产生了适应性变化,休息后(D7)的基线状态下内皮型一氧化氮合酶(eNOS)的表达高于基线值。其次,氢气的抗氧化作用旨在降低过氧亚硝酸盐(ONOO⁻)水平,且不会进一步破坏一氧化氮的水平。
一氧化氮的生物利用度取决于其合成与消耗(例如被活性氧消耗)之间的动态平衡。我们认为,补充氢气的抗氧化作用在这两方面都发挥了作用。首先,运动后一氧化氮和内皮型一氧化氮合酶(eNOS)的消耗在安慰剂组和氢气补充组呈现出相同特征。已有研究表明,运动诱导的血管壁剪切应力增加会提高血管内皮型一氧化氮合酶(eNOS)的表达和活性,从而增加全身一氧化氮的生成量及生物利用度。然而,这一过程似乎并不适用于每天都进行训练的职业运动员。在本研究的安慰剂组中,运动员运动后的一氧化氮合酶(NOS)水平低于基线水平,但内皮型一氧化氮合酶(eNOS)水平与基线水平相同。在补充氢气后,经过6天运动训练后的休息日,内皮型一氧化氮合酶(eNOS)水平高于基线水平。因此,在应激条件下,补充氢气具有抗氧化作用,可减少内皮型一氧化氮合酶(eNOS)的解偶联。其次,我们发现补充氢气能够保护一氧化氮合成途径中的关键分子四氢生物蝶呤(BH4)和L - 精氨酸(L - Arg)的水平,从而有助于在运动后维持一氧化氮水平。运动过程中活性氧(ROS)水平升高最终会消耗四氢生物蝶呤(BH4)。因此,当氢气发挥其抗氧化特性时,四氢生物蝶呤(BH4)的消耗就会减少。运动员运动后的四氢生物蝶呤(BH4)水平高于其基线水平。休息后,内皮型一氧化氮合酶(eNOS)二聚体的形成未受阻碍,内皮型一氧化氮合酶(eNOS)继续以L - 精氨酸(L - Arg)为底物、以四氢生物蝶呤(BH4)为辅助因子合成一氧化氮。这一过程保护了运动员在运动后持续产生一氧化氮的能力。
减轻氧化应激
有人提出,增加一氧化氮合成是一把双刃剑。一方面,因其血管舒张作用,它能够改善血液灌注;另一方面,一氧化氮会迅速与氧气反应生成过氧亚硝酸盐(ONOO⁻),这会降低大鼠心脏的最大收缩力,损害心室肌细胞的收缩能力。过氧亚硝酸盐(ONOO⁻)能够氧化DNA碱基,尤其是鸟嘌呤,这会导致碱基错配和DNA突变,造成遗传不稳定。这些氧化反应会破坏蛋白质结构,改变其功能或使其失活。在运动过程中,超氧阴离子(O₂⁻)与一氧化氮反应生成过氧亚硝酸盐(ONOO⁻),这不仅损害一氧化氮的生物利用度,还会增加氧化损伤标志物的水平。因此,当分子氢选择性地清除过氧亚硝酸盐(ONOO⁻)时,它不仅保护一氧化氮信号传导,还能减少对蛋白质中DNA造成氧化损伤的过氧亚硝酸盐(ONOO⁻)。吸入氢气似乎有助于平衡这两个方面。我们的研究结果显示,运动后血液中8 - 羟基 - 2′ - 脱氧鸟苷(8 - OHdG)和丙二醛的水平均显著升高。休息后,丙二醛水平仍高于基线水平。补充氢气并没有显著改变氧化损伤标志物的变化情况,但与安慰剂处理相比,降低了血液中8 - 羟基 - 2′ - 脱氧鸟苷(8 - OHdG)的水平。有趣的是,在柴山等人(2020年)的研究中,参与者在运动后摄入氢气(氢气浓度与本研究相同),但血清中氧化标志物的变化并不显著。这两项报告之间的差异表明,摄入氢气的时间可能会显著影响氧化应激水平。运动员的总抗氧化能力在训练过程中逐渐下降,而摄入氢气使运动员在高强度训练期间能够维持一定水平的抗氧化能力。此外,经过一晚休息后,补充氢气后的总抗氧化能力高于安慰剂组。这一发现与多巴希、竹内和小山(2020年)的研究结果一致。在他们的研究中,参与者连续运动3天,补充富氢水组的总抗氧化能力高于安慰剂组。诺盖拉等人(2021年)以及诺盖拉等人(2018年)的研究也表明,氢气在小鼠急性运动后提高了骨骼肌中抗氧化酶的活性,这意味着氢气对抗氧化能力有积极作用,这与我们的研究结果相符。
缓解炎症水平
剧烈运动可能导致活性氧(ROS)过量产生,这可能引发细胞损伤,进而出现炎症而非适应性变化。许多研究表明氢气具有抗炎作用,我们的研究结果在这方面进一步提供了证据。与安慰剂处理相比,补充氢气在运动训练后(D6)和休息一天后(D7)均使血清白细胞介素-6(IL - 6)水平显著降低。有趣的是,在安慰剂组中,白细胞介素-1β水平在运动训练后(D6)和休息后(D7)均高于基线水平,而氢气组中的白细胞介素-1β水平并未呈现出这种差异。白细胞介素-1β的细胞生成是一个受到严格调控的过程,只有在响应炎症信号时才会发生。在长期运动过程中,白细胞介素-1β水平升高,介导血管壁炎症,增加白细胞趋化性,产生活性氧(ROS),并加剧氧化应激。此外,炎症因子通过刺激活性氧(ROS)的产生来降低一氧化氮的生物利用度。正如本研究安慰剂组所呈现的那样,运动员在剧烈训练期间炎症水平升高,并且炎症细胞因子水平与氧化损伤标志物升高的趋势相吻合。然而,氢气缓解了高强度训练期间的炎症反应;因此,氢气组和安慰剂组之间不再存在差异。所以,在本研究中,补充氢气所诱导的炎症因子变化似乎归因于其抗炎作用,这有助于保护一氧化氮信号传导。
局限性
本研究存在一些局限性。参与者均为男性,因此,所得结论可能不适用于女性职业运动员。在未来的研究中,我们将确保样本中包含足够数量的女性,以确定在氢气补充效果方面是否存在性别差异。
结论
本研究结果支持了我们的假设,即运动训练前吸入富氢气体将提高职业运动员运动后的一氧化氮水平,并在运动后的一段时间内维持一氧化氮合成关键分子的水平。这些效应保护了运动训练期间一氧化氮信号的响应。氢气同时发挥抗氧化和抗炎作用,降低了运动后氧化损伤标志物和炎症因子的水平。然而,本研究仅考察了男性运动员,氢气对女性运动员是否有相同作用还需要进一步研究。
本研究的发现为支持职业运动员补充氢气以减轻运动诱导的氧化应激和损伤以及促进训练后恢复的做法提供了证据。未来有必要开展研究,探究支撑氢气补充对运动员训练期间一氧化氮信号传导影响的分子机制,以优化心血管适应性。
https://blog.sciencenet.cn/blog-41174-1465640.html
上一篇:如何确保只有死亡的细胞才会破裂
下一篇:藻类利用水下光谱感知深度