博文
培养皿中的迷你心脏
||
培养皿中的迷你心脏
诸平
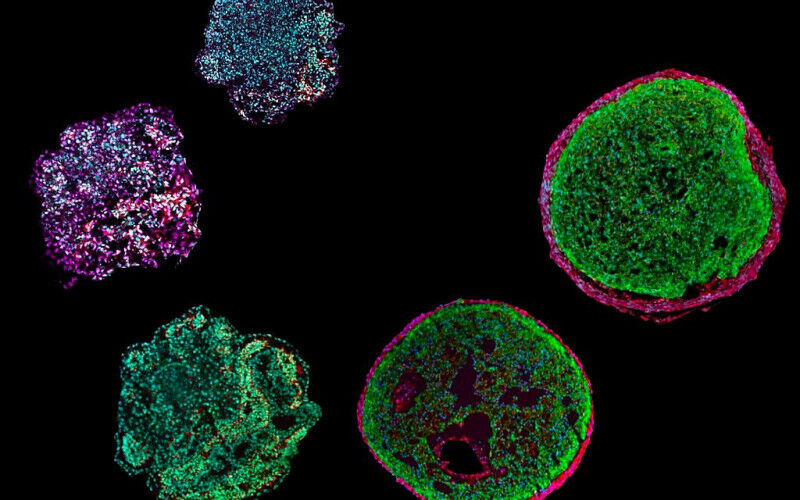
据德国慕尼黑工业大学(Technical University of Munich简称TUM, Germany)2023年4月4日提供的消息,慕尼黑工业大学 (TUM) 的一个团队已经诱导干细胞模拟人类心脏的发育。结果是一种被称为类器官的“迷你心脏”(A mini-heart in a Petri dish)。它将允许研究我们心脏的最早发育阶段,并促进疾病研究。上述图1(Fig. 1)显示了这些“心外膜样细胞”("epicardioids")——由多能干细胞制成的类器官——大小仅为0.5 mm。研究人员可以利用它们在实验室中模拟人类心脏的发育,研究遗传性心脏病。
类器官的进展(Progress with organoids)
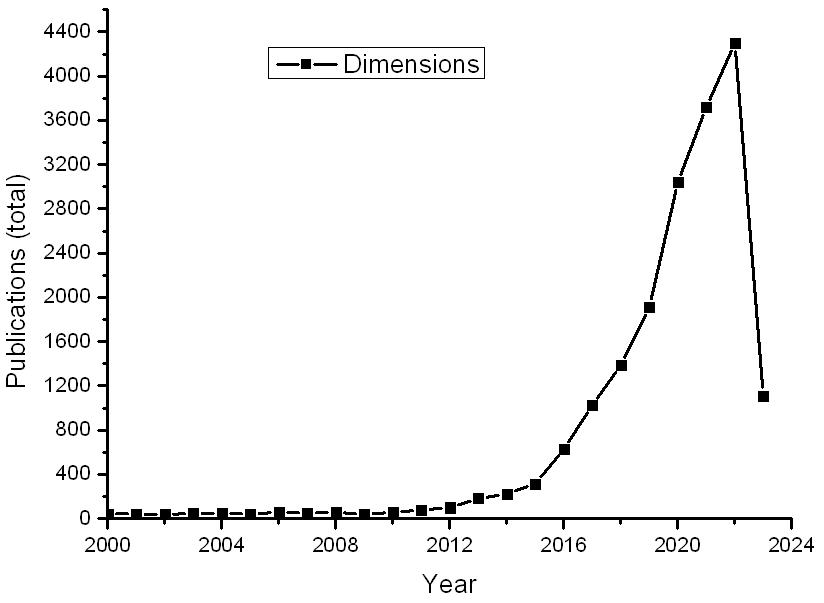

图3 类器官的文献变化
以Dimensions数据库为例,近20余年来关于类器官(organoid)文献数量的变化见图3所示。特别是2015年以来变化之快几乎呈现出直线上升。
人的心脏在受孕后大约三周开始形成。因此,心脏发育的早期阶段是处于女性通常仍未意识到自己怀孕的时期。这就是为什么我们仍然对心脏如何形成的许多细节知之甚少的原因之一。动物研究的结果不能完全转移到人类身上。TUM开发的类器官可能对研究人员有帮助。
一个由 35,000 个细胞组成的球(A ball of 35,000 cells)
与心血管疾病再生医学教授亚历山德拉·莫雷蒂(Alessandra Moretti, Professor of Regenerative Medicine in Cardiovascular Disease,Fig. 2)合作的团队开发了一种使用多能干细胞(pluripotent stem cells)制造一种“迷你心脏”的方法。大约 35,000 个细胞在离心机中旋转成一个球体。在几周的时间里,不同的信号分子按照固定方案添加到细胞培养物中。“通过这种方式,我们模拟了体内控制心脏发育程序的信号通路,”亚历山德拉·莫雷蒂解释道。该小组的相关研究结果于2023年4月3日已经在《自然生物技术》(Nature Biotechnology)杂志网站发表了2篇论文,其一为Anna B. Meier, Dorota Zawada, Maria Teresa De Angelis, Laura D. Martens, Gianluca Santamaria, Sophie Zengerle, Monika Nowak-Imialek, Jessica Kornherr, Fangfang Zhang, Qinghai Tian, Cordula M. Wolf, Christian Kupatt, Makoto Sahara, Peter Lipp, Fabian J. Theis, Julien Gagneur, Alexander Goedel, Karl-Ludwig Laugwitz, Tatjana Dorn, Alessandra Moretti. Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease. Nature Biotechnology, Published: 03 April 2023. DOI: 10.1038/s41587-023-01718-7. https://www.nature.com/articles/s41587-023-01718-7
参与此项研究的除了来自德国慕尼黑工业大学(TUM)的研究人员之外,还有来自德国慕尼黑心脏联盟德国心血管研究中心(German Center for Cardiovascular Research简称DZHK, Munich Heart Alliance, Munich, Germany)、德国慕尼黑赫尔穆茨中心(Helmholtz Center Munich, Neuherberg, Germany)、德国慕尼黑亥姆霍兹协会-慕尼黑数据科学学院{ Helmholtz Association—Munich School for Data Science (MUDS), Munich, Germany}、德国洪堡萨尔大学(Saarland University, Homburg, Germany);意大利卡坦扎罗大希腊大学(University ‘Magna Graecia’, Catanzaro, Italy)、瑞典斯德哥尔摩卡罗林斯卡医学院(Karolinska Institute, Stockholm, Sweden)以及美国耶鲁大学医学院(Yale University School of Medicine, New Haven, CT, USA)的研究人员。
另外一篇论文为Dorota Zawada, Jessica Kornherr, Anna B. Meier, Gianluca Santamaria, Tatjana Dorn, Monika Nowak-Imialek, Daniel Ortmann, Fangfang Zhang, Mark Lachmann, Martina Dreßen, Mariaestela Ortiz, Victoria L. Mascetti, Stephen C. Harmer, Muriel Nobles, Andrew Tinker, Maria Teresa De Angelis, Roger A. Pedersen, Phillip Grote, Karl-Ludwig Laugwitz, Alessandra Moretti, Alexander Goedel. Retinoic acid signaling modulation guides in vitro specification of human heart field-specific progenitor pools. Nature Communications, Published: 03 April 2023. Volume 14, Article number: 1722. DOI:10.1038/s41467-023-36764-x. https://www.nature.com/articles/s41467-023-36764-x
有史以来第一个“心外膜” (First-ever “epicardioids”)
由此产生的类器官直径约为半毫米。虽然它们不泵血,但它们可以受到电刺激,并且能够像人类心室一样收缩。亚历山德拉·莫雷蒂教授和她的团队是世界上第一批成功创建含有心肌细胞(heart muscle cells / cardiomyocytes)和心壁外层细胞-心外膜(epicardium)的类器官的研究人员。在心脏类器官的年轻历史中——第一个在2021年被描述——研究人员之前只用心肌细胞和来自心脏壁内层的细胞创造了类器官-心内膜(endocardium)。
“要了解心脏是如何形成的,心外膜细胞是决定性的,”该研究的第一作者安娜·迈耶(Anna Meier)博士说。“心脏中的其他细胞类型,例如连接组织和血管的细胞,都是由这些细胞形成的。心外膜在形成心腔方面也起着非常重要的作用。” 该团队恰当地将新的类器官命名为“心外膜”(“epicardioids”)。 由亚历山德拉·莫雷蒂教授(Fig. 2)领导的团队开发了生产心脏类器官的工艺。
发现新的细胞类型(New cell type discovered)
除了生产类器官的方法外,该团队还报告了其第一个新发现。通过对单个细胞的分析,他们确定了最近才在小鼠身上发现的一种前体细胞(precursor cells)是在类器官发育的第七天左右形成的。心外膜由这些细胞形成。“我们假设这些细胞也存在于人体内——哪怕只存在几天,”亚历山德拉·莫雷蒂教授说。
这些见解也可能提供线索,说明为什么胎儿心脏可以自我修复,而成年人的心脏几乎完全没有这种能力。这些知识可能有助于找到治疗心脏病和其他疾病的新方法。
生产“个性化类器官” (Producing “personalized organoids”)
该团队还表明,类器官可用于调查个体患者的疾病。研究人员使用来自一名患有努南综合征(Noonan syndrome)的患者的多能干细胞,在培养皿中生成了模拟该病症特征的类器官。在接下来的几个月里,该团队计划使用类似的个性化类器官来研究其他先天性心脏缺陷。
由于有可能在类器官中模拟心脏病,未来可以直接在类器官上测试药物。“可以想象,这样的测试可以减少开发药物时对动物实验的需求,”亚历山德拉·莫雷蒂说。
类器官研究是慕尼黑工业大学的重点研究领域(Organoid research is a key research area at TUM)
研究人员已经为创建心脏类器官的过程注册了一项国际专利。Epicardioid模型(Epicardioid model)是TUM的几个类器官项目之一。在类器官系统中心(Center for Organoid Systems),来自不同部门和大学教授的工作组将进行协作。他们将通过最先进的成像和细胞分析对胰腺、大脑和心脏类器官进行跨学科研究,以研究器官、癌症和神经退行性疾病的形成,并通过人体3D系统取得医学进展。
本研究获得了来自欧洲研究委员会 (European Research Council, grant 788381 and grant 261053)、德国研究基金会{ German Research Foundation (Transregio Research Unit 152, Unit 267)}、德国心血管研究中心{ German Centre for Cardiovascular Research (DZHK; grant FKZ 81Z0600601)}、翁贝托·韦罗内西基金会(Fondazione Umberto Veronesi)和德国赫兹基金会(Deutsche Herzstiftung e.V.)的资助或支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Abstract (DOI: 10.1038/s41587-023-01718-7)
The epicardium, the mesothelial envelope of the vertebrate heart, is the source of multiple cardiac cell lineages during embryonic development and provides signals that are essential to myocardial growth and repair. Here we generate self-organizing human pluripotent stem cell-derived epicardioids that display retinoic acid-dependent morphological, molecular and functional patterning of the epicardium and myocardium typical of the left ventricular wall. By combining lineage tracing, single-cell transcriptomics and chromatin accessibility profiling, we describe the specification and differentiation process of different cell lineages in epicardioids and draw comparisons to human fetal development at the transcriptional and morphological levels. We then use epicardioids to investigate the functional cross-talk between cardiac cell types, gaining new insights into the role of IGF2/IGF1R and NRP2 signaling in human cardiogenesis. Finally, we show that epicardioids mimic the multicellular pathogenesis of congenital or stress-induced hypertrophy and fibrotic remodeling. As such, epicardioids offer a unique testing ground of epicardial activity in heart development, disease and regeneration.
Abstract(DOI: 10.1038/s41467-023-36764-x.)
Cardiogenesis relies on the precise spatiotemporal coordination of multiple progenitor populations. Understanding the specification and differentiation of these distinct progenitor pools during human embryonic development is crucial for advancing our knowledge of congenital cardiac malformations and designing new regenerative therapies. By combining genetic labelling, single-cell transcriptomics, and ex vivo human-mouse embryonic chimeras we uncovered that modulation of retinoic acid signaling instructs human pluripotent stem cells to form heart field-specific progenitors with distinct fate potentials. In addition to the classical first and second heart fields, we observed the appearance of juxta-cardiac field progenitors giving rise to both myocardial and epicardial cells. Applying these findings to stem-cell based disease modelling we identified specific transcriptional dysregulation in first and second heart field progenitors derived from stem cells of patients with hypoplastic left heart syndrome. This highlights the suitability of our in vitro differentiation platform for studying human cardiac development and disease.
https://blog.sciencenet.cn/blog-212210-1383227.html
上一篇:[转载]清明诗选
下一篇:对催化的原子尺度的新理解可以节省大量的能源
