博文
Dictys:动态基因调控网络剖析发育连续体
||
Dictys:动态基因调控网络剖析发育连续体
生物分子网络包括mRNA、蛋白质、DNA调控元件等之间的上下文依赖的物理相互作用、化学反应和其他因果关系的纲要。这些网络共同决定了细胞身份、基因功能和最终的表型特征。在发育过程中,高度有序、动态进化的基因调控网络(GRN)是由一系列细胞类型特异性转录因子(TF)形成的。这些TF通过结合近端(即启动子)和远端(即增强子)顺式调控DNA元件,调节决定细胞命运的基因表达,从而建立起调控程序。因此,GRN已被用于模拟TF活性,确定关键主调控因子的优先级,并了解它们如何动态地重塑调控程序。
在过去的几十年里,已经提出了许多方法,仅从批量转录组学数据推断GRN。这些方法在区分因果关系和相关关系以及直接影响和间接影响方面面临挑战。这促使其他数据模式的结合,如自然遗传变异作为因果锚或TF结合(例如,染色质免疫沉淀与测序(ChIP-seq)或染色质可及性)作为机制证据。然而,这些基于批量的方法需要大量的转录组样本和相应的统计能力,这严重限制了它们的实际可负担性,更不用说比较研究了,如特定环境或动态GRN。
单细胞RNA测序(scRNA-seq)通过经济高效地分析数千个细胞的转录程序,克服了这些限制,并导致了GRN推断的新计算发展。SCENIC是最早的此类方法之一,通过将scRNA-seq数据与基于保守的基因启动子中假定的TF结合信息相结合,利用随机森林回归重建了种群水平的GRN。CellOracle通过scRNA-seq和群体水平染色质可及性数据的线性或袋装回归进一步推断细胞类型特异性GRN。FigR可以解释TF在远端调控元件如增强子中的结合。Pando和TRIPOD在其回归模型中明确地包括开放染色质效应。
然而,单细胞GRN推理面临着几个挑战,其中一些是几十年前的问题,尚未解决。事实上,这些方法都是基于稳态回归模型,因此不能考虑反馈回路或检测噪声,而这反过来又会因单细胞稀疏性而加剧和混淆。这些挑战降低了从有限数量的单细胞中推断GRN的准确性,并阻止了现有方法仅使用每种细胞类型的单细胞数据推断完全细胞类型特异性GRN。虽然单细胞多组学分析可以联合分析基因表达和染色质可及性,但没有现有的方法可以模拟(伪)时间分辨的动态GRN在连续过程中的重新连接,如发育或分化。总之,这些挑战阻碍了准确、可重复、特定于上下文和时间精度水平的GRN推断。
在这里,为了解决这些挑战,Dicys(图1)利用最新的多组学技术,使用特定上下文的TF足迹、随机过程建模、概率规划和动态网络。这些进步提高了GRN推理质量,并且由于专用的网络可视化,能够沿着差异化路径对特定于上下文的GRN和动态GRN进行比较分析。通过重新发现已知的关键调节因子,并通过发现和优先考虑以前未知的候选调节因子及其靶基因,证明了它们在血液和皮肤系统中作为发育背景的效用。
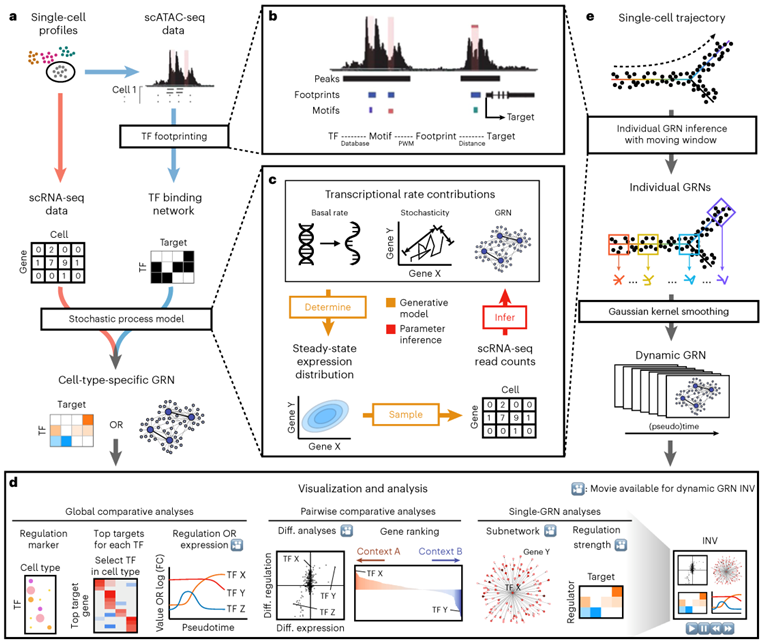
图1 从单细胞转录组和染色质可及性中重建和分析上下文特异性和动态GRN的概述。a 对给定细胞亚群的上下文特异性GRN重建的示意图概述。B 从带有TF足迹的scATAC-seq数据重构初始TF结合网络。每个TF通过其基序和上下文特异性活性足迹与潜在靶基因相连;PWM,位置权重矩阵。C 在TF结合网络约束下,基于随机过程模型的scRNA-seq数据的情境特异性GRN重构。包括GRN在内的动力学模型参数解析地决定了单细胞基因表达的稳态分布。从稳态分布来看,scRNA-seq对具有强技术噪声的读计数矩阵进行稀疏采样。整个过程用概率规划的参数推理(包括GRN)生成模型来描述。D 从左至右的多个(≥2)、两个或单个静态GRN和一个动态GRN的可视化对比和分析。E 沿着单细胞轨迹的动态GRN重建示意图
Dicys可以在https://github.com/pinellolab/dictys中免费获取。
参考文献
[1] Wang L, Trasanidis N, Wu T, Dong G, Hu M, Bauer DE, Pinello L. Dictys: dynamic gene regulatory network dissects developmental continuum with single-cell multiomics. Nat Methods. 2023 Sep;20(9):1368-1378. doi: 10.1038/s41592-023-01971-3.
以往推荐如下:
5. EMT标记物数据库:EMTome
8. RNA与疾病关系数据库:RNADisease v4.0
9. RNA修饰关联的读出、擦除、写入蛋白靶标数据库:RM2Target
13. 利用药物转录组图谱探索中药药理活性成分平台:ITCM
19. 基因组、药物基因组和免疫基因组水平基因集癌症分析平台:GSCA
22. 研究资源识别门户:RRID

https://blog.sciencenet.cn/blog-571917-1403933.html
上一篇:ScRNAPip:单细胞RNA数据分析管道
下一篇:分子网络分析的因果发现方法综述