博文
氢分子在肝脏疾病中作用【攀枝花 综述】
||
氢分子在肝脏疾病中作用【综述】
氢分子在肝脏疾病中作用的分子机制:现有证据综述
《欧洲医学研究杂志》第30卷,文章编号:1074(2025年)引用本文
摘要
氧化应激与炎症在肝脏疾病的发生发展中起着关键作用,可诱导肝细胞凋亡、肝纤维化,甚至引发肝癌。然而,目前尚缺乏能减缓肝脏炎症及代谢性肝病进展的有效治疗干预手段。氢分子具有选择性清除病理性自由基的独特生物学特性,这一特性在慢性肝病的动物研究与临床试验中展现出治疗潜力。本综述阐述了氢分子在肝损伤及肝脏代谢性疾病治疗中的创新技术与应用,重点分析其在调控氧化还原反应、炎症级联信号转导中的作用机制,并具体探讨其在糖脂代谢稳态维持、肠道菌群重塑及细胞保护方面的潜在价值。未来仍需进一步研究以明确氢分子改善肝脏微环境有益作用的未知机制,并推动氢疗法的临床应用进程。
Zhu Q, Li X, Li S, Liu S, Tian Y, Xing X, Yin L. Molecular mechanisms associated with effects of hydrogen molecule in liver diseases: the review of current evidence. Eur J Med Res. 2025 Nov 5;30(1):1074.
作者来自四川攀枝花中心医院等单位。
背景
最新《2023年全球肝脏疾病负担报告》显示,全球每年约有200万人死于肝脏疾病,占总死亡人数的4%[1]。其中,亚太地区人口基数大,承担了全球大部分慢性肝病相关疾病的负担——全球近50%的慢性肝病、肝硬化及肝癌相关死亡病例发生在该地区[2]。根据世界卫生组织近期发布的《2024年全球肝炎报告》,全球病毒性肝炎致死人数呈上升趋势,每年死亡130万人,已成为全球第二大感染性致死原因[3,4]。维护肝脏健康是减轻疾病负担、延长人类寿命的重要途径。
近年来,多项实验室研究与临床研究表明,氢分子在多种急慢性肝病治疗中具有应用前景。氢分子具有极强的生物膜穿透性和细胞内扩散能力,可进入细胞核、细胞质内的多种细胞器结构。2007年,Ohsawa等人[5]发表了一项里程碑式研究成果:在缺血性脑卒中模型中,氢分子(浓度>25μM)可降低过氧亚硝酸根阴离子与羟基自由基水平。对成年活体小鼠的微传感器研究显示,氢分子在肝脏中的溶解度高达43μM[6];且通过多种方式补充外源性氢分子后,肝脏中的氢分子浓度在所有器官中最高[7]。这表明氢分子在肝脏中的滞留浓度足以发挥其抗氧化作用,为阐明氢分子对肝脏有益作用的潜在机制提供了基础。本综述全面总结了氢分子疗法在肝脏疾病中潜在作用的相关研究报道,涵盖脂肪性肝病、非酒精性脂肪性肝炎(NASH,又称代谢相关脂肪性肝病,MASLD)、病毒性肝炎、肝脏缺血再灌注损伤(IRI),以及肿瘤放化疗或其他原因导致的肝损伤与肝功能异常。
氢分子递送技术创新
生理状态下,人体内源性氢分子主要来源于肠道菌群。肠道菌群的氢代谢稳态可影响肝脏疾病的进展。研究表明,肠道菌群产生的内源性氢分子可抑制刀豆蛋白A诱导的肝炎,而抗生素抑制肠道菌群则会加重肝炎损伤[8]。外源性摄入产氢底物(如20%高直链玉米淀粉[9]、乳果糖[10]、L-阿拉伯糖[11])可显著改善动物的急性肝脏缺血再灌注损伤、脂肪性肝病,并加速肝脏再生。外源性氢分子的常见递送方式包括氢气吸入、饮用富氢水(HRW)及注射富氢盐水(HRS)。
值得注意的是,氢分子水溶性低、扩散性强且无定向性,难以预测其在特定部位的有效浓度及对其他器官可能产生的影响。氢分子的靶向递送、可控释放与长期蓄积是氢医学研究中的共性挑战。为解决这一问题,近期有科学家设计出可在局部靶点稳定释放氢分子的载体。例如,珊瑚氢化钙(CCH)是珊瑚钙与氢气在800-950℃高温下反应约2-12小时制成的多孔粉末。Chen等人[12]与Ma等人[13]将珊瑚氢化钙用作富氢载体,证实其产生的氢分子可改善非酒精性脂肪性肝炎(NASH)与代谢相关脂肪性肝病(MASLD)。但作为膳食补充剂,珊瑚氢化钙对人体毒性的实验证据尚不充分,其强碱性水解产物可能导致严重组织损伤,需对其毒性进行细致评估。
具有优异生物安全性的纳米材料为氢分子的靶向高剂量递送提供了可能。Wu等人[14]构建了一种X射线触发的原位可持续产氢平台Au-TiO₂@ZnS,该平台与放疗联合用于小鼠原位肝癌治疗时,展现出优异的治疗效果且炎症副作用低。He等人[15]开发了N-(3-三乙氧基硅基丙基)葡萄糖酰胺(Glu)修饰的硅化镁(Mg₂Si)纳米片(MSN-Glu),其可通过主动识别肝细胞上的去唾液酸糖蛋白受体实现肝细胞靶向。所研发的MSN-Glu纳米药物具有105mg/g的高氢递送能力,是饱和富氢水(HRW)的6.6×10⁴倍;且在生理条件下,其氢分子持续释放时间长达8天,非常有利于氢分子的高剂量递送。该团队还开发了一种钯(Pd)纳米颗粒,静脉注射后可靶向蓄积于肝脏,能快速捕获流经肝脏的氢分子并以氢氧化钯(PdH)的固体形式储存,最终通过催化清除羟基自由基(·OH)实现局部高效抗慢性肝病作用[16]。
材料科学与纳米技术的发展,结合靶向药物递送技术,也是未来氢医学技术创新的动力。然而,纳米氢药物要获得稳定的生物学效应并实现精准治疗,仍面临诸多困难与挑战。例如,外源性纳米颗粒的引入可能增加药物递送与释放扩散的复杂性,且纳米载体在体内转运过程中对细胞、组织及器官产生的生物学效应尚不明确,这些都为进一步的临床研究设置了障碍。
氢分子的动物实验与临床应用
越来越多的文献证实氢分子具有调控肝脏稳态的潜力,且其在生理与病理条件下的分子效应已得到关注。在健康状态下,长期氢干预会引起全身生理功能的广泛变化:在不同时间点,体重及血清生化指标(包括血脂、血糖、肝酶、甾醇类脂质)均发生显著改变[17]。在肝组织内部,炎症相关通路及脂质、氨基酸分解代谢重塑被激活,其中NADP/NADPH氧化还原通路可能是核心调控通路[18,19]。饮用富氢水(HRW)还可能通过上调P-糖蛋白与Mrp2蛋白的表达,促进有毒物质向胆汁中排泄[20]。
根据现有研究结果,健康状态下摄入氢分子不会对机体造成健康威胁或肝损伤,但氢分子的“合理应用”需考虑干预时长、浓度及其与特定靶器官的相互作用,目前关于氢分子对健康人群的适用性仍有大量空白有待填补。
氢分子疗法已在多种肝病动物模型中开展应用研究,相关证据与机制详见补充表SI(Table SI)。基于已报道的实验数据,氢分子在脂肪性肝病、非酒精性脂肪性肝炎/代谢相关脂肪性肝病(NASH/MASLD)、肝脏缺血再灌注损伤(IRI)及其他原因导致的肝损伤模型中均展现出有益作用,可减轻肝脏组织病理学损伤,其公认的抗氧化、抗炎特性在此过程中发挥重要作用。
氢分子疗法在临床肝病中的应用报道详见补充表SII(Table SII)。在代谢相关脂肪性肝病(MASLD)临床患者中,饮用富氢水(HRW)或吸入氢氧混合气可改善血清肝酶水平、减少肝脏脂肪蓄积与变性,并改善氧化应激及炎症指标[21,22]。但也有其他研究指出,这些指标仅呈现向好趋势,绝对变化并不显著[23,24],目前尚无足够证据判断这种变化是“假性进展缓解”还是氢分子确实发挥了作用。
富氢水(HRW)辅助治疗可改善代谢相关脂肪性肝病(MASLD)患者的血小板线粒体生物能量功能,并提高血小板中辅酶Q10(CoQ10)浓度[24],因此富氢水可能成为恢复MASLD患者线粒体健康的潜在策略。此外,富氢水可显著降低乙型肝炎患者的病毒DNA水平[25],并改善肿瘤放化疗患者的肝功能与生活质量[26,27]。越来越多的数据似乎证实了氢分子在肝病治疗中具有概念性获益的证据。
随着氢医学基础研究对疾病类型的覆盖趋于饱和,以及氢医学转化应用需求的增加,高质量临床研究正逐渐受到关注。然而,目前关于氢分子治疗肝病的高水平临床试验证据仍较少,部分研究仍处于注册阶段。氢分子在肝病预防及疾病长期缓解中的作用,仍需通过严格设计的高质量临床试验及实际应用进一步验证。
未来研究还需明确氢疗法在特定肝病人群(如肝癌患者或接受靶向治疗/放化疗后的病毒性肝炎患者)中的有效性。此外,氢疗法的最佳应用时机仍有待确定,其在预防阶段、治疗中/治疗后阶段作为新辅助治疗或联合治疗的最大获益潜力备受期待。过去,无论是基础研究还是临床研究,氢医学都更侧重于肝病治疗;理想情况下,氢分子的应用可通过日常生活方式融入生命周期,氢医学研究方向需向疾病预防倾斜。
另一尚未满足的需求是确定氢分子的预后标志物与靶向反应标志物:预后标志物可用于判断特定患者群体是否需早期采用氢疗法以预防并发症,而目前尚无法预测患者对特定氢治疗方案的反应,因此靶向反应标志物的鉴定也至关重要。
氢分子保护作用的潜在机制
肝损伤是一类由多种致病因素(如药物诱导、毒性作用、创伤、缺血或感染)引起的肝功能进行性下降疾病。图1(Fig.1)总结了氢分子在肝病应用中的潜在作用机制,其病理生理学核心包括清除自由基、抑制炎症级联反应、重塑糖脂代谢、调控细胞死亡及调节肠道菌群。
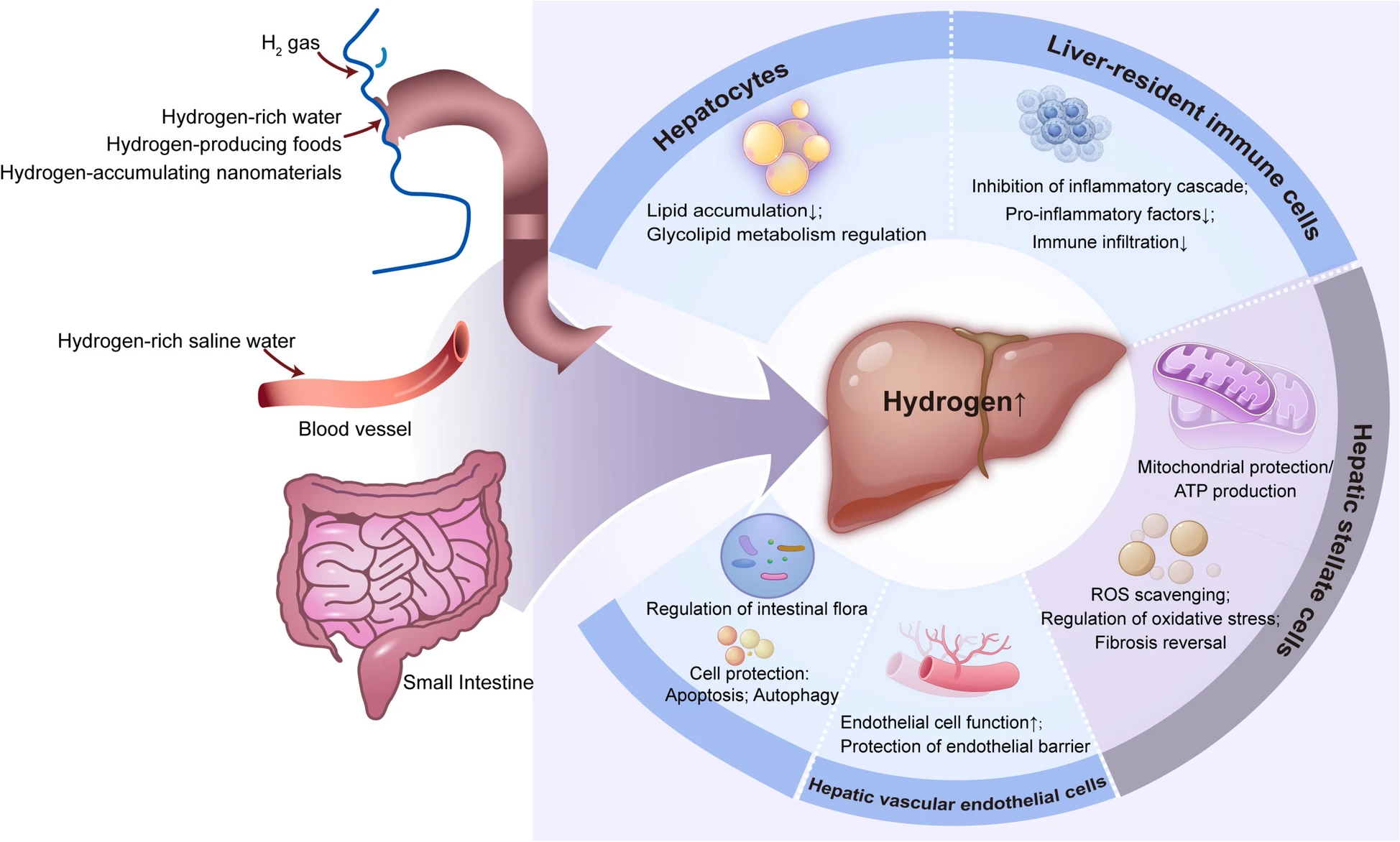
图1 氢分子延缓肝脏疾病进展的潜在机制
(ROS:活性氧;ATP:三磷酸腺苷)
氢分子作用的细胞靶向性
在肝损伤模型中,氢分子(H₂)的作用涉及肝组织中的多种关键细胞类型,其保护效应通过调控这些细胞的功能状态实现:
1. 肝细胞:作为肝脏的主要功能细胞,肝细胞负责代谢、解毒等核心生理功能,也是最易受肝损伤影响的细胞类型。氢分子可通过清除肝细胞内过量的活性氧(ROS)、减少脂质蓄积,直接对肝细胞发挥保护作用[28]。
2. 肝驻留巨噬细胞(库普弗细胞):是固有免疫的核心参与者[29]。氢分子能抑制库普弗细胞的过度激活,具体机制包括:减少肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等促炎因子的分泌以减轻局部炎症反应;下调炎症趋化因子以抑制中性粒细胞向肝损伤部位迁移,从而缓解炎症介导的组织损伤。
3. 肝星状细胞:是肝纤维化的关键效应细胞。持续的肝损伤会触发其活化(分化为肌成纤维细胞),进而合成大量细胞外基质(如胶原蛋白),最终导致肝纤维化甚至肝硬化。在非酒精性脂肪性肝炎(NASH)模型中,氢分子可通过以下途径逆转肝纤维化:抑制信号转导与转录激活因子3(STAT3)的磷酸化、阻断下游丝裂原活化蛋白激酶(MAPK)信号通路的激活、调控氧化应激-炎症通路(如核因子-κB(NF-κB)),从而减少肝星状细胞活化及胶原蛋白沉积[30]。
4. 肝血管内皮细胞:构成肝血窦屏障。在缺血再灌注损伤(IRI)、急性胆管炎等模型中,内皮细胞损伤会增加血管通透性、引发微循环障碍,进一步加重肝脏缺血与炎症。氢分子可通过抑制NF-κB活化保护内皮细胞功能,并通过抑制基质金属蛋白酶(MMP2/9)活性、调控紧密连接蛋白等机制,减少内皮屏障破坏。
综上,氢分子在肝损伤模型中的作用具有细胞靶向性,这种多细胞调控特性是其在多种肝损伤模型中发挥保护效应的核心机制。
自由基相关的氧化还原与氧化应激
当机体氧化还原稳态失衡(氧化能力大于抗氧化能力)时,体内活性氧(ROS)与活性氮(RNS)的产生与清除失衡会引发氧化应激,进而导致肝细胞损伤、炎症及肝纤维化。在急慢性肝损伤动物模型中,氢分子可通过以下方式发挥作用:
- 减轻氧化损伤:减少ROS的过度蓄积,显著降低氧化损伤标志物水平,如DNA氧化损伤终产物8-羟基-2-脱氧鸟苷(8-OHdG)[31]、蛋白质氧化损伤终产物3-硝基酪氨酸(3-NT)[32]、脂质过氧化终产物丙二醛(MDA)[33]与4-羟基壬烯醛(4-HNE)[34];这些效应可显著改善肝酶指标与肝脏形态学损伤,降低α-平滑肌肌动蛋白(Acta2/α-SMA)[16]、转化生长因子β/Smad蛋白(TGFβ/SMAD)[30]等肝纤维化标志物水平,并促进移植后肝脏再生。
- 激活抗氧化酶:通过激活超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)等关键抗氧化酶的活性,促进ROS清除[35]。
- 调控氧化还原敏感信号通路:细胞信号与基因表达受氧化还原状态精细调控,多种信号转导通路可响应细胞氧化还原平衡变化。氢分子通过调控氧化还原敏感分子与信号通路,抑制ROS生成或修复ROS造成的损伤。例如:激活核因子E2相关因子2(NRF2)及其下游抗氧化酶SOD1/2、抗应激蛋白血红素氧合酶1(HO-1),以缓解肝胆管细胞的缺氧再灌注损伤与脂肪变性[36,37];此外,NF-κB、MAPK、c-Jun氨基末端激酶(JNK)等信号通路也是氧化应激信号的“传感-效应”机制,已有研究在肝病模型中观察到氢分子对这些分子活性的调控作用[30,36,38]。
线粒体呼吸链是ROS产生的主要来源,局部高浓度ROS可直接破坏线粒体动态平衡,导致DNA突变。研究发现,在梗阻性黄疸小鼠的肝脏中,氢分子与线粒体呼吸功能及ATP生成相关[39];珊瑚氢化钙(CCH)可逆转肝脏呼吸控制率(RCR)异常与质子泄漏,恢复线粒体复合物II与IV的功能[12]。
细胞内的NAD(P)H醌脱氢酶1(NQO1)主要功能是将NADH与NADPH转化为NAD⁺与NADP⁺,并通过将醌类物质转化为氢醌类,保护细胞免受氧化应激损伤。既往研究表明,应用氢分子与肝脏中NQO1的上调相关,且NQO1也是受NRF2调控的解毒酶[33]。此外,铁卟啉是氢分子的靶向分子及氧化还原相关生物传感器,可通过与H₂反应抑制游离血红素催化的类芬顿反应,从而预防非酒精性脂肪性肝病[15]。
氢分子在恢复肝脏氧化还原平衡、减轻氧化应激、延缓肝损伤进展方面的潜力,凸显了其对自由基的稳定作用。ROS与RNS是氧化还原反应的核心参与者,统称为内源性自由基:
- ROS(狭义定义)包括4类:单线态氧(¹O₂)、超氧阴离子(O₂·⁻)、过氧化氢(H₂O₂)与羟基自由基(HO·)[40];
- RNS指一氧化氮(NO)与细胞内外靶点相互作用生成的高氧化活性自由基及硝基化合物,包括过氧亚硝酸根(ONOO·)及其质子化形式过氧亚硝酸(HOONO)[41]。
在诱导细胞凋亡方面,由于兼具过氧化与硝化作用,RNS的效应强于大多数ROS。2007年,Ohsawa等人[5]在脑缺血再灌注损伤模型中发现,H₂可选择性中和细胞毒性最强的ROS(HO·与ONOO·),且不影响其他生理性ROS。目前,临床与动物肝损伤模型研究多聚焦于氢分子对ROS的整体清除效应,仅He等人明确证实了氢分子对小鼠肝脏AML-12细胞中HO·的清除作用[15,16]。既往部分研究发现,不同肝损伤模型中ROS/RNS水平及其介导的氧化应激程度存在显著差异[42,43,44],因此以下问题仍有待明确:不同肝损伤模型中起主导作用的自由基类型、氢分子清除HO·的效应是否能完全解释其抗氧化作用、氢分子对其他活性自由基是否也具有选择性清除效应。
炎症信号转导与反应
抗炎效应是氢分子另一公认的作用机制。氢分子通过以下途径发挥抗炎作用:
1. 调控炎症因子与介质:调节循环系统及组织中的细胞因子与炎症介质(如IL-1β、IL-6、IL-10、TNF-α、诱导型一氧化氮合酶(iNOS)、干扰素-γ(INFγ)、血管内皮生长因子(VEGF)),减少巨噬细胞与中性粒细胞在肝脏病变组织中的浸润[8,13,35]。
2. 干预炎症信号通路:机体炎症反应被触发后,免疫细胞表面的传感器识别并结合炎症诱导物,激活NF-κB、MAPK、STAT3等经典炎症信号通路的级联转导。在NASH样本中,氢分子通过调控HO-1/IL-10轴的交叉对话,抑制磷酸化STAT3的表达及下游pMAPK信号的激活,从而逆转肝细胞凋亡、肝脏炎症与纤维化[30];在部分肝切除或肝脏缺血再灌注模型中,富氢盐水(HRS)处理可显著抑制NF-κB的活化[45,46]。
氢分子参与肝病中这些经典炎症信号通路的调控,且这些转录因子也是氧化应激的调控靶点——炎症与氧化应激具有“相互诱导、相互促进”的关系:活性氧中间体被认为是参与TNFα、IL-1β诱导NF-κB活化的第二信使[47]。NF-κB信号通路的激活可能是肝病中炎症与氧化应激关联的关键,但氢分子调控肝脏炎症与氧化应激的核心通路是否为NF-κB、其与其他炎症信号的协同作用机制,目前仍不明确(见图2)。
高迁移率族蛋白1(HMGB1)是细胞应激反应的信号传递分子,也是肝脏缺血再灌注损伤中炎症反应的关键触发因子。HRS处理可抑制肝脏HMGB1的表达与释放[48];此外,HRS还可通过降低MMP2/9活性、抑制肝脏间隙连接与紧密连接蛋白,减轻急性梗阻性胆管炎导致的肝脏氧化损伤与炎症[49]。
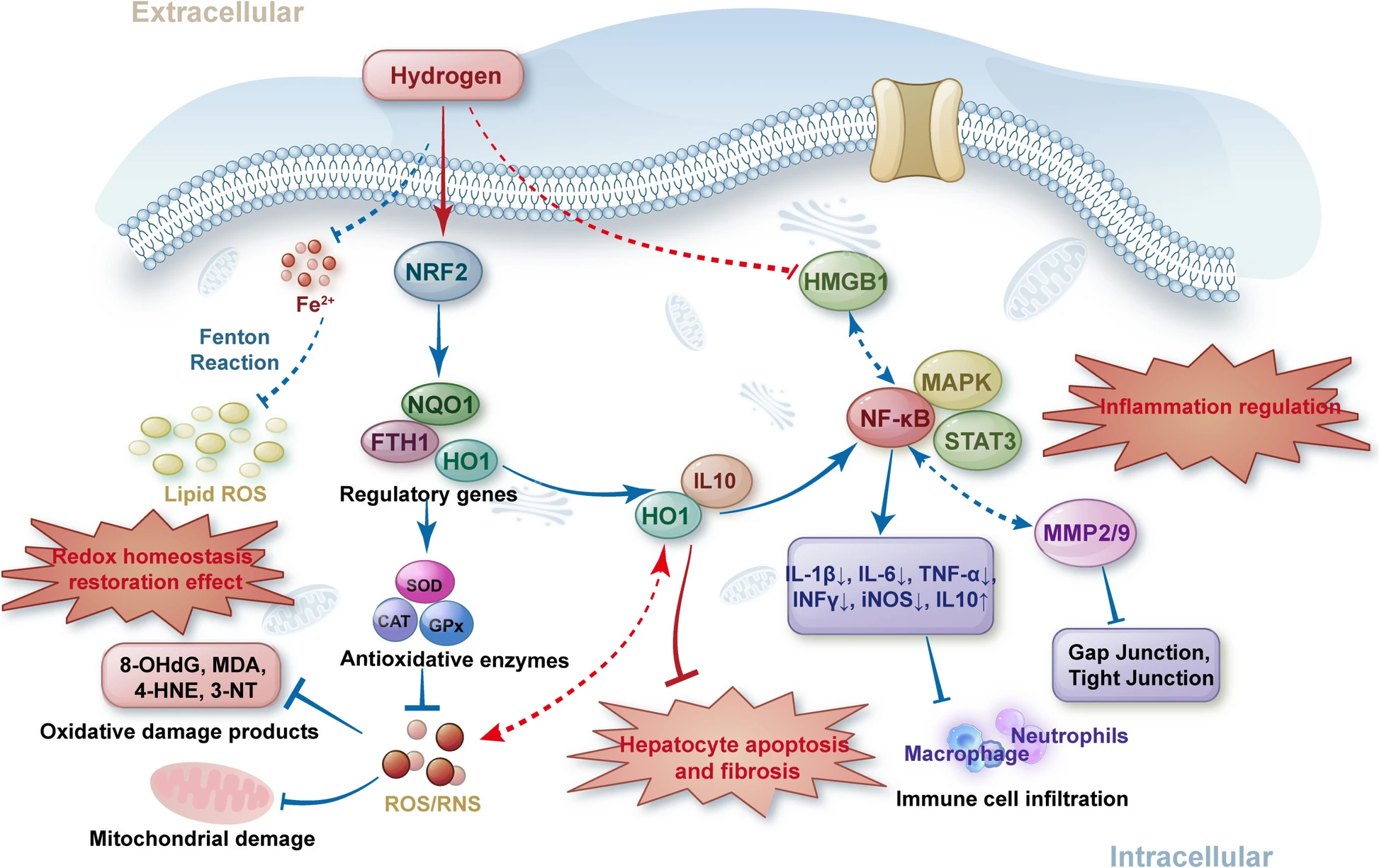
图2氢分子对肝脏氧化应激与炎症级联反应的交互调控机制
CAT:过氧化氢酶;FTH1:铁蛋白重链1;GPx:谷胱甘肽过氧化物酶;HMGB1:高迁移率族蛋白1;HO1:血红素氧合酶1;IL:白细胞介素;iNOS:诱导型一氧化氮合酶;INFγ:干扰素-γ;MAPK:丝裂原活化蛋白激酶;MDA:丙二醛;MMP2/9:基质金属蛋白酶2/9;NF-κB:核因子-κB;NRF2:核因子E2相关因子2;NQO1:NAD(P)H醌脱氢酶1;ROS:活性氧;SOD:超氧化物歧化酶;STAT3:信号转导与转录激活因子3;TNFα:肿瘤坏死因子α;3-NT:3-硝基酪氨酸;4-HNE:4-羟基壬烯醛;8-OHdG:8-羟基-2-脱氧鸟苷
糖脂代谢重塑
氢分子的抗氧化与抗炎作用已得到充分证实,但其清除自由基的特性无法完全解释其广泛的生物学效应(尤其在脂肪性肝病、NASH、代谢相关脂肪性肝病(MASLD)等代谢性肝病中)。在代谢性肝病的人群与动物模型中,氢分子对糖脂代谢的调控作用主要体现在以下方面:
#脂质代谢调控
氢分子可作用于脂质谱,降低循环系统与肝组织中的胆固醇、甘油三酯及游离脂肪酸水平[15,50],具体机制包括:
1. 抑制脂质合成通路:
- 吸入4%氢气可显著减少高脂饮食(HFD)诱导的循环系统与肝脏中磷脂氧化产物蓄积,其中1-棕榈酰-2-(9-氧代壬酰)-sn-甘油-3-磷脂酰胆碱(PONPC)的降低最为显著[51];
- 下调固醇调节元件结合转录因子1(SREBP1)、乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)的表达,抑制脂质从头合成通路,减少肝脏脂肪蓄积[13];
- L-阿拉伯糖(氢分子前体)可有效调控高脂饮食小鼠肝脏中脂肪酸延长酶Elovl3与脂肪酸β-氧化酶Acadm的表达[11];
- 通过HO-1/AMPK/PPARα/PPARγ通路诱导Sirt1/AMPK通路,逆转肝细胞中脂肪酸氧化与脂质合成失衡,抑制棕榈酸介导的异常脂肪代谢[30]。
2. 调控脂肪酸转运:分化簇36(CD36)是主要的脂肪酸转运酶,可结合长链脂肪酸并促进其跨膜转运。Jackson[52]与Lio[28]观察到氢分子与肝细胞中CD36表达下调相关,但Tsou[53]的实验结果与此不一致,因此CD36是否为氢分子的作用靶点尚无定论。
3. 减轻脂质过氧化:细胞膜上的不饱和脂肪酸易受ROS攻击引发脂质过氧化。吸入4%氢气可改善高密度脂蛋白(HDL)的蛋白组成,影响与HDL结合的氧化应激相关酶(如脂蛋白相关磷脂酶A2(Lp-PLA2)、对氧磷酶1(PON-1)、卵磷脂胆固醇酰基转移酶(LCAT)),从而减轻氧化应激诱导的脂质过氧化[51];饮用富氢水(HRW)可通过激活AMPK/Nrf2/HO-1通路,减小HepG2细胞中脂滴直径,降低脂质过氧化及游离脂肪酸(FFA)诱导的氧化应激[53];此外,HRW还可通过miR-136/MEG3/Nrf2轴改善游离脂肪酸暴露下肝细胞的脂质蓄积[54]。
4. 影响胆固醇代谢:Ma等人[13]报道,氢分子还可影响肝脏胆固醇合成基因SREBF2及其下游靶基因3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)的表达。但目前评估的参数有限,尚无法就氢分子对胆固醇代谢行为的影响及其在代谢性肝病中的作用机制得出明确结论。
葡萄糖代谢调控
肝脏葡萄糖代谢异常是脂肪性肝病的标志性特征[55]。氢分子可降低脂肪性肝病模型中的空腹血糖与胰岛素水平,维持葡萄糖稳态,具体机制包括:
- HRW通过诱导肝脏成纤维细胞生长因子21(FGF21)减少肝脏脂质蓄积,从而改善胰岛素敏感性、增加能量代谢[56];
- Kamimura[57]发现,HRW可调控4-HNE/Akt/Foxo1信号转导通路,调节过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)的表达,激活PPARα通路,促进脂肪酸β-氧化相关代谢基因FGF21的转录,增加脂肪酸与葡萄糖的消耗;
- HRS可激活PPARα与PPARγ的表达,抑制脂肪酸合成酶表达,改善高脂高糖饮食诱导的大鼠肝脏脂肪变性与葡萄糖敏感性[32](见图3)。
尽管氢分子对肝脏糖脂代谢具有整体保护作用,但目前对其在肝组织关键代谢调控位点的具体效应及潜在机制仍缺乏深入研究。
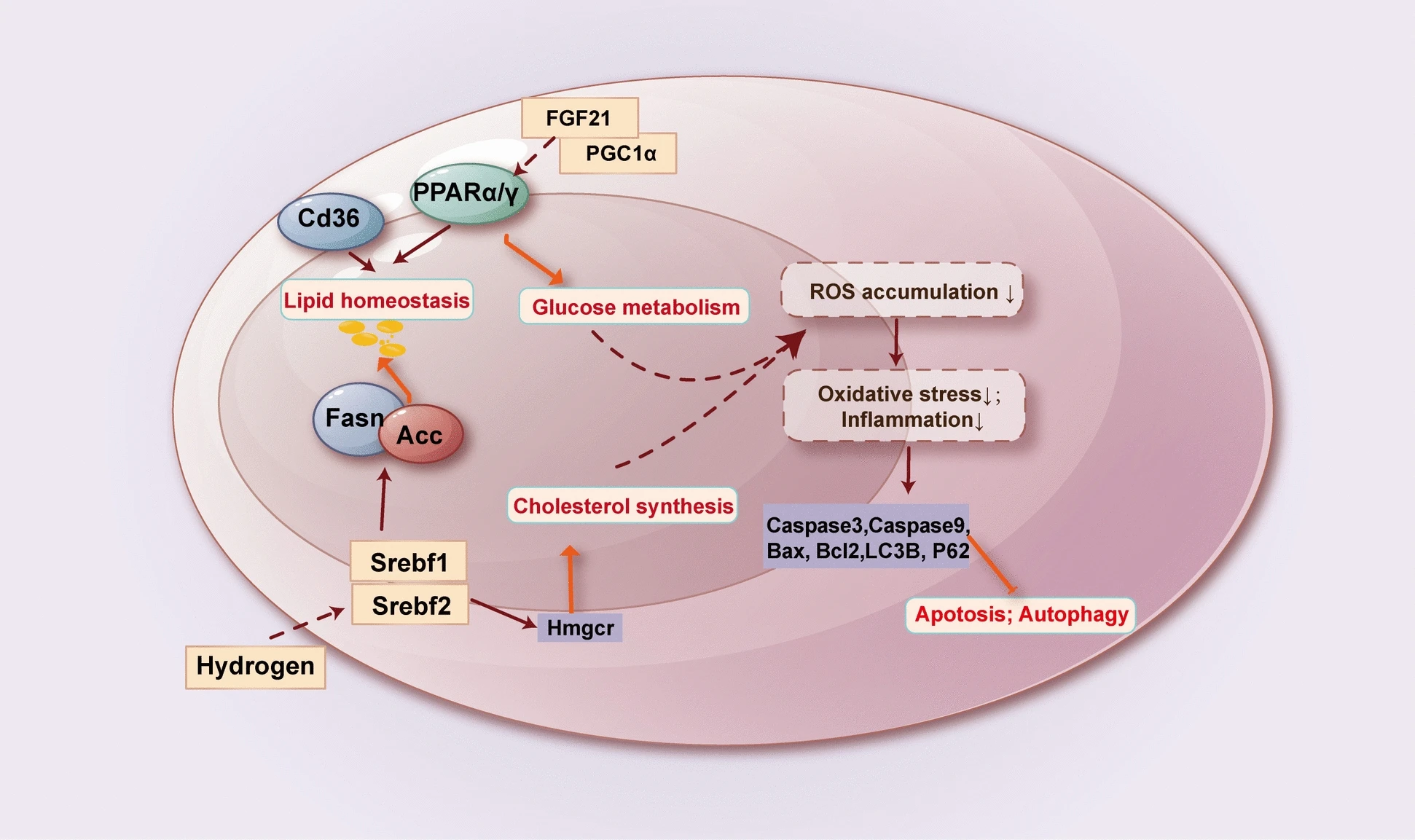 图3 氢分子调控肝脏糖脂代谢的潜在机制
图3 氢分子调控肝脏糖脂代谢的潜在机制
(ACC:乙酰辅酶A羧化酶;CD36:分化簇36;FASN:脂肪酸合成酶;FGF21:成纤维细胞生长因子21;HMGCR:3-羟基-3-甲基戊二酰辅酶A还原酶;PGC1α:过氧化物酶体增殖物激活受体γ共激活因子1α;PPAR:过氧化物酶体增殖物激活受体;SREBF1/2:固醇调节元件结合转录因子1/2)
程序性细胞死亡
氢分子在肝脏疾病中对抗细胞死亡的保护机制尚未完全明确。细胞死亡是生物发育过程中维持形态发生与生理稳态的重要机制,其类型包括凋亡、坏死性凋亡、焦亡、铁死亡,以及与自噬相关的细胞死亡和非程序性坏死。研究发现,氢分子可降低肝损伤病灶中TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法)阳性细胞比例,下调肝细胞凋亡信号分子Caspase3/9(半胱天冬酶3/9)与Bax/Bcl2(Bcl2相关X蛋白/ B细胞淋巴瘤2)的表达,同时上调KI67(增殖标志物)、PCNA(增殖细胞核抗原)与Cyclin D1(细胞周期蛋白D1)的表达,从而促进肝脏再生[38,58,59]。
抑癌基因P53可通过促进Bax表达、抑制Bcl2表达来调控细胞凋亡。在猪的肝脏缺血再灌注损伤(IRI)与肝切除模型中,富氢盐水(HRS)通过调控P53的表达抑制肝细胞凋亡,进而发挥促进肝功能恢复的保护作用[60]。此外,吸入2%氢气3小时可上调脓毒症动物肝脏中线粒体自噬相关蛋白(P62、LC3B-II、Tim23)的表达,保护肝脏免受线粒体损伤[61]。自噬(包括脂噬)也参与脂质滴降解的调控:在HepG2肝细胞(人肝癌细胞系)中,富氢水(HRW)可恢复被游离脂肪酸(FFA)抑制的LC3B-II蛋白表达水平,并下调P62蛋白表达,从而促进自噬活性与脂质滴分解[53]。
氢分子的抗氧化与抗炎特性同样有助于细胞保护,例如其可激活核因子-κB(NF-κB)——该因子参与调控抗凋亡级联反应及相关基因(包括血红素氧合酶、A20蛋白、Bcl2)的表达。人源与鼠源的Caspase-1(半胱天冬酶1)是焦亡的关键激活因子,目前仅有严(Yan)等人的研究提及,2%氢气可降低肝脏中Caspase-1的表达[61]。鉴于高迁移率族蛋白1(HMGB1)与干扰素-γ(IFN-γ)被证实是Caspase-1依赖性焦亡激活的必需因子[62],因此可合理推测,氢分子具有减轻焦亡相关肝脏炎症的潜力。
肠道屏障与肠道菌群(GM)谱
肠-肝轴的异常改变(如肠道菌群组成变化、菌群代谢产物水平波动)被认为与代谢相关脂肪性肝病(MASLD)密切相关,而肠道屏障与肠道菌群是氢分子发挥抗MASLD效应的潜在靶点。在高脂饮食(HFD)喂养的小鼠模型中,L-阿拉伯糖(一种氢分子前体物质)可调控肠道中产氢菌、耗氢菌及与代谢综合征相关肠道细菌的相对丰度,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)以及益生菌(如嗜酸乳杆菌、双歧杆菌)在此过程中发挥重要作用[11]。
薛(Xue)等人[63]提出,吸入氢气可上调肠道上皮细胞上两种紧密连接蛋白(ZO-1,闭合小环蛋白1;occludin,闭合蛋白)的表达,从而改善肠道上皮细胞功能;同时,氢气还可改变拟杆菌门与厚壁菌门的相对丰度,进而改善高脂饮食大鼠的肝脏表型。金(Jin)等人[64]发现,通过纳米胶囊介导的肠道氢气释放,可逆转高脂饮食诱导的疣微菌门(Verrucomicrobia,门水平)与 Akkermansia菌属(属水平)丰度降低。这些结果表明,重塑肠道菌群可能是氢分子治疗肝脏代谢功能障碍的潜在机制。
然而,目前的研究证据仅能观察到肠道菌群结构与组成的变化,尚缺乏粪菌移植实验的验证;此外,针对靶细胞的进一步体外研究或许能更清晰地揭示这一机制。
结论
本综述除阐述氢气吸入、饮用富氢水、注射饱和氢溶液等传统氢分子递送方式外,重点总结了富氢饮食、纳米储氢材料等创新性氢递送技术及其优势,并强调了氢分子递送与储存技术转化过程中跨学科交流的必要性。其次,本综述突破了以往“氢分子主要通过抗炎与维持线粒体功能发挥作用”的认知局限,聚焦总结了氢分子在肝脏疾病应用中涉及代谢重塑、肠道菌群稳态调控及细胞保护的最新机制,旨在为氢医学未来在肝脏疾病领域的应用提供更多思路与方向。
在基础实验中,氢分子已展现出治疗肝脏炎症与脂肪代谢性肝病进展的巨大潜力。尽管临床试验与相关研究的初步结果令人鼓舞,但仍需开展更大样本量、更严谨方法学的研究来验证这些发现,尤其是在病毒性肝炎与肝癌领域。现有生物医学理论体系无法完全解释氢分子对肝脏疾病的生物学效应,氢分子在糖脂代谢稳态重塑、细胞保护及肠道菌群调控中的生物学意义尚不明确。因此,有必要通过进一步研究全面阐明氢分子的具体作用机制,为炎症性及代谢性肝脏疾病提供安全有效的治疗方案。
强烈建议未来开展更多体外实验与临床前研究,明确氢分子在慢性肝病及其相关并发症中的确切生物利用度、生物有效性及细胞转导信号通路。从长远来看,氢医学应基于“产学研融合”的发展理念,与其他学科进行创新性整合,以在健康促进领域实现更大突破。
https://blog.sciencenet.cn/blog-41174-1509166.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:[转载]美国密苏里大学闫政等综述:可穿戴超声设备在治疗中的应用