博文
英国氢生物医学博士论文 第二章 材料方法
||
读本文先阅读:
第二章 设备、材料和方法
2.1 设备和试剂
2.1.1 使用HydroVitality™水电解装置评估氧氢生成。
• HydroVitality™氧氢发生器(450 mL/min)(Water Fuel Engineering, Wakefield, UK)
• H2 Blue™(亚甲基蓝/铂纳米颗粒)(H2 Sciences Inc., Henderson, USA)
• Clarke型O2电极(Hannah Instruments Ltd., Bedfordshire, UK,目录号Opdo™ HI98198)
• Jenway™ 3510 pH计(Camlab, Cambridgeshire, UK,目录号SKU - 1140956)+校准标准品(pH 4,pH 7和pH 9.5)
2.1.2 种子处理
• HydroVitality™氧氢发生器(Water Fuel Engineering, Wakefield, UK)
• 豌豆种子(Pisum sativum seeds)(Thompson and Morgan, Suffolk, UK。目录号24298)
• 离心机(Microstar 17, Avantor™/VWR™, Leicestershire, UK。)
• 培养箱(LEEC, Nottingham, UK。精度190)
• NaCl(Sigma Aldrich, St. Louis, USA。目录号S1679)
• 琼脂糖(Agargel)(Sigma Aldrich, St. Louis, USA。目录号A3301)
• 70%乙醇(Sigma Aldrich, St. Louis, USA。目录号493546)
• 手持式均质器
• 放射免疫沉淀(RIPA)裂解缓冲液(Thermo Fisher Scientific, Waltham, USA,目录号89900)
• 磷酸盐缓冲盐水(PBS)片剂(Thermo Fisher Scientific, Waltham, USA,目录号18912014)
2.1.3 种子测定 - 铜离子还原抗氧化能力(CUPRAC)
• 微孔板分光光度计(Spectramax M2, Avantor™/VWR™, Leicestershire, UK。)
• 96孔微量滴定板用于微量滴定板测定。
• RIPA裂解缓冲液(见第2.1.2节)
• PBS(见第2.1.2节)
• Cuprac测定(Bioquochem, Asturias, Spain。目录号KF01005)
2.1.4 种子测定 - 铁离子还原抗氧化潜能(FRAP)
• 离心机(Microstar 17, Avantor™/VWR™, Leicestershire, UK。)
• 分光光度计Jenway™ 6300(Cole-Parmer, St. Neots, UK。目录号WZ-79000-64)
• PBS(见第2.1.2节)
• Fe2+(Sigma Aldrich, St. Louis, USA。目录号215422)
• Fe3+(Sigma Aldrich, St. Louis, USA。目录号236489)
• 2,3,5-三苯基四唑氯化物(TPTZ)(Sigma Aldrich, St. Louis, USA。目录号1.08380)
• 无水乙酸钠(Sigma Aldrich, St. Louis, USA。目录号W302406)
• 乙酸(Sigma Aldrich, St. Louis, USA。目录号A6283)
• 醋酸缓冲液(无水乙酸钠/乙酸)(Sigma Aldrich, St. Louis, USA。目录号S7899)
• 六水合氯化铁(III)(FeCl3·6H2O)(Sigma Aldrich, St. Louis, USA。目录号F2877)
• RIPA裂解缓冲液(见第2.1.2节)
2.1.5 线虫处理
• NaCl(Sigma Aldrich, St. Louis, USA。目录号S1679)
• 线虫生长介质(NGM):(17克Bacto琼脂粉(Sigma Aldrich, St. Louis, USA。目录号A5306),3克NaCl(Sigma Aldrich, St. Louis, USA。目录号S1679,2.5克Bacto蛋白胨(Sigma Aldrich, St. Louis, USA。目录号P5905),1毫升胆固醇(Sigma Aldrich, St. Louis, USA。目录号C3045 -(5毫克/毫升在乙醇中)),975毫升去离子水,0.5毫升CaCl2(1 M)(Sigma Aldrich, St. Louis, USA。目录号C5670),1毫升MgSO4(1 M)(Sigma Aldrich, St. Louis, USA。目录号83266),25毫升KPO4缓冲液(1 M)(108.3克KH2PO4(Sigma Aldrich, St. Louis, USA。目录号P3786),35.6克K2HPO4(Sigma Aldrich, St. Louis, USA。目录号P5629),蒸馏水至1升。
• PBS(见第2.1.2节)
• RIPA裂解缓冲液(见第2.1.2节)
• 液氮
• 过氧化氢(30% w/w)(Sigma Aldrich, St. Louis, USA。目录号H1009)
• 培养箱(Inculine IL23, VWR™ Leicestershire, UK。)
• Microson XL超声波细胞破碎仪XL(Misonix, New York, USA。)
• 离心机(Microstar 17, Avantor™/VWR™, Leicestershire, UK。)
• UV/Vis分光光度计Jenway™ 6305(Cole-Parmer, St. Neots, UK。目录号WZ-99968-68)
• 显微镜(Brunel Microscopes, Chippenham, UK。目录号SP22)
• HydroVitality™氧氢发生器(Water Fuel Engineering, Wakefield, UK)
• 离心机(Microstar 17, Avantor™/VWR™, Leicestershire, UK。)
2.1.6 细胞培养:灭菌
• 含有L-谷氨酰胺和碳酸氢钠的Roswell Park Medical Institute (RPMI) 1640培养基(Sigma Aldrich, St. Louis, USA。目录号R8758)
• 70%乙醇(Sigma Aldrich, St. Louis, USA。目录号493546)
• 高压灭菌器Priorclave/tactrol 2(Medline Scientific, Oxfordshire, UK)
2.1.7 细胞培养和处理
• H2发生器(Aukewel, Guangzhou, China。目录号ABS-XQ-O2)
• 0.5微米不锈钢扩散石(Filson Filter, Henan, China)
• TK6细胞 - 由英格兰西部大学的Dr. A. Thomas提供的细胞库培养
• 胎牛血清(FBS)(Sigma Aldrich, St. Louis, USA。目录号F7524)
• T-75和T-25培养瓶
• 台盼蓝(Sigma Aldrich, St. Louis, USA。目录号302643)
• CytoSmart™细胞计数设备和软件(Axion Biosystems Inc., Atlanta, USA)
• CellDropFL荧光细胞计数器(DeNovix Inc., Wilmington, USA。目录号CellDrop FL-UNLTD)
2.1.8 流式细胞术
• 80%乙醇(Sigma Aldrich, St. Louis, USA。目录号493546)
• Accuri™ C6流式细胞仪(BD Biosciences, Berkshire, UK)
• 涡旋混合器(Cole-Parmer, St. Neots, UK。V系列Stuart,目录号WZ-04729-01)
• PBS(见第2.1.2节)
• 核糖核酸酶A(RNase A)(Sigma Aldrich, St. Louis, USA。目录号10109142001)
• 碘化丙啶(Sigma Aldrich, St. Louis, USA。目录号P4170)
2.2. 方法
2.2.1 生物信息学方法
使用Ensembl.com基本局部比对搜索工具 - 蛋白质(BLASTP)平台调查了复合体I蛋白亚单位与氢化酶之间的同源性。氨基酸序列来源于www.UniProt.com,而序列比对则使用Clustal Omega程序进行,序列同一性> 25%表明功能可能相似(Anderson和Brass, 1998)。在Expasy.org内使用Dotlet和ScanProtsite程序进行了蛋白质结构域的分析。
2.2.2 评估HydroVitality™氧氢发生器
2.2.2.1 流速
使用水置换法(图2.1)确定了HydroVitality™设备的气体输出体积。
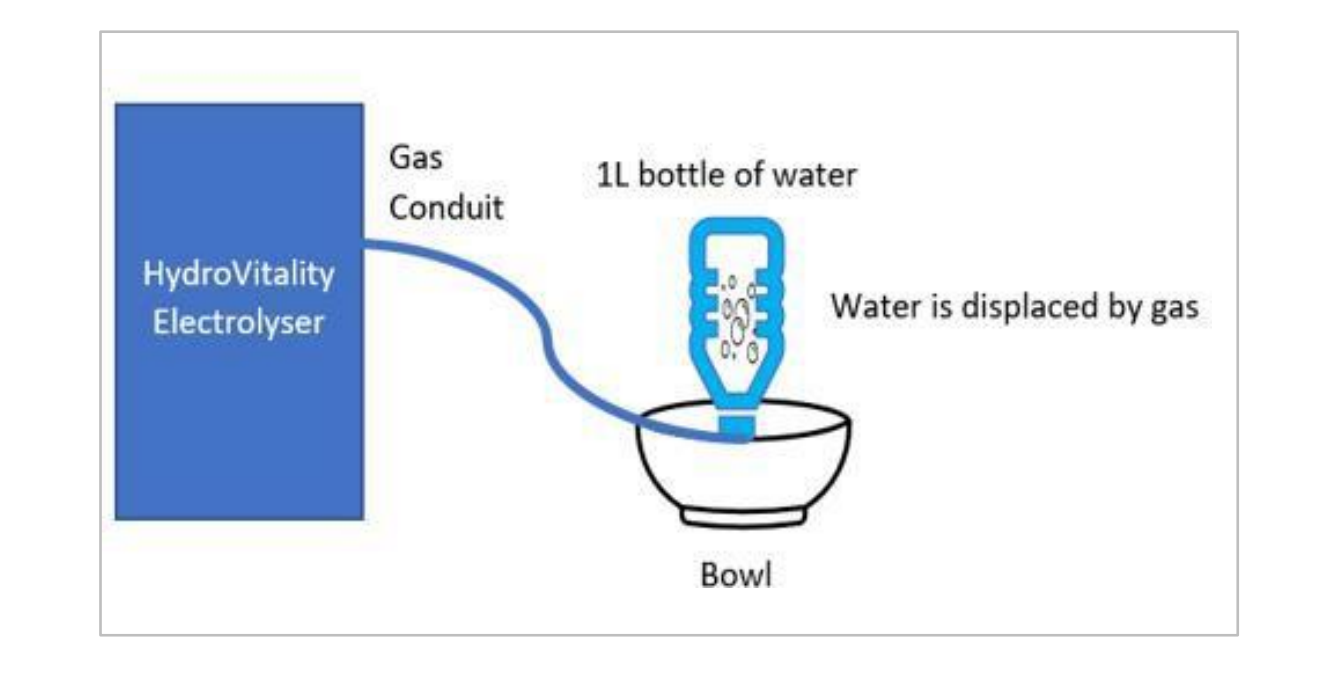
图2.1 水置换法的图形表示。该图描绘了通过硅导管管道进入装有1升水的倒置瓶口的氧氢气体离开发生系统的情况。下方的碗中也装有水,并且获得了稳定的水压和水位。产生的气体将瓶中的水置换到碗中,一分钟后测量瓶中水的减少量,从而得出气体输出量(毫升/分钟)。
(这简直是初中物理学实验的方法!!英国的博士,值得学习)
2.2.2.2 气体分析
HydroVitality™设备的气态输出分析外包给了SGS气体分析服务(Bristol, BS15 4PJ, UK)。由SGS气体分析服务的现场代表收集了750毫升的气体到一个密封的Tedlar®袋中,用于使用气相色谱进行测试(22/2/23)。
该公司(SGS)被要求测试多种污染物,即甲烷(CH4)、一氧化碳(CO)、二氧化碳(CO2)、硫化物(S)和氮气(N2)。
2.2.2.3 水中H2含量的测定
水溶液被注入玻璃Duran瓶中,在从容器中取出样品后替换盖子。瓶子在测量间暴露于室温(21±20°C)。使用滴定法计算溶解氢水平,其中向含有未知水平H2的6毫升水中加入H2 Blue™。H2 Blue™滴定利用亚甲蓝和胶体铂。
MB是一种常用的生物染料氧化剂,在铂催化剂存在下与溶解的分子氢反应产生还原形式(无色)的亚甲蓝:无色亚甲蓝,如反应1所示。
化学反应:MB(蓝色)+ H2 → 无色亚甲蓝(无色)
H2 Blue™与分子氢反应,在溶解的氢气存在下变清澈。随着额外的H2 Blue™滴入,溶解的H2内容被氧化直到完全耗尽。这被称为滴定终点。当达到终点时,额外的滴入不再变清澈,溶液将保持蓝色。清澈液体中的溶解H2含量可以用1滴(0.025毫升)清澈的H2 Blue™来计算,代表0.1毫克/毫升的H2浓度。为了考虑O2对H2的置换,记录结果乘以11米海拔高度下水溶液中H2的饱和点(1.6毫克/升)。
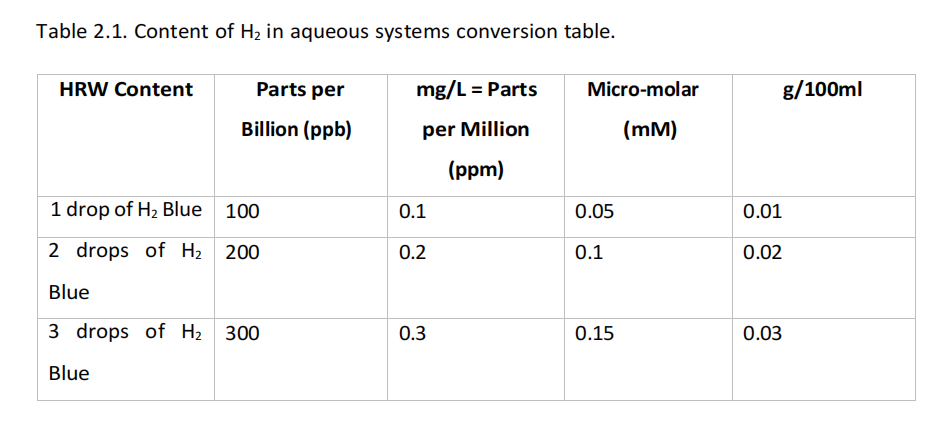
结果以毫克/升显示,相当于百万分比(ppm)。然而,学术界的许多研究使用各种浓度测量(Meng等人,2016;Dobashi、Takeuchi和Koyama,2020;Cheng等人,2021;Tanaka和Miwa,2022)。因此,这些差异可能阻碍了对H2剂量的全面理解,表2.1提供了一个转换指南。
2.2.2.4 水溶液中O2含量的测定
使用O2电极(Hannah Instruments Ltd., Bedfordshire, UK, Cat. #Opdo™ HI98198)进行O2测量。在注入后每5分钟记录一次,持续15分钟,然后在注入后30分钟进行最终记录。样品所处的实验室条件与第2.2.2.3节所述相同。
2.2.3 种子
2.2.3.1 存储
处理后,将种子在吸水纸上风干三小时,然后存放在冰箱(4°C)过夜。
2.2.3.2 种植和培养
在种植到填充有琼脂的培养皿之前,对种子进行称重和编号。这些培养皿用胶带密封,放入透明冷冻袋中,贴上标签,注明日期,并在光照强度等于1200 Lux的培养箱中培养。温度设定为23°C,湿度为85%,光周期设置为16小时光照和8小时黑暗,持续7天。
2.2.3.3 收获和清洗
使用无菌技术收获种子。然后将发芽的幼苗用ddH2O清洗,以去除多余的琼脂。种子在空气中干燥并称重,以记录其生物量数据供以后分析。
2.2.3.4 处理
在对主根进行任何切割之前,先清洁、干燥并称重种子,从中取1厘米用于分析。
2.2.3.5 确定NaCl在植物培养基中的影响
选择一种常见且相对健壮的Mangetout豌豆品种(Pisum sativum L. 'Oregon sugar pod')进行实验分析(Neugschwandtner等人,2019年)。为了更好地理解H2对盐胁迫下发芽的幼苗的影响,需要先进行一项关于生长介质中NaCl含量的初步研究。按照制造商的指示制备Agargel™(7 g Agargel™/L水)作为对照组,同时添加50 mM或100 mM的盐(NaCl)来评估幼苗的相对生长情况。种子用溶解在蒸馏水中的氧氢预处理10分钟,空气干燥,然后放在冷藏单元(4°C)过夜后再种植。对照组种子不进行处理,但会在种植前过夜冷藏。
2.2.3.6 a 种子准备
按照Oyebanji等人(2009年)的方法,对Oregon Sugar-pod Mangetout种子进行表面灭菌。简而言之,用80%乙醇洗涤种子5分钟,然后空气干燥30分钟,再在4°C下冷藏。
使用无菌技术从储存容器中随机提取经过表面灭菌的种子,单独编号并称重后进行处理。每个培养皿上放置三颗种子,确保种子嵌入介质中,每个培养皿底部都标有编号以便于识别。
2.2.3.6 b 对照组
六个种子,每个培养皿三颗,以三角形配置放入两个含有0 mM、50 mM或100 mM NaCl的Agargel填充的培养皿中。
2.2.3.7 H2O
六颗种子分别浸泡在带有盖子的Bijou罐(7 mL)中,每个罐子含有4 mL蒸馏H2O,持续10分钟,空气干燥后,放入含有0 mM、50 mM或100 mM NaCl的Agargel填充的培养皿中。
2.2.3.7 HRW
使用HydroVitality™设备制备HRW。简而言之,将300 mL的ddH2O放入玻璃容器中,使用0.5微米扩散石浸泡30分钟。将4 mL的HRW分装到Bijou罐(7 mL)中,然后将种子放入处理10分钟,空气干燥后,再放入含有0 mM、50 mM或100 mM NaCl的Agargel填充的培养皿中。
2.2.3.8 抗氧化剂测定准备
从每颗种子中取出0.05 g(±0.02 g)的根部材料,放入含有2 mL RIPA裂解缓冲液的15 mL Falcon管中。使每个管中的内容物均匀化。溶液在600 x g下离心6分钟,将1 mL的细胞裂解物分装到1.5 mL离心管中。然后将每个管子快速冷冻在液氮中,之后存放在-20°C的冰箱中。对于抗氧化剂测定,立即收集裂解物进行分析。FRAP测定分析了七次实验数据重复,而由于试剂可用性,CUPRAC测定只评估了三次重复。
2.2.3.9 a 抗氧化剂测定 - CUPRAC测定法
这些实验数据是由在我的监督下(Grace Russell)进行的硕士研究生Bipana Dewan产生的。首先,制备了一个具有已知CUPRAC浓度的校准曲线(补充图1)。按照制造商的指示使用试剂(第2章,第2.1.3节)。抗氧化活性以µM Trolox标准表示。µM Trolox当量 = ((OD 450 nm-截距)/斜率) * 稀释因子。将96孔板在室温下孵育30分钟。使用微板分光光度计在450 nm处测量反应的吸光度(第2.1.3节)。
2.2.3.9 b 种子:抗氧化剂测定 - FRAP测定法
这些数据是由在我监督下由硕士研究生Bipana Dewan收集。首先,制备了一个具有已知FRAP浓度的标准曲线(补充图2)。种子的制备与上述CUPRAC协议相同。为了分析,将细胞裂解物在冰上解冻以防止过度酶活化。对于测定,将50 µl提取液与950 µl FRAP试剂混合。将混合物在室温下孵育30分钟。使用可见光谱分光光度计在593 nm处测量反应混合物的吸光度(Benzie和Strain,1996)(第2.1.4节)。
2.2.4确定氧氢气体给药对盐胁迫线虫的影响。
2.2.4.1 秀丽隐杆线虫:库存培养
为了分析不同NaCl浓度对秀丽隐杆线虫生长和繁殖能力的影响,使用无菌技术,将1平方厘米的库存Bristol N2株线虫(第2章,第2.1.5节)放置在含有标准(50 mM NaCl)NGM琼脂的中心圆形培养皿中,这一过程被称为“播种”(Brenner,1974)。然后,将培养物在22°C下孵育最少五天,最多十天。制备了四种NGM琼脂浓度(NaCl 25 mM/50 mM/100 mM/200 mM),代表亚优(25 mM)(Derycke等人,2007)、最优(50 mM)(Brenner,1974)和超优(100 mM/200 mM)(Xie等人,2012)盐度,并将新培养的线虫分转到每种浓度的五个平板上。这些培养皿再次放置在22°C的培养箱中至少五天。
2.2.4.2 用氧氢气体处理线虫。
为了评估气态氧氢给药对处于压力下的多细胞生物的效果,将线虫播种在含有25 mM/50 mM/100 mM/200 mM NaCl的相应琼脂平板上。然后将开放的培养皿放入一个密封的、有盖的容器(15 x 7 x 5 cm/650 mL)中,该容器连接到HydroVitality™生成装置30分钟(图2.2)。此后,将线虫返回到培养箱(22°C)中48小时,然后评估线虫的形态和繁殖能力。
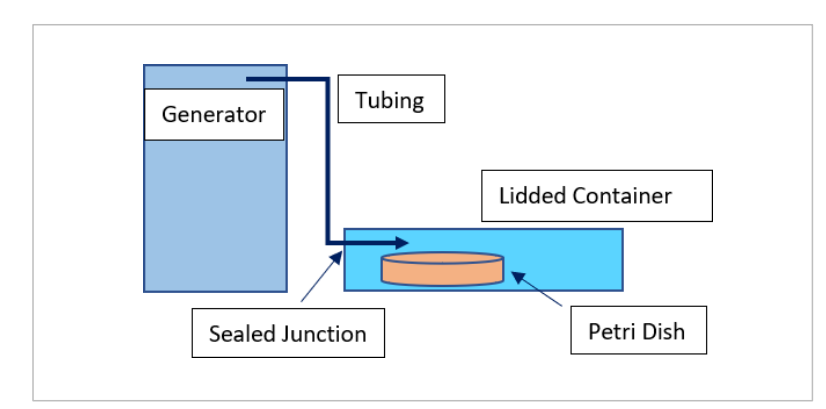
图2.2:氧氢处理设备的示意图,描述了用于将氧氢引入活跃复制线虫大气中的装置。线虫暴露于氧氢(450 mL/min)30分钟,然后在显微镜下以40倍放大进行视觉评估之前,再培养48小时。
2.2.4.3 蛋白质提取
蛋白质提取方法使用了3 mL的PBS缓冲液来从琼脂表面清洗线虫。然后将1 mL的液体分装到1.5 mL离心管中,并以400 x g离心3分钟,形成一线虫沉淀物。移除上清液并丢弃。然后用1 mL的PBS洗涤线虫,以400 x g离心3分钟并移除上清液。用1 mL的HRW或1 mL的ddH2O处理线虫1小时。再次以400 x g离心含有线虫的管子3分钟。移除上清液并丢弃。向离心管中加入0.5 mL含蛋白酶抑制剂的RIPA缓冲液,倒置管子5次并在冰上孵育5分钟。然后,在液氮中快速冷冻离心管,并在每次管子暴露于手持式细胞破碎器内的管子中进行三轮10秒的声波处理前部分解冻(第2.1.5节)。然后彻底解冻管子,并以600 x g离心10分钟。
2.2.4.4 过氧化氢酶测定
过氧化氢酶测定是一种高度敏感、简单且直接的测定法,用于测量各种生物样本(如细胞和组织裂解物或生物流体)中的过氧化氢酶活性。样品中存在的过氧化氢酶与过氧化氢(H2O2)反应生成水和氧气。未转化的H2O2与过氧化氢酶反应,降低溶液的光密度,这通过紫外光谱的240 nm处用分光光度计测量(Hadwan, 2018)。活性计算为每分钟每毫克细胞悬浮液蛋白质的摩尔浓度。摩尔浓度由光密度读数表示,这些值随后除以时间(分钟)。计算出的值再次除以H2O2在240nm处的消光系数,即43.6 M-1 cm-1(Zhang等人,2022)。
使用UV/Vis分光光度计,用装有PBS的石英比色皿(UV波长所需)校准仪器。向该比色皿中加入H2O2,直到吸光度达到0.55 - 0.52。从这个混合物中提取0.1 mL并丢弃。然后向PBS/H2O2溶液中加入0.1 mL线虫裂解物,并每隔10秒进行一次分光光度读数,持续180秒。
2.2.5 细胞培养和处理协议
2.2.5.1 细胞培养方法(库存培养)
从低温存储中取出1 mL TK6淋巴母细胞等分试样,并在室温下解冻约5分钟。使用无菌技术,向45 mL的RPMI培养基中加入4.5 mL的FBS。将这种“完整”培养基置于设定为37°C(5% CO2)的珠浴中。加热后,转移5 mL至无菌的50 mL Falcon管中。将1mL的细胞等分试样转移到50 mL Falcon管中并轻轻混合。然后,将此溶液转移到T-25细胞培养瓶中,并缓慢加入另外10 mL完整培养基。然后将瓶子放回同一孵育器中,在37°C(5% CO2)下培养48小时。
4.8小时后,从培养中取出培养物,并使用无菌技术向瓶中加入另外10 mL完整培养基。然后将瓶子替换回孵育器中再培养72小时。此后,使用无菌技术向培养瓶中加入额外的26 mL温热的完整培养基。将培养瓶放回孵育器中再培养72小时直至实验开始。
2.2.5.1 a 实验对照
在3 x T-25烧瓶中,每个烧瓶含有20 mL完整培养基,接种1.5 x 105个细胞/mL。细胞在37°C、5% CO2条件下孵育。
2.2.5.1 b 急性(单次)处理
将60 mL非完全RPMI(无血清)培养基用氧氢(300 mL/min的H2+ 150 mL/min的O2)气体浸润30分钟。浸润后加入6 mL FBS,并向3 x T-25烧瓶中(每个烧瓶20 mL完整培养基)加入1.5 x 105个细胞/mL。细胞在37°C、5% CO2条件下孵育,并在24、48和72小时时间点每天评估一次。所有实验均重复三次。
2.2.5.1 c 慢性(每日)处理
对于对照组和治疗组,每天向培养烧瓶中加入20 mL新鲜各自的培养基,即完整培养基/氧氢浸润的或未改变的完整培养基。细胞在37°C、5% CO2条件下孵育,并在24(一次浸润)、48(两次浸润)和72小时(三次浸润)时间点进行评估。
2.2.5.2 灭菌
将铝箔包裹的硅胶管在120°C下高压灭菌15分钟,然后放在干燥架上超过1小时。在生物安全柜内,确保扩散石完全浸没在100 mL 70%乙醇中(图2.3 A-C),HydroVitality™氧氢发生器循环2分钟。用干净的手套,从管中取出扩散石,用塑料薄膜包裹,并在安全柜内与管道一起存放在密封容器中。所有进一步的过程都在无菌环境中使用无菌技术完成。

图2.3:消毒和注入方法的照片。从左到右:(A)显示了消毒和注入所需的设备(100mL乙醇;60mL罗斯威尔帕克纪念研究所1640(RPMI)细胞培养基;HydroVitality™氧氢发生器;6mm硅胶管(包在箔中)和0.5微米扩散石)。(B)展示了设备的消毒方式。(C)细胞培养基的注入。
2.2.5.3 氧氢注入
所有设备在使用前都用70%乙醇彻底消毒。为了评估将氧氢注入细胞培养基是否会对TK6细胞的存活和增殖有任何影响,使用HydroVitality™氧氢发生器(450 mL/min的氧氢)将60 mL的RPMI培养基在玻璃制的150 mL Duran瓶中注入30分钟。为了增加压力并改善氧氢到培养基中的注入,HydroVitality™设备通过6 mm硅胶管连接到一个0.5微米的不锈钢扩散石(图2.3 (C))。注入后加入10%胎牛血清(FBS)。由于抗生素可能会影响基因表达和调控(Ryu等人,2017年),因此没有添加任何抗生素物质。
2.2.5.4 H2气体注入
在我的监督下,由硕士生Georgia Mannings进行的实验和生成的数据(Grace Russell)。注入需要通过无菌管道将H2气体鼓泡30分钟进入细胞培养基。
2.2.5.5 细胞计数:急性和慢性处理
在轻轻手动搅动细胞之前,从烧瓶中取出1 mL加入到无菌离心管中。然后将管子以400 x g离心5分钟,在管底部形成细胞沉淀。取出20 µL的沉淀细胞转移到96孔板中。向孔中加入20 µL的台盼蓝并使用移液管的动作混合均匀。取10 µL这种混合物滴到玻璃血球计数板上,并使用自动化设备和软件进行细胞计数和存活率评估(第2.1.7节)。
2.2.5.6 促有丝分裂剂的确定
在将TK6细胞暴露于促有丝分裂剂之前,进行了促有丝分裂活性的比较。为了测试氧氢的抑制效应是否会在促有丝分裂剂刺激下持续存在,测试了原发性B细胞(Pokeweed (PWM))、T细胞(刀豆蛋白A (ConA)、植物血凝素 (PHA))和非特异性促有丝分裂剂脂多糖(LPS)在促进TK6细胞增殖方面的效能(第6章,第6.5.3节)。
2.2.5.6 a 刀豆蛋白A
ConA是一种标准的淋巴细胞促有丝分裂剂,用于体外增强淋巴细胞的增殖(Paetkau等人,1976年)。细胞以与对照组相同的数量和条件种植。根据Yang等人(2020a)的改良方法,将1 mg的ConA溶解在1 mL的RPMI培养基中。将0.33 mL的等分试样加入到烧瓶中的20 mL培养基中,使每个烧瓶的最终浓度为0.016 mg/mL(16 µg/mL)。细胞以相同的数量(1.5 x 105 /mL)种植,并在相同的条件下(37°C/5% CO2)孵育24小时。进行了2次重复实验。
2.2.5.6 b 脂多糖
LPS是一种细菌毒素,存在于革兰氏阴性细菌的外膜中,作为一种普遍的非特异性促有丝分裂剂(Ziegler-Heitbrock, 1995)。根据Alzahrani等人(2022年)的方法改良,将5 mg的LPS溶解在1 mL的培养基中。将0.33 mL的等分试样加入到20 mL的细胞培养基中,使每个烧瓶的最终浓度为80 µg/mL。细胞以相同的数量(1.5 x 105 /mL)种植,并在相同的条件下(37°C/5% CO2)孵育24小时。进行了2次重复实验。
2.2.5.6 c 植物血凝素
PHA是一种从红肾豆(Phaseolus vulgaris)中提取的有毒的、结合糖的凝集素,是T细胞刺激活性的强效促有丝分裂剂(Nowell, 1960)。根据Maotoana、Burt和Goedhals(2023年)的方法改良,将1 mg的PHA溶解在1 mL的培养基中。将0.33 mL的等分试样加入到20 mL的细胞培养基中,使每个烧瓶的最终浓度为16 µg/mL。细胞以相同的数量种植,并在相同的条件下孵育24小时。进行了2次重复实验。
2.2.5.6 d 美洲商陆促有丝分裂剂
PWM是一种B细胞特异性的促有丝分裂剂(Mellstedt, 1975)。根据Portugal(2022年)进行的实验改编,将1 mg的PWM溶解在1 mL的培养基中。将0.33 mL的等分试样加入到20 mL的细胞培养基中,使每个烧瓶的最终浓度为16 µg/mL。细胞以相同的数量种植,并在相同的条件下孵育24小时。进行了2次重复实验。
2.2.5.7 流式细胞术
流式细胞术按照Riccardi和Nicoletti(2006年)设计的协议进行。简要地说,从每个培养烧瓶中取出1 mL的细胞悬液转移到1.5 mL离心管中。细胞在400 x g下离心5分钟。计数约200,000个细胞,并将相应体积的每个培养物随后转移到离心管中,在4°C下以400 x g离心5分钟。去除上清液,向每个管子中加入200 µL冰冷的PBS。将每个细胞悬液转移到冷冻管中。在涡旋的同时缓慢向每个冷冻管中加入1 mL冰冷的80%乙醇。样品在冰上放置10分钟以固定,并储存在-20°C下24小时。
在分析当天,将样品升温至室温(20°C ± 2°C),并向细胞中加入1 mL PBS。然后细胞在600 x g下离心5分钟,并去除上清液。每个样品用478.5 µl PBS和1.5 µl RNase A重悬。这在室温下孵育一小时。孵育后,向每个样品中加入20 µL碘化丙啶染料(50 µg / 1 mL (PBS)),并用箔纸覆盖离心管以防止光线进入。使用BD Accuri™ C6 Plus流式细胞仪进行流式细胞术。
2.2.6 统计分析
除非另有说明,所有数据均报告为均值(n = 3)和标准误差(均值±SEM)。使用Microsoft Excel™(2023)软件进行统计分析。进行了假设等方差的配对双样本t检验或方差分析(ANOVA),以确定组间的统计学显著差异。进一步分析采用Tukey-Kramer协议完成。统计学显著的数据定义为p <0.05。
https://blog.sciencenet.cn/blog-41174-1450317.html
上一篇:免疫系统的性别差异
下一篇:人类淀粉酶基因的近期进化