博文
氢果冻治疗抑郁症的小鼠研究2024
||
氢果冻治疗抑郁症的小鼠研究2024
本文最近发表在PCN Reports杂志,作者主要来自日本国防医学院,该机构一种开展氢气的基础和临床医学研究,曾经报道过给患者注射氢气生理盐水治疗脑出血的工作。本次研究是通过含氢气果冻,发现这种氢气补充食物能有效缓解LPS诱导的小鼠兴趣丧失的抑郁样行为。

本文的研究目标是评估氢气在预防和治疗精神症状,特别是抑郁情绪和兴趣丧失方面的潜力,并探索其潜在机制。研究采用了一种表现出炎症衍生的抑郁症状的小鼠模型进行调查。
研究方法:
对癌症研究所小鼠进行了为期7天的干预,通过果冻摄入的方式分别给予30%氢气或每天40克空气。在最后一天,通过腹腔注射5毫克/千克的脂多糖(LPS)来诱导与炎症相关的抑郁症状。在LPS给药后24小时进行行为学和生化评估。
研究结果:
LPS给药后观察到自发行为的减少;然而,这种效应在氢气处理组中得到了缓解。社交互动测试显示,LPS处理组与不熟悉的小鼠之间的互动显著减少,而氢气处理组没有出现这种减少。两组在强迫游泳测试中均未观察到显著变化。此外,在氢气组中,LPS给药并未导致紧密连接蛋白-1(zonula occludens-1,一种与脑血管屏障的屏障功能相关并在紧密连接中表达的生化标志物)的减少。
研究结论:
氢气给药显示出对LPS诱导的兴趣丧失有预防作用,表明了其在症状预防方面的潜在角色。然而,在该特定模型中,它并没有显示出对抑郁症状的抑制效果。这些发现强调了氢气在炎症诱导的精神症状背景下的细微影响,指出了进一步探索和研究的潜在途径。
关键词:血脑屏障,炎症,脂多糖,氢气
这项研究探讨了氢气在预防脂多糖(LPS)诱导的兴趣丧失方面的潜力,采用了一个炎症衍生的抑郁症状小鼠模型。氢气给药缓解了LPS后自发行为的减少并维持了正常的社交互动,表明了其对抗LPS诱导的兴趣丧失具有预防作用。
前言
氧化作用对于通过有氧呼吸获取能量的生物来说是不可避免的。然而,慢性的氧化积累,即所谓的氧化应激,会损害细胞性质和形态维护,并引发如心脏病和血管病变等健康问题。人类大脑仅占体重的2%,但却消耗高达20%的总氧气量和大量的能量,因此大脑极易受到氧化应激的影响。导致氧化应激的因素包括超氧化物阴离子自由基、过氧化氢和羟基自由基等,其中最常见的体内因素是超氧化物,它被超氧化物歧化酶所中和。过氧化氢则由过氧化氢酶和谷胱甘肽过氧化物酶解毒。摄入的类胡萝卜素,如α-和β-胡萝卜素,能有效清除单线态氧。氢气作为一种简单的还原分子,吸引了大量研究关注,因为越来越多的证据表明氢气对身体健康有益。最近的研究显示,氢气的摄入对预防或治疗身体疾病和中枢神经系统相关疾病具有效果。然而,氢气如何预防这些疾病的发生和发展的具体机制尚未明确。
氧化应激会引起炎症,反之亦然。全身性给予脂多糖(LPS)会导致行为异常,类似于抑郁症的核心症状(如焦虑、抑郁和缺乏兴趣),并诱导细胞因子释放及增加活性氧物种的产生。这些因素可能有助于精神症状的病理生理学发展。
本研究旨在分析氢气给药对恢复LPS诱导氧化应激小鼠模型中的行为异常的效果。此外,为了阐明与此效果相关的生化机制,评估了大脑和外周血中蛋白质表达的差异。鉴于小胶质细胞和星形胶质细胞与大脑免疫系统有关,本研究调查了以下标志物:胶质纤维酸性蛋白(GFAP,一种星形胶质细胞标志物)、离子钙结合适配器分子1(IBA1,一种活化的小胶质细胞标志物)以及外周苯二氮卓受体(PBR,一种促进炎症的胶质激活标志物)。另外,由于LPS诱导的全身性炎症被报道会破坏血脑屏障(BBB),因此也调查了闭锁小带蛋白-1(ZO-1)和封闭蛋白。ZO-1位于细胞间紧密连接的胞浆膜表面,可能参与细胞间连接处的信号传导。封闭蛋白是紧密连接的第一个被识别的成分,可能有助于屏障和栅栏功能或调节。本研究的发现可能有助于预防精神障碍的发生、治疗方法的开发以及这些障碍的药物发现。
材料与方法
动物:八周龄的雄性癌症研究所(ICR; CD-1)小鼠购自日本SLC(滨松市,日本),并在温度(22-24°C)和湿度(50%)调节的房间内,以12:12小时的光暗周期维持,早上7:00开灯。为消除动情周期的影响,行为和生化分析只使用了雄性小鼠。食物和水随意提供。小鼠被安置在标准笼子里,每个笼子最多四只小鼠,尺寸为225×338×140毫米,铺有锯末。此外,准备了两只小鼠作为社交互动测试的社会目标。每项实验使用16只小鼠,在到达后在动物设施中的家笼中适应1周。适应后,将供水瓶替换为含有30-40毫克/升气泡(东京新菱公司)的果冻,为期1天。
氢气果冻
使用含有空气或氢气的果冻,浓度为30-40毫克/升;其成分如表1所示。为确定小鼠消耗的果冻量,准备了九只单独笼子的小鼠。通过移除水瓶使它们脱水24小时,然后在一个10厘米的盘子中放入40克含气泡的果冻;在0、30、60、120、180、300和420分钟后称重果冻。在同一房间的另一个盘子中放置果冻和小鼠笼,测量各时间点的果冻重量损失以确定因干燥导致的重量损失。小鼠消耗的果冻量定义为小鼠笼中各时间点果冻的重量损失减去因干燥导致的重量损失。
Table 1 Composition of jelly administered to mice.
Hydrogen gel | Placebo gel | ||
Ingredients | Composition | Ingredients | Composition |
Water | 98.1% | Water | 98.1% |
Gelator* | 1.7% | Gelator* | 1.7% |
Sucrose myristate | 0.1% | Sucrose myristate | 0.1% |
Acesulfame potassium | 0.1% | Acesulfame potassium | 0.1% |
Molecular hydrogen | ~30–40 mg/L | Air | ~30–40 mg/L |
*Gelator | |||
Ingredients | Composition | ||
Carrageenan | 20% | ||
Xanthan gum | 15% | ||
Tara gum | 10% | ||
Carob bean gum | 5% | ||
Glucomannan | 5% | ||
Potassium dihydrogen phosphate | 10% | ||
Dextrin | 35% |
氢气在诱导神经炎症前7天给予小鼠。此持续时间的选择基于先前的研究,这些研究证明了在类似期间内给予氢气时具有显著的神经保护效果。氢气通常作为健康补充剂消耗,这表明其具有潜在的预防益处。因此,在诱导神经炎症前给予氢气以评估其预防效果。
分组和处理
小鼠被分为三组:第1组小鼠(对照组)接受含气泡的果冻1周;然后在周末的最后一天腹膜内注射生理盐水。第2组小鼠(LPS组)接受含气泡的果冻1周,在周末的最后一天,注射来自大肠杆菌O127:B8血清型的LPS(Sigma, St. Louis, MO, USA),剂量为每公斤体重5毫克,以诱导全身性炎症,这被用作基于神经炎症假说的精神病症状的病理模型。第3组小鼠(H2-LPS组)接受含氢气泡的果冻(Shinryo)1周,在周末的最后一天,注射LPS,剂量为每公斤体重5毫克。每天在不锈钢鼠笼盖顶部供应40克含空气或氢气泡的果冻。生理盐水和LPS以每公斤体重10毫升的固定体积注射。在LPS注射后24小时进行社交互动测试,次日进行开场和强迫游泳测试。
以5毫克/公斤的剂量腹膜内注射LPS以诱导神经炎症。此剂量基于先前模拟神经炎症的研究选择,这些研究报告了在LPS给药后24小时进行的行为实验。根据Dantzer等人的研究,炎症在LPS给药后24小时转变为病态和抑郁,继初始的2-6小时急性炎症期之后。因此,在LPS给药后24小时进行行为测试和组织收集用于基因表达分析,以观察由炎症而非急性运动功能下降引起的行为异常。
组织收集
行为测试后,使用麻醉混合物(0.75毫克/公斤美托咪啶[Medetomin注射剂,明治制藥],4.0毫克/公斤咪达唑仑[咪达唑仑注射剂,TEVA,武田药品]和5毫克/公斤布托啡诺[Vetorphale,明治制藥])麻醉小鼠,并用0.1M磷酸盐缓冲盐水(PBS)进行心脏灌注以去除血液。麻醉混合物以每公斤体重10毫升的体积注射。接下来,提取大脑并浸入RNAlater溶液(Thermo Fisher Scientific)。第二天解剖大脑以获得海马体用于蛋白质表达分析。解剖的组织储存在-80°C直至分析。处理、行为测试和蛋白质表达分析的组织采样时间表如图1所示。
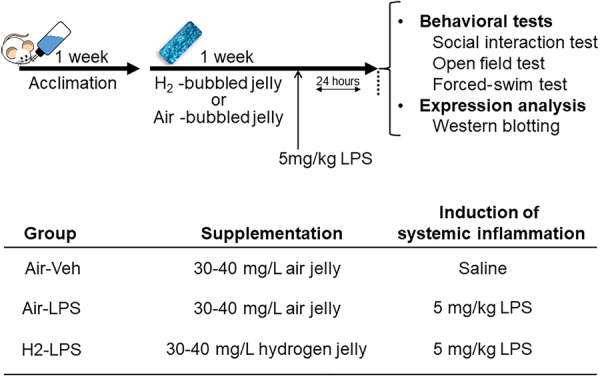
图1 实验设计的示意图。
在第1组和第3组中,由于斗殴导致严重受伤的个体被移除(每组一个个体)。在第2组中发现一只小鼠在社交性测试后受伤,因此该小鼠随后从研究中移除。
所有程序均按照ARRIVE指南和国家卫生研究院实验室动物护理和使用指南(NIH出版物编号8023,修订于1978年)执行。所有动物实验均已获得国防医学院本地动物调查委员会的批准(批准号:18008和22042)。
行为测试
社交性测试
在最后一次注射后24小时,使用U型两选择场测量社交性。这用于通过确定实验小鼠在“社交区”与“非社交区”中的“社交区域”内花费的时间和与社交刺激小鼠互动的时间来评估社交接近和兴趣的行为状态。U型两选择场是一个修改过的开放场(宽40厘米,深30厘米,高30厘米),其中部用一堵墙(厚1厘米,宽18.5厘米,高28.5厘米)部分隔开,使得场地包含两个封闭象限和两个相同大小的开放象限。每个区域的左上和右上角包含两个小金属网室(宽10厘米,深6厘米,高6厘米),左上角落的室用于容纳社交刺激小鼠。使用10-12周龄的雄性ICR小鼠作为社交刺激。测试小鼠在没有任何社交刺激小鼠的情况下自由移动5分钟以适应场地。然后,小鼠可以在有社交刺激小鼠的情况下自由移动5分钟。交互区域定义为每个室前3.3厘米和侧面5厘米的区域(左侧区域定义为感兴趣区域[ROI] 1,右侧区域定义为ROI 2),并测量每只测试小鼠在这些区域中花费的总时间。然后计算每只小鼠在ROI 1和ROI 2中花费时间与会议时间(300秒)的比例。
开场测试
第二天早上,进行开场测试以评估自发运动活动水平、焦虑和在陌生环境中移动的意愿。评估在由丙烯酸盒子组成的开场竞技场中进行,尺寸为43.2×43.2×30.5厘米(Med Associates)。侧壁覆盖有纸板以阻挡小鼠的视线。水平和垂直阵列的16个红外光束分别追踪水平和垂直移动。小鼠被放置在场地中心,允许在明亮光照的房间中自由探索5分钟。每次记录后,从竞技场中清除粪便和尿液,并使用20%乙醇清洁竞技场。使用Activity Monitor Version 7.0.5.10软件(Med Associates)分析小鼠的总移动距离和站立活动。
强迫游泳测试
下午,开场测试后,根据Porsolt等人的方法进行强迫游泳测试。然而,使用MicroAct(NeuroScience)测量不动的持续时间。在测试开始前,立即使用即时粘合剂将一个小磁铁(直径1.6毫米,厚度0.5毫米)附着在两只脚的脚跟上。每只附着磁铁的小鼠被放置在一个充满水(维持在22-23°C)至深度12.5厘米的丙烯酸圆筒(高18厘米,直径11厘米)中,持续6分钟,周围环绕着圆形线圈。根据附着在脚跟上的磁铁的移动,线圈中产生小电流。这个电流被放大,转换成电压,并由系统记录。在6分钟测试期的最后5分钟内测量不动的持续时间。不动的持续时间自动检测。系统调整为在1-30赫兹的频率范围内检测电压脉冲,并且振幅超过0.10伏特。使用这些设置分析反映游泳行为的电压变化。不动的持续时间定义为每个间隔(秒)的总时间超过1.00秒,在检测到的相邻脉冲之间。
蛋白质印迹分析
提取的海马体使用手持式Polytron匀浆器(PT1200E, Kinematica AG)在含有0.5%肌氨酸钠和1×Halt蛋白酶抑制剂混合物(Thermo Fisher Scientific)的PBS中进行匀浆。匀浆物以15,000转/分钟离心10分钟,分离上清液用于蛋白质印迹分析。使用双辛可宁酸试剂盒(Thermo Fisher Scientific)测定蛋白质样品的浓度,并用PBS稀释至4μg/μL的浓度。将Invitrogen NuPAGE LDS样品缓冲液(4×; Thermo Fisher Scientific)与4 mM二硫苏糖醇(FUJIFILM Wako Pure Chemical Corporation, Osaka, Japan)混合后加入到稀释的样品中,得到1×浓度。每个样品的最终浓度为3μg/μL。然后将蛋白质样品在70°C加热10分钟。接下来,30μg的蛋白质样品在4%-10%梯度十二烷基硫酸钠-聚丙烯酰胺凝胶(Bio-Rad)上分离,并转移到Immobilon-P聚偏氟乙烯膜(Merck Millipore)上。电泳后,用含0.5% Tween 20的PBS洗涤膜,然后转移到5% Blocking One封闭溶液(Nacalai Tesque)中孵育1小时。膜分别用抗GFAP(ab53554, 1:10,000, Abcam)、IBA1(ab5076, 1:200, Abcam)、PBR(ab109497, 1:200, Abcam)、occludin(13409‐1‐AP, 1:2,000, ProteinTech)、ZO‐1(Ab221547, 1:2,000, Abcam)和α‐ ubulin(1:50,000, FUJIFILM Wako Pure Chemical Corporation)的一抗在4°C下过夜孵育。第二天,洗去多余的抗体,再用辣根过氧化物酶(HRP)标记的二抗对occludin和ZO‐1以及β-actin的小鼠IgG进行1小时孵育。然后,用含0.5% Tween 20的PBS(FUJIFILM Wako Pure Chemical Corporation)洗去多余的抗体。使用Amersham Imager 600(Cytiva)通过ImmunoStar LD化学发光HRP底物(FUJIFILM Wako Pure Chemical Corporation)检测发光信号,并使用Image Studio Lite Version 5.2软件(LICOR Biosciences)进行定量。所有检测到的量都以α-tubulin进行归一化,并用于组间比较分析。
酶联免疫吸附测定
使用商业可获得的酶联免疫吸附测定(ELISA)试剂盒(Mouse IL-1 beta/IL-1F2 Quantikine ELISA Kit, Mouse TNF-alpha Quantikine ELISA Kit, R&D Systems)测定小鼠血浆中的白细胞介素(IL)-1β和肿瘤坏死因子(TNF)-α浓度。然后将血清用PBS以1:3.3的比例稀释。随后,将50μL稀释后的血浆分装到包被的ELISA板上,根据制造商的说明检查样本中的IL-1β和TNF-α水平。每个样本均重复测定两次。
统计分析
使用重复测量方差分析(rmANOVA)测量处理前后吸入空气或氢气果冻摄入的体重变化。使用非配对t检验比较两个实验组,使用Dunnett检验比较三个组。使用JMP 15.2.0(SAS Institute)进行四分位数范围异常值方法和rmANOVA分析,使用GraphPad Prism 9(GraphPad Software)进行非配对t检验和Dunnett检验。数据表示为均值±标准误差,并使用GraphPad Prism 9整合到图表中。p值<0.1认为趋势显著,p<0.05认为统计显著。
结果
果冻消耗量
在7小时内对小鼠的果冻消耗量进行了评估。图2显示了每个时间点小鼠消耗的果冻数量。对于九只小鼠,在任何时间点的消耗量中均未发现异常值。在给药后7小时,平均果冻消耗量为5.28±2.08克(以气体量计算为0.16±0.06毫克)。最低和最高消耗量分别为2.11克和8.70克(以气体量计算分别为0.063毫克和0.261毫克)。
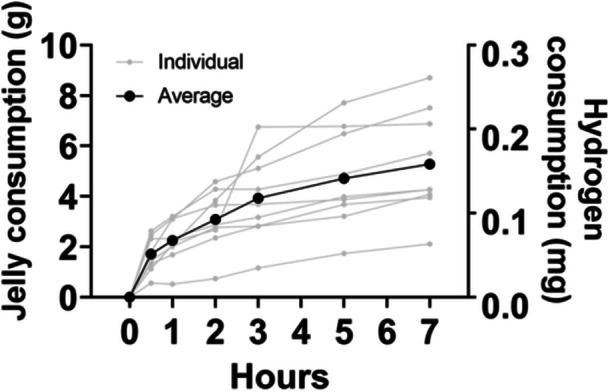
图2小鼠的果冻消耗情况。灰色线条表示个体果冻消耗量,黑色线条表示在将果冻放入小鼠笼子后的0、30、60、120、180、300和420分钟时的平均消耗量。在任何时间点的果冻消耗量中都不存在异常值。
氢气摄入对体重的影响
在连续7天摄入含氢果冻后,氢气组和空气果冻组小鼠之间的体重没有显著差异(图3)。
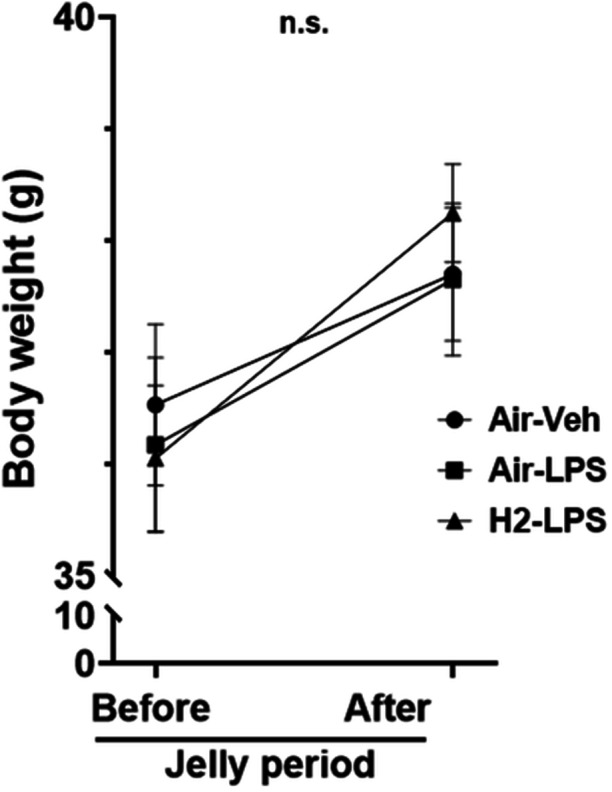
图3空气或氢气果冻补充一周后小鼠体重的变化。通过重复测量方差分析,各组之间未观察到显著差异(n.s.)(每组n=15,p=0.51)。
社会交往
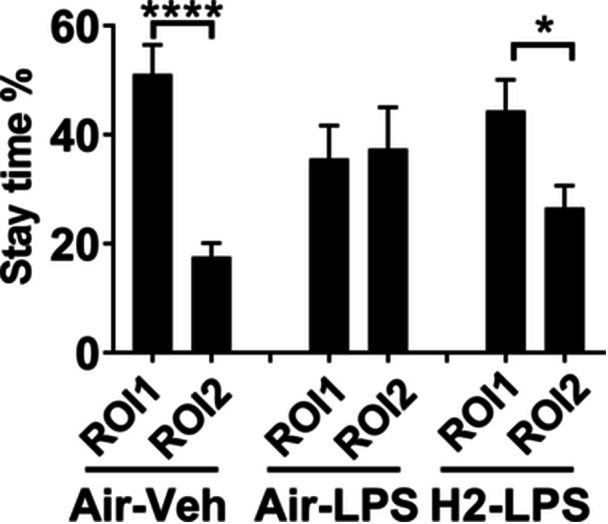
图4显示了在社会交往测试中,小鼠在5分钟会话期间在ROI 1和ROI 2区域花费的时间百分比。当同种小鼠出现时,它们会相互互动,因此在社交区域花费的时间明显多于在非社交区域。因此,与对照组相比,对照组在ROI 1中花费的时间百分比更高(ROI 1中为51.06%±5.42%,ROI 2中为17.62%±2.47%,t(28)=5.612,p<0.0001,t检验)。脂多糖(LPS)给药降低了ROI 1中的不均匀分布(ROI 1中为35.59%±6.08%,ROI 2中为37.44%±7.60%,t(30)=0.1894,无显著差异,t检验)。相比之下,氢气摄入恢复了LPS诱导的减少,并反映了对照组中观察到的结果(ROI 1中为44.43%±5.65%,ROI 2中为26.58%±4.07%,t(28)=2.564,p<0.05,t检验)。
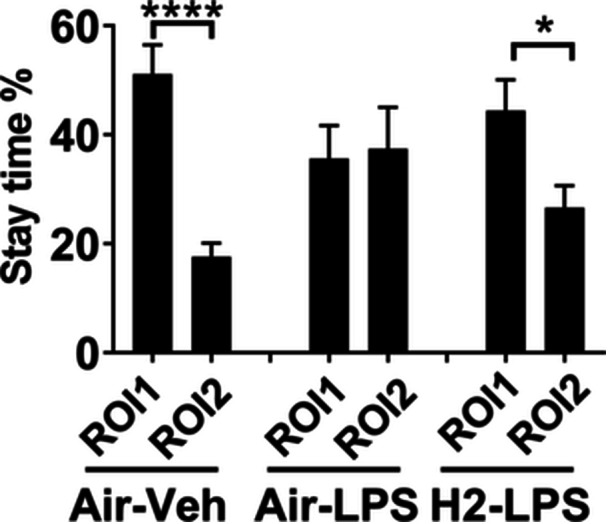
图4氢气摄入对社会交往的影响。小鼠接受空气或氢气气泡果冻1周,随后给予5 mg/kg脂多糖(LPS)以诱发全身性炎症。使用社会交往测试进行评估。图中显示了三个实验组中每只小鼠在感兴趣区域(ROI)1和ROI 2中花费的时间百分比相对于总会话时间(300秒)的平均值±标准误差。n.s.,无显著差异;与Air–Veh组相比,*p<0.001和**p<0.0001(t检验)。
自发活动
与Air–Veh组(2303±190.0厘米)相比,Air–LPS组的总距离显著减少(1625±180.9厘米,p<0.05)。然而,H2–LPS组的总距离呈下降趋势(1727±167.7厘米,p<0.1),因此与Air–Veh组相比,氢气补充并不能显著逆转活动减少(图5a)。中心和外区的距离在各组之间无显著差异(图5b,c)。与Air–Veh组(108.2±9.108次)相比,Air–LPS组的垂直活动次数显著减少(62.73±8.638次,p<0.001)。然而,H2–LPS组也显著减少(51.13±6.777次,p<0.0001),因此氢气补充并未逆转LPS引起的减少(图5d)。
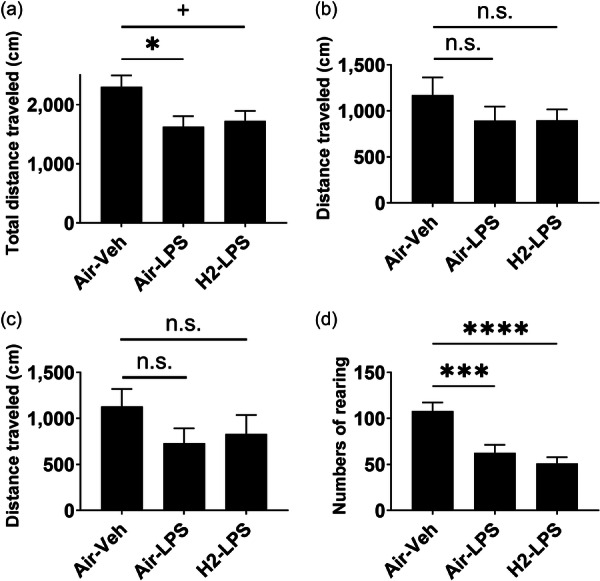
图5氢气摄入对自发活动的影响。小鼠接受空气或氢气气泡果冻1周,随后给予5 mg/kg脂多糖(LPS)以诱发全身性炎症。使用开场试验评估自发活动。图中显示了(a)总距离、(b)中心区域行走的距离、(c)外区行走的距离和(d)站立次数的平均值±标准误差。使用Dunnett检验与Air–Veh组相比,n.s.表示无显著差异,+p<0.1,p<0.05,**p<0.001和****p<0.0001。
抑郁症状
在强迫游泳试验中,各组小鼠在最后5分钟的不动时间无显著差异(图6)。
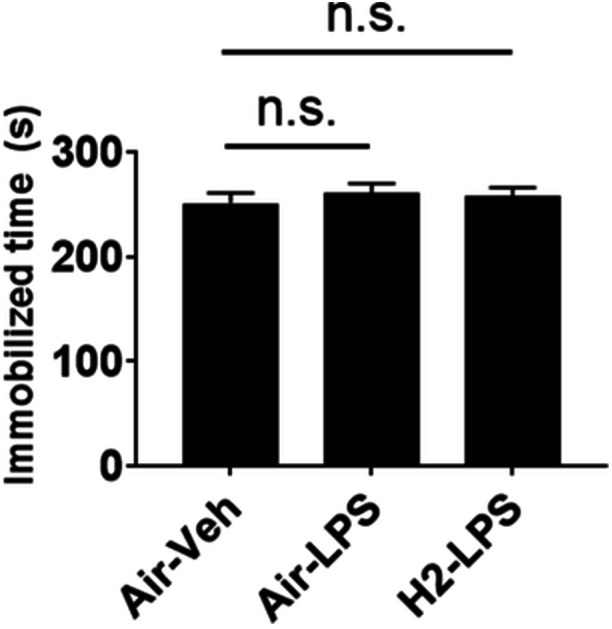
图6氢气摄入对强迫游泳试验中不动时间的影响。小鼠接受空气或氢气气泡果冻1周,然后给予5 mg/kg脂多糖(LPS)以诱发全身性炎症。使用强迫游泳试验评估其抑郁情绪。图中显示了6分钟会话中最后5分钟不动时间的平均值±标准误差。使用Dunnett检验与Air–Veh组相比,n.s.表示无显著差异。
氢气引起脑内胶质细胞和紧密连接标记蛋白的表达变化
图7a显示了代表性的蛋白质印迹图像。图7b显示了目标蛋白GFAP、IBA1和PBR的平均强度,它们分别是星形胶质细胞、小胶质细胞和活化胶质细胞的标记物;其强度已针对α-微管蛋白进行归一化处理。各组之间GFAP和IBA1的表达无显著差异。氢气摄入并未降低PBR的表达,而PBR会促进LPS诱导的炎症增加。图7c显示了BBB功能标记物的平均强度,已针对α-微管蛋白进行归一化处理。与对照组相比,LPS组ZO-1和occludin的表达水平显著降低。然而,氢气摄入使它们的表达恢复到正常水平。
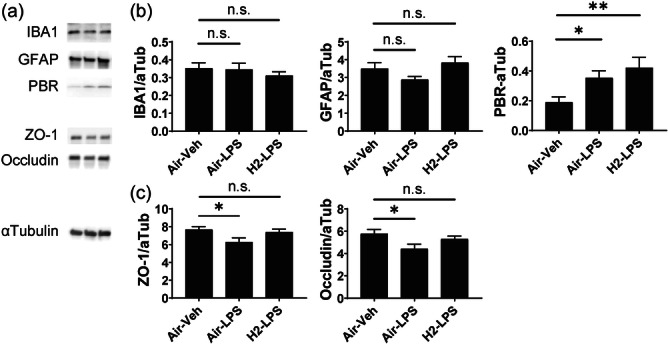
图7 脂多糖(LPS)给药后海马体中的蛋白质表达。(a)左侧显示了蛋白质印迹的代表性图像。条形图表示(b)与胶质细胞相关的分子(包括离子化钙结合适配器分子1、胶质纤维酸性蛋白和外周苯二氮卓受体)和(c)血脑屏障屏障功能标记物(包括紧密连接蛋白-1和闭锁蛋白)的检测条带图像强度的平均值±标准误差比,这些值已针对三组实验小鼠中的α-微管蛋白进行归一化处理。使用Dunnett检验与Air–Veh组相比,n.s.表示无显著差异,*p<0.05和**p<0.01。
氢气摄入引起的血清中炎症细胞因子表达变化
图8显示了三组小鼠在行为测试后血清中炎症细胞因子的浓度。三组之间IL-1β水平无显著差异。TNF-α水平因LPS诱导的全身性炎症而显著增加,且氢气摄入无法逆转这一增加。
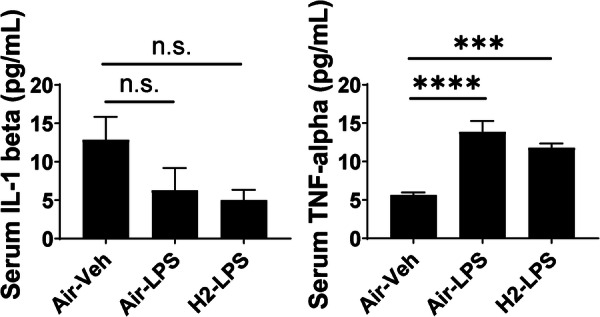
图8脂多糖(LPS)给药后血清中的蛋白质浓度。条形图展示了使用酶联免疫吸附测定法分析的小鼠血清中白细胞介素(IL)-1β和肿瘤坏死因子(TNF)-α的浓度。n.s.:无显著差异;***p < 0.001 和 ****p < 0.0001 表示与Air–Veh组相比,采用Dunnett检验得出的差异具有显著性。
讨论
本研究探讨了氢气摄入对精神疾病发展的预防作用,并探索了潜在机制。氢气抑制了由LPS诱导的全身性炎症引起的兴趣降低(即与同种小鼠的互动减少)。此外,本研究中的生化分析表明,氢气可能对LPS诱导的血脑屏障(BBB)标志物蛋白质表达减少具有缓解作用。
本研究通过开放场测试发现,LPS导致自发活动和探索行为减少,这可以解释为动机降低。然而,氢气给药并未抑制这些效应。尽管氢气可能不影响动机的减少,我们还是使用了高剂量(5 mg/kg)来构建神经炎症模型。因此,发生了强烈的炎症反应,本研究中使用的氢气剂量可能不足以恢复。相比之下,社交互动测试显示,LPS诱导的互动减少被氢气给药明显抑制。这一结果表明,动机和兴趣的减少可能涉及不同的机制。
生化分析揭示了对照组与LPS组之间BBB的ZO-1和occludin成分显著减少。相反,对照组与氢气+LPS组之间没有观察到显著差异,这表明氢气对LPS诱导的BBB损伤具有保护作用。先前的研究已经将BBB异常与精神障碍的发病机制联系起来。本研究的结果表明,氢气对BBB具有修复作用,逆转了LPS诱导的门卫功能的减弱。然而,由于本研究中LPS组与氢气+LPS组之间没有显著差异,我们得出结论,氢气对BBB损伤的保护作用证据较弱。鉴于BBB保护的证据较弱,探索氢气可能发挥其作用的其他潜在机制至关重要。我们没有观察到氢气给药的抗炎效果,这表明炎症不是行为异常及其抑制的因素。考虑到已经提出了精神障碍的神经炎症假设,已经在精神障碍患者中进行了抗炎剂的干预研究,但结果不一。总的来说,尚未明确证明抗炎剂在治疗精神障碍中的有效性,这表明炎症可能是精神障碍的一个附带现象。氢气给药改善行为的可能机制之一是其作为抗氧化剂的作用。炎症和氧化应激密切相关,彼此都能相互促进。我们的西方印迹结果显示,在LPS诱导的炎症小鼠的海马中,IBA1的表达没有增加。正如Shi等人所指出的,大脑免疫细胞对LPS的反应中IBA1的表达不一致。也许PBR是反映神经炎症的更合适的标志物。鉴于本研究中未抑制LPS诱导的炎症,氢气可能抑制了由炎症引起的氧化应激。氧化脂质和氧化应激会破坏BBB。因此,LPS诱导的炎症可能触发了氧化应激,导致BBB破坏。
本研究有几个局限性。首先,果冻是随意提供的;因此,每只小鼠的剂量不同。尽管如此,之前的报道中通常使用随意口服富氢水的方式,并评估了氢气的生化和行为效应。使用富氢水的先前研究通常以0.8-3 mg/L的浓度给药。最近,Li等人通过给予高浓度7.0 mg/L的氢气,展示了富氢水对脂肪肝模型中肝脏损伤的保护作用。尽管小鼠的每日水摄入量取决于小鼠种类和周龄,但通常不超过8 mL。在Li等人报道的研究中,这导致每天大约摄入0.056 mg的氢气。相比之下,本研究中的小鼠通过含泡果冻至少每天摄入0.063 mg的氢气。因此,尽管随意摄入存在变化,但氢气剂量似乎超过了大多数先前的研究。
第二,系统性炎症模型中氢气给药后行为变化与BBB状态变化的因果关系尚未完全阐明;因此,需要进一步调查。第三,本研究仅在神经炎症模型中测试了一种剂量的LPS。因此,我们无法确定观察到的效果是由于简单的病态行为还是炎症诱导的神经退行性变。第四,本研究仅使用了LPS模型。在精神障碍的病理模型中,如慢性轻度压力和社会挫败压力模型,已报告异常积累的氧化应激和/或炎症。有必要检查这些压力模型,以确定氢气摄入是否有效抑制精神症状的发作,并研究病理途径分类。第五,需要对LPS诱导的BBB衰败和氢气摄入对BBB的保护进行新的机制探索,因为本研究和先前研究的发现表明巨噬细胞和小胶质细胞中存在独立于细胞因子释放的途径。第六,我们使用总组织裂解液进行西方印迹分析,因为目标蛋白具有高细胞特异性。虽然这种方法可以检测来自多种细胞类型的蛋白质,但它可能不会提供精确的细胞机制细节。为了更准确地阐述这些机制,未来的研究应考虑从单个细胞类型中分离和分析蛋白质。
由于目前还没有确定的精神障碍治疗或预防药物,阐明精神障碍的生物学机制至关重要。本研究和先前研究的结果表明,氢气在保护BBB方面具有特定作用,而不是一般的抗氧化和抗炎作用。进一步的研究可以帮助阐明疾病发病机制,并促进精神症状的治疗或预防。
https://blog.sciencenet.cn/blog-41174-1448110.html
上一篇:CD40L是自身免疫疾病治疗的理想靶点
下一篇:高压氧对久坐老年人体能和心脏灌注的影响