博文
CD40L是自身免疫疾病治疗的理想靶点
|
选择性关闭适应性免疫的能力为自身免疫疾病的治疗干预提供了一个绝佳的机会。有一个分子,其靶向作用将允许对疾病进行如此无限制的控制,那就是细胞因子CD40配体(CD40L)。CD40L在活化的T细胞上短暂表达,对于抗体介导和细胞介导的免疫反应的发展至关重要。30多年来,人们一直在寻求开发安全有效的治疗剂来禁用CD40L的功能。终于,这场战斗已经取得胜利。多种CD40L拮抗剂已进入临床试验,并在器官特异性和系统性自身免疫疾病中显示出治疗效果。由于新发现的控制疾病进展的能力,CD40L拮抗剂的使用将扩展到更广泛的人类免疫介导的炎症性疾病,如炎症性肠病和类风湿关节炎。
50多年前,免疫学家Avrion Mitchison将T细胞帮助定义为一种“位于炎症以及免疫学和传染病其他方面核心”的功能(1, 第2页)。二十年后,T细胞帮助的分子体现,CD40L,于1992年被发现(2)。CD40L对免疫有着深远的影响,影响体液和细胞介导的途径,以及控制非造血细胞的炎症贡献。CD40L主要在活化的T细胞和血小板上表达。它对于B细胞激活、生发中心形成、B细胞记忆、免疫球蛋白的产生以及对所有胸腺依赖性抗原的同种型转换至关重要。同样,树突状细胞授权CD4和CD8 T细胞的启动也是由CD40L介导的。此外,几乎所有骨髓细胞都对CD40L信号做出响应,以介导炎症反应(2)。CD40L不仅与其受体CD40结合,还与许多整合素分子结合,这些整合素在其控制免疫的多效性活动中发挥作用。CD40L的这些多效性功能是不可替代的,不能被任何其他免疫分子复制,从而允许使用CD40L拮抗剂可预测和精确地控制免疫(见图)。
临床前研究揭示了在各种自身免疫小鼠模型中阻断CD40L的显著效果,并通过诱导耐受促进皮肤和器官同种异体移植的接受(2)。抗CD40L疗法的广泛成功归因于其在启动和传播许多炎症途径中的中枢功能,这些途径是自身免疫发展的核心,并且是移植排斥反应的中介。
在这些令人印象深刻的临床前发现之后,人们对于开发针对人类疾病的抗CD40L治疗方法的热情激增。两种天然免疫球蛋白G1(IgG1)CD40L抗体在1990年代末进入临床试验。然而,其中一种由于抗体对CD40L和血小板上的Fc受体(FcRs)的双重结合而导致的血栓栓塞事件而致命(3)。最初报告显示,只有能与FcR结合的CD40L抗体才具有治疗效果,因此,不引起毒性的情况下靶向CD40L被认为是不可能的。但是,出现了相悖的证据表明,在非人类灵长类动物中,Fc沉默的CD40L抗体具有治疗效果且不具血栓生成性(4)。有了这一新认识,出现了多种策略来开发旨在安全有效治疗自身免疫以及人类同种异体器官和组织移植的CD40L拮抗剂。
下一代方法涉及开发设计为不含FcR结合活性的免疫球蛋白或完全缺乏Fc结构域的CD40L拮抗剂。值得注意的例子包括frexalimab(5)和tegoprubart,两者都是具有Fc结构域内沉默突变的人源化CD40L特异性IgG1抗体。Dapirolizumab pegol(6)是一种聚乙二醇偶联的抗CD40L Fab片段,而dazodalibep(7)则作为非抗体生物拮抗剂脱颖而出,由两个均能结合CD40L的Tn3蛋白与人血清白蛋白融合而成。至关重要的是,所有这些CD40L阻断剂都表现出良好的安全性特征,在数百名患者和健康对照组中没有显示血栓栓塞活动的迹象。这四种拮抗剂在系统性红斑狼疮(SLE)、干燥综合症和多发性硬化症(MS)的二期临床试验中展示了有希望的结果,其中几种已进入关键的三期试验。
SLE是一种由T细胞、B细胞和骨髓细胞失调激活所介导的异质性全身性炎症自身免疫性疾病。值得注意的是,自身抗体的产生依赖于CD40L,当其在目标器官中沉积时,会引起全身性病变。在患有肾小球肾炎的SLE患者中,T细胞和B细胞上增强的CD40L表达、血清可溶性CD40L增加以及肾活检标本中CD40L的高表达凸显了这一分子在疾病进展中的中心作用(8)。在易患SLE的小鼠中的临床前研究展示了CD40L的多效性影响。在这些小鼠中,疾病开始后早期使用CD40L拮抗剂治疗会破坏B细胞和T细胞功能并减少自身抗体滴度。相比之下,在疾病晚期治疗小鼠对自身抗体的产生影响较小,但减少了由CD40L激活的肾脏炎症巨噬细胞引起的病变(9)。
目前,在一项涉及200多名不同疾病严重程度患者的二期试验(NCT04129164)中,接受dapirolizumab治疗的90名个体显示出改善疾病的生物标志物(降低双链DNA抗体滴度和增加血清C3浓度),以及减少的疾病爆发次数和总体疾病指数评分的改善。这些发现累积地表明,针对CD40L的治疗在SLE中是有效的(6)。两项关于SLE的三期试验正在使用dapirolizumab进行(NCT04976322和NCT04294667),同时还有一项使用frexalimab的二期试验(NCT05039840)。必须承认,SLE是一种异质性疾病,尽管CD40L在许多病理机制中扮演着重要角色,但由T细胞独立机制(例如Toll样受体)驱动的疾病可能不会明显响应抗CD40L治疗。
有效管理多发性硬化症依赖于急性炎症发作的治疗和残疾进展的阻止。人们认为,MS的攻击和进展依赖于不同的但又相互交织的机制:从淋巴结招募B细胞和T细胞是攻击的主要组成部分,而进展则依赖于脑膜的持续炎症和血管周围空间的细胞相互作用。CD40L拮抗剂被认为可以针对这种未解决的炎症。临床前研究已经证明,抗CD40L可以防止小鼠出现类似MS的疾病(10)。此外,来自MS患者的死后脑组织显示,在小胶质细胞和浸润性巨噬细胞上大量表达CD40,并且表达CD40L。这些研究为在MS中使用抗CD40L疗法提供了概念基础。一项为期12周的抗CD40L(frexalimab; NCT04879628)二期临床试验,在129名MS患者中达到了其主要终点,通过钆增强磁共振成像检测到的大脑病变减少了89%,在静脉注射组和79%在皮下注射组(5)。此外,脑脊液中的神经丝轻链水平降低,表明组织损伤减少。两年后,超过90%的患者仍然没有病变。
CD40L控制自身免疫
CD40L(细胞表面和可溶性)触发产生自反应性炎症T细胞、细胞毒性T细胞和产生自身抗体的B细胞。它还导致先天免疫细胞产生炎症性细胞因子。CD40L拮抗剂阻止了先天和适应性免疫及其相关病变。
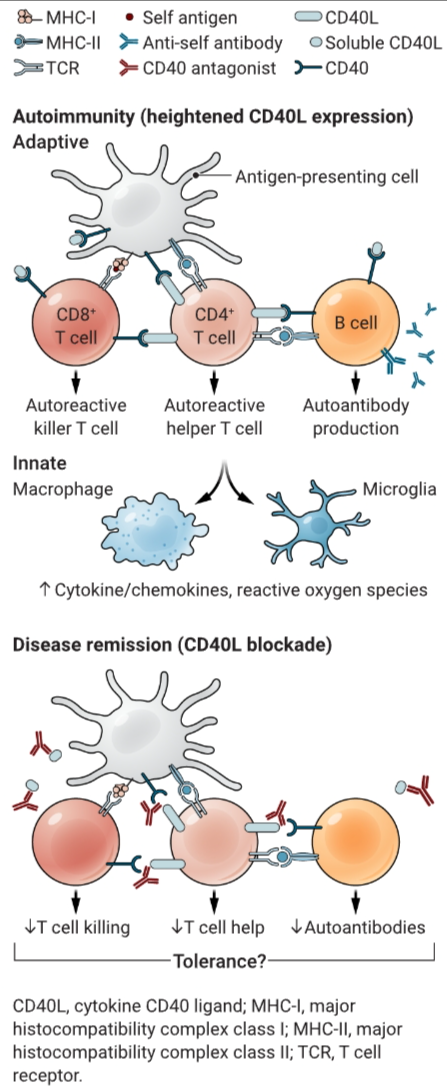
抗CD40L治疗所见的病变减少与使用高效MS疗法抗CD20的结果一致,后者通过消耗B细胞。这表明,与直接消耗B细胞相比,干扰T细胞和B细胞的激活也能带来类似的益处。这在已启动的抗CD40L全面三期试验(NCT06141473和NCT06141486)中尚未得到证实。由于抗CD40L疗法阻断了作为T细胞激活关键第二信号的共同刺激,因此治疗可能会限制疾病进展期间出现的T细胞多样性。偶尔在MS患者脑膜中发现的第三淋巴器官(异位滤泡)也可以通过全身给药的抗CD40L直接接触并溶解,就像在颈部淋巴结中进行亲和力成熟和增殖的B细胞一样。因此,抗CD40L可能无需进入大脑实质就能实现对MS的治疗作用。此外,抗CD40L还限制了由表达在大脑内皮上的CD40促进的白细胞迁移。在大脑实质内,阻断T细胞上表达的CD40L与小胶质细胞、星形胶质细胞和浸润性巨噬细胞上表达的CD40的相互作用,限制了炎症性细胞因子和趋化因子以及活性氧物种的产生。这些抗CD40L的广泛多效效应可能限制MS的急性和进展方面,并证明优于目前仅消耗B细胞的疗法。
干燥综合症是一种没有主要治疗选择的疾病,由免疫系统攻击负责唾液和泪液产生的腺体引起。T细胞在干燥综合症的炎症过程中起着关键作用,通过产生细胞因子和激活B细胞。反过来,B细胞负责产生自身抗体(例如,抗Ro和抗La),这些在干燥综合症患者中常见。研究显示,与健康个体相比,干燥综合症患者的唾液腺中CD40L和CD40的表达显著增加(11)。临床前研究表明,阻断CD40L通路可抑制干燥综合症小鼠模型中的疾病进展(12)。值得注意的是,经抗CD40L治疗后,异位淋巴结构形成和自身抗体产生大幅减少。人类CD40L拮抗剂frexilimab(NCT04572841)和dazodalibep(NCT04129164)在干燥综合症中对临床相关生物标志物显示出显著效果。接受任一药物治疗的患者血清中C-X-C基序趋化因子13(CXCL13)水平显著降低,CXCL13在生发中心的形成中起核心作用,生发中心是自反应性抗体产生的地方(13)。因此,CXCL13的减少和生发中心的消除为CD40L拮抗剂在干燥综合症患者中提供了明确的作用机制。实际上,在二期试验中,CD40L拮抗剂报告了约50%的疾病临床评分减少。随着正在进行的三期试验(NCT06104124)结果的公布,CD40L拮抗剂可能成为这种慢性疾病的首个有效药物。
开发CD40L拮抗剂的最大挑战一直是确保安全性。目前,第二代CD40L拮抗剂似乎已经取得了实质性的安全改进。数百名患者现已接受了这类药物治疗,即使在具有较高基线风险的患者中也未观察到血栓栓塞事件。这些药物在临床试验中耐受性良好,其三期试验的探索凸显了对其安全性和潜在有效性的信心。在已完成的多项二期试验中,抗CD40L疗法的安全性与其他常伴有重大安全担忧的免疫疗法形成了鲜明对比,包括结肠炎、上呼吸道感染和进行性多灶性白质脑病(PML)。然而,随着三期试验的进行,必须仔细监测长期阻断CD40L-CD40通路可能导致对传染病和癌症易感性增加的情况。
临床前研究表明,抗CD40L可以诱导免疫耐受。接受异体肾移植并经抗CD40L治疗的非人类灵长类动物在药物停用后很长时间内未发生排斥反应(14)。在1型糖尿病(T1D)小鼠模型的临床前研究中,疾病初期单次早期使用抗CD40L治疗可阻止疾病的进展(15)。抗CD40L依赖的长期抗原特异性耐受涉及删除对抗原有反应的T细胞和出现表达叉头框P3(FOXP3+)的抗原特异性调节性T细胞(14)。目前,抗CD40L正在异体肾移植试验中,以证明其优于标准治疗。此外,抗CD40L正在进行2期T1D研究,以确定其在保护新诊断T1D参与者的内源性胰岛素分泌中的有效性(NCT06111586)。尽管现有的临床试验并未明确设计来测试停药后对疾病进展的影响,但这些试验的细胞和分子研究将阐明自体反应性或异体反应性效应T细胞是否在抗CD40L治疗期间被消除,以及是否出现了调节性T细胞。
当前的临床试验是基于CD40L阻断将干扰T细胞和B细胞激活并减轻炎症的前提设计的。对抗CD40L活性影响的更仔细检查显示,它禁止树突状细胞的许可和B细胞的活化。这导致这两个群体介导了耐受性的诱导和持续的无反应状态。如果抗CD40L确实能触发持续的疾病缓解而无需持续给药,它有可能彻底改变人类炎症性疾病的治疗范式。
https://blog.sciencenet.cn/blog-41174-1447999.html
上一篇:安慰剂效应缓解疼痛的中枢机制
下一篇:氢果冻治疗抑郁症的小鼠研究2024