博文
新技术可动态显示肌球蛋白分子运动过程
|
新技术可动态显示肌球蛋白分子运动过程
自20世纪50年代以来,科学家们对肌肉的工作原理有了相当清晰的认识。这一行动的核心蛋白质是肌球蛋白,它是一种分子马达,能够沿着类似绳索的肌动蛋白链——抓取、拉扯、释放然后再抓取——使肌肉细胞收缩。
These ‘movies’ of proteins in action are revealing the hidden biology of cells (nature.com)
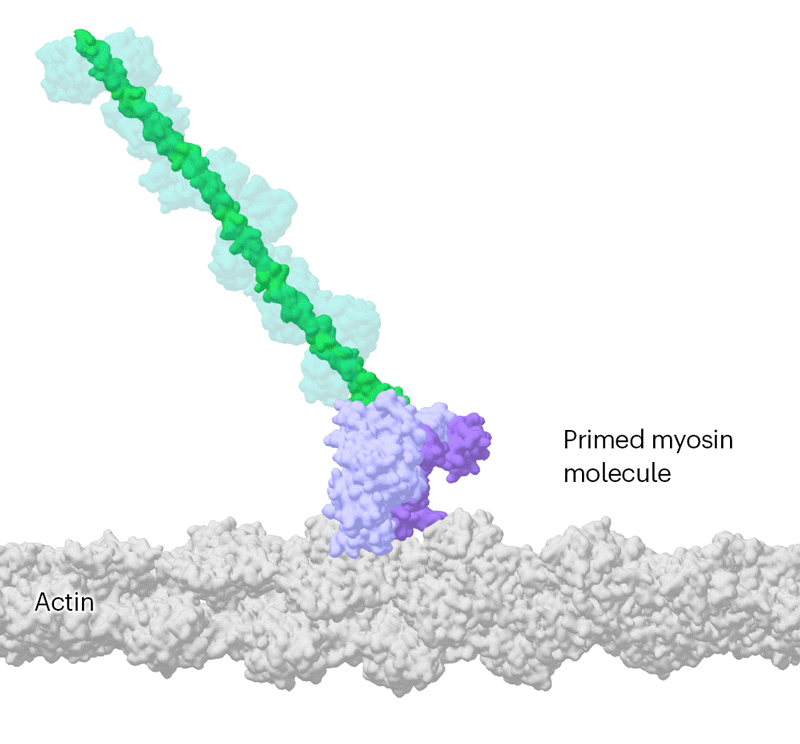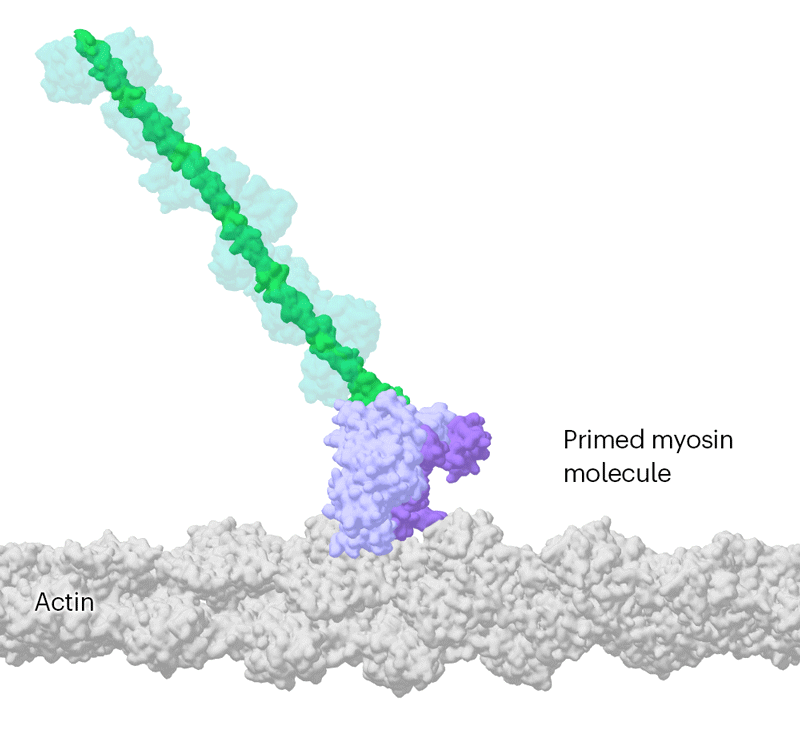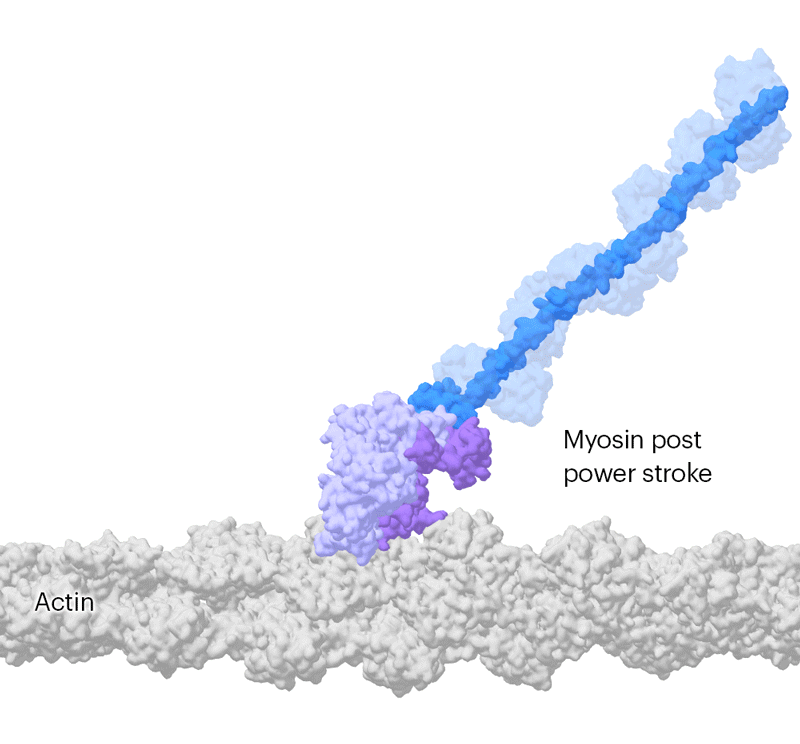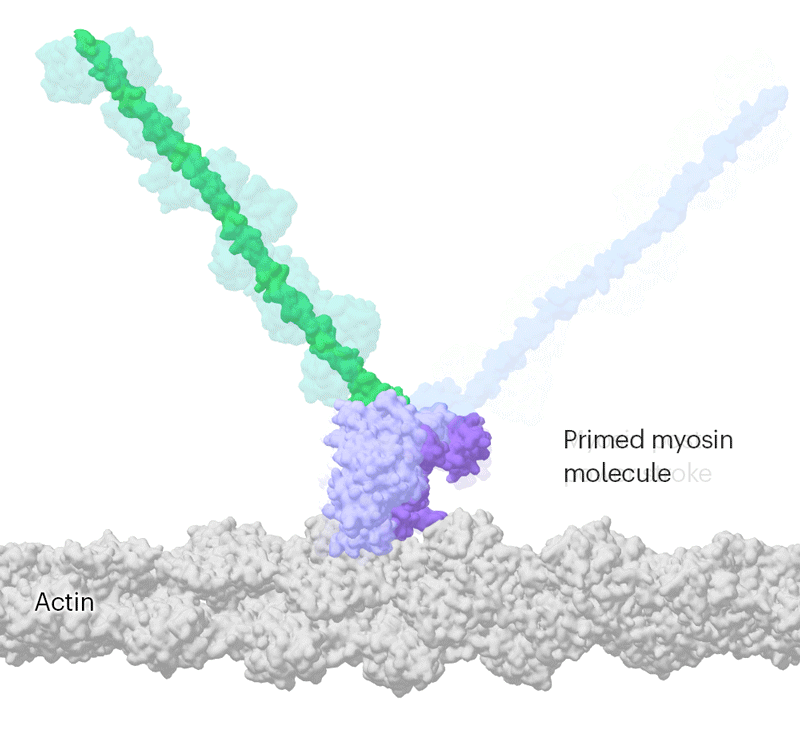
这些基本原理最初在《自然》杂志上发表的一系列具有里程碑意义的论文中得到了解释,并且通过详细的肌球蛋白及其伴侣的分子图谱得到了证实和阐述。研究人员认为,肌球蛋白通过将附着在蛋白质马达部分的长杆状臂向后摆动来产生力量。
唯一的问题是,科学家从未见过这种转瞬即逝的预击打状态——直到现在。
在1月份发表的一篇预印本研究中,研究人员使用了尖端的结构生物学技术记录下了这一瞬间,而这一时刻在活细胞中仅持续数毫秒。
“这是教科书里你会忽略的东西之一,”英国利兹大学的结构生物学家斯蒂芬·蒙奇(Stephen Muench)说,他共同领导了这项研究。“这些是人们40年前就想做的实验,但他们当时没有这项技术。”
这项技术——称为时间分辨冷冻电子显微镜技术(cryo-EM)——现在让结构生物学家像电影摄影师一样思考,将生命的分子机器的静态快照转变为揭示其工作方式的运动画面。
蒙奇和他的同事们的肌球蛋白电影并不是长篇大论;它只包括两个框架,展示了分子运动的不同阶段。然而,它证实了几十年前的理论,并解决了关于肌球蛋白编排步骤顺序的争论。其他研究人员正将他们新发现导演的眼光聚焦于理解细胞信号系统,包括那些与阿片类药物过量相关的系统,基因编辑巨头CRISPR–Cas9以及其他大多数情况下使用高度详细但静态的结构图谱研究的分子机器。
“大局是要尽可能地摆脱这种单一的静态快照,”加利福尼亚斯坦福大学的结构生物学家乔治奥斯·斯金尼奥蒂斯(Georgios Skiniotis)说,他的团队使用这项技术记录了一种称为G蛋白偶联受体(GPCR)的细胞信号分子的激活过程。“我想要的是电影。”
定格动画
为了强调cryo-EM的力量,斯金尼奥蒂斯和其他人喜欢将其与有史以来最早的电影之一进行比较。在19世纪70年代,摄影师艾德沃德·迈布里奇(Eadweard Muybridge)使用了当时最先进的高速摄影技术,捕捉了一系列奔马的静态图像。它们首次展示了动物的四个蹄子同时离地——这是人眼无法区分的。
斯金尼奥蒂斯说,将同样的想法应用于蛋白质结构将会得到类似的洞见。“我想要得到一个动态的画面。”
将蛋白质和其他生物大分子映射到单个原子位置的能力已经改变了生物学,支撑了基因编辑、药物发现以及革命性的人工智能工具如AlphaFold(可以预测蛋白质结构)的进步。但是,由X射线晶体学和cryo-EM提供的大多数静态图像掩盖了生命分子的动态本质,这两种技术负责确定了大部分蛋白质结构。
“生物分子不是由岩石构成的,”纽约市Flatiron研究所的计算生物物理学家索尼娅·汉森(Sonya Hanson)说。它们存在于水中并且不断运动。“它们更像是果冻,”蒙奇补充道。
生物学家经常说“结构决定功能”,但这并不完全正确,洛桑联邦理工学院(EPFL)的分子物理学家乌尔里希·洛伦兹(Ulrich Lorenz)说。大多数结构研究捕获的蛋白质姿态是能量稳定的“平衡”状态,它们对短暂存在的、不稳定的确认状态提供的线索有限,而这些状态是化学反应和分子机器执行的其他功能的关键。“结构允许你推断功能,但只是不完整和不完美地,而且你错过了所有的细节,”洛伦兹说。
Cryo-EM是获取细节的好方法,但捕捉这些短暂的状态需要仔细的准备。蛋白质样本被滴到网格上,然后用液态乙烷快速冷冻。然后使用强大的电子束成像,记录单个分子的快照(复杂的软件对这些图片进行分类和变形,形成结构图谱)。样本在被冻结之前在水中游动,因此理论上任何在试管中可以发生的化学反应都可以在cryo-EM网格上被冻结在位——如果研究人员能够足够快地捕捉到它的话。
这是第一个大挑战之一,哥伦比亚大学的结构生物学家、2017年诺贝尔化学奖得主约阿希姆·弗兰克(Joachim Frank)说。“即使对于非常灵巧的人来说,这也需要几秒钟。”在这段时间内,任何化学反应——以及介导反应的中间结构——可能在冻结之前就已经消失了。“这是我们想要填补的空白,”弗兰克说。
弗兰克的团队尝试使用微流控芯片解决这个问题。该设备能够迅速混合两种蛋白质溶液,让它们在一定时间内反应,然后将反应液滴传递到即时冷冻的冷冻电镜网格上。
今年,弗兰克的团队利用他们的设备研究了一种细菌酶HflX,这种酶能在细胞的蛋白质制造工厂——核糖体,因抗生素或其他压力而停滞时进行救援。HflX酶通过将核糖体的两个亚基分离来回收卡住的核糖体。
弗兰克的团队捕捉到了HflX与核糖体结合的三张图片,跨越140毫秒,展示了它如何像小心翼翼地从牡蛎中剥去壳一样分开核糖体。酶逐一破坏维系核糖体两个亚基的大约十几个分子桥,直到只剩下两个,然后核糖体弹开。“对我来说最令人惊讶的是,这是一个非常有秩序的过程,”弗兰克说。“你会以为核糖体被一分为二就结束了。”
慕尼黑和他的同事们,包括利兹大学的结构生物学家查理·斯卡夫和位于弗吉尼亚州诺福克的东弗吉尼亚医学院的动力学家霍华德·怀特,也使用了微流控芯片通过迅速混合肌球蛋白和肌动蛋白来制作他们的肌球蛋白电影。
但是这个分子马达运动得如此之快,为了进一步减慢速度,他们使用了一种变异的肌球蛋白,其运作速度大约是正常速度的十分之一。这使团队能够确定两个结构,相隔110毫秒,显示了肌球蛋白杠杆状臂的摆动。这些结构还表明,驱动马达化学反应的副产品——一种叫做ATP的细胞燃料的分解产物——在杠杆摆动之前而不是之后离开蛋白活性位点。“这结束了几十年的猜测,”斯卡夫说。
有了这个新模型,专门研究肌球蛋白的斯卡夫和慕尼黑计划使用时间分辨冷冻电镜来研究某些已知会导致心脏病的药物和突变如何影响肌球蛋白动态。
微流控芯片并不是研究人员在蛋白质结构上加上时间戳的唯一方式。由加州红木城陈-扎克伯格成像研究所的技术总监、结构生物学家布里奇特·卡拉格尔领导的一个团队开发了一种“喷射和混合”的方法,该方法涉及将微小体积的反应样本射到网格上,然后瞬间冷冻。
在另一种装置中——由马里兰州巴尔的摩约翰霍普金斯大学医学院的结构生理学家爱德华·图梅和他的团队开发——一束光触发光敏化学反应,然后通过瞬间冷冻来停止反应。与此同时,洛伦兹的设备则采用已经冷冻的样本,并使用激光脉冲在电子显微镜的注视下使它们复活几微秒,然后再次冷冻。
每种方法都有其优缺点。卡拉格尔的喷射和混合方法使用微小的样本量,对大多数蛋白质来说应该很容易获得;图梅表示他的“开源”光触发装置相对便宜,只需几千美元就能制造出来;而洛伦兹则说他的激光脉冲系统有潜力记录比其他时间分辨冷冻电镜技术更多的短暂事件——短至十分之一微秒。
但这些技术还没有准备好推广。目前,没有商业化的时间分辨冷冻电镜技术供应商,这限制了它的应用范围,布鲁塞尔VIB-VUB结构生物学中心的结构生物学家鲁斯兰·埃弗莫夫说。“所有这些东西都很挑剔,难以控制,它们还没有真正流行起来,”卡拉格尔补充说。
德国哥廷根马克斯·普朗克多学科科学研究所的结构生物学家霍尔格·斯塔克表示,目前的时间分辨冷冻电镜形式可能对一些基于大规模运动的分子机器有用——例如,核糖体。然而,这项技术还没有准备好用于任何生物系统。“你必须精心挑选你的对象,”他说。“我们到处都是局限性。”
尽管存在缺陷,但研究人员现在有很多有趣的问题可以开始使用这些技术来解决。图梅正在使用时间分辨冷冻电镜研究Cas9,这是CRISPR基因编辑背后的DNA切割酶,他说这些洞察力可以帮助制造更高效的基因编辑系统。
洛伦兹使用他的激光融化方法展示了一种植物病毒在感染细胞后如何膨胀以释放其遗传物质(见“病毒爆炸”)。他现在正在研究其他病毒进入分子,如HIV的包膜蛋白。“我们有这些静态结构,但我们不知道系统是如何从一个状态转变到另一个状态的,以及机器是如何工作的,”他说。
斯金尼奥蒂斯的团队正在研究GPCRs,包括一种称为β-肾上腺素能受体的受体,它与哮喘有关。他们的工作显示了激活受体如何触发它摆脱其伴侣G蛋白,这是细胞中传播信号的关键步骤。
研究人员现在正在研究一个称为μ-阿片受体的GPCR中的同一过程,该受体由吗啡和芬太尼等药物激活。在初步的未发表结果中,他们发现受体的动态有助于解释为什么有些药物如芬太尼在促进G蛋白激活方面如此有效,而其他药物则不是。斯金尼奥蒂斯说,这样的洞察力是分子电影承诺揭示的未见生物学的一瞥。只是别忘了带爆米花。
https://blog.sciencenet.cn/blog-41174-1426147.html
上一篇:高压氧的新血管生成效应
下一篇:机器人孤立波现象