博文
氢气治疗类风湿性狼疮重叠综合征个案2026
||
氢气治疗类风湿性狼疮重叠综合征个案2026
背景与目的:类风湿性狼疮重叠综合征(Rhupus综合征)是类风湿关节炎(RA)与系统性红斑狼疮(SLE)的重叠疾病,临床表型异质性强,治疗难度大。传统治疗方案包括糖皮质激素、改善病情抗风湿药(DMARDs)、免疫抑制剂及生物制剂,但常因药物不耐受和激素相关并发症而受限。氢气(H₂)因具有抗氧化和免疫调节特性,已成为潜在的辅助治疗手段。本研究旨在评估氢气联合利妥昔单抗,治疗合并多种药物不耐受的难治性类风湿性狼疮重叠综合征患者的临床疗效。
病例报告:我们报告1例47岁男性患者,其类风湿关节炎病史长达27年,后确诊系统性红斑狼疮,符合类风湿性狼疮重叠综合征诊断标准。患者病程复杂,对多种药物存在不耐受,包括甲氨蝶呤、柳氮磺吡啶、羟氯喹、硫唑嘌呤、来氟米特,以及标准剂量的利妥昔单抗。尽管采用低剂量利妥昔单抗联合麦考酚酸治疗,患者病情仍持续活动,并被确诊为狼疮性肾炎。2023年10月,患者开始口服氢气胶囊作为辅助治疗,临床症状得到显著改善,同时伴随T、B淋巴细胞亚群的特征性改变,抗双链DNA(dsDNA)抗体、红细胞沉降率(ESR)及补体水平均恢复正常,且成功停用泼尼松。氢气治疗耐受性良好,未出现严重不良反应。患者因既往长期使用糖皮质激素出现股骨头缺血性坏死,但于2025年1月接受髋关节置换术后恢复良好。目前,患者依靠麦考酚酸联合持续氢气治疗,病情维持稳定。
结论:本病例提示,对于合并多种药物不耐受的难治性类风湿性狼疮重叠综合征,氢气治疗或可作为潜在的辅助治疗方案。该治疗可实现免疫调节、减轻炎症反应、帮助停用激素,并与低剂量利妥昔单抗协同维持病情稳定。其疗效验证及临床应用标准化仍需进一步研究。
Tsai HL, Lu JW, Ho YJ, Lui SW, Hsieh TY, Wang KY, Liu FC. Rhupus Syndrome With Multiple Drug Intolerances Managed by Reduced-dose Rituximab and Adjunctive Molecular Hydrogen Therapy: A Case Report. In Vivo. 2026 Jan-Feb;40(1):561-570.
引言
类风湿性狼疮重叠综合征是类风湿关节炎(RA)与系统性红斑狼疮(SLE)的重叠性疾病。目前被广泛接受的定义为:患者同时满足SLE的诊断标准〔系统性红斑狼疮国际协作组(SLICC)或美国风湿病学会(ACR)分类标准〕和RA的诊断标准〔ACR或ACR/欧洲抗风湿病联盟(EULAR)标准〕⁽¹⁾。然而,RA与SLE共存的情况极为罕见,近期最大规模的系列研究报道其患病率分别为1.3%⁽²⁾和1.4%⁽³⁾。由于该病临床表型异质性强,且常累及多系统,治疗极具挑战性⁽²⁾⁽⁴⁾。目前,类风湿性狼疮重叠综合征尚无标准化的分类、随访及治疗指南⁽¹⁾。现有治疗方案主要基于有限的临床试验、病例报告和回顾性队列研究,缺乏大型随机对照试验的支持。因此,临床治疗在很大程度上依赖医师经验,并借鉴RA和SLE的成熟治疗策略⁽²⁾。多数患者在确诊时即开始使用糖皮质激素,平均日剂量为6.5~15 mg⁽²⁾⁽⁴⁾⁽⁶⁾。甲氨蝶呤、羟氯喹、柳氮磺吡啶、硫唑嘌呤、来氟米特等传统改善病情抗风湿药,常与糖皮质激素联合使用⁽²⁾⁽⁵⁾⁽⁷⁾。吗替麦考酚酯、环磷酰胺、环孢素等免疫抑制剂,主要用于合并重要脏器受累的患者,尤其是肾脏受累者⁽⁸⁾⁽¹¹⁾。用于类风湿性狼疮重叠综合征治疗的生物制剂包括抗肿瘤坏死因子(抗TNF)药物(如依那西普、阿达木单抗)⁽⁷⁾⁽¹²⁾、阿巴西普⁽¹³⁾及利妥昔单抗⁽⁵⁾⁽¹⁴⁾。然而,研究表明,长期使用糖皮质激素会显著增加股骨头缺血性坏死(AVN)、感染及心血管并发症的风险⁽¹⁵⁾⁽¹⁶⁾。当患者对传统治疗出现不耐受或不良反应时,治疗难度将进一步加大。药物诱导的白细胞减少、肺炎及其他严重不良事件,可能导致有效治疗方案被迫中断,从而进一步限制这类复杂病例的治疗选择⁽¹⁷⁾。因此,寻找安全性良好的新型辅助治疗手段,已成为该病治疗的关键环节。
氢气(H₂)在多种自身免疫性疾病和炎症性疾病中展现出辅助治疗潜力,包括RA、SLE及心血管疾病等⁽¹⁸⁾⁽²²⁾。近年来,凭借其独特的抗氧化和免疫调节特性,氢气已成为极具前景的治疗策略。氢气可选择性清除高细胞毒性的羟自由基(•OH)和过氧亚硝基阴离子(ONOO⁻),同时调控关键的细胞信号通路:包括激活核因子红细胞2相关因子2(Nrf2)以增强抗氧化防御能力,抑制核因子κB(NF-κB)以减少促炎细胞因子的表达,以及通过上调B细胞淋巴瘤-2(Bcl-2)和抑制半胱天冬酶-3(caspase-3)来调控细胞凋亡⁽²³⁾⁽²⁶⁾。此外,氢气可抑制NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体的激活,清除线粒体活性氧,并通过增强调节性T细胞(Treg)功能、抑制致病性辅助性T细胞17(Th17)反应、改善B细胞亚群平衡,促进免疫稳态的恢复⁽²⁷⁾⁽³¹⁾。这些多方面的作用机制表明,氢气不仅可缓解自身免疫性疾病的症状,还可能影响疾病进展,为个体化免疫调节治疗提供了新方向。
本病例报告介绍1例47岁男性患者,其RA病史27年,后确诊SLE(类风湿性狼疮重叠综合征)。尽管接受持续治疗,患者病情仍逐渐加重,且合并多种药物不耐受,最终发展为股骨头缺血性坏死。本研究重点关注氢气作为利妥昔单抗辅助治疗的作用,观察到的获益包括免疫调节、炎症标志物恢复正常及成功停用糖皮质激素。本研究经中国台湾地区国防医学院三军总医院机构审查委员会批准(伦理审批号:C202405129;批准日期:2024年7月31日)。所有研究流程均符合机构指南,以及《赫尔辛基宣言》及其修订版的伦理标准。
病例报告
患者为47岁男性公务员,20岁时(1997年)于台北荣民总医院首次确诊RA。37岁时(2014年6月),患者出现符合SLE的临床表现,包括左耳廓血管炎及抗双链DNA抗体水平升高(102 IU/ml),据此确诊为类风湿性狼疮重叠综合征⁽¹⁾⁽³⁾。为稳定病情,患者接受了多种治疗(图1)。2017年4月,患者开始使用柳氮磺吡啶联合羟氯喹治疗,但因出现恶心和视觉异常而停药。同年6月,患者发生SLE相关的左下肺肺炎,需住院治疗,接受静脉糖皮质激素⁽¹⁵⁾、输血及静脉白蛋白输注,后续又并发双下肢蜂窝织炎。2017年9月,患者SLE病情活动度加重,出现蛋白尿和全血细胞减少(白细胞:3500/μl;血红蛋白:8.5 g/dl;血小板:126000/μl),并伴随进行性乏力和贫血。2017-2018年间,患者接受多疗程利妥昔单抗(500 mg)治疗⁽⁵⁾⁽¹⁴⁾,并于2017年7月开始使用麦考酚酸(麦考酚钠肠溶片)⁽³²⁾⁽³³⁾。2018年1月加用甲氨蝶呤(MTX),但因反复口腔溃疡,于2018年8月停药⁽¹²⁾。尽管使用利妥昔单抗500 mg治疗,患者临床症状仍持续恶化,2018年6月肾活检确诊为弥漫增生性狼疮性肾炎(国际肾脏病学会/肾脏病理学会分类Ⅳ+Ⅴ型),美国国立卫生研究院(NIH)活动指数为11/24,慢性化指数为1/12⁽³⁴⁾⁽³⁵⁾。2018年12月,患者在输注500 mg利妥昔单抗时出现腹部绞痛,剂量被迫减至100 mg。尽管因该不良反应而长期维持100 mg剂量,但需注意的是,美国利妥昔单抗官方处方信息仅建议在发生输注反应时暂停、减慢输注速度或停药,并未提供减量指导。因此,该剂量调整是临床判断的结果,而非基于指南的策略,值得进一步探讨。在低剂量利妥昔单抗治疗期间,患者病情活动度随时间波动,炎症标志物虽呈逐渐下降趋势,但始终高于正常范围(表1)。
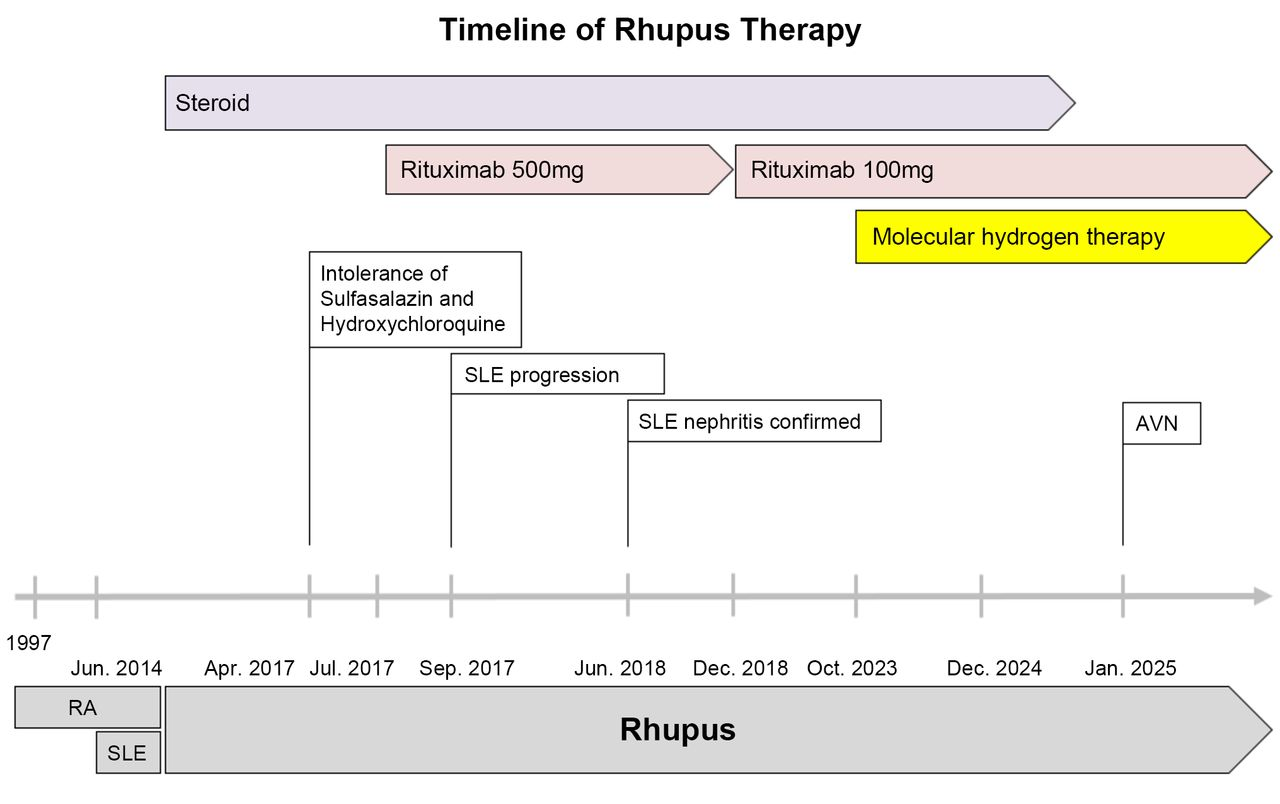
图1患者于1997年确诊类风湿关节炎(RA),2014年确诊系统性红斑狼疮(SLE),符合类风湿性狼疮重叠综合征诊断标准。患者长期接受激素、利妥昔单抗(初始剂量500 mg,后减至100 mg)治疗,并于2023年10月开始氢气治疗。关键事件包括:2017年7月对柳氮磺吡啶和羟氯喹不耐受、2017年9月SLE病情进展、2018年6月活检确诊狼疮性肾炎、2025年1月发生股骨头缺血性坏死。
表1系列实验室检查数据
2023年10月,患者46岁时,开始口服氢气胶囊作为辅助治疗(每粒胶囊含170 mg富氢钙,可释放约1.7×10²¹个氢分子,每日1次;生产厂家:中国台湾地区台北市好好生技股份有限公司)。为评估氢气治疗前后的免疫及血清学变化,采用流式细胞术和血清学检测对患者外周全血进行分析。后续流式细胞术分析严格遵循标准荧光标记流程,使用冻干试剂抗体试剂盒(美国加利福尼亚州布雷亚市贝克曼库尔特公司)。实验方法、操作流程、免疫表型分析及设门策略均参照既往研究报道⁽³¹⁾⁽³⁶⁾⁽³⁷⁾。结果显示,患者T、B淋巴细胞亚群发生显著改变。具体而言,8项特异性免疫指标呈现出特征性的时间依赖性变化⁽²⁹⁾⁽³¹⁾。效应记忆性Tim-3⁺辅助性T细胞(表达T细胞免疫球蛋白黏蛋白分子3的效应记忆性辅助性T细胞)、初始KLRG1⁺细胞毒性T细胞(表达杀伤细胞凝集素样受体G1的初始细胞毒性T细胞)、KLRG1⁺中心记忆性细胞毒性T细胞及浆母细胞的比例随时间波动,出现短暂峰值后下降(图2)。与之相反,初始Fas⁺B细胞(表达细胞表面死亡受体Fas的初始B细胞)、非转换型记忆B细胞、调节性B细胞(Breg)及静息调节性T细胞(Treg)的比例则呈现出先下降、后逐渐恢复的趋势(图3)。
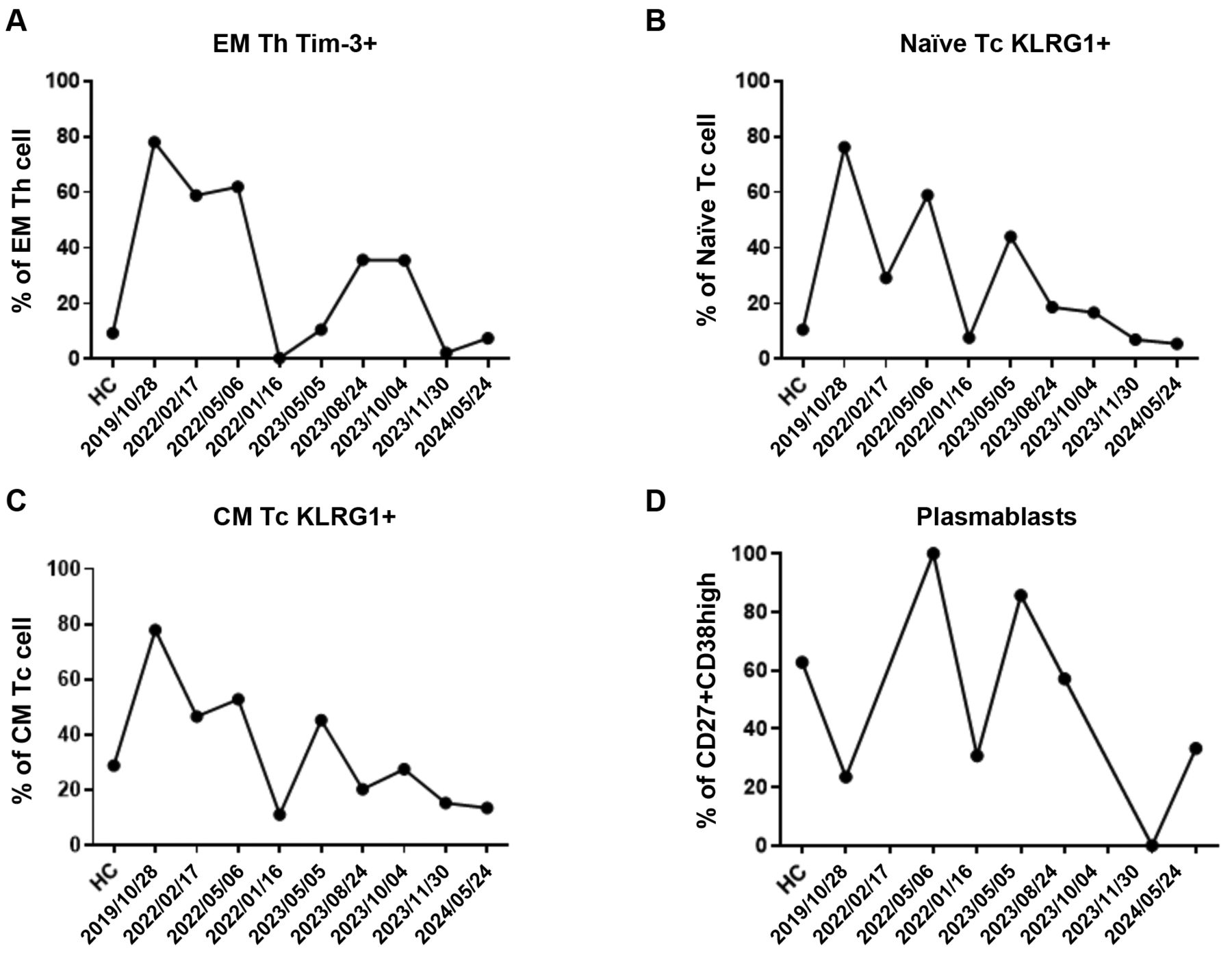
图2对比2023年10月氢气胶囊治疗前后,效应记忆性Tim-3⁺辅助性T细胞、初始KLRG1⁺细胞毒性T细胞、KLRG1⁺中心记忆性细胞毒性T细胞及浆母细胞的免疫表型变化,并以健康对照(HC)作为参照。全血检测在多个时间点进行。(A)效应记忆性Tim-3⁺辅助性T细胞在治疗后先短暂升高,随后下降。(B)初始KLRG1⁺细胞毒性T细胞呈下降趋势。(C)KLRG1⁺中心记忆性细胞毒性T细胞在治疗后下降。(D)浆母细胞数量波动,随访期间出现间歇性升高。
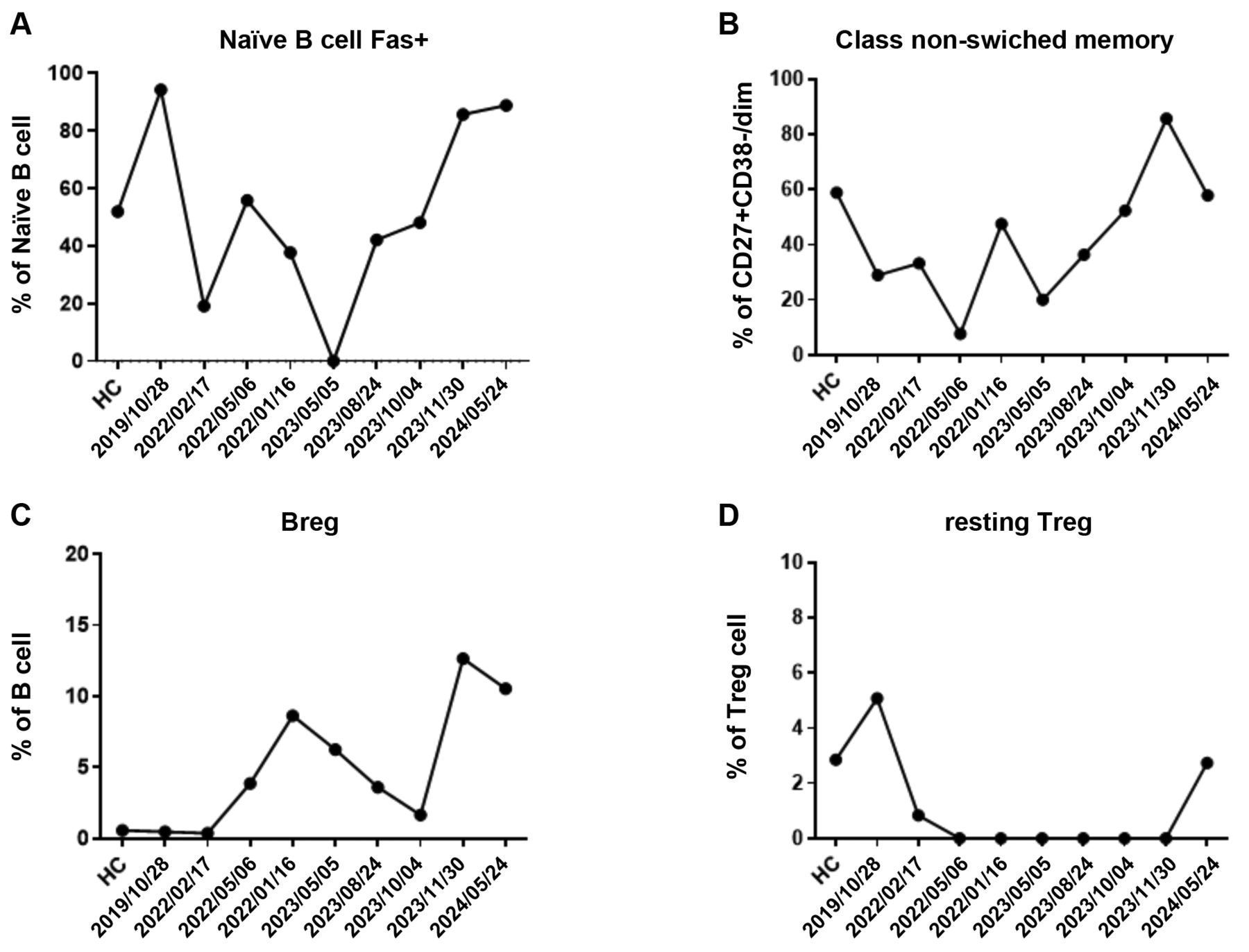
图3对比2023年10月氢气胶囊治疗前后,初始Fas⁺B细胞、非转换型记忆B细胞、调节性B细胞(Breg)及静息调节性T细胞(Treg)的免疫表型变化,并以健康对照(HC)作为参照。全血检测在多个时间点进行。(A)初始Fas⁺B细胞在治疗后数量增加。(B)非转换型记忆B细胞在治疗后期数量上升。(C)调节性B细胞(Breg)在初始下降后,出现延迟性升高。(D)静息调节性T细胞(Treg)在氢气治疗后呈现恢复趋势。
在氢气治疗期间,除患者临床症状显著改善外,实验室检查结果也显示炎症标志物恢复正常(表1)。2018年4月抗dsDNA抗体水平曾高达332 IU/ml,2023年启动氢气胶囊治疗后,该指标稳定在正常范围内。2018年4月红细胞沉降率(ESR)为69 mm/h,经氢气治疗后逐渐下降,于2025年7月首次降至正常上限以下。补体水平也接近正常,治疗后补体C3维持在93~124 mg/dl,补体C4则从持续低于正常水平升至参考范围下限。上述结果表明,氢气胶囊治疗与疾病活动度降低密切相关,实验室指标稳定且变异性低。值得注意的是,患者于2024年12月成功停用泼尼松⁽³⁸⁾⁽³⁹⁾,仅依靠麦考酚酸(麦考酚钠肠溶片360 mg,每日2次)维持病情控制⁽³⁸⁾。
2024年4月29日,患者因输尿管中段结石合并轻至中度肾积水、镜下血尿、急性肾损伤及脓毒症,接受输尿管镜激光碎石术,并留置左侧双J管。双J管于2024年5月9日拔除。2024年6-9月患者接受第二个疗程的氢气治疗,12月启动第三个疗程,均实现临床症状持续改善,且未出现显著不良反应⁽¹⁹⁾⁽²⁵⁾⁽²⁶⁾。尽管整体病情稳定,患者于2024年开始出现左髋疼痛。影像学检查显示股骨头缺血性坏死并塌陷,推测与既往长期使用糖皮质激素相关⁽¹⁵⁾⁽¹⁶⁾。2025年1月,患者48岁时接受全髋关节置换术,术后恢复良好。目前患者用药包括秋水仙碱、塞来昔布、麦考酚酸(麦考酚钠肠溶片)、匹伐他汀、比索洛尔、华法林、奥美沙坦,以及持续的氢气治疗⁽¹⁾⁽³⁾⁽¹⁹⁾⁽²⁵⁾⁽²⁶⁾。本研究遵循CARE病例报告指南(2013版CARE清单)。
讨论
本病例的显著特点是患者存在多种药物不耐受:甲氨蝶呤导致肺炎和反复口腔溃疡;硫唑嘌呤和来氟米特引发白细胞减少;柳氮磺吡啶使用3周后出现恶心;羟氯喹导致视觉异常;标准剂量利妥昔单抗引发腹痛。这些药物不耐受情况极大地限制了传统治疗方案的选择。本病例揭示了氢气治疗作为辅助手段,在复杂自身免疫性重叠综合征治疗中的多个值得关注的方面。
氢气治疗后观察到的免疫学变化,为其潜在作用机制提供了重要线索。特定免疫细胞亚群呈现出独特的时间依赖性变化模式,提示氢气对固有免疫和适应性免疫均具有调节作用。在T细胞亚群中,效应记忆性辅助性T细胞表面的Tim-3表达在氢气治疗后先短暂升高,随后下降⁽¹⁹⁾⁽²⁰⁾。Tim-3是调控T细胞活化和炎症反应的关键免疫检查点分子⁽²⁹⁾。Tim-3表达异常与自身免疫性疾病的发病机制相关,对其进行调节可能是氢气治疗影响疾病活动度的机制之一⁽¹⁹⁾⁽²⁰⁾⁽²⁹⁾。此外,初始和中心记忆性CD8⁺细胞毒性T细胞(初始Tc细胞、中心记忆性Tc细胞)表面KLRG1表达降低,提示氢气治疗可能减轻CD8⁺T细胞耗竭,从而恢复长期免疫监视功能,有助于维持自身免疫性疾病患者的免疫稳态⁽¹⁹⁾⁽²⁰⁾⁽⁴⁰⁾。
调节性B细胞(Breg)和静息调节性T细胞(Treg)数量的增加具有特殊意义,因为这些细胞群在维持免疫耐受和抑制病理性自身免疫反应中发挥关键作用⁽³⁶⁾⁽³⁷⁾⁽⁴¹⁾⁽⁴²⁾。既往研究表明,RA和SLE患者体内这些调节性细胞的数量和功能均存在缺陷⁽³⁷⁾。本病例中,氢气治疗后,调节性B细胞和静息调节性T细胞数量先下降、后升高,提示增强这些调节性细胞亚群的功能,可能有助于免疫稳态的恢复,进而促进临床症状改善。
治疗过程中,浆母细胞数量出现多个峰值,表明在氢气治疗下,体液免疫存在间歇性激活。但这种激活并未伴随临床病情恶化,可能反映了调节机制对过度免疫反应的有效抑制⁽³⁶⁾⁽⁴³⁾⁽⁴⁴⁾。初始B细胞表面Fas表达增加,可能促进自身反应性B细胞凋亡,从而减少致病性自身抗体的产生⁽³⁷⁾⁽⁴³⁾⁽⁴⁴⁾。在记忆性和调节性B细胞群中,非转换型记忆B细胞在治疗后期数量增加,这可能有助于稳定长期免疫记忆,防止对自身抗原产生过度反应⁽³⁷⁾⁽⁴⁴⁾⁽⁴⁵⁾。
本病例报告进一步证实,对于2018年因标准剂量不耐受而被迫使用低剂量利妥昔单抗的患者,2023年起加用口服氢气胶囊治疗后,出现了显著变化,包括免疫细胞亚群与临床指标同步改善,以及成功停用糖皮质激素。这些结果支持以下假说:氢气治疗并非仅缓解症状,而是通过多种途径发挥疾病修饰作用,包括恢复调节性细胞群、降低免疫耗竭标志物水平,以及促进自身反应性B细胞凋亡⁽³⁶⁾⁽³⁷⁾。
该患者的临床病程凸显了类风湿性狼疮重叠综合征治疗的挑战性,尤其是在合并多种药物不耐受的情况下。利妥昔单抗是一种B细胞清除疗法,已被证实对RA和SLE均有效,因此被认为是治疗类风湿性狼疮重叠综合征的合适选择⁽⁵⁾⁽¹⁴⁾。然而,由于患者对标准剂量不耐受,不得不进行减量,这可能影响了治疗效果。在这种情况下,加用氢气治疗很可能提供了互补的免疫调节作用,使得患者在利妥昔单抗剂量不足的情况下,仍能实现病情控制⁽¹⁹⁾⁽²⁰⁾⁽²⁴⁾。
尽管病情控制得到改善,患者仍发生了股骨头缺血性坏死,这反映了既往长期使用糖皮质激素造成的累积损伤。股骨头缺血性坏死是糖皮质激素治疗的公认并发症,在长期用药患者中的发生率为5%~40%⁽¹⁵⁾⁽¹⁶⁾。本病例中,股骨头损伤很可能在氢气治疗开始前即已存在,应被视为既往治疗策略的后果,而非当前治疗的失败。
在成功停用糖皮质激素的同时实现病情持续控制,是该患者治疗的重大突破。在自身免疫性疾病中,无激素缓解是关键的治疗目标,因为这能降低糖皮质激素相关并发症的风险⁽¹⁵⁾⁽³⁹⁾。本病例中,患者在既往治疗失败后,通过低剂量利妥昔单抗联合氢气治疗实现了病情稳定,提示两者可能存在协同作用,值得进一步研究⁽⁵⁾⁽¹⁴⁾。
结论
本病例为氢气作为治疗选择有限的复杂自身免疫性疾病的有效辅助治疗手段,提供了初步证据。对于因多种药物不耐受而限制了传统治疗方案的患者,氢气治疗有助于维持病情长期稳定。伴随的免疫学数据为进一步研究其潜在机制和生物标志物提供了线索。然而,上述发现仍需对照试验加以验证,并需制定氢气治疗自身免疫性疾病的标准化方案⁽¹⁹⁾⁽²⁰⁾⁽²⁴⁾⁽⁴⁶⁾。
https://blog.sciencenet.cn/blog-41174-1516946.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:皮肤科医生为何不推荐用胶原蛋白补充剂改善皮肤老化