博文
氢气疗法影响蛛网膜下出血铁死亡
|
自发性蛛网膜下腔出血(SAH),作为第三大常见中风亚型,与高死亡率和残疾率相关联。因此,寻找有效疗法以改善SAH后的神经功能至关重要。本研究的目的是探究氢气在SAH情况下的潜在神经保护作用,具体来说,是检验其在减轻神经元铁死亡和抑制神经炎症方面的作用,这两者都会因SAH后过量的铁离子而加剧。方法:小鼠被置于含有3%氢气的环境中,细胞则在含有60%氢气的培养箱中培养。通过行为评分来评估小鼠的神经功能。使用西方印迹法检测蛋白质变化。利用酶联免疫吸附测定法检测炎症因子。采用探针、电子显微镜及相关试剂盒来检测氧化应激和铁死亡。结果:氢气改善了SAH后小鼠的运动功能、感觉功能和认知能力。此外,氢气促进了核因子红细胞2相关因子2的激活,上调了谷胱甘肽过氧化物酶4,并抑制了Toll样受体4,从而导致炎症反应下调,减轻了SAH后的氧化应激,并抑制了神经元铁死亡。结论:氢气通过抑制神经元铁死亡和减轻神经炎症,在SAH后发挥神经保护作用。
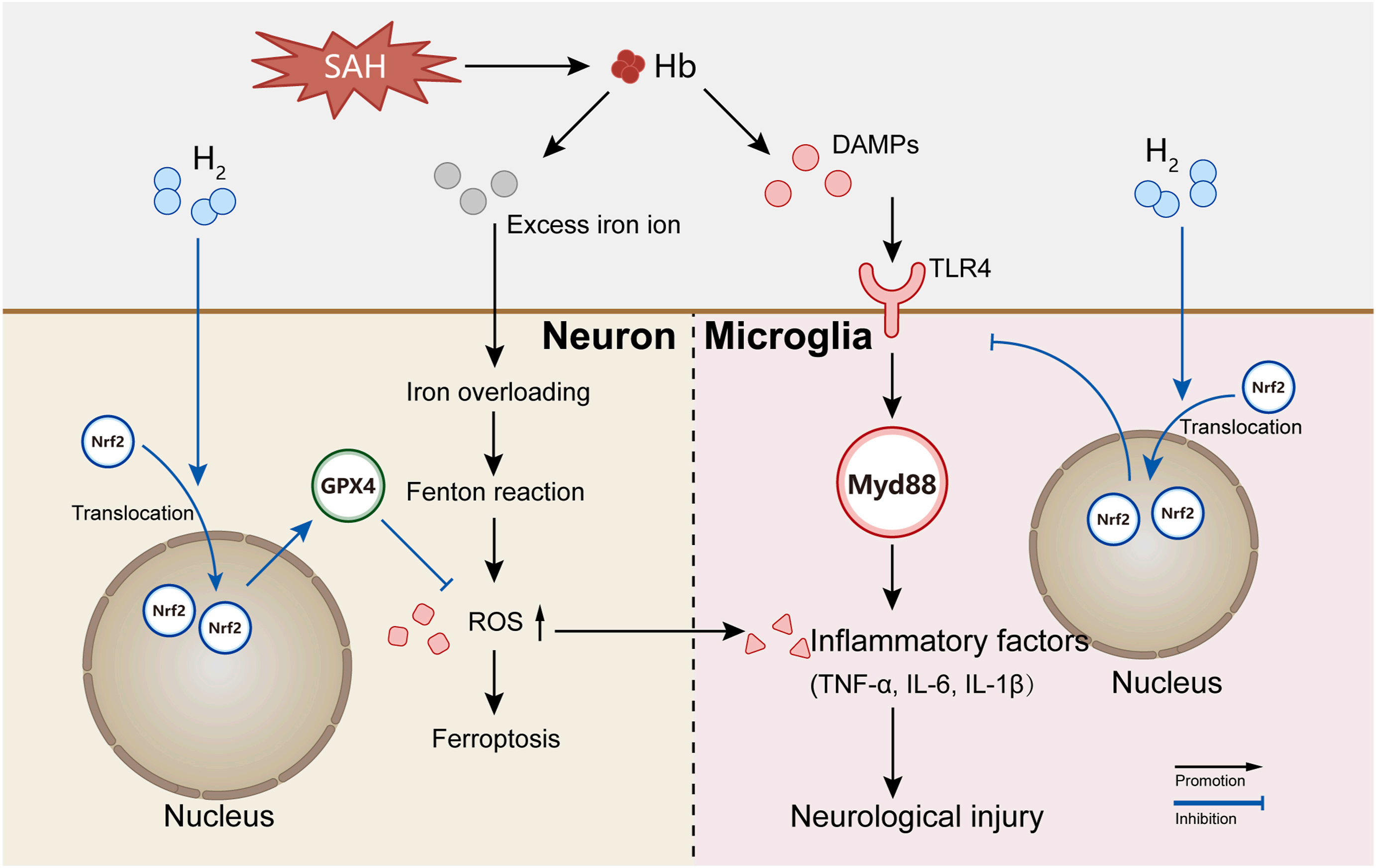
图形摘要
该图示描绘了氢气干预在调节SAH后铁死亡和神经炎症涉及的各种细胞过程中的作用。具体来说,血红蛋白的代谢导致过量铁离子和损伤相关分子模式(DAMPs)的积累,随后激活铁死亡和Toll样受体4(TLR4)/髓样分化初级应答蛋白88(MyD88)途径介导的神经炎症。铁死亡过程中产生的活性氧(ROS)进一步加剧了炎症反应,并对神经造成损害。然而,氢气干预促进了核因子红细胞2相关因子2(Nrf2)向核内的转移,从而增强了谷胱甘肽过氧化物酶4(GPX4)的表达并降低了ROS水平。这种对铁死亡的抑制和对ROS依赖性炎症反应的减弱伴随着TLR4/MyD88途径的下调,导致了神经炎症的抑制。
前言
自发性蛛网膜下腔出血(SAH),由颅内动脉瘤破裂引起的,是一种普遍的急性脑血管疾病[1]。SAH对全球公共健康构成重大威胁,院前死亡率在22%至26%之间[2]。此外,大约50%的SAH幸存者会经历持续的神经功能损伤[3]。尽管手术在预防再出血方面有效,但SAH患者的临床预后并没有显著改善[4,5]。因此,彻底检查SAH后神经损伤的关键机制,并确定潜在的干预疗法以减轻这些伤害是至关重要的。从溶解的红细胞中释放的血红蛋白(Hb)被认为是SAH后神经元损伤的主要催化剂。来源于Hb的大量铁离子在蛛网膜下腔内形成出血微环境。这些多余的铁离子主要通过转铁蛋白-转铁蛋白受体运输系统在神经细胞中积累,随后经历Fenton反应。这一反应导致铁离子与过氧化氢相互作用,产生过量的高毒性羟基和活性氧(ROS)。最终,这一过程诱导了神经元铁死亡[6,7]。此外,神经炎症作为另一个重要因素,也促进了神经损伤[8,9]。具体来说,源自Hb的损伤相关分子模式(DAMPs)在激活微胶质细胞通过Toll样受体4(TLR4)方面发挥着关键作用,随后导致炎症因子的释放[10,11]。这些炎症因子,进一步受到铁离子诱导的ROS刺激[12,13],导致血脑屏障损害、脑血管痉挛和程序性神经细胞死亡[11,14,15]。
值得注意的是,氢气作为一种具有强大抗氧化应激特性的理想治疗气体,已在中枢神经系统(CNS)的各种临床应用中取得成功。我们的初步实验证明了氢气在SAH中的神经保护作用,因为它有效地抑制了氧化应激[20,21],这一点已经得到了日本和美国研究小组的确认[22,23]。然而,氢气抑制神经细胞死亡的机制仍不清楚。需要进一步的研究来阐明氢气在调节SAH中氧化应激诱导的铁死亡中的作用。因此,本研究的主要目的是通过检查氢气对铁死亡和神经炎症的抑制作用,来调查氢气在SAH情况下的潜在神经保护效果。
临床试验
我们进行了氢气治疗SAH的临床试验。这项临床试验获得了南京鼓楼医院伦理委员会的批准(编号:2021-569-02)。该研究已在中国国家临床试验注册中心注册(ChiCTR2200059060)。所有参与者均已获得知情同意。本研究符合《随机对照试验报告规范》(CONSORT)。入组的纳入标准如下:1)因颅内动脉瘤破裂导致SAH的个体;2)年龄在20至70岁之间的个体,不分性别和种族;3)自愿参与并提供知情同意的个体,可亲自或通过可信家庭成员提供;4)在动脉瘤破裂后72小时内接受干预的个体。另一方面,排除标准包括:1)不符合纳入标准或被医生认为不适合参加的个体;2)有严重心脏、肝/肾或肺功能不全的个体;3)有大颅内血肿的个体;4)接受开颅手术封闭动脉瘤的个体;5)拒绝随机分组的个体。参与者随机分配到氢气干预组或常规治疗组。氢气干预组的患者从入院到出院每天吸入氢气(NB-X71A,上海纳米气泡科技有限公司)18-24小时,流量为350 ml/min。脑脊液(CSF)在SAH后的第1-3天、第5-7天和第8-10天通过腰穿收集。
死亡率
动物实验的图表显示在图S1B中。假手术组没有小鼠死亡。本研究包括两个实验。对于实验1,小鼠在SAH后接受氢气治疗。获取组织进行生化测试的时间是SAH后3天。SAH组的死亡率为22.86%(12/54)。SAH + H2组的死亡率为19.23%(10/52)。对于实验2,小鼠在SAH后接受氢气治疗。
在体内实验中,小鼠被安置在含有3%氢气浓度的小室内。进行不间断的氢气吸入,实验研究的终点是SAH后的第三天。使用氢气发生器和空气发生器连续输出3%的氢气。在体外实验中,细胞经过孵育过程,放置在培养箱(PH-min,无锡普和生物医药科技有限公司)中,其组成为60%氢气、5%二氧化碳和30%氧气,同时保持37°C的温度和控制湿度。在对照组中,细胞在相同的孵育条件下接受处理,二氧化碳和氧气的浓度相同,湿度和温度水平也相当。
临床患者数据
氢气吸入抑制了SAH参与者中的铁死亡和炎症反应。本研究调查了CSF因子。图9A显示,氢气干预组与传统治疗组之间的MDA存在显著差异,前者在8-10天时的MDA水平较低。TNF-α和IL-6的观察结果相似,如图9B和9C所示。IL-1β显示出更早的暴露差异,氢气干预组在5-7天和8-10天的CSF水平低于传统治疗组(图9D)。
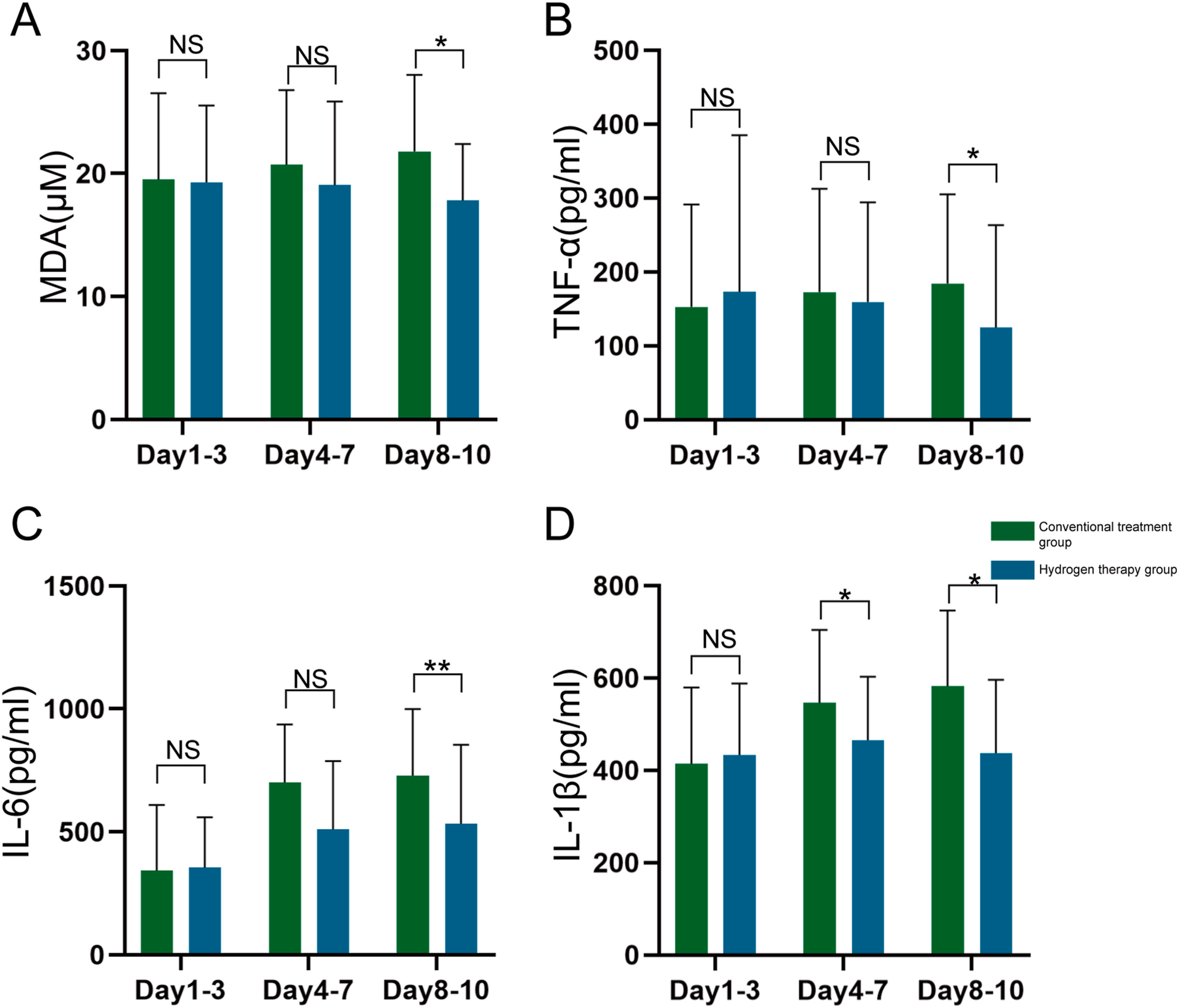
图9 在氢气吸入治疗的患者(n=23)与传统治疗的患者(n=26)中,不同时间点脑脊液中的MDA(图A)、TNF-α(图B)、IL-6(图C)和IL-1β(图D)的差异。
讨论
铁死亡是一种程序化的神经元死亡形式,发生在蛛网膜下腔出血(SAH)之后[32]。SAH 导致脑脊液中血细胞溶解释放出过量的铁离子,从而扰乱神经系统内的铁稳态。这种紊乱导致铁过载和随后的神经元铁死亡[33,34]。
在诱导细胞氧化应激的各种因素中,脂质双层中的脂质氧化修饰,尤其是脂质过氧化,已成为细胞命运的重要调节因子[35]。在生物体内,自由基诱导的脂质过氧化最终产物是丙二醛(MDA)[36]。MDA 作为评估生物体脂质过氧化的重要生物标志物,影响线粒体呼吸链复合体和线粒体内关键酶活性,并进一步加剧膜结构损伤[37]。GPX4 是一种内源性调节蛋白,通过限制细胞毒性脂质过氧化和通过将还原型谷胱甘肽转化为氧化型谷胱甘肽来对抗铁死亡,对保护细胞免受铁沉积起着至关重要的作用[7, 38, 39]。由于广泛的脂质过氧化诱导的谷胱甘肽耗竭,GPX4 的失活发生,这是铁死亡的一个显著特征[40]。GPX4 的缺失允许磷脂过氧化物在铁离子存在下启动催化反应,导致细胞死亡[35]。
结论
以前的研究已经证实了氢气在 SAH 情况下的神经保护特性。在本研究中,我们旨在阐明这种保护作用的潜在机制。我们的调查显示,氢气在 SAH 后展现了双重保护效应,它促进了 Nrf2 向核内的转移,激活了 GPX4,并抑制了 TLR4。因此,这种抑制减轻了神经元铁死亡并减弱了神经炎症。我们的研究结果为氢气的未来临床应用提供了理论框架。
Z. Peng, X.-J. Li, Y. Zhou, J.-T. Zhang, Q. Zhu, J.-Q. Sun, C.-H. Hang, W. Li,Q.-R. Zhang, Z. Zhuang, Hydrogen exerts neuroprotective effects after subarachnoid hemorrhage by attenuating neuronal ferroptosis and inhibiting neuroinflammation, Free Radical Biology and Medicine (2024),
https://blog.sciencenet.cn/blog-41174-1424786.html
上一篇:氢气治疗癌症的基础和临床【14章】
下一篇:人工智能(AI)设计的蛋白质能否被用作生物武器?