博文
线粒体内共生起源和炎症千丝万缕的关系
|
线粒体内共生和炎症的关系
线粒体是细胞内非常特殊的细胞器,也具有和其他细胞器不一样的地位和作用,例如能量代谢、细胞死亡、炎症氧化损伤调节等影响细胞生存的重要任务都需要线粒体的参与。本文提出的问题是,所以慢性病和过敏性疾病泛滥,可能是线粒体共生失调导致。这背后的逻辑基础何在?本文从线粒体内共生角度,对这个问题进行了思考和探索,值得我们学习和思考。
A break in mitochondrial endosymbiosis as a basis for inflammatory diseases | Nature
线粒体由于其内共生起源而保留了细菌性状,但宿主细胞不会将它们识别为外来物,因为细胞器是隔离的。然而,线粒体因子向胞质溶胶中的调节释放会引发细胞死亡、先天免疫和炎症。这种20亿年前的内共生关系的选择性分解使线粒体能够充当细胞内信号传导枢纽。线粒体信号包括蛋白质、核酸、磷脂、代谢物和活性氧,它们具有多种从线粒体释放以及在胞质溶胶和细胞核中解码的模式。由于这些线粒体信号可能有助于炎症的稳态作用,因此这些过程的失调可能导致自身免疫性和炎症性疾病。这些疾病发病率增加的一个潜在原因可能是线粒体功能和信号的变化,以应对肥胖、饮食变化和其他环境因素等近期现象。因此,关注线粒体的混合遗产可以预测未来的见解、研究路径和治疗机会。因此,虽然线粒体可以被认为是细胞内的“敌人”,但进化以有趣的方式利用了这种紧张关系,越来越多的证据表明,最近内共生的失败对炎症性疾病的发病机制至关重要。
现在人们普遍认为,线粒体在细胞内起着许多核心作用,远远超出了它们在氧化磷酸化、克雷布斯循环和脂肪酸氧化中的基本能量功能。这些非典型活性包括信号传导、生物合成和细胞命运的调节。特别有趣的是,关于线粒体如何在免疫和细胞死亡信号通路中起作用的大量发现,使细胞能够对感染或损伤做出反应5,6.最近的一项分析表明,自2011年以来,关于线粒体的出版物开始使其他细胞器的出版物黯然失色,反映了对生物能量学之外的线粒体的兴趣激增。
这就提出了一个问题,即为什么这么多对感染或组织损伤挑战做出反应的途径使用线粒体作为中央信号枢纽来整合和转导细胞的反应。一个可能的因素是,线粒体的内共生起源将它们与细胞的其余部分区分开来,这种方式可以被共同选择以产生与细胞命运有关的关键信息。在这里,我们讨论细胞如何利用线粒体的进化起源来促进它们对损伤和感染的反应。除了解释线粒体在细胞命运中的关键作用外,这一假设还提出了有趣的新研究问题。我们在这里特别提出的一个问题是,过去几代炎症性疾病的增加,包括系统性红斑狼疮、多发性硬化症、类风湿性关节炎和炎症性肠病,可能是由于线粒体和细胞之间的内共生关系中断,这是由肥胖、慢性压力、对加工食品的饮食变化、睡眠不足等社会变化以及环境中的合成化学物质等相对较新的现象驱动的。这些见解是否为治疗慢性炎症性疾病提供了新的治疗选择,其中许多疾病仍然难以解决,并给人类带来了沉重的负担,导致了超过50%的死亡?
内共生起源的影响
尽管细节仍在激烈争论中,线粒体和真核细胞的内共生起源的大致轮廓现在已被广泛接受。尽管 Portier 和 Wallin 在 19 世纪末首次提出线粒体的细菌祖先,这个想法直到 1967 年被 Lynn Margulis 令人信服地复兴才得到广泛接受。现在人们的共识是,真核细胞是在大约20亿年前出现的,当时阿斯加德古细菌与α蛋白细菌建立了内共生关系。两个细胞都必须从这种安排中受益,尽管这些优势的机制基础仍然存在争议。
随着时间的流逝,大多数α变形菌DNA要么重新定位到新生细胞核,要么被消除,其功能被宿主的基因组取代,留下一个小的线粒体DNA(mtDNA)分子,在哺乳动物中为16.5 kb,仅编码氧化磷酸化机制组装所需的37个基因。哺乳动物线粒体中剩余的 1,200 种左右的蛋白质在胞质溶胶中被翻译,随后输入线粒体。有趣的是,线粒体保留了许多细菌特征:代谢途径、未甲基化的DNA、双链(ds)RNA、N-甲酰肽、活性氧(ROS)产生升高和磷脂心磷脂(CL)(框1)。重要的是,线粒体的这些细菌方面都与基质、内膜和膜间空间 (IMS) 有关。这些隔室被线粒体外膜包围,线粒体外膜可能来自α变形杆菌的外膜和古细菌宿主的内吞质膜。这种混合起源由线粒体外膜表示,该外膜含有从细菌外膜前体进化而来的β桶蛋白,而线粒体外膜的磷脂组成与其他细胞膜相似,但与线粒体内膜不同。因此,尽管线粒体现在显然已经完全整合到真核细胞中,但我们也可以将线粒体视为一种“砖砌”在线粒体外膜后面的假细菌,它允许交换代谢物,但在大多数情况下,保留了大分子。线粒体外膜提供的保护屏障的任何突破都将允许这些假细菌因子进入胞质溶胶,这些细胞质可能被识别为“外来”,激活免疫信号传导和细胞死亡途径。因此,进化并没有消除线粒体的细菌起源,而是保留了许多这些特征,因为它们对细胞有用。
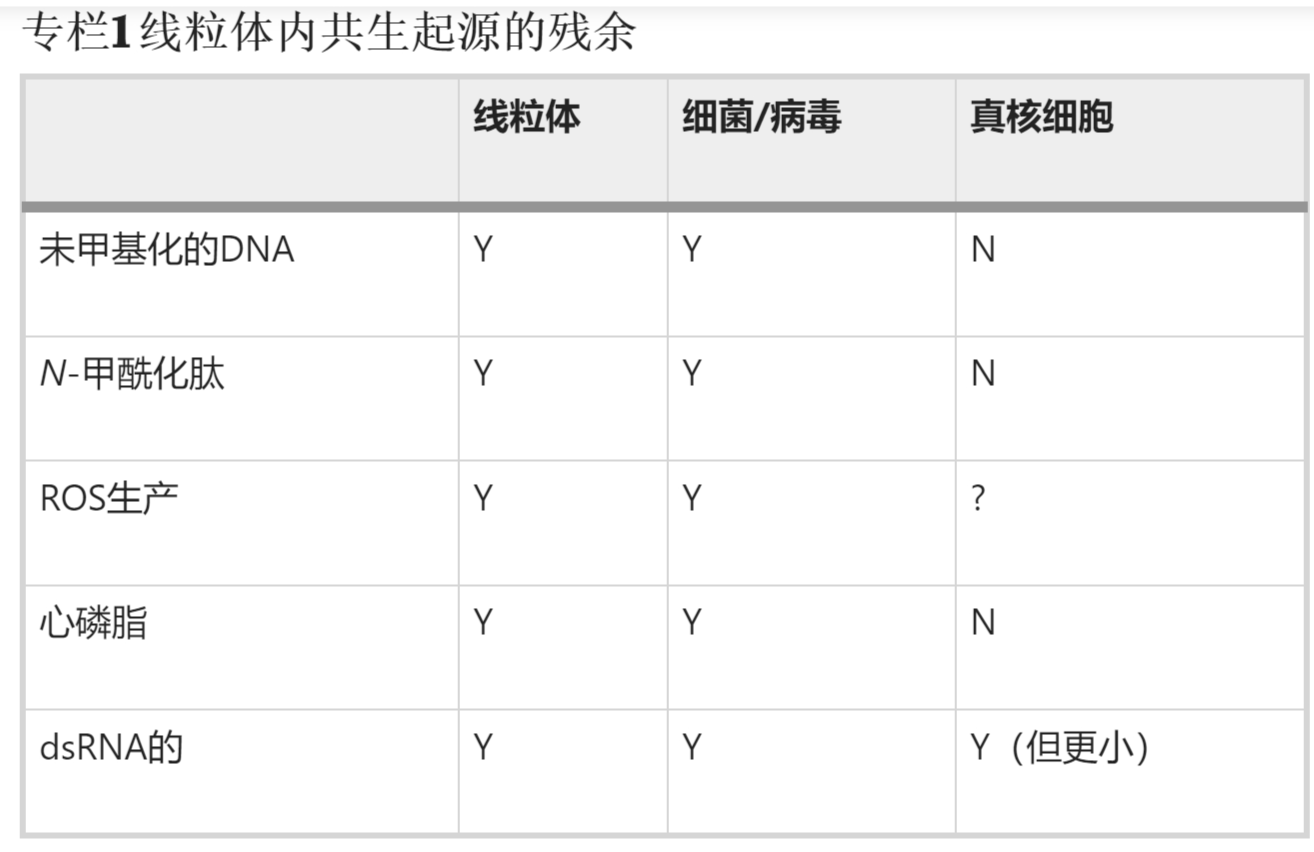
真核细胞内的线粒体保留了许多细菌残留物,这些残留物更典型:mtDNA存在于许多拷贝中,并且在CpG处未甲基化,这与许多核DNA相反;它更容易受到氧化损伤;它的遗传密码略有不同;在线粒体内翻译的 13 种多肽均由 N-甲酰蛋氨酸引发;ROS水平升高,可由高膜电位驱动;并且线粒体基因存在双向转录,因此信使 RNA 与 dsRNA 的潜力重叠。
向胞质溶胶发出线粒体信号
线粒体的这种保留的“他性”通过多种机制将分子释放到细胞质中,从而向细胞的其余部分显示自己的存在(图1)。激活多种免疫信号或程序性细胞死亡途径(图1)。

图1:线粒体分子信号释放途径。
信号可以通过多种机制从线粒体中释放。a,细胞色素c(CytC)可以通过MOMP从线粒体IMS中释放出来,MOMP是由Bcl-2家族蛋白形成的线粒体外膜上的一个孔。这些释放的蛋白质能激活细胞凋亡。b,氧化应激和钙升高诱导mPTP导致内膜中出现孔隙,使其可渗透高达约1.5 kDa的分子,但也可能导致线粒体内膜肿胀,可能破坏外膜,在某些情况下,内膜破裂。c、mtDNA 和 dsRNA 可通过不完全表征的通路释放。一种是通过mPTP氧化新形成的mtDNA片段,另一种是含有mtDNA的线粒体内膜囊泡的鼓泡,可能通过MOMP样结构。含有mtDNA的囊泡通过内体途径进行处理,使mtDNA暴露于TLR4,尽管这些囊泡的其他潜在命运仍不确定。d,CL通常位于线粒体内膜内,但可以在接触部位转移到外膜上。此外,CL 中的多不饱和脂肪酸氧化为 oxCL 和/或溶解 CL 会影响细胞色素 c 的释放,也可以作为线粒体自噬的标志物。e, 极性代谢物很容易通过一系列载体蛋白在线粒体内膜上交换,因此可以向胞质溶胶发出信号,包括衣康酸盐、琥珀酸盐和柠檬酸盐。f,g, 线粒体呼吸链复合物I和III可产生超氧化物。配合物 I 产生的超氧化物可以通过 RET (f) 产生,而配合物 III 产生的超氧化物来自 Q 处的泛精醌自由基o站点 (g)。高质子动量大大增强了超氧化物的形成。超氧化物能作用于乌头酸酶释放Fe生成过氧化氢,也可通过锰依赖性超氧化物歧化酶的作用变异为过氧化氢;过氧化氢一旦形成,可以通过作用于硫醇或诱导脂质过氧化来充当氧化还原信号。

图2:内共生的破坏如何导致炎症。
涉及许多因素,包括肥胖和环境污染物对线粒体的影响,破坏其完整性并推动一系列因素的释放,这些因素通过特定的传感器驱动炎症,著名的例子是NLRP3和核酸传感器。来自线粒体的代谢物也会引起炎症,其中一种富马酸盐在被破坏时可以驱动线粒体 dsRNA 的释放,进而驱动 I 型 IFN 的产生。这些各种诱发因素的增加会是炎症和自身免疫性疾病发病率上升的原因吗?
在线粒体外膜通透化 (MOMP) 后释放源自线粒体 IMS 的蛋白质,例如细胞色素 c、SMAC/Diablo 和 Omi,以诱导内源性细胞凋亡途径响应细胞应激。MOMP 孔的形成仍未完全表征,但响应于 Bcl-2 家族蛋白(如 Bax 和 Bak)的促凋亡成员的相互作用而发生。MOMP将IMS暴露于胞质溶胶中,而不会改变内膜的通透性,从而允许蛋白质退出。许多IMS蛋白(如细胞色素c)主要存在于嵴内,因此与线粒体内边界膜和外膜之间的空间不平衡;因此,OPA-1 与 MOMP 协同对嵴进行了广泛的进一步重塑,以增强这些蛋白质的释放38,41,42.还提出了内膜中CL不饱和脂肪酸的过氧化,以增强细胞色素c的释放。从嵴到线粒体内边界和外膜之间空间的进出也受到线粒体接触位点和嵴组织系统复合体的作用的调节。
由于线粒体内膜的表面积远大于外膜,线粒体基质的肿胀会使外膜破裂,随后释放IMS蛋白。基质膨胀的一种机制是通过诱导线粒体通透性过渡孔 (mPTP) 在内膜中形成,使其对高达 1.5 kDa 的分子具有渗透性。尽管 mPTP 的组成存在争议,它是由多种因素引起的,特别是氧化应激和线粒体钙超载,因此通常与坏死细胞死亡有关。然而,其功能还有许多其他氧化还原和应力调节剂,包括线粒体膜电位,而孔本身具有许多不同的渗透状态,其(病理)生理意义尚不清楚。mPTP的诱导是否可以调节以从膜间空间选择性释放蛋白质,或者它是否会导致内膜破裂和基质大分子的释放,尚不确定。
MtDNA与细胞核中的MtDNA不同,由于缺乏CpG甲基化,因此类似于细菌DNA49.因此,如果 mtDNA 出现在胞质溶胶中,它将被细菌 DNA 的传感器检测到,例如 Toll 样受体 9 (TLR9) 和 cGAS,从而产生第二个信使 cGAMP50.这些传感器将导致多种促炎基因的诱导,特别是细胞因子,包括 I 型干扰素 (IFN)。有许多潜在的机制可以从线粒体基质中释放mtDNA51.一种是线粒体内膜疝,当线粒体基质膨胀时发生,推动包裹 mtDNA 及其结合蛋白的内膜部分通过线粒体外膜中的 Bax/Bak 孔。此外,无偏倚筛选显示了 OPA-1 在 mtDNA 释放中嵴重塑的潜在作用。释放的 mtDNA 似乎是完整的,并且仍然封装在囊泡内,然后囊泡可以与内体结合,从而能够通过内体 TLR9 识别 mtDNA。片段化的mtDNA从基质中直接释放到胞质溶胶中,这似乎与线粒体外膜中mPTP的诱导和成孔电压依赖性阴离子通道(VDAC)的寡聚化有关53.最后,还有新合成和氧化的mtDNA分子的释放,这些分子已被证明与NLRP3炎症小体相互作用。NLRP3 的激活导致 caspase-1 的刺激,caspase-1 处理炎性细胞因子 IL-1β 和 IL18 的前体以及 gasdermin 蛋白家族,以促进热细胞死亡。然而,线粒体对 NLRP3 的调节仍然很复杂,因为还表明线粒体 ATP 是 NLRP3 激活所必需的,产生磷酸肌酸,进而通过肌酸激酶 B 导致胞质 ATP 的产生,ATP 通过直接结合 NLRP3 的 NACHT 结构域而成为 NLRP3 炎症小体组装所必需的。在所有这些情况下,关于释放的mtDNA是否完整,片段化或氧化,或者mtDNA的挤出过程是否具有选择性,直接发生在胞质溶胶中还是通过可以进一步加工甚至从细胞中挤出的囊泡,仍然存在相当大的不确定性。
mtRNA释放到胞质溶胶中也发生在一系列情况下。哺乳动物 mtDNA 编码 2 个核糖体 RNA、22 个转移 RNA 和 11 个 mRNA,其中 2 个是双反子的,从而编码 13 个线粒体多肽。由于 mtDNA 编码重叠的两条链上的基因,这可能导致 dsRNA 分子释放后,可以通过 RIG-I 样受体(包括 RIG-I 本身和 MDA-5)激活病毒传感通路,这些受体与 MAVS 相互作用,MAVS 可能方便地定位于线粒体外膜表面。dsRNA释放的机制不太确定,但可能与mtDNA释放的机制相似。
13 个线粒体翻译的多肽含有一个 N 端、N 甲酰化蛋氨酸 (fMet) 残基,该残基起源于一部分带蛋氨酸电荷的 tRNA 的 N 甲酰化,用于启动线粒体核糖体上的翻译。N-甲酰化Met保留在哺乳动物的13种线粒体编码蛋白中的12种中,唯一的例外是细胞色素氧化酶的Cox III亚基61.细菌蛋白还含有 N 端 fMet,因此哺乳动物细胞在细胞膜上含有一系列 N-甲酰肽 G 蛋白偶联受体,这些受体充当趋化性受体以响应细菌 fMet 肽。此外,许多源自线粒体翻译蛋白N末端的N-甲酰肽在各种形式的炎症期间被释放并且似乎通过 N-甲酰肽 G 蛋白偶联受体起作用。这些肽是如何从线粒体中加工和释放的尚不清楚,但这是线粒体产生的潜在信号的细菌起源的另一个例子。
心磷脂的结构与其他磷脂略有不同,两种磷脂酸由第三个甘油分子连接。CL广泛存在于细菌中,但在真核生物中主要存在于线粒体内膜内,在那里它被合成并重塑其脂肪酸组成。在细菌和线粒体膜中,CL的特性都用于调节膜曲率,并且还与许多膜蛋白的功能密切相关,并且对许多膜蛋白的功能至关重要,这表明它被线粒体保留的原因。在许多情况下,CL易位到线粒体外膜,可能在线粒体内膜和外膜之间的接触位点。CL 的易位通常与 CL 中占主导地位的不饱和脂肪酸的过氧化有关,一旦暴露在线粒体外膜上,过氧化的 CL 可能有助于形成使 MOMP。此外,在线粒体外膜的胞质表面暴露 CL 可以促进蛋白质信号传导组装体的形成,可能包括 NLRP3 的募集和激活。此外,线粒体外膜上暴露 CL 也可以标记细胞器的线粒体自噬,自原生软骨体α-变形杆菌内共生的起源以来,它可能一直保留下来。有趣的是,危险假说的创始人波莉·马辛格(Polly Matzinger)认为,免疫系统识别各种威胁会被激活,他认为CL识别是“危险”信号的一个很好的例子。目前的问题包括如何调节 CL 上不饱和脂肪酸的过氧化,以及如何协调 CL 向外膜的重塑和易位。
线粒体呼吸链可以从复合物 I 和 III 中产生超氧化物。在高质子动量 (Δp) 和辅酶 Q 库减少的条件下,复合物 I 通过反向电子传递 (RET) 产生超氧化物特别令人感兴趣,因为它可以响应这些关键线粒体参数的变化进行生理调节并正在成为线粒体氧化还原信号传导的潜在模式。因此,人们对氧化还原信号背后的这一过程有相当大的兴趣。例如,RET可以通过F关闭Δp的消耗来激活oF1-ATP合酶,或通过增强谷氨酰胺分解作为琥珀酸的来源来驱动RET。预期是,任一复合物在线粒体基质中产生的超氧化物将转化为H2O2通过局部高浓度的Mn-超氧化物歧化酶。H2O2可以作为潜在的氧化还原信号,最有可能通过可逆氧化关键信号转导中继蛋白上的半胱氨酸残基,例如在细菌中氧化还原敏感的 OxyR 转录因子中看到的那些以及在真核蛋白中广泛存在的类似氧化还原敏感半胱氨酸中。即便如此, 在何种情况下仍存在不确定性H2O2可从细胞内线粒体扩散,或是否升高 H2O2可能在线粒体内起作用,从而有助于其他因子释放到胞质溶胶中,例如,通过激活 mPTP。同样,CL 的过氧化是另一种潜在的信号传导模式,但 CL 是否直接受到线粒体 ROS 的调节尚不清楚。在某些情况下,有迹象表明,线粒体ROS升高可以作为杀死细胞内入侵细菌的一种手段。
线粒体基质中大部分中枢代谢的隔离,加上极性代谢物(包括α-酮戊二酸、柠檬酸盐、衣康酸盐和琥珀酸)在线粒体内膜上的选择性转运,使线粒体代谢物的释放能够作为信号。在所有情况下,信号传导模式都需要调节代谢物的产生和输出到胞质溶胶/细胞核,然后是对该信号的反应模式。柠檬酸盐生成的增加及其向胞质溶胶的输出会产生大量的乙酰辅酶A,其中一些驱动脂肪酸的生物合成,但也改变了组蛋白乙酰化的水平。在炎症期间,琥珀酸盐的产生通过增加谷氨酰胺分解和辅酶 Q 库的减少来增强,这导致琥珀酸盐通过二羧酸载体输出到胞质溶胶。一旦进入胞质溶胶,琥珀酸就会影响α-酮戊二酸依赖性双加氧酶的活性,其作用是将氧原子引入蛋白质靶标中。这在缺氧诱导因子 1α 的激活中很重要,导致白细胞介素 (IL)-1β 等细胞因子的诱导。琥珀酸和α-酮戊二酸等线粒体代谢物也可以改变DNA和组蛋白甲基化,作为潜在的表观遗传信号。同样,在巨噬细胞的炎症激活后,乌头酸脱羧酶-1(由基因IRG-1编码)上调,从乌头酸产生衣康酸盐,然后从基质输出到胞质溶胶。衣康酸盐是一种代谢物,现在引起了人们的强烈兴趣,并且已被证明具有抗菌作用,但还可以调节各种炎症蛋白,从而产生净抗炎作用。
除了来自线粒体的单个代谢物信号外,还有一种公认的代谢转变,称为Warburg效应。Warburg效应的基本原理通常被认为是,它可以通过糖酵解和磷酸戊糖途径增加通量,从而产生更多的细胞生长代谢构建块。在免疫细胞活化过程中和癌细胞中,通过糖酵解的通量要大得多,通常会导致足够的 ATP 产生,因此不再需要氧化磷酸化。然而,重要的是要注意,通过氧化磷酸化产生的 ATP 只是线粒体执行的众多作用之一。其中许多 - 特别是TCA循环和呼吸链 - 对于生物合成至关重要,因此对于正在向糖酵解代谢转变的细胞仍然需要。即使线粒体不再是ATP的主要供应者。这种通过氧化磷酸化提供 ATP 到糖酵解的转变的一个被低估的方面是,它也可以通过阻断线粒体氧化磷酸化向胞质溶胶供应 ATP 的能力来实现,从而迫使细胞转向糖酵解 ATP 的产生。总之,向有氧糖酵解的转变并不是线粒体功能丧失的指标,因为大多数肿瘤和炎症状况需要具有功能性呼吸链和克雷布斯循环的活性线粒体,可以产生肿瘤代谢物或中间体进行生物合成。
因此,线粒体与细胞其余部分的隔离以及它们的异性使线粒体能够用作多个过程的信号枢纽,特别是在细胞死亡和免疫方面。然而,这引发了许多问题,并留下了许多松散的结局。其中包括:在成为线粒体的细菌中,这些途径是否有任何前因?现在在古细菌中存在的真核细胞中是否存在活性受体的前体,或者这些途径是在内共生后进化的?
继承还是洗礼?
真核细胞内隔离的线粒体区室含有细菌来源的成分,因此可能促进了以细胞器为中心的信号通路的进化。可能有两种互补的方案。一是线粒体信号通路是从内共生之前已经使用的线粒体信号通路发展而来的。这些可能来自转移到宿主基因组的原软粒体α-变形菌,或来自古细菌宿主。另一种选择是,内共生使许多线粒体成分能够重新用于新功能,这些功能是为了利用内共生后的新情况——这一过程称为洗礼。定义为获取最初未选择的新功能的特征。例如,Bax/Bak 与 OPA-1 在 mtDNA 释放中的作用符合洗礼模型,该功能可能在内共生后进化。最有可能的是,这两个过程的结合都有贡献。
考虑到线粒体RET的细菌前因,重要的是要注意来自α-变形杆菌反硝化副球菌的复合物I,它通常被用作原软骨体内共生体的模型,可以很容易地进行RET。尽管RET在反硝化假单胞菌中的作用尚不清楚,但它表明RET可能作为早期原核细胞中潜在的信号传导模式。反硝化假单胞菌等细菌可以提高ROS的产生,以应对应激源,如导致细胞死亡的DNA损伤,因此真核细胞中线粒体 ROS 的产生和裂解可能来自细菌前因。
因子从线粒体释放到胞质溶胶中概括了一种机制,通过这种机制,细菌通过在入侵者有机会完全复制之前裂解受感染的细胞来防止噬菌体感染。此外,细菌可以释放包裹细胞内成分的囊泡。然而,这些细菌过程与线粒体中 MOMP、囊泡释放和 mPTP 诱导之间的机制相似性尚不完全清楚。此外,真核细胞自主先天免疫反应的关键成分是从cGAS-STING通路的细菌前体、gasdermins和Toll-IL-1受体抗性(TIR)结构域蛋白(如发生在哺乳动物的TLR中)进化而来的,它们都可以保护细菌免受噬菌体感染8.因此,这些途径中至少有一些可能存在于最初托管α-变形杆菌的古细菌中,然后在需要时被选择来感知内共生体中因子的释放。在最初的内共生体中,核基因表达可能是由这些系统启动的,以确保在内共生体受损并表现出来时的稳态。线粒体自噬可以清除受损的内共生体,也许可以通过识别暴露的 CL,尽管线粒体自噬是如何进化的仍然不确定。在多细胞生物中,又花了14亿年(大约)的时间才进化出来,这些相同的途径以及其他途径可能会引起局部或全身炎症,以恢复组织损伤或感染后的体内平衡。因此,最初是单个细胞响应线粒体损伤而生存的能力变成了生物体炎症过程,在这两种情况下,保护性事件都是由识别受损线粒体中的成分引发的。
无菌性和非无菌性炎症重叠
模式识别受体 (PRR) 通过危险相关分子模式 (DAMPS) 对无菌炎症做出反应,并通过病原体相关分子模式 (PAMP) 对感染做出反应,对线粒体内源性 DAMPS 有反应的 PRR 与对细菌或病毒感染的外部 PAMP 有反应的 PRR 有相当大的重叠。这就提出了一个问题,即哪个先来。先天免疫系统是响应导致 DAMPS 释放的细胞损伤而产生的,然后随后对 PAMP 做出反应,还是最初设计用于解决感染问题,然后被选中来应对线粒体损伤?有证据表明,PAMP和DAMP传感之间存在有趣的相互作用。含有RNA的病毒,如流感病毒、登革热病毒或诺如病毒,可以通过RNA传感器(如RIG-I)检测,然后促进mtDNA的释放,mtDNA通过cGAS-STING扩增I型IFN的诱导。疱疹病毒等DNA病毒也驱动mtDNA的释放,以促进抗病毒先天免疫。因此,它似乎是最佳响应所需的 PAMP-DAMP 组合,DAMP 以 mtDNA 的形式起源于线粒体(图 1)。

图3:核酸感应PRR是否进化为感知线粒体核酸?
mtDNA 已被证明可以被 PRR cGAS 和 TLR9 感知,而线粒体 dsRNA 可以被 PRR MDA-5 和 RIG-1 感知。然而,这些PRRs被发现是作为微生物来源的核酸的传感器,那么哪个先出现呢?最近有研究表明,RNA病毒,包括流感、登革热和诺如病毒,被RIG-I感应,但也会引起线粒体核酸的释放,而线粒体核酸又被相关的PRR感应到。这种PAMP-DAMP组合似乎是对这些病毒做出最佳反应所必需的。最终,这是否适用于所有微生物的感应,其中响应是通过感应微生物PAMP来启动的,而微生物PAMP反过来又驱动线粒体DAMP的释放以获得最佳响应?
内共生和自身免疫
来自线粒体的 DAMP 和感染的 PAMP 激活的 PRR 的相似性提出了有助于自身免疫的 DAMP/PAMP 传感之间的串扰问题。在这种情况下,重要的是要注意,在许多自身免疫性疾病中,检测到针对线粒体抗原的抗体,包括针对 CL 的抗体、线粒体蛋白、mtDNA和 mtRNA。此外,对线粒体和细菌DNA的反应以及线粒体和病毒dsRNA的反应之间的重叠创造了另一种可能产生自身免疫反应的方式。
此外,在某些情况下,琥珀酸来自线粒体代谢,这可能有助于炎症信号传导。支持这一点,琥珀酸盐存在于发炎的关节中,并通过琥珀酸受体 SUCNR1 促进 IL-1β 的产生。最近的一项研究还表明,dsRNA在多种自身免疫性和炎症性疾病中占有重要地位。.引人注目的是,作者报告了腺苷脱氨酶如何通过作用于RNA的腺苷脱氨酶对dsRNA的异常编辑,将腺苷转化为肌苷,使dsRNA更像“自身”RNA,产生由MDA-5感知的免疫原性dsRNA,从而促进炎症。因为真核细胞中很大一部分 dsRNA 很可能是线粒体来源的,这表明线粒体 dsRNA 的异常感应可能是许多自身免疫性疾病的病理性。最后,已经建立了富马酸水合酶与线粒体 dsRNA 释放之间的联系。用革兰氏阴性细菌产物脂多糖激活 TLR4 导致巨噬细胞中富马酸水合酶的减少,这与通过未知机制释放 dsRNA 有关。然后,dsRNA 通过 MDA-5 和 RIG-I 驱动 I 型 IFN 的产生。据报道,富马酸水合酶在系统性红斑狼疮(一种已知的干扰素病)患者的单核细胞中受到抑制,再次可能将线粒体 dsRNA 与自身免疫联系起来。富马酸水合酶缺陷的肿瘤也被证明可以释放其 mtDNA 并促进 I 型 IFN 的产生,这进一步支持富马酸水合酶在线粒体核酸释放中的作用。
新出现的方面
从考虑线粒体的细菌起源中获得的见解表明,拓宽了我们的视野,以考虑线粒体是否可能在真核细胞中使用其他细菌途径。例如,细菌使用群体感应,通过它它们自我产生细胞外化学信号,这些信号可以在局部环境中积累到激活特定基因转录所需的水平。线粒体定期释放代谢信号,如琥珀酸盐、柠檬酸盐和衣康酸盐,并且还可以释放 ROS 和其他信号来调节接头蛋白(如 Miro)的作用,这些接头蛋白调节线粒体与细胞骨架相互作用并被细胞骨架移动的方式。目前的重点是读取胞质溶胶和细胞核中的这些信号,但这些信使也可以很容易地被同一细胞中的线粒体吸收,并且确实通过质膜转运蛋白从一个细胞传递到另一个细胞,或者作用于细胞表面受体。与此相关的是 FGF21 和 GDF15 等有丝分裂因子的产生,这些有丝分裂因子响应线粒体应激向其他组织发出信号,但关于这些是线粒体选择性反应还是一般应激反应,仍有许多问题需要解决。其他值得探索的潜在信号传导模式包括来自线粒体的脂质过氧化信号的产生,可能来自 CL 上不饱和脂肪酸的过氧化或ROS诱导的ROS释放。这些信号是否会影响局部线粒体转录/翻译尚未被探索,但可能是一个肥沃的区域,特别是在线粒体与细胞核相距较远的细胞中,例如在神经元中。
细菌响应信号的趋化迁移率已得到充分证实。线粒体很容易在整个细胞中移动、分裂和重组,这个过程也与线粒体自噬有关。.线粒体动力学涉及线粒体、细胞骨架和其他细胞器(尤其是内皮网)之间的密切相互作用。此外,细胞内的线粒体位置可以动态地响应许多刺激,在ATP需求或感染的条件下靠近质膜移动。目前的假设是线粒体通过细胞骨架在细胞周围移动,但很可能存在由细胞内线粒体产生并作用于线粒体的局部信号,这些信号有助于这些过程。
有趣的是,现在很明显,完整的线粒体可以在体内从一个细胞迁移到另一个细胞,包括从一种细胞类型迁移到另一种细胞类型。这可以通过管状连接、囊泡转移或细胞间连接(如间隙连接通道)或细胞融合来实现。受损的线粒体也可能触发健康细胞或干细胞的线粒体转移激活。与此相关的是,人们对线粒体转移/移植作为一种治疗策略有相当大的兴趣,例如,在缺血再灌注损伤后的心脏。外部线粒体很容易在细胞内吞吐,并且默认的假设是添加新的线粒体增强了靶细胞中的氧化磷酸化,尽管这很少被明确证明,并且对积极作用的许多其他解释是可能的。线粒体从细胞迁移到细胞的这种能力当然是它们内共生起源的进一步反映。
展望
一个关键问题是:内共生何时会破裂?因为炎症是一个正常的生理过程,旨在使我们在受伤和感染后恢复健康,为什么这个过程在这么多疾病中会流氓?这些疾病发病率的上升导致各种罪魁祸首受到牵连,包括肥胖、慢性压力、不良饮食(可能与加工食品有关)和生活方式的改变,如睡眠中断或环境毒素,很可能是在特定遗传背景的背景下。线粒体为我们提供了所有这些过程的统一目标(图2). 肥胖、慢性压力、某些食物、昼夜节律紊乱或各种环境毒素引起的线粒体损伤对线粒体造成的压力是否会加剧稳态目标是以有益方式驱动炎症的过程?所有这些触发因素都可能导致这里讨论的线粒体因子的增强释放,无论是 ROS、代谢物、肽还是核酸,传感器的过度激活旨在引发导致炎症性疾病的有益炎症。
有趣的是,线粒体研究的早期先驱,如汉斯·克雷布斯(Hans Krebs)或彼得·米切尔(Peter Mitchell),可能会对这里讨论的令人兴奋的发展做出什么贡献。内共生理论为我们提供了对真核生物进化的巨大见解;如果没有这个不太可能的随机事件,我们作为一个物种就不会进化到考虑它。克雷布斯循环被重新用于炎症,或者线粒体核酸可能是通过诱导细胞因子产生免疫力的关键触发因素,这为我们提供了一个全新的视角来了解线粒体在我们的细胞中的作用。这些新见解能否为炎症和自身免疫性疾病发病率的增加提供解释?这些疾病是否部分可以解释为20亿年关系的破裂?这一见解很可能会产生新的疗法来治疗快速增长和令人不安的疾病。未来的研究应该有助于澄清这些问题,并使我们能够针对这些最有趣的细胞器以获得治疗效果。
【IBP科普报道】衣康酸的“前世”与“今生”--中国科学院生物物理研究所 (cas.cn)
https://blog.sciencenet.cn/blog-41174-1421167.html
上一篇:富氢果冻改善肠道紊乱的研究【衰老鼠】
下一篇:为什么廉价、有效的腹泻治疗方法没有得到充分利用?