博文
癌症精准化研究
|
癌症药物的高效输送到肿瘤组织一直是一个长期目标。虽然许多针对癌症的药物输送系统已经成功,但仍有改进的空间,特别是对于治疗侵袭性癌症。
日本千叶县国立癌症中心的前发展治疗学部门负责人山本武彦(Yasuhiro Matsumura)将自己的职业生涯致力于设计和改进针对癌症治疗的药物输送系统。 “癌症药物由于其高毒性和强效,人们在接受化疗时常常感到不适,” 山本武彦说道,他也是位于东京的RIN研究所的创始人。“为了减少对健康细胞的损害和由此产生的副作用,我们必须找到确保药物仅在肿瘤细胞中积累的输送方法。”
科学家现在知道,健康的细胞与癌细胞共享分裂生长因子,因此基于分子的抑制细胞增殖信号的药物输送系统在癌症治疗方面存在局限性。 “癌症药物研发必须从微观层面退后一步,考虑整个肿瘤环境,” 山本武彦说。 “全面了解宏观肿瘤组织对于未来的癌症治疗实现其全部潜力至关重要。”
如何利用自然效应? 1986年,山本武彦和他的前上司、熊本大学医学院已故教授岩田重雄发表了一篇论文,揭示了某些特定大小的分子更有可能大量聚集在肿瘤组织中而不是健康组织中。这种'增强渗透和保留'(EPR)效应被认为是由于肿瘤组织过度刺激血管生长导致的血管结构异常和非正常的流体动力学所致。 这种效应可以帮助区分癌组织和正常组织,许多研究人员已经使用它来将抗体药物和其他疗法直接输送到肿瘤中。 虽然这种方法在小鼠模型中效果良好,但在人类中出现了问题。“我们开始注意到,在人类实体肿瘤组织中,到达目标肿瘤细胞的药物分子数量太少,这可能会降低抗肿瘤效果,” 山本武彦解释道。“抗体在人实体肿瘤中的路径被称为基质的结构障碍所阻挡,而在异种移植实验性肿瘤的小鼠中,基质的形成程度要低得多。” 当恶性肿瘤形成时,癌性活动会诱导血液凝固,并伴随着不可溶性纤维蛋白、胶原和炎性细胞的沉积。这些成分在肿瘤细胞周围形成强大的结构屏障或基质,保护它们并帮助固定实体肿瘤。基质在所有类型的癌症中都很常见,但其程度和厚度变化很大。实际上,基质的程度与恶性之间存在直接联系,侵袭性更强的癌症具有最强的基质存在。 “基质可以阻止治疗到达并杀死癌细胞,” 山本武彦说。“我们决定关注基质的一个组成部分——不可溶性纤维蛋白,看看我们是否能够找到一种穿过基质到达癌细胞的方法。关键是,这些不可溶性纤维蛋白分子仅在恶性肿瘤组织中发现,而不是在健康组织或非恶性疾病的慢性阶段中发现。”
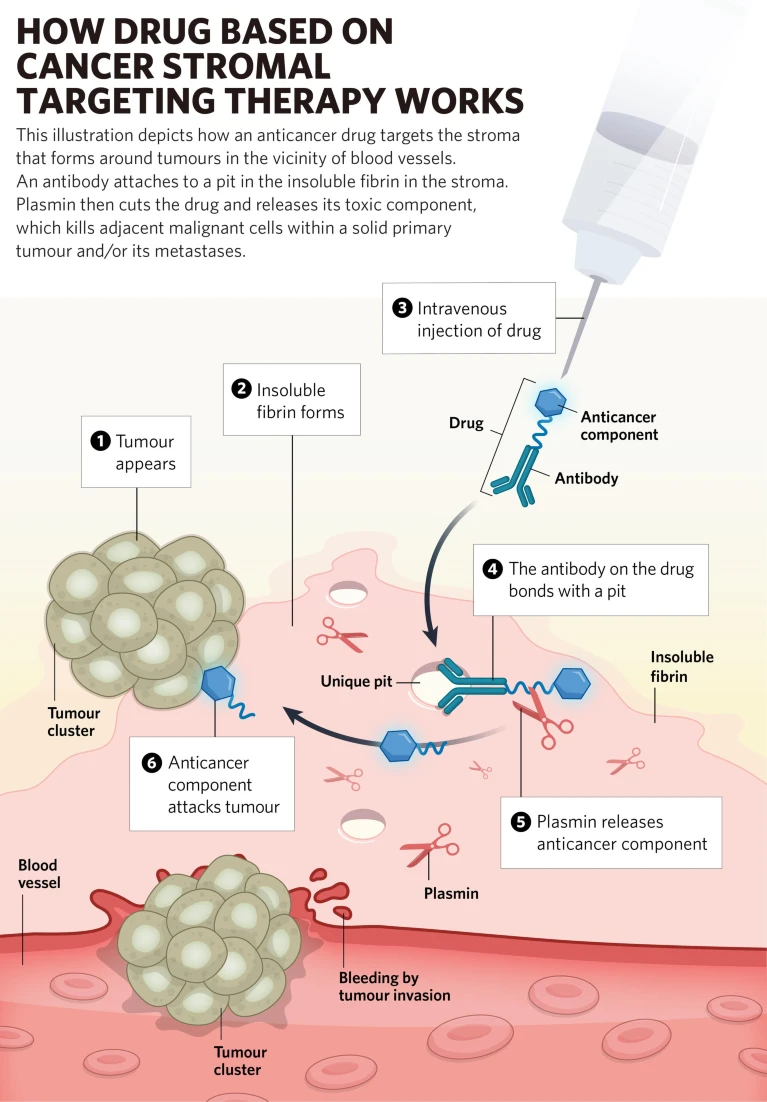
基质的弱点。山本武彦在2006年1月开发了一种针对不可溶性纤维蛋白的单克隆抗体。然后他和团队寻找抗体在不可溶性纤维蛋白分子上的表位。他们确定了不可溶性纤维蛋白分子侧面的一个中空部分,该部分的氨基酸序列是表位,只有在不可溶性纤维蛋白完全形成时才会暴露出来。还澄清了在它的前体或降解形式中,表位肽通过与相邻肽的疏水键紧密闭合。 “这个表位在所有物种中都有完全的保守性,从鱼到人类——我猜测甚至恐龙也有,” 山本武彦说。“我们有信心靶向这个表位对人类也会有效,尽管我们还没有进行临床试验。” 这一发现使得团队能够创建一种携带并释放化疗药物分子(单甲基阿莫司他丁E,或MMAE)的抗体-药物共轭物(ADC)。
MMAE足够小,可以穿过基质到达肿瘤细胞。 ADC在输送过程的每个步骤中都会以某种方式表现。当它到达不可溶性纤维蛋白部位时,抗体结合到表位上,持有MMAE的连接分子被一种名为纤溶酶的酶降解,这种酶只在存在不可溶性纤维蛋白的地方被激活。然后MMAE穿过基质并攻击癌细胞。 “只有不可溶性纤维蛋白释放纤溶酶,这意味着只有通过与不可溶性纤维蛋白表位的相互作用才能释放MMAE,而不是其他地方,” 山本武彦说。 “这使得我们的ADC具有高度的特异性,可能比其他化疗药物的输送系统更安全。” 这种癌症基质靶向治疗(CAST therapy)对于多种癌症类型具有巨大潜力,特别是那些目前难以治疗的侵袭性癌症。为了优化ADC的效果,团队最近开发了原始抗体的克隆。
从小鼠到人类,山本武彦的团队正在使用小鼠模型和人细胞培养进行广泛的实验,以验证他们的ADC的稳定性和安全性。他们开发了一种探针,使他们能够在小鼠中可视化富含不可溶性纤维蛋白的基质,并观察他们的ADC的表现如何。最近,他们通过改进连接部分成功地生产出一种ADC,比原始ADC具有更高的抗肿瘤效果。 使用ADC对抗胶质母细胞瘤(一种快速生长、侵略性很强的脑癌)的小鼠模型试验显示出希望。与小鼠异种移植不同,研究人员小心翼翼地确保患者来源的异种移植肿瘤富含基质,模拟人类的肿瘤。ADC在血流中保持稳定,特异性地积累在不可溶性纤维蛋白部位,药物在那里释放并通过基质。他们的治疗显示出明显的抗肿瘤效果,但必须仔细监测剂量,以防止小鼠体重减轻。即使在试验期间形成血栓的部位,他们也没有观察到组织损伤或出血。进一步的毒性研究正在进行,同时调查最佳剂量。
CAST治疗在人体试验之前需要进一步的动物试验和安全概况测试。如果获得资金许可,山本武彦团队计划在未来三年内将CAST治疗推向人体试验。 “我也好奇CAST是否能与免疫检查点抑制剂很好地结合,后者的目标存在于基质中,” 山本武彦说。 “我相信我们独特的治疗系统可以改变未来的癌症治疗方法,同时也为治疗涉及血液凝固的其他疾病开辟了大门。”

山本武彦在他的实验室里。
https://blog.sciencenet.cn/blog-41174-1403780.html
上一篇:被吹捧为药物发现的新时代,但AlphaFold真行吗?
下一篇:2.5亿年后地球会变成啥样