博文
脂质参与离子通道家族孔隙的结构成分
|
问题提出
细胞熟练地在复杂的环境中穿梭,感知和响应各种刺激,机械信号在触觉和听觉等过程中起着至关重要的作用1.机械敏感离子通道,包括相关的 OSCA 和 TMEM63 通道家族2,是嵌入细胞膜脂质双层中的蛋白质,专门用于检测机械线索。当在周围膜中被力激活时,这些通道从封闭构象转变为开放构象,为离子穿过细胞膜创造了一条途径,并将机械刺激转化为电化学信号1.尽管它们很重要,但这些通道如何通过机械力激活的确切结构基础在很大程度上仍然是未知的。主要障碍之一,也是一个关键而又具有挑战性的研究领域,是在收集结构数据时难以施加确定的机械力。
研究发现我们的目标是使用不同和互补的策略来捕捉OSCA/TMEM63通道的开放结构。最初的方法涉及纳米盘(由支架蛋白包围的脂质双层小块)以模拟增加的膜张力。通过减少每个纳米盘的脂质数量,我们诱导了脂质膨胀,从而增强了嵌入的 OSCA/TMEM63 蛋白周围的膜张力。尽管这些尝试暗示了这些通道的门控过程,但正是OSCA通道的结构重组为小脂质体(球形脂质囊泡),通过在通道周围引入大量的局部机械应力,为我们提供了开放OSCA通道的最清晰画面。同时,我们使用计算和电生理学方法来指导和解释这些结构研究。
通过这些结合结构、功能和计算的研究,我们揭示了 OSCA/TMEM63 通道如何对机械力做出反应,脂质在构象转变中起着独特而关键的作用。最令人兴奋的观察结果是,我们激活的(开放的)OSCA通道中的孔表现出与膜的横向开口,这意味着离子通路由脂质衬里。通常在离子通道中,孔隙完全被蛋白质包围。结构和模拟数据显示,脂质的头基(脂质结构一端的亲水部分)沿着孔隙组织,起到脂质壁的作用,引导离子通过(图1)。功能数据表明,脂质头部基团上的电荷可以调节通道的离子选择性。因此,我们揭示了 OSCA/TMEM63 通道门控周期的全局视图,并明确确定了离子渗透的“蛋白脂质”孔,该孔首次在 TMEM16 蛋白中提出3.
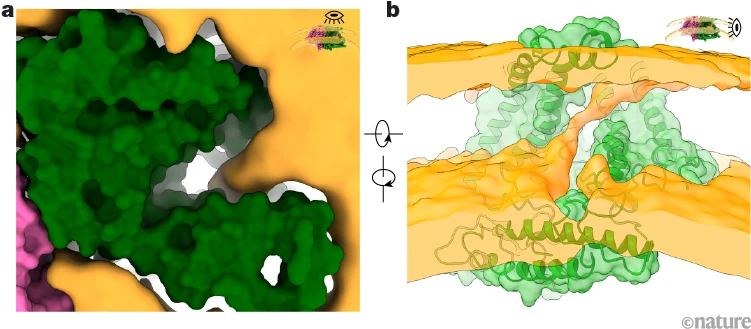
图 1 |OSCA1.2的蛋白脂质孔。嵌入脂质体膜(橙色)中的开放OSCA离子通道(绿色和粉红色)的顶部(a)和侧面(b)视图,显示孔壁的一部分(顶部视图右侧)由脂质组成。
研究意义我们模拟机械力的方法可以广泛应用于各种机械敏感膜蛋白。纳米盘方法提供了一种可控的方法来模拟增加的张力并区分构象变化。此外,我们成功使用脂质体进行 175 千道尔顿小 OSCA 二聚体的结构研究,为使用脂质体研究大量膜蛋白注入了信心。OSCA/TMEM63 通道与机械敏感的 TMC1 通道共享结构特征,后者是听觉的关键,之前曾提出表现出侧向开口并需要脂质壁4;它们还与 TMEM16 家族的成员共享功能,TMEM16 家族具有离子通道和脂质扰频酶(将脂质穿过膜双层两侧的蛋白质)的双重功能5.因此,我们的开放结构可能会为这些相关蛋白质的功能周期提供分子见解。
鉴于与相关 TMEM16 蛋白的相似性,人们可能会质疑 OSCA/TMEM63 通道是否可以作为机械敏感脂质扰乱酶发挥作用,脂质易位和离子渗透是否可以偶联,以及这种扰乱酶活性的生理作用可能是什么。尽管这项研究在这些方面提供了有趣的提示,但我们缺乏实验证据或开放的TMEM63结构来支持这些假设。我们很高兴能够探索 OSCA/TMEM63 通道的潜在机械敏感脂质加扰酶特性,并将我们的力模拟方法应用于其他机械敏感通道。— Yixiao Zhang就职于中国上海生物与化学交叉学科研究中心,Charles D. Cox就职于澳大利亚悉尼Victor Chang心脏研究所。
专家意见也许这项研究最令人兴奋的方面是不同脂质在门控过程中发挥的功能作用的多样性。在开放构象中,脂质头基形成离子渗透途径的一部分的发现很有趣。这些通道可能借鉴了所谓的“信用卡”机制,其中脂质头基通过蛋白质亲水路径从一个小叶转移到另一个小叶。— 杰罗姆·拉克鲁瓦(Jerome Lacroix)就职于美国加利福尼亚州波莫纳的西部健康科学大学。
论文背后我们最初的手稿侧重于 OSCA/TMEM63 通道的激活机制,以及 TMEM63 蛋白与 OSCA 不同,具有单体功能的意外发现。然而,在我们的纳米盘结构中,两个成孔螺旋没有被解析,这给我们留下了一个问题,即它们是否真的代表了开放状态。在修订过程中,我们探索了脂质体和脂质脱落策略,幸运的是,他们能够解析所有跨膜螺旋,确认开放状态并明确分配“蛋白脂质”孔。因此,在修订版中,我们大幅调整了叙述,强调了我们开放结构中的“蛋白脂质”孔,并几乎删除了单体 TMEM63 结构研究,因为有几篇论文在过渡时期报道了这一发现。我们感谢所有审稿人的批判性思维和建议,我们希望这些建议使这个故事更加完整和令人兴奋。— Y.Z.
编者的话
这项研究让我感到惊讶,因为它展示了最大的力敏离子通道家族在受压时如何使其孔隙与脂质对齐。这种机制与离子通道通常的工作方式完全不同,其中蛋白质中高度专业化的孔定义了通道的功能。像这样的研究提出的问题多于答案,提出了新的研究方向。— Bryden Le Bailly,《自然》杂志高级编辑
Mechanical activation opens a lipid-lined pore in OSCA ion channels | Nature (yyttgd.top)
OSCA/TMEM63通道是已知最大的机械敏感通道家族1,2,3,在植物4,5,6,7和哺乳动物8,9的机械传导中发挥着关键作用。在这里,我们确定了44个不同环境中的OSCA/TMEM63通道的低温电子显微镜结构,以研究OSCA/TMEM63通道机械敏感性的分子基础。在纳米盘中,我们模拟了增加的膜张力,并观察到一个OSCA1.2亚基中的孔道扩张,与膜接触。在脂质体中,我们捕获了OSCA1.2在内侧朝向下的完全开放结构,其中孔道向膜展示了一个大的横向开口。对于离子通道来说不寻常的是,结构、功能和计算证据支持存在一个“蛋白-脂质孔”,其中脂质作为离子渗透途径的壁。在对张力不太敏感的同源物OSCA3.1中,我们识别了一个紧密结合在中央裂缝中的“互锁”脂质,保持通道关闭。突变协调脂质的残基诱导了OSCA3.1的激活,揭示了OSCA通道的保守开放构象。我们的结构提供了OSCA通道门控周期的全局图景,揭示了结合脂质的重要性,并显示每个亚基可以独立打开。这扩展了我们对通道介导的机械传导和通道孔形成的理解,并对TMEM16和TMC蛋白质家族具有重要的机制意义。
https://blog.sciencenet.cn/blog-41174-1444438.html
上一篇:氢气缓解癌症放化疗副作用的研究【综述】
下一篇:营养标签如何改变了美国的食品