博文
FDA将审核渐冻症新药托弗森Tofersen
|
美国食品和药物管理局(FDA)将很快裁定批准一种用于罕见形式的肌萎缩侧索硬化症(ALS)的新药。备受期待的决定预计将标志着该机构对神经药物的愿景 - 以及它愿意灵活监管这些疗法。
患有这种疾病的人迫切需要新的治疗方法,因为他们面临着导致神经元死亡的退行性疾病,并且通常在症状出现后的三年内导致致命的呼吸衰竭1.由马萨诸塞州剑桥市的生物技术公司Biogen和加利福尼亚州卡尔斯巴德的Ionis Pharmaceuticals开发的托弗森Tofersen并没有减缓患者的衰退,在III期试验中并没有减缓患者的衰退。2.然而,有人说临床试验时间太短,并指出有迹象表明可能有益,例如神经元损伤和死亡的生物标志物称为神经丝轻链(NFL)的减少。正因为如此,Biogen已要求FDA在“加速”基础上批准该药物,以快速将其传递给患者,并保证未来的试验数据将决定其是否有效。
如果获得批准,tofersen将成为FDA不断发展的神经药物开发方法的最新案例,这可能会促进行业对脑部疾病的投资热情。对这种药物的信任投票也将增加人们对使用NFL作为衡量大脑健康和未来测试药物的工具的兴趣。“这可能是一个新时代的开始,”意大利米兰马里奥·内格里药理研究所的神经科学家瓦伦蒂娜·博内托说。
《自然》杂志分析了FDA于4月25日做出的这一决定将如何改变神经药物的格局。
Hotly anticipated ALS drug could pave way for more brain treatments (nature.com)
FDA会批准托弗森tofersen吗?
今年3月,FDA召集了一个小组讨论tofersen数据集。其9名独立顾问团结起来支持加速批准该药物,一致投票认为现有证据支持tofersen帮助SOD1 ALS患者的“合理可能性”。这种罕见疾病是由影响蛋白质SOD1的基因突变引起的,导致其在大脑,脑干和脊髓的运动神经元中形成有毒团块。FDA通常遵循其咨询委员会的建议。
Tofersen是一种反义RNA药物,能与SOD1 mRNA结合并减缓该蛋白质的表达。通过减少神经毒素的积聚,tofersen旨在保护运动神经元,有望帮助这类患者活得更强壮,更长寿。
渤健通过其III期VALOR试验测试了Tofersen2,给 108 名 SOD1 ALS 患者服用Tofersen或安慰剂。在为期6个月的试验结束时,使用ALSFRS-R评估该药物,这是一种跟踪身体功能随时间变化的问卷。根据ALSFRS-R结果,托弗森使用者的表现并不比安慰剂接受者好。然而该药物确实降低了SOD1和NFL的水平。此外,该试验的开放标签扩展的结果表明,六个月可能太短而无法看到临床效果。
FDA的顾问将这一“证据组合”作为支持加速批准的理由。但他们并没有全部支持批准,以5票对3票 - 1票弃权 - 反对。完全批准将需要对该药物进行较少或没有后续研究,一些小组成员认为这是至关重要的。“所提供的数据是否完整...提供令人信服的有效性水平?“伊利诺伊州芝加哥西北医学的神经学家Tanya Simuni问道。“简短的回答是否定的。我们需要更多的数据。”
对未来的神经药物意味着什么?
FDA愿意审查和讨论tofersen数据,突显了FDA在神经药物开发方面新发现的灵活性。“他们愿意倾听的事实对制药公司来说是一件大好事,”瑞士巴塞尔诺华公司神经科学全球负责人Robert Baloh说。“看到这一点公司会认为,'哦,我们应该在这个领域运营,因为我们将有更多的成功机会'。”
tofersen的审议也突出了NFL作为药物开发工具的崛起。
NFL是一种杆状蛋白质,可作为神经元的内部支架。当神经元受损或死亡时,它们会将NFL碎屑释放到脑脊液和血液中。神经科学家长期以来一直推测,NFL的水平可以用来测量大脑健康。大约十年前,研究人员发现了一种准确测量血液中NFL水平的方法后,该标记物的使用在研究实验室和临床试验中获得了关注。3.
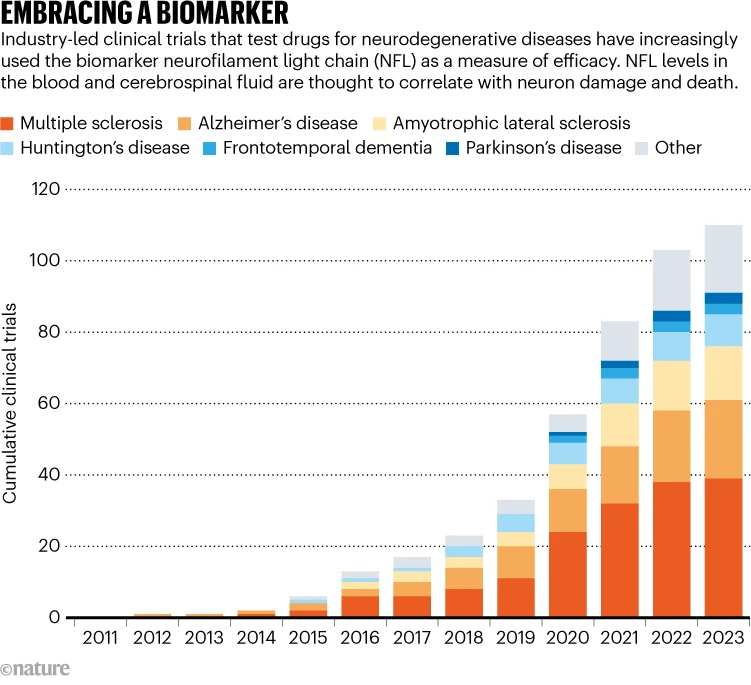
制药公司已将NFL的追踪纳入约100项针对各种疾病的临床试验中,包括阿尔茨海默氏症、帕金森氏症和亨廷顿氏病(参见“拥抱生物标志物”)。但它的测量尚未用于获得监管部门的批准。对于瑞士巴塞尔大学医院的神经学家Jens Kuhle来说,批准tofersen将是“NFL原则的重要证明”。
Kuhle对使用NFL作为工具来确定哪种多发性硬化症药物在哪些患者中表现最佳感到特别兴奋,为“个性化”神经学处方铺平了道路。他推测,有一天,NFL测量可以更广泛地用于识别和跟踪脑损伤,作为常规护理的一部分。“我非常确信,将来当你去看家庭医生时,我们将测量NFL,就像我们测量胆固醇一样。
tofersen是否会缓解或重新激化关于FDA使用加速批准神经药物的争论?
2021 年,FDA 批准了同样由 Biogen 开发的 aducanumab 用于治疗阿尔茨海默病——尽管疗效证据尚无定论,也违背了咨询小组的建议。这种加速的批准使神经科学界分裂,美国国会后来的一项调查发现,它“充斥着违规行为”。批评者不仅质疑aducanumab数据的可靠性,还质疑Biogen为该药物选择超出预算的价格标签。
托弗森的批准申请有重要的区别 - 包括它将影响多少人。在美国,阿尔茨海默病有6百万人。但只有 330 名 SOD1 ALS患者。
这些神经退行性疾病是“不同的野兽”,这意味着它们需要不同的治疗方法,澳大利亚墨尔本弗洛里神经科学与心理健康研究所的神经科学家斯科特艾顿说。Ayton说,罕见疾病需要更多的治疗灵活性,因为当患者数量较少时,更难开展和重复性临床试验。
但是,他补充说,给tofersen开绿灯并非对患者或临床试验生态系统没有风险 。“这些加速批准的意外后果是设计和进行临床试验不当,”他说。在tofersen的案例中,Biogen设计了一项III期试验,该试验时间太短,无法明确评估药物的效果。监管机构、医生和患者现在必须充分利用不确定的数据集。“如果批准的门槛较低,行业将追求较低的门槛,”艾顿说。
“我们确实错过了目标,”Biogen高级医疗总监Stephanie Fradette在咨询委员会询问试验的设计缺陷时说。但由于SOD1 ALS的特殊罕见稀有性,她说该公司的数据集有限,无法指导其试验设计决策。“当然,这不是一个借口,而是承认为什么事情与我们预期的如此不同。”
https://blog.sciencenet.cn/blog-41174-1384591.html
上一篇:工程化皮肤细菌变身癌症疫苗!
下一篇:AI搜索引擎爆发对科研会有价值吗?