博文
【遗传病科普第106期】阿尔兹海默病神经网络受损的新机制-PLD3影响阿尔茨海默病的轴突球状体和神经网络缺陷
||
2022年11月30日,复旦大学与耶鲁大学的研究人员在国际著名期刊Nature上发表了题为PLD3 affects axonal spheroids and network defects in Alzheimer’s disease的文章,发现了阿尔茨海默病中神经网络功能受损的新机制,并提出PLD3可作为治疗AD的潜在分子靶点。
研究背景
阿尔兹海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,其核心症状是记忆减退。AD的两大主要的病理特征为β-淀粉样蛋白(Aβ)沉淀形成老年斑以及tau样蛋白聚集形成神经纤维缠结。目前被广泛认可的AD的发病机制是Aβ级联假说,即Aβ在脑内的累积是驱动AD发病的早期诱发因素,它直接或间接地导致tau病理状态,进而改变神经元功能;神经纤维缠结、神经炎症、神经元损伤或死亡等都是Aβ沉淀所引发的病理改变。然而,Aβ沉积和神经网络障碍之间确切的细胞学机制目前尚不明确。
研究结果
目前对AD的研究,在病因方面,主要集中在突触损伤以及神经细胞的死亡;在治疗方面,主要集中在减少或清除胞外Aβ的沉积。然而,AD的另外一个重要的病理特征--营养不良性神经突--却鲜有研究。营养不良性神经突是在老年斑周围聚集的明显增大的神经元突起,被认为是轴突损伤后的退行性结构。在本研究中,研究人员针对该结构进行研究,并将其命名为斑块相关的轴突球状体(Plaque associated axonal spheroids, PAASs),并发现了损害AD神经网络功能的新机制。
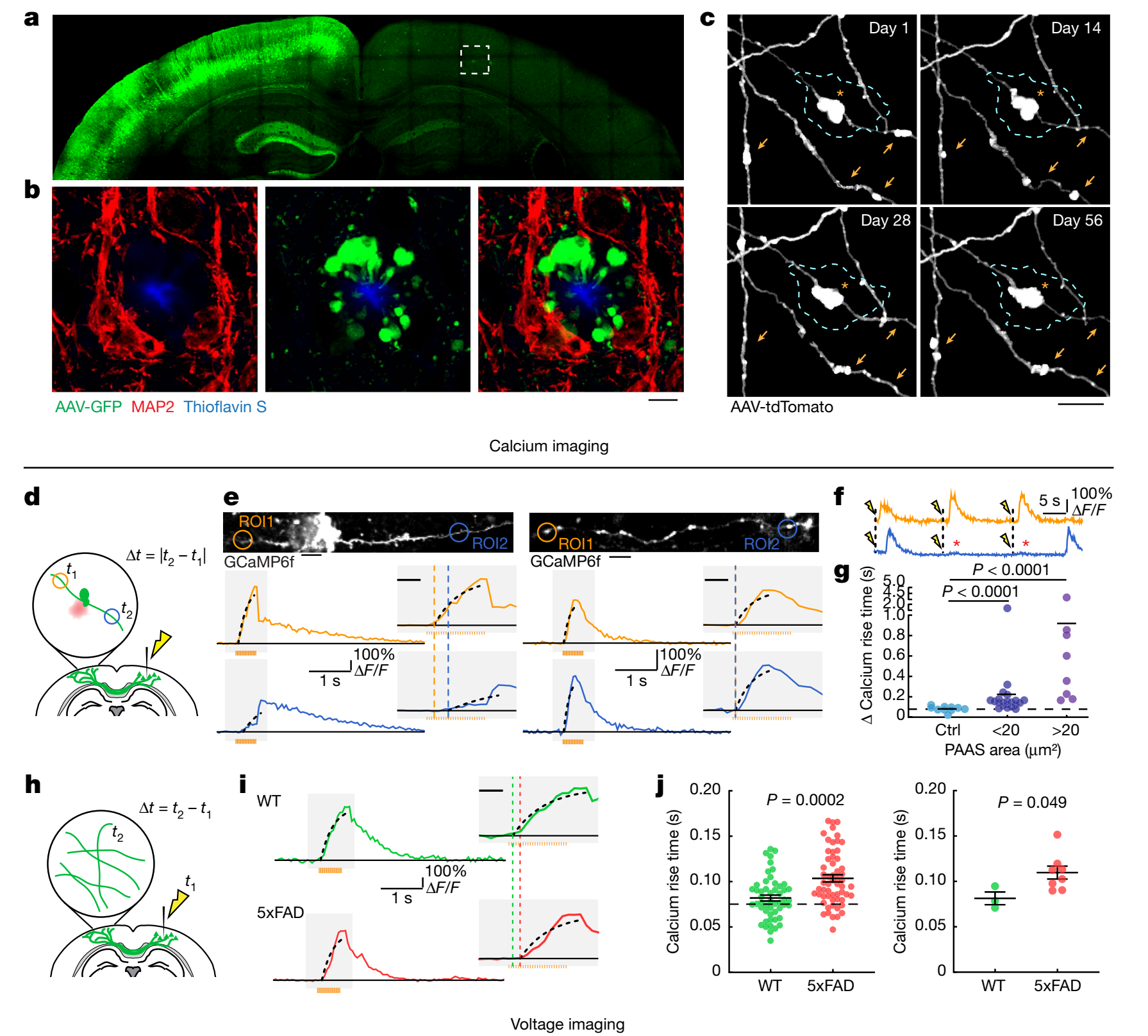
图1. PAASs破坏了动作电位以及大脑半球间的神经传导
5xFAD转基因小鼠可表现出Aβ沉淀的病理特征,是研究AD的一个常用小鼠模型。使用共聚焦成像对5xFAD小鼠单个PAAS的平均体积以及老年斑周围的PAASs晕的总体积进行估算,发现单个老年斑可以影响数百个轴突,提示PAASs可能在神经网络功能障碍中发挥重要作用。对5xFAD小鼠老年斑周围的轴突进行长时程活体双光子成像追踪,发现在长达数月的时间内,大部分PAASs的体积增大,部分PAASs缩小或消失,表明PAASs不是退化的轴突,而是一种稳定的结构,并具有可逆性的潜力。对5xFAD小鼠大脑进行活体钙成像,发现动作电位的破坏程度随PAASs总面积的增大而增加;临近Aβ沉淀的轴突传导功能并未受到影响,而若轴突形成了球状体病变,其两侧中的钙信号则存在明显延迟;大脑半球间的神经传导速度也明显延迟。此外,对死后AD患者的大脑进行分析,与轻度认知障碍的AD患者相比,中度至重度认知障碍的AD患者的每个老年斑周围的轴突球状体平均数量更多,单个PAAS的体积更大。这些数据表明,PAASs参与神经传导缺陷,单个PAAS的大小是决定轴突传导缺陷程度的关键因素。
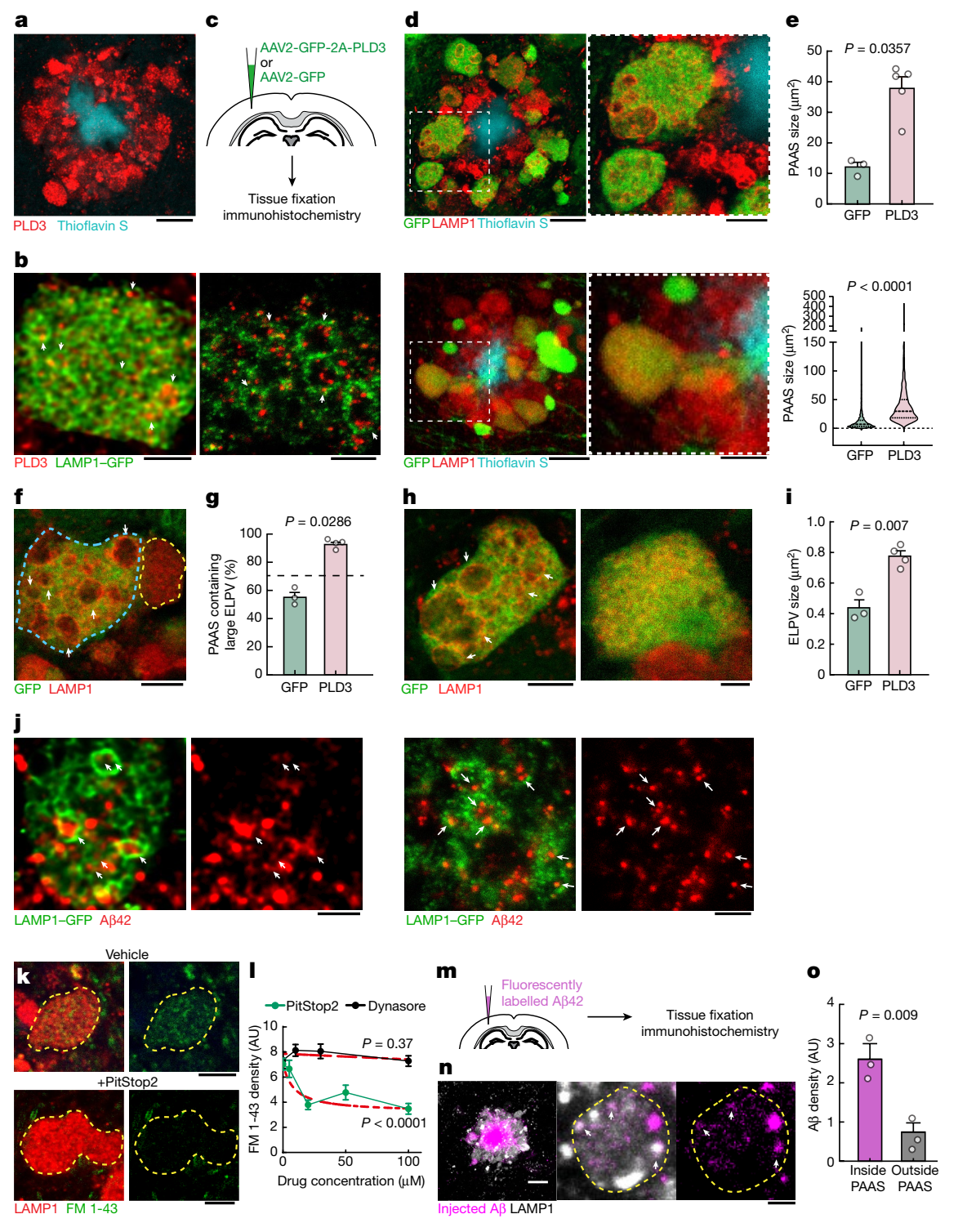
图2. PLD3介导内体性溶酶体和轴突球状体的增大
高分辨率共聚焦成像显示,随着5xFAD小鼠年龄的增长,在轴突球状体内有异常增大的溶酶体相关膜蛋白1阳性囊泡(LAMP1 positive vesicles,ELPVs)逐渐积累,透射电子显微镜成像显示,内体(MVBs)、内体性溶酶体、内吞自噬融合体、自噬溶酶体与ELPVs存在不同程度的重叠;且ELPVs与单个PAAS的大小之间存在明显的相关性。PLD3是种溶酶体驻留蛋白,参与MVB的生成;免疫荧光表明,PLD3蛋白存在于ELPVs中,且在PAASs中也高度富集。研究人员进一步将AAV-PLD3注射到5xFAD小鼠大脑皮层使神经元过表达PLD3,发现ELPVs的大小和数量增加,PAASs的体积也增大。为了进一步评估PLD3对轴突球状体的影响,研究人员使用CRISPR-Cas9技术敲除5xFAD小鼠的PLD3基因,发现ELPVs的丰度明显下降,PAASs的整体体积变小,轴突传导恢复;而老年斑的大小和数量没有任何变化。这些结果表明,PLD3积累引起ELPVs积聚,驱动ELPVs膨大,进而造成神经传导障碍。
结论
总之,本研究发现了一种AD神经网络功能受损的新机制—轴突球状体影响神经传导,为今后系统地研究各种神经系统疾病中的轴突球状体提供了理论和实验框架。此外,由于目前针对减少和清除Aβ沉淀的一系列药物在临床试验并未取得很好的效果,而针对PLD3的处理可以有效缓解小鼠中的神经网络的损伤,提示PLD3可作为治疗AD的有效分子靶点。
参考文献:
1. Alzheimer's disease: the amyloid cascade hypothesis. Science. 1992 Apr 10;256(5054):184-5.
2. PLD3 affects axonal spheroids and network defects in Alzheimer's disease. Nature. 2022 Dec;612(7939):328-337.

欢迎关注
遗传咨询、基因检测和科研合作请联系QQ:710334290
撰文:贾魏珉
编辑:刘振兴
审核:张贤钦
课题组网址 http://life.hust.edu.cn/info/1046/13645.htm
https://blog.sciencenet.cn/blog-3479614-1367346.html
上一篇:【遗传病科普第105期】DNM1外显子10a的新发剪接位点突变导致发育性癫痫性脑病
下一篇:【遗传病科普第107期】TCEAL1功能缺失突变导致X连锁显性神经发育综合征