博文
Mol Cell:吕志民团队揭示PI3Kβ磷酸化OGT调控肿瘤乙酰辅酶A合成及表观遗传修饰
|
磷脂酰肌醇3-激酶 (PI3K) 在多种恶性肿瘤中异常激活,与肿瘤发生发展密切相关。Ⅰ型PI3K是一类由催化亚基p110和调节亚基p85组成的脂质激酶家族,其经典功能是通过磷酸化磷脂酰肌醇-4、5-二磷酸 (PIP2) 生成第二信使磷脂酰肌醇-3、4、5-三磷酸 (PIP3),从而招募并激活AKT等下游效应分子,参与调控细胞生长、增殖、代谢等多种生物学过程。 然而,PI3K是否具有不依赖于PIP3的“非经典功能”以驱动肿瘤进展,此前尚未完全明确。胶质母细胞瘤(GBM)作为恶性程度最高的脑肿瘤,患者中位生存期不足15个月,亟需突破性治疗策略。
2025年3月24日,浙江大学吕志民教授团队在Molecular Cell期刊上发表了题为“PI3Kβ functions as a protein kinase to promote cellular protein O-GlcNAcylation and acetyl-CoA production for tumor growth”的研究论文。该研究首次揭示磷脂酰肌醇3-激酶β(PI3Kβ)通过非经典蛋白激酶活性调控蛋白质O-GlcNAc修饰和乙酰辅酶A代谢,驱动胶质母细胞瘤恶性进展的新机制,并提出联合抑制PI3Kβ与O-GlcNAc转移酶(OGT)的协同治疗策略,为肿瘤精准治疗开辟新方向。
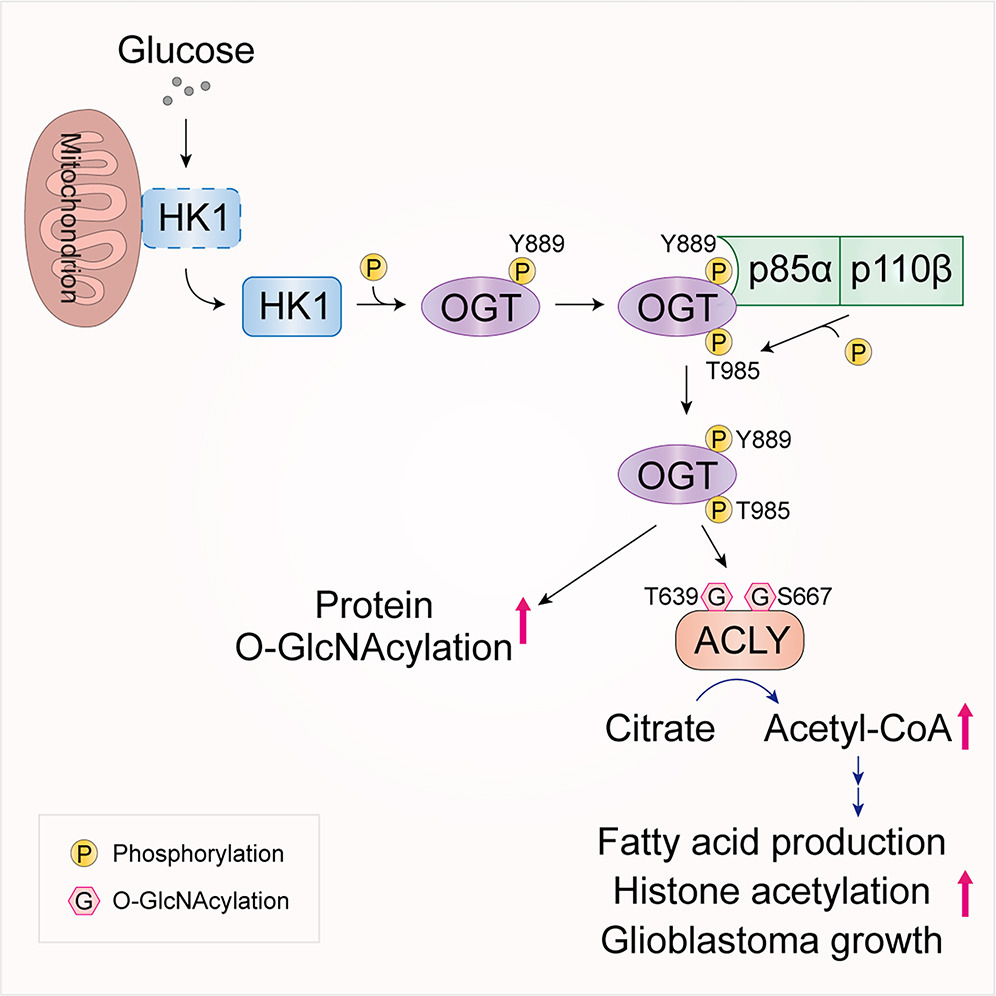
O-GlcNAc转移酶(OGT)是催化蛋白质丝氨酸/苏氨酸残基发生O-GlcNAc糖基化修饰的关键酶。研究团队发现,在胶质母细胞瘤的高葡萄糖微环境(Warburg效应)中,糖酵解关键酶己糖激酶1(HK1)通过其非经典的蛋白激酶活性磷酸化OGT的Y889位点,进而招募PI3Kβ的调节亚基p85α,驱动PI3Kβ与OGT的特异性结合。重要的是,PI3Kβ可作为蛋白激酶磷酸化OGT的T985位点,显著增强OGT催化活性,导致细胞内蛋白质O-GlcNAc糖基化水平整体升高。进一步研究发现,活化的OGT通过催化ATP柠檬酸裂解酶 (ACLY) T639和S667位点的O-GlcNAc糖基化修饰,提升ACLY活性及其产物乙酰辅酶A (Acetyl-CoA) 的合成,从而促进脂肪酸生成,并增强组蛋白H3乙酰化及基因转录。靶向抑制PI3Kβ介导的OGT磷酸化或ACLY的O-GlcNAc修饰,可显著抑制胶质瘤细胞的增殖、脂肪酸生成、组蛋白H3乙酰化及肿瘤生长。此外,PI3Kβ与OGT抑制剂的联合应用展现出协同抗肿瘤效应。本研究不仅揭示了PI3Kβ通过蛋白激酶活性调控O-GlcNAc糖基化、脂肪酸代谢及染色质修饰的非经典功能,更为深入理解PI3K在肿瘤进展中的作用提供了全新视角。
综上所述,该研究揭示了PI3K具有独立于经典PIP3信号的非经典功能,通过其蛋白激酶活性促进肿瘤细胞脂肪酸代谢和表观遗传修饰。这一发现不仅重构了对PI3K功能的传统认知,更揭示了其在调控肿瘤代谢及基因转录中的全新作用模式,为理解PI3K在肿瘤中的复杂角色提供了新的理论框架,并为开发靶向PI3K新功能的精准治疗策略奠定了重要基础。
亮点 Highlights
•HK1 phosphorylates OGT to recruit p85α/p110β
HK1通过磷酸化OGT招募p85α/p110β复合体
•PI3Kβ phosphorylates and activates OGT to enhance cellular protein O-GlcNAcylation
PI3Kβ通过磷酸化并激活OGT增强细胞蛋白质O-GlcNAc糖基化修饰
•OGT O-GlcNAcylates and activates ACLY, resulting in enhanced acetyl-CoA production
OGT介导的O-GlcNAc修饰激活ACLY,促进乙酰辅酶A生成
•Combined treatment with PI3Kβ and OGT inhibitors additively suppresses tumor growth
PI3Kβ与OGT抑制剂联合应用可协同抑制肿瘤生长
摘要 Summary
Phosphatidylinositol 3-kinase (PI3K) phosphorylates PI(4,5)P2 to produce PI(3,4,5)P3, thereby activating AKT and other effector proteins. However, whether PI3K has non-PI(3,4,5)P3-related functions critical for tumor development remains unclear. Here, we demonstrate that high glucose induces PI3Kβ binding to O-linked β-D-N-acetylglucosamine (O-GlcNAc) transferase (OGT) in glioblastoma cells, dependent on hexokinase 1 (HK1)-mediated OGT Y889 phosphorylation and subsequent p85α recruitment. Importantly, PI3Kβ functions as a protein kinase, phosphorylating OGT at T985 and enhancing OGT activity and total cellular protein O-GlcNAcylation. Activated OGT O-GlcNAcylates ATP-citrate synthase (ACLY) at T639 and S667, leading to ACLY activation-dependent acetyl-coenzyme A (CoA) production to increase fatty acid levels and histone H3 acetylation for gene transcription. Intervention in PI3Kβ-mediated OGT phosphorylation and ACLY O-GlcNAcylation inhibits glioblastoma cell proliferation and tumor growth in xenografts. These findings underscore the critical role of PI3Kβ in governing protein O-GlcNAcylation, fatty acid metabolism, and chromatin modification through its protein kinase activity and provide instrumental insight into the roles of PI3K in tumor progression.
磷脂酰肌醇3-激酶(PI3K)通过磷酸化PI(4,5)P2生成PI(3,4,5)P3,从而激活AKT等下游效应蛋白。然而,PI3K是否具有与PI(3,4,5)P3无关的、对肿瘤发展至关重要的功能仍不清楚。本研究发现,在胶质母细胞瘤细胞中,高糖环境通过己糖激酶1(HK1)介导的OGT Y889位点磷酸化及后续p85α招募,诱导PI3Kβ与O-连接的β-D-N-乙酰葡萄糖胺转移酶(OGT)结合。重要的是,PI3Kβ发挥蛋白激酶功能,通过磷酸化OGT T985位点增强OGT活性及整体细胞蛋白的O-GlcNAc修饰水平。被激活的OGT在T639和S667位点对ATP-柠檬酸合酶(ACLY)进行O-GlcNAc糖基化修饰,从而促进ACLY依赖的乙酰辅酶A生成,这既能增加脂肪酸水平,又能通过组蛋白H3乙酰化调控基因转录。通过干预PI3Kβ介导的OGT磷酸化和ACLY的O-GlcNAc修饰,可有效抑制胶质母细胞瘤细胞增殖及异种移植模型中的肿瘤生长。这些发现不仅揭示了PI3Kβ通过其蛋白激酶活性在调控蛋白质O-GlcNAc修饰、脂肪酸代谢和染色质修饰中的核心作用,更为深入理解PI3K在肿瘤进展中的多重功能提供了重要理论依据。
DOI:https://doi.org/10.1016/j.molcel.2025.02.024
原文链接:https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00186-8
https://blog.sciencenet.cn/blog-446272-1479252.html
上一篇:[转载]朱波、石嵘、姚刚、张旭、陈孝平、王红阳院士:临床问题驱动的肿瘤研究新范式
下一篇:2025年璧山团建--赏油菜花