博文
深度睡眠有助于心脏愈合  精选
精选
|
深度睡眠有助于心脏愈合
在心脏病发作后,免疫细胞被招募到大脑中以诱导睡眠,这抑制了心脏的炎症并帮助恢复。但如果睡眠受到干扰,过度的炎症会恶化心脏功能并延缓愈合。
过去20年里,研究睡眠如何影响身体、精神和认知健康的热潮涌现。结果表明,睡眠具有恢复功能,包括修复受损的组织和细胞,以及减少体内的炎症。Huynh等人在《自然》杂志上发表的研究揭示,被称为单核细胞的免疫细胞在心脏病发作后被招募到大脑,以改善睡眠。这种心脏病发作后的睡眠提高了心脏功能,限制了心脏的炎症并促进了愈合。
Huynh及其同事观察到,心脏损伤增加了“慢波”睡眠,也称为深度睡眠。这种类型的睡眠特征是大脑中电活动的缓慢、同步振荡,是一个身体进行必要修复和恢复过程的时期。作者识别出身体和大脑中几种检测心脏损伤并将炎症细胞招募到大脑以促进慢波睡眠的机制。睡眠的增加限制了交感神经系统的活动(负责战斗或逃跑反应的系统),降低了心率和血压以促进愈合。值得注意的是,在心脏病发作后打断慢波睡眠会增加大脑和心脏中的炎症,导致心脏功能和恢复受损(图1)。
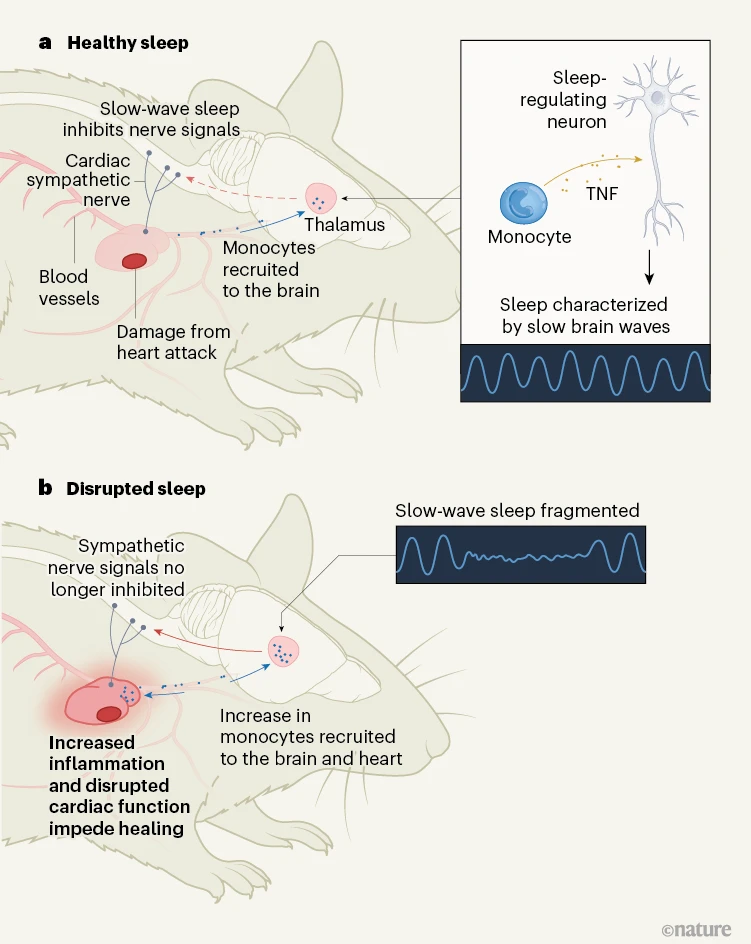
图1 | 心脏病发作后睡眠在恢复中的作用。a, Huynh等人发现,在小鼠中,心脏病发作引起的心脏组织损伤触发了免疫细胞(单核细胞)被招募到大脑。在这里,单核细胞被重新编程以释放一种称为肿瘤坏死因子(TNF)的促炎蛋白。TNF作用于调节睡眠的神经元,诱导深度或“慢波”睡眠,其特征是大脑中电活动的缓慢、同步振荡。这种恢复性睡眠限制了来自交感神经系统对心脏的信号,这抑制了炎症并促进了愈合。b, 当睡眠被打断时,交感神经信号不再被抑制,并且招募到大脑和心脏的单核细胞增加。过度的心脏炎症通过破坏心脏的正常节律损害心脏功能,并恶化恢复结果。
炎症和睡眠受到严格调控,众所周知,炎症介质如被称为细胞因子的信号蛋白影响慢波睡眠。Huynh及其同事发现,心脏病发作后发生的心脏损伤被大脑的免疫细胞检测到,这触发了血液中循环的单核细胞迅速前往大脑产生促进睡眠的细胞因子。在小鼠中,心脏病发作导致大脑中单核细胞的数量增加了一倍多。同样地,在死于心脏病发作的人的大脑中,单核细胞的数量取决于心肌损伤的程度。
为了检查心脏病发作后被招募到大脑的单核细胞的活动,作者使用了一种称为单细胞RNA测序的技术来分析单个脑细胞中的RNA表达。他们发现,大脑中的单核细胞展现了一种特定的基因表达模式,通过一种称为肿瘤坏死因子(TNF)的细胞因子促进了炎症信号传递。研究揭示了TNF与睡眠之间的强烈联系,特别是与慢波睡眠的联系。例如,将TNF注射到调节睡眠的大鼠大脑区域会增加慢波睡眠。Huynh及其同事发现,TNF作用于小鼠大脑中的促进睡眠的神经元,并且关键地,通过药理学或遗传干预阻止单核细胞招募或TNF产生消除了心脏病发作后睡眠的增加。
研究人员接下来调查了心脏损伤后炎症诱导的睡眠的生理相关性。立即在使小鼠经历心脏病发作后,作者允许一组小鼠不受打扰地睡觉,而故意打断另一组小鼠的睡眠。打断睡眠减弱了心脏功能并降低了心率变异性(心跳间隔时间的自然波动),并且睡眠被打断的小鼠比未受打扰睡眠的小鼠显示出更差的心血管健康和恢复结果。
这一发现通过对一组患有急性冠状动脉综合症的人的数据进行验证——这是一个用来描述血流到心脏受限或阻塞的各种短期状况的术语。在急性冠状动脉综合症发生几周后的健康睡眠支持了心脏愈合并改善了整体恢复。这些发现共同表明,不间断的睡眠对心脏病发作后的心脏恢复至关重要。除了心脏外,Huynh及其同事的研究可能为其他类型的伤害或感染如何导致单核细胞被招募到大脑以增加慢波睡眠和促进愈合提供了见解。
作者的结果暗示,心脏病发作后的大脑炎症促进了恢复性睡眠并有助于恢复,但炎症在何种程度上是有益的尚不清楚。尽管炎症诱导的睡眠支持短期恢复,但慢性免疫激活和过度炎症可能对健康有害。例如,长时间高水平的TNF可以削弱心肌并增加受伤后进一步损害心脏的可能性。作者没有特别检查大脑中过度产生TNF是否会损害心脏健康,需要进一步研究来确定何时心脏病发作后的炎症从有益转变为有害。
这项工作还提出了关于睡眠和炎症中的性别差异的问题,这些问题需要进一步调查。由于雄性小鼠遭受心脏病发作的存活率低,大多数实验仅使用了雌性小鼠。然而,雄性和雌性小鼠在正常条件下表现出不同的睡眠模式,并对炎症挑战如伤害或感染做出不同反应。此外,在心脏病发作后观察到小鼠心脏功能的性别相关变化。性别如何影响Huynh及其同事结果的临床应用尚未确定。
尽管关于炎症平衡和性别特异性差异的问题仍然存在,但作者的发现强烈支持优质睡眠对整体恢复无价之见。整合定期睡眠评估和睡眠卫生实践(可以帮助促进健康睡眠的行为,如如减少咖啡因摄入量和有一个固定的睡眠时间表)纳入临床护理,对于改善心脏病发作后的康复和促进愈合至关重要。
https://blog.sciencenet.cn/blog-41174-1457856.html
上一篇:富氢水减轻睡眠呼吸暂停模型鼠血管损伤【加拿大硕士论文】1
下一篇:多吃容易导致糖尿病,根源竟然在大脑!