博文
细胞周期的反向制动器  精选
精选
|
在细胞周期中,癌细胞的DNA含量常常异常,这是因为控制细胞周期的途径被打乱了。细胞在响应称为有丝分裂原的小肽信号时进入细胞周期,这些信号确保细胞进入S期进行DNA复制。一旦S期开始,细胞周期通常能够自我维持且不可逆转。然而,在某些情况下,可以发生两轮连续的DNA复制而不伴随细胞分裂(内复制),导致全基因组倍增。McKenney等人在本期刊的第525页上报告说,在延迟的G2期,通过细胞周期蛋白依赖性激酶4和6(CDK4/6)的有丝分裂信号充当至关重要的反向制动器,防止细胞滑回到G1状态并重新启动S期。鉴于有丝分裂信号通路经常成为癌症治疗的靶点,这一发现可能对癌症治疗具有广泛影响。
通过CDK4/6的有丝分裂信号通过视网膜母细胞瘤蛋白(RB)的磷酸化启动S期进入,这反过来激活了一个涉及E2F转录因子和CDK2的正反馈循环。为了确保在一个细胞周期内只复制一次基因组,泛素连接酶、后期促进复合体或环体-CDH1(APC/CCDH1)充当双稳态开关,标记了DNA复制启动的不归点(2)。APC/CCDH1在G1期间活跃,允许招募解旋酶和其他为DNA复制起点授权所需的因子。一旦S期开始,由于CDK2和早期有丝分裂抑制剂1(EMI1)的活动,它就被保持不活跃直到有丝分裂,EMI1是有丝分裂信号通路的靶标。当APC/CCDH1不活跃时,复制起点不能重新授权。然而,在S期或G2期间的DNA损伤可以触发p53依赖性的CDK2失活和APC/CCDH1的过早再激活(3)。这通常导致p53依赖性的衰老或凋亡,尽管一部分细胞可以逃避阻滞并重新授权其DNA以重新启动细胞周期,从而导致全基因组倍增(4)。
防止全基因组倍增的反向制动器
有丝分裂信号对于维持延迟的G2期至关重要。各种类型的短暂应激都可以引起这种延迟。如果在G2期间CDK4/6被失活,这种延迟会导致细胞周期的重新开始和全基因组复制。染色体内容:2C,正常的二倍体细胞;4C,四倍体细胞;8C,八倍体细胞。
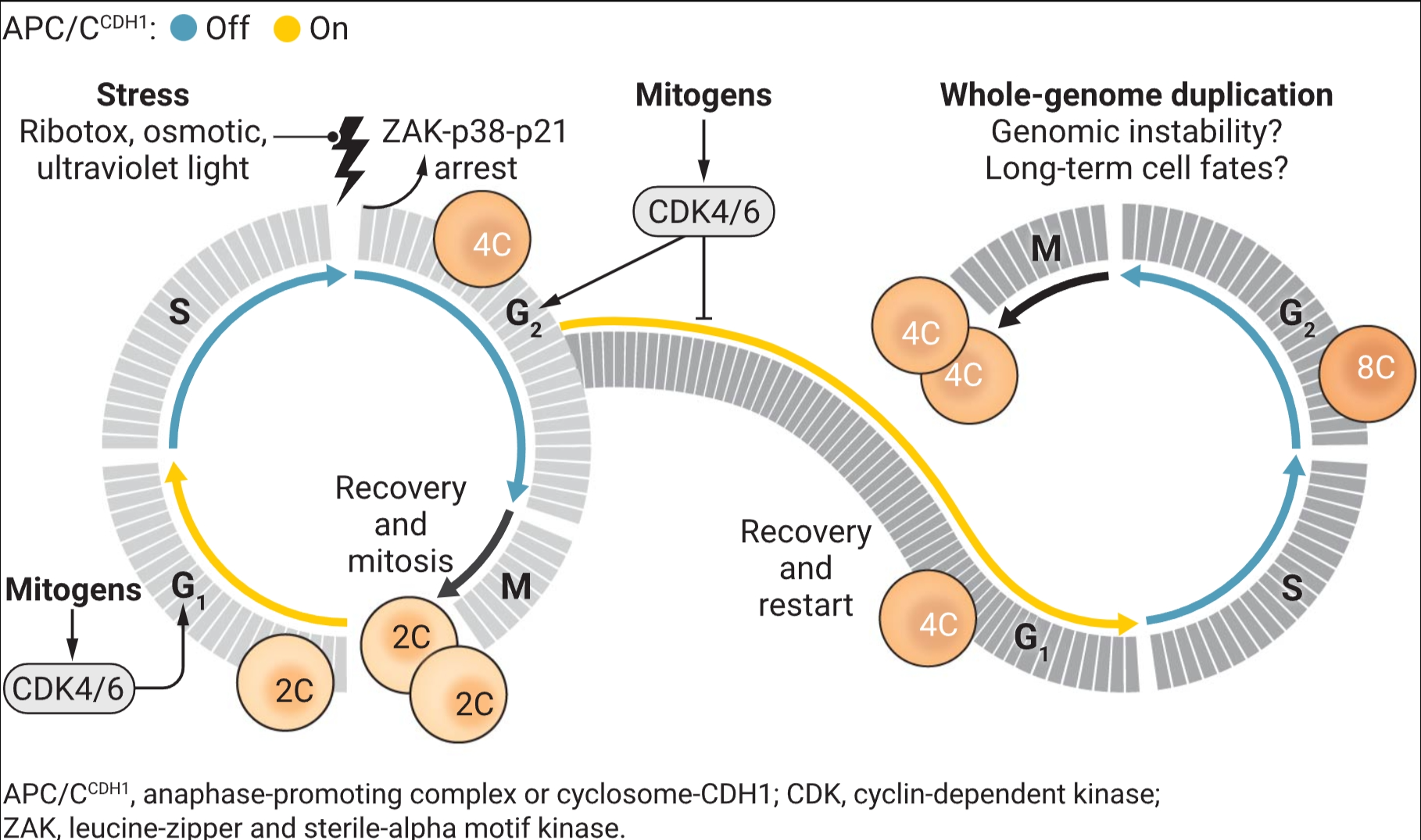
McKenney等人展示了类似的由压力驱动的全基因组倍增事件也可以完全独立于p53发生。在循环细胞中诱导短暂压力,使用核糖体抑制剂anisomycin、紫外线(UV)照射或渗透压应激诱导剂sorbitol,导致了G2期的阻滞和APC/CCDH1的重新激活。这种效应是通过与压力相关的蛋白激酶(SAPK)信号传导,通过亮氨酸拉链和不育α基序激酶(ZAK)和p38激酶介导的,因为ZAK的遗传缺失或药理学抑制ZAK或p38消除了这种过早的APC/CCDH1重新激活。p53通过转录激活CDK抑制蛋白p21来介导G2期APC/CCDH1重新激活的经典机制。然而,McKenney等人展示了SAPK信号可以绕过p53直接激活p21(见图)。该机制尚未完全阐明,但先前的工作表明p38可以磷酸化并因此稳定p21(5)。值得注意的是,经历SAPK依赖性的G2期阻滞的细胞亚群可以重新进入细胞周期,开始新一轮的S期,从而变成四倍体。
为了以单细胞分辨率监测这些全基因组倍增事件的动态,McKenny等人开发了一种创新的荧光报告器,它作为APC/CCDH1、cyclin A-CDK1和cyclin A-CDK2活性的生物传感器。通过在人类细胞系中共表达这个新报告器和现有的CDK4/6活性(6)和CDK2活性(7)的生物传感器,可以在单个细胞内同时跟踪主要CDKs的活性。有了这些工具,McKenney等人展示了在一个未受干扰的细胞周期中,cyclin A-CDK1和cyclin A-CDK2的活性足以在G2期间保持E2F的活跃和APC/CCDH1的不活跃。然而,当SAPKs抑制CDK1/2时,有丝分裂原诱导的CDK4/6活性维持足够的E2F依赖性转录,使APC/CCDH1在几个小时内保持不活跃。CDK4/6活性是维持一个延长的G2期并有可能进入有丝分裂所必需的。相应地,当G2期因cyclin A耗尽而延迟时,CDK4/6抑制剂palbociclib导致了大量的APC/CCDH1重新激活。随后洗掉palbociclib导致出现了大量具有8C DNA含量的细胞群体,这表明发生了全基因组倍增。
McKenney等人的工作补充了最近的一项研究,该研究表明在缺乏有丝分裂原信号和CDK4/6的情况下,向有丝分裂进展的2小时延迟可以在G2期间导致APC/CCDH1的过早重新激活(8)。此外,CDK2的抑制被证明可以迅速由CDK4/6补偿,以维持S期的进展(9)。结合这些研究,McKenney等人的工作表明,在S期和G2期间的CDK4/6活性可以补偿其他CDKs的损失,以维持细胞周期的进展并防止滑回到第二个S期。
全基因组倍增是癌症发展的标志性事件,可能导致染色体不稳定并恶化各种癌症类型的预后(10)。p53是阻止全基因组倍增后增殖的基因组稳定性的关键守门员。发现SAPK信号和CDK4/6抑制可以使细胞准备进行全基因组倍增,意味着四倍体和基因组不稳定细胞克隆生长的风险,特别是在p53突变的癌症中。鉴于CDK4/6抑制现在是雌激素受体阳性乳腺癌的标准治疗方法(11),研究这些抑制剂是否可能在患者中促进不希望的全基因组倍增事件和基因组不稳定性是很重要的。要回答这些问题,将需要创新的方法来体内追踪CDK4/6活性受到干扰的G2期间产生的四倍体细胞的长期命运和克隆生长。
https://blog.sciencenet.cn/blog-41174-1432511.html
上一篇:第一只使用药用植物的野生动物
下一篇:注意论文工厂的升级版