博文
微压氧到底有没有作用?
|
微压氧到底有没有作用?
最近微压氧市场开始活跃,这种吸氧的方式是介于高压氧和空气之间的一种。从业者往往对氧气和高压生理学缺乏了解,导致非常多夸大宣传等混乱。我个人认为,开发这种吸氧模式有一定价值,甚至有必要鼓励,但是需要建立统一的规范和标准,特别是吸氧方法和程序等细节,否则可能会浪费消费者时间和资源,导致得不偿失的境地。不仅没有用处,还额外增加了风险。关于这种方式产生生物学效应的可能性,我最近从文献中查找的资料,以提供其效应解释。
Nisa BU, Nakanishi R, Tanaka M, Lin H, Hirabayashi T, Maeshige N, Kondo H, Fujino H. Mild Hyperbaric Oxygen Exposure Enhances Peripheral Circulatory Natural Killer Cells in Healthy Young Women. Life (Basel). 2023 Feb 1;13(2):408.
Cannellotto M, Yasells García A, Landa MS. Hyperoxia: Effective Mechanism of Hyperbaric Treatment at Mild-Pressure. Int J Mol Sci. 2024 Jan 8;25(2):777.
Takemura A. Exposure to a mild hyperbaric oxygen environment elevates blood pressure. J Phys Ther Sci. 2022 May;34(5):360-364. doi: 10.1589/jpts.34.360. Epub 2022 May 1.
高压氧治疗(HBOT)增加了血液中溶解氧气的比例,产生高氧状态。这种增加的氧气扩散进入线粒体,线粒体消耗了吸入氧气的大部分,并构成了HBOT效应的中心。通过这种方式,进入线粒体的氧气可以逆转组织缺氧,激活电子传递链产生能量。此外,间歇性HBOT被细胞感知为相对缺氧,诱导细胞反应,如激活HIF-1α途径,进而激活包括血管生成和炎症在内的多种细胞过程。这些效应被用于治疗各种病理。本综述总结了证据表明,使用中等压力HBOT可以产生高氧状态并激活能够产生上述效果的细胞途径。将中等压力HBOT作为不同病理的直接或辅助治疗的可能性可能会带来益处,有可能导致未来治疗学的变革性进展。
1前言
氧气是细胞有氧代谢的基本组成部分。它通过对流进入呼吸通路和血管,然后通过毛细血管壁扩散到间质,最终到达线粒体,在那里参与细胞呼吸。
氧气不仅作为需要氧气补充的患者的治疗剂使用,还被视为一种能够诱导目标临床反应的药物,如高压氧疗法(HBOT)[1]或利用“常压氧悖论”或“高低氧悖论”进行治疗[2,3]。这些效果可能因使用的压力、氧气暴露持续时间以及针对各种病理的不同疗程而有所不同。因此,有必要标准化这些参数,并根据患者的具体需求来描述反应。
本综述的目的是证明,使用1.5大气压进行的高压治疗可以在血液和组织中增加氧气,影响细胞代谢,并为各种病理的治疗产生有益效果。
2. 高氧
高氧定义为组织和血浆中的氧气浓度高于正常水平。术语“高氧”在科学语言中广泛使用,单词“HYPEROXIA”在Pubmed Central (PMC)-nih.gov上有23,957篇文章记录,在PubMed-nih.gov上有9541篇出版物记录。鉴于其临床相关性,这个概念也在ClinicalTrials.gov上报告的243项临床研究中得到广泛应用。
高氧可以在个体接受氧气补充(氧气疗法)的情况下实现,无论是在常压还是高压条件下。常压氧气补充通过面罩输送,用作各种医疗条件的疗法。高压氧疗法(HBOT)涉及在高于正常大气压(在海平面,1.0绝对大气压或atm)的压力舱内呼吸高浓度的氧气(O2)(约100%)。对于临床使用,根据2019年第14版《潜水与高压医学会指南》所述,压力必须至少为1.4 atm。高氧是通过这些治疗获得有益效果的原因因素[4]。
氧气稳态
氧气对所有需氧生物至关重要。常氧状态定义为正常氧化条件,对生理过程的适当执行是必需的。 线粒体中的氧气水平非常低,因此即使是小的变化也会成为代谢信号的强有力触发因素。线粒体在氧气利用中发挥核心作用,因为细胞呼吸在那里发生。ATP作为细胞的能量来源是从葡萄糖产生的,氧气在呼吸链中充当最终电子受体。在这个过程中会产生少量的活性氧种(ROS),这些分子能够与其他分子反应。 在高压氧治疗期间的高氧状态可以提高ROS的产生。最近,已经证明HBOT会诱导ROS的增加,其动力学特征与1.4 ATA和2.5 ATA时的血浆活性氧种相似。峰值产生在大约2小时达到,并在基线水平以上持续48小时[5](见图1)。

图1. 60分钟氧气吸入后,温和(1.4 ATA, n = 6)或高压力暴露(2.5 ATA, n = 8)后ROS(血浆)产生的百分比变化。图例中显示了氧气水平。结果以对照值的平均百分比变化表示(*: p < 0.05, **: p < 0.01, ***: p < 0.001, **: p < 0.0001;RM-ANOVA和Dunnet's post hoc检验)。
ROS的影响可以通过NRF2的作用来平衡,NRF2是一个调节抗氧化反应的转录因子[3](见图2)。
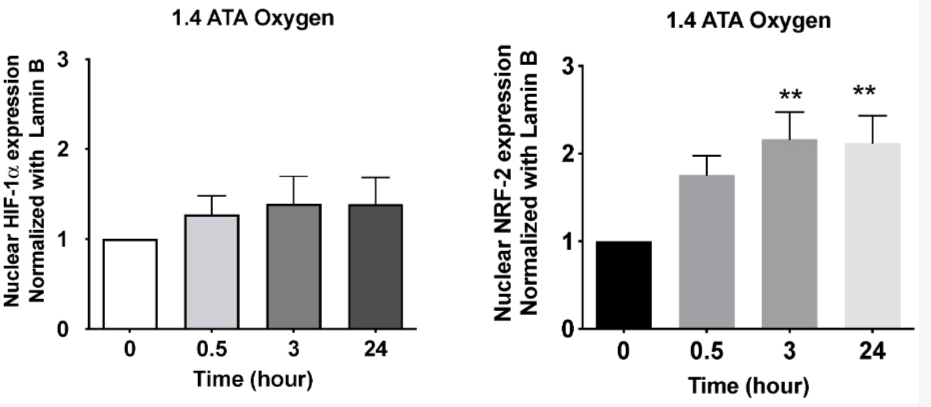
图2. 1小时高压高氧后,1.4 ATA高氧条件下人类受试者(N = 6)在恢复到常氧条件前后HIF-1α和NRF-2核转位情况。结果以与基线(0)相比的倍数变化(均值±SEM)表示,基线设为1。 p < 0.01;采用单因素ANOVA继以Dunnett's post hoc检验(修改自Fratantonio等人(2021) [6])。 其响应的大小和持续时间也取决于应用的氧气剂量,如Fratantonio等人所提议(Fratantonio等人, 2021)[6]。
当细胞内氧过多,内源性抗氧化系统受到破坏时,就会触发氧化应激。这可能导致脂质、蛋白质和DNA的损伤。此外,众所周知,氧化应激、炎症、免疫系统和新陈代谢是相互联系的。在这种情况下,ROS被用作某些炎症细胞因子信号级联的一部分,有助于慢性炎症疾病的发展与/或进展[7]。 相反,如果组织持续缺氧(氧缺乏),组织可能会发展出低氧血症应激,这可能导致器官功能障碍和永久性功能损害,如急性高山病[8,9]所见。为了防止这种损害,缺氧作为细胞基因表达的关键诱导因素,促进各种过程,如细胞保护和修复、血管生成、干细胞增殖和分化等。大多数诱导的基因表达是由称为HIF-1(缺氧诱导因子1)的转录因子指导的。在常氧条件下,由于细胞代谢产物ROS的存在,HIF-1水平降低,因为它们促进它们的降解。在缺氧情况下,产生的ROS较少,导致HIF-1稳定,转移到细胞核,并促进约200个对适应低氧条件至关重要的基因表达。这些基因包括用于ATP合成的糖酵解酶、VEGF以诱导血管生成、iNOS(诱导型一氧化氮合酶)以及其他增强组织氧合的因素。HIF-1还与其他过程相关,如通过SIRT1进行的线粒体生物发生和衰老[2]。
4. 高压氧疗法(HBOT)
在某些情况下,高压氧疗法是主要的治疗方式,而在其他情况下,它作为手术或药物干预的辅助手段[10]。
高压氧疗法使用不同类型的舱室进行。多舱室可同时容纳多达约20名患者接受治疗。这些舱室用压缩空气加压,并通过覆盖鼻子和嘴巴的面罩或包裹整个头部的头罩给予100%氧气。舱室内的空气和温度都经过仔细地调节和控制。这些舱室允许重症监护设备的进入和医务人员的在场。
单体舱是最常使用的类型。这些舱室可以用接近100%的氧气加压,患者直接从舱室环境中呼吸氧气。它们也可以用压缩空气加压,而患者通过面罩、头罩或气管内管呼吸接近100%的氧气。这种类型的舱室提供了单独的患者管理(隔离,适用于感染),使患者易于观察。不需要特殊的减压程序。比多舱室更经济。需要的空间比多舱室少。需要的操作简单。单体舱的设计非常适合照顾不需要医务人员在舱室内的患者。大多数身体功能可以从外部监控,包括呼吸机,可以从舱室外部控制。
4.1. 高氧治疗的基础
HBOT的主要生理效应是产生高氧状态,这允许血液中的氧气更多地溶解在血浆中,这个过程不依赖于血红蛋白[11]。氧气供应链从肺部开始,在那里它通过呼吸通道和血管的对流输送。然后它通过毛细血管壁扩散到间质,最终到达线粒体[2]。
在血液中,氧气以两种形式运输:一部分与血红蛋白结合,一部分自由溶解在血浆中。根据亨利定律,溶解的氧气量与特定温度下氧气分压成比例[12]。因此,在较高的部分气压下,它倾向于从气态转变为液态,反之当溶于血浆中的气体压力降低时,则发生相反的情况。
此外,我们应该考虑到我们正常呼吸的空气由78%的氮气、21%的氧气和其他微量气体组成。根据道尔顿定律,混合气体的总压力等于各气体分压的总和。这意味着在海平面上,1 ATA(绝对压力),大气中的氧气分压为159.6 mmHg。在1.5 ATA(绝对大气压)下暴露于纯氧气会导致1140 mmHg的氧气压力。吸入氧气压力的增加导致肺泡氧气压力增加,当在1.5 ATA的高压舱中呼吸100%氧气时,肺泡氧气压力达到1053 mmHg,相比之下,在1 ATA下呼吸空气时为102 mmHg,意味着它增加了10倍。
在正常的大气压下,只有有限的吸入氧气溶解在血液中,但在HBOT中使用的更高压力下,可以溶解足够的氧气来满足身体通常的需求。与此一致,Jain等人描述说,随着压力的增加,动脉氧气压力也会增加,这样理想情况下,在1.5 ATA下呼吸100%氧气会导致动脉氧气与正常条件下(在1 ATA下呼吸空气)相比增加10倍,证明了在1.5 ATA下的HBOT产生的高氧状态[13]。Ishihara等人也报道了使用中等压力HBOT时溶解氧气的增加[14]。
在高压环境下呼吸100%氧气会增加组织氧张力。溶解氧气扩散到组织中遵循Krogh数学模型[15]。使用Krogh模型,基于毛细管半径以及动脉和静脉端点,解释了径向和纵向压力梯度(PpO2)的存在。结合这些变量,该模型允许预测组织中的PpO2。通过在一个环境压力为1.45 atm的环境中给予接近100%浓度的O2,氧气从毛细血管到组织的穿透半径大约为~75 µm,使得能够实现大约950 mmHg的动脉PpO2。这个压力足以确保通过氧气从血浆扩散和渗透到所有细胞,为全身所有组织提供足够的氧气供应。因此,在1.5 ATA下,实现了并远远超过了支持细胞功能所需的最小平均穿透半径(~40 µm)的最小所需PpO2(20 mmHg)。Holbach等人证明,在1.5 ATA下的HBOT增加了动脉PO2和脑脊液氧压[16]。
将患者接受HBOT治疗后组织氧水平的增加已经得到广泛证实[17,18]。即使在HBOT产生的血管收缩之后,这种增加仍然持续,因为它并不阻碍组织部分氧气压力的提升[18]。
此外,在暴露于1.5 ATA的高压治疗的大鼠大脑中,也已经证实了组织高氧状态[19]。这些结果在Rockwold及其同事的临床研究中得到了确认,他们展示了HBOT在1.5 ATA下显著提高了患者大脑中的组织氧合[20]。这些发现也在二期临床试验中得到了复制,证明了在该压力下产生的高氧状态[21]。此外,通过HBOT在1.5 ATA下实现的组织氧合的增加能够提高脑损伤后大脑组织中的ATP和NAD+水平,这意味着高压氧供应在治疗一小时后可以恢复线粒体功能。这些效果伴随着海马区神经元细胞损失的减少,有助于改善认知恢复[19]。
Niza等人观察到,在1.4 ATA下,通过高氧引起的副交感神经激活,HBOT增加了外围组织毛细血管的血流量[22]。
已经证明,使用单体舱在1.5 ATA下进行的HBOT引起的组织氧的增加产生了细胞反应,正如Fratantonio等人所描述的。他们报告说,在1.5 ATA下对健康个体诱导的高氧状态导致调节与氧波动相关细胞反应的转录因子表达增加。此外,还观察到谷胱甘肽和MMP9(基质金属蛋白酶9)的增加,表明治疗引起了氧化应激。这些观察突显了由高氧状态在1.5 ATA下引发的转录因子介导的细胞反应[6]。
Leveque等人描述了健康患者在1.5 ATA和2.5 ATA下接受1小时高压氧暴露后,最多48小时内ROS的动力学。该工作证明了由于在1.5 ATA下产生的高氧状态引起了ROS的显著增加,以及抗氧化机制的激活。ROS的动力学和达到的水平与在2.5 ATA下接受HBOT的组相当。同样,观察到两种压力下的抗氧化剂的动力学和水平相当,而免疫调节效应则根据剂量而有所不同[5]。
Bosco等人的研究也描述了HBOT后ROS和抗氧化剂的增加。他们观察到这些参数在相同压力下进行的20次每日HBOT会议期间保持升高。在1.5 ATA下,直到第7天,两个压力之间的ROS水平保持相当,并在完成20次会议后恢复正常,而在2.5 ATA下它们继续升高。这与具有相同动力学的抗氧化化合物的增加相伴,即使在完成治疗后一个月,也表明还原态的氧化还原平衡发生了转变[23]。这使我们得出结论,在1.5 ATA下,有一个明确的抗氧化作用占主导地位,超过了氧化应激,这种氧化应激在完成测试的20次会议后一个月仍然保持升高。此外,还观察到了抗炎作用,通过IL-6和miRNA表达的降低来证明,这与显示促炎细胞因子减少和血红蛋白增加的其他研究结果一致。这些结果表明,在1.5 ATA下产生的间歇性高氧状态导致由于组织氧增加而产生的ROS增加,以及有助于抗氧化、抗炎和增加血红蛋白效果的细胞反应,在没有肾损伤的安全背景下[24,25]。
间歇性高氧对于炎症、氧化应激等过程的影响可以通过所谓的“常压氧悖论”或“低氧-高氧悖论”现象来解释[2,26],这取决于使用的压力。然而,重要的是要考虑到常压和高压间歇性暴露都会产生相同的反应。这个悖论在2006年被提出,当时作者观察到间歇性高氧/常氧暴露诱导了促红细胞生成素(EPO)的合成。本质上,在高氧环境中,溶解的氧气更多,导致ROS的增加。适应性反应诱导抗氧化蛋白(清除剂)的增加来中和增加的ROS,防止活性物质对DNA和其他细胞过程造成损害。当回到常氧状态时,氧气和ROS水平正常化,但清除剂活性在较长时间内保持高水平。当重复高氧暴露时,由于清除剂的半衰期比ROS长,ROS/清除剂比率较低。这导致ROS减少,因此,在蛋白酶体中HIF(低氧诱导因子)的降解减少,更多的活跃HIF进入细胞核促进EPO、VEGF、sirtuins等的转录,导致像低氧一样的效果(血管生成、细胞再生等)。换句话说,细胞将间歇性高氧感知为一种低氧状态,促进由HIF诱导的细胞过程,但在常氧条件下进行。
高压氧在1.5 ATA对免疫系统的影响已被多位作者研究,他们观察到毛细血管中的血流量增加[22]。如前所述,U Nisa和同事最近证明,IL-6和IL-12没有变化,表明该治疗对在半压下接受HBOT的健康女性具有抗炎作用。作者还报告说,副交感活动增加,自然杀伤细胞(NKC)增加,表明这些参与早期免疫的细胞的动员和增殖增加[27]。换句话说,在健康女性中,1.5 ATA下产生的高氧具有抗炎作用。
4.2 由HBOT产生的高氧的生理效应
4.2.1. 逆转低氧
高压氧恢复了线粒体功能和细胞呼吸。高氧维持线粒体膜电位并增加ATP产生[28,29]。HBOT提供了组织灌注交换能力,由于氧气扩散的增加实例,这与所有其他氧疗方法不同。在这方面,对于临界COVID-19患者的低氧血症,1.4–2.0 ATA的HBOT治疗继续是一个有前景的途径[30]。Cannellotto等人证明,在1.45个大气压的压力下,COVID-19患者接受高压氧治疗可以显著加快解决低氧问题的速度,与对照患者相比[31]。
4.2.2. 非低氧性血管收缩
HBOT产生的增加的氧气可用性引起健康组织中的小动脉和毛细血管的血管收缩,不会损害氧合,有利于血流重定向至灌注不足的区域。产生的血管收缩被称为“非低氧性”,因为它不会抵消高氧的效果或加深缺血或灌注不良组织的低氧。通过α-肾上腺素受体由中枢神经系统介导的血管收缩,可减少多达20%的血流量而不改变静脉回流,从而在任何水平上减少水肿和减少炎症反应方面受益。此外,HBOT可以增加血管张力,提高血压和降低心率[32,33]。
4.2.3. 血管生成
高氧通过两个过程刺激新血管形成或新血管的形成:血管生成和血管发生[1]。许多生长因子、转录因子、激素和化学介质参与了这些机制,包括低氧诱导因子1(HIF-1)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)、血小板源性生长因子(PDGF)、白细胞介素(IL)[34]。特别是,由HBOT触发的促血管生成效果是通过增加VEGF的产生来介导的,促进几次治疗后新血管的形成[35]。在骨髓中,HBOT影响髓内一氧化氮合酶(NOS)酶的活性,该酶合成一氧化氮(NO),并在干细胞的动员中发挥作用,促进新血管形成和愈合[36]。
4.2.4 干细胞的增殖和刺激
高压氧疗法(HBOT)通过一氧化氮合酶产生高氧状态所需的氧化应激,以从骨髓基质中释放多能干细胞[37]。在健康个体和接受放射性坏死治疗的患者中,已经证明了祖细胞(SPCs)的动员。高压氧能够动员内皮祖细胞(EPCs),这些细胞与内皮细胞的生成有关,并展示了血管生成能力[38]。它还促进了神经干细胞向神经元和少突胶质细胞的分化,并在体外减少了星形胶质细胞的数量,可能是通过调节Wnt3蛋白信号通路、β-连环蛋白和骨形态发生蛋白2(BMP2)。在成人大脑的神经发生微环境中也观察到神经细胞增殖的上调[39]。
4.2.5 胶原蛋白合成
研究表明,HBOT增加了肌腱和韧带愈合过程中I型前胶原基因的表达,并抑制了金属蛋白酶的表达[40]。HBOT诱导的高氧状态激活了成纤维细胞活化的生长因子的表达,在愈合过程中,与局部一氧化氮的产生相关,导致I型和III型胶原蛋白合成显著增加。氧气不仅在胶原蛋白成熟中很重要,这对于稳定的胶原形成是必需的,而且还增加了胶原前体的合成,有利于各种类型组织的合成和修复[41]。
4.2.6 成骨作用
高压氧疗即使在发炎或感染的骨骼中也能增加氧气灌注,促进营养骨骼组织的血管生成,随后促进成骨作用。高氧还促进骨组织分化。在这方面,已经证明在1.5 ATA和2.4 ATA的HBO治疗下,HBOT刺激早期成骨分化,增加成骨细胞数量、钙沉积、碱性磷酸酶活性和骨结节[42]。与未接受高压氧处理的成骨细胞相比,成骨作用加速了[43]。增加的氧化应激触发了与衰老和骨质疏松症相关的骨吸收过程[44]。
4.2.7 抗菌效果
HBOT产生的高氧逆转了组织低氧,这是发展和增殖厌氧和微需氧细菌的有利环境。它增强了抗生素对抗生物膜产生细菌(如铜绿假单胞菌)的杀菌效果,显示出与抗生素对生物膜产生细菌的协同杀菌作用[45]。它增加了活性氧物质的浓度(这些物质对细菌具有内在的杀菌活性),促进先天和适应性免疫反应,增强对金黄色葡萄球菌等细菌的吞噬作用,支持线粒体功能,逆转线粒体损伤,并提供氧气用于代谢和活性氧物质的产生。这提供了促进细胞免疫和增强对各种病原体防御的必要元素。它抑制了在传染病中重要的细菌毒素的作用[46]。
4.2.8 神经功能和神经保护
HBOT产生的高氧增加了缺氧诱导因子1α(HIF-1α)及其后细胞因子促红细胞生成素(EPO)的合成,从而产生显著的神经保护效果[47,48]。作为预处理方法的高压氧还提供了低氧耐受性,通过在大脑皮层、海马体和脊髓提供神经保护。它促进了神经元凋亡的抑制,减少Caspase-3表达,防止DNA断裂并保持细胞完整性[49]。
4.2.9 线粒体功能、氧化应激和炎症反应
高压氧疗法(HBOT)诱导活性氧物质(ROS)的产生,这些物质可以作为信号,衡量线粒体中的生理反应。高压氧通过维持线粒体膜电位并减少线粒体凋亡途径来保护线粒体的完整性。在中毒情况下,它可以恢复细胞呼吸[50]。此外,高压氧治疗诱导线粒体自噬[51]。线粒体自噬的激活与神经病理性疼痛的显著减少有关[52]。增加的溶解氧导致神经病理性疼痛显著减少。高氧可以同时刺激ROS水平和抗氧化物质的增加,包括酶类和非酶类的[53]。它可以通过在一些组织中经过多次高压氧治疗后过度表达抗氧化基因,诱导对内皮细胞的氧化刺激产生保护作用[23]。HBOT的短期效应会产生压力,并导致线粒体减少其活动,部分减少ROS的产生。然而,从长远来看,抗氧化活性增加,帮助线粒体在不改变氧化还原平衡的情况下发挥作用,甚至提高它们的活动[54]。HBOT介导的抗炎作用导致血管收缩,减少水肿和炎症反应。它还减少了中性粒细胞和单核细胞产生和释放促炎细胞因子[1,55]。HBOT对细胞因子的产生有影响,减少了白细胞介素1(IL-1)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-alpha),这些都是促炎的。血管内皮生长因子(VEGF)、转化生长因子β1(TGF-beta1)和血小板衍生生长因子(PDGF-beta)表现出双向释放模式。这意味着它们在低氧和高氧条件下都会被释放。然而,高氧刺激的释放更大,促进愈合过程[56]。
4.2.10 再生
研究报告称,由HBOT产生的高氧促进了各种组织的再生机制,包括大脑、脊髓、骨骼、软骨、心血管组织和肌肉。所观察到的再生可以通过HBOT对以下过程的影响来解释:凋亡、干细胞动员、氧化应激反应、炎症、组织重塑、血管生成、细胞-细胞粘附机制、组织再生、分化和增殖[57]。HBOT促进轴突再生,因为高氧诱导的抗炎细胞因子积累和巨噬细胞积聚。
5. 安全性
高压氧疗法是各种病理条件的重要辅助治疗,如前所述,目前是一种安全且可用的治疗方法,主要报告的不良效应出现在高压力下。与HBOT相关的不良事件的发生率很低,通常不严重,包括耳/鼻窦气压伤、幽闭恐惧症、低血糖、氧中毒、眼部副作用、气胸、癫痫发作和呼吸急促等情况[58]。已经定义了绝对的禁忌症,例如未处理的气胸,相对禁忌症包括使用某些药物、哮喘、怀孕、幽闭恐惧症、慢性阻塞性肺病(COPD)、胰岛素依赖型糖尿病或急性低血糖等[59]。系统评估不同治疗压力和持续时间的风险和效益概况,以标准化治疗方案和提高患者护理至关重要。
Monge等人证明,使用便携式舱室进行1.45 atm的HBOT增加了血氧饱和度,证明了高氧,并且比其他报告的舱室更安全,因为不良效应较轻,且没有报告气压伤[60]。同样,Jaim及其同事也没有报告不良效应[13]。
其他研究已经证明了在1.5 atm下治疗的安全性。Ilni和同事在健康志愿者中报告说,在半压下,没有观察到肺容量的变化[61]。此外,在支气管肺泡灌洗液中没有增加IL6和IL-8,也没有观察到肺部或脑部氧中毒[62]。在健康个体接受1.45 atm的HBOT的实验室参数研究中,血液学或止血参数以及炎症和急性期标志物均未发生变化[63]。
6. 方法
在Pubmed中进行了文献搜索,以识别在过去20年中进行的探讨在1.45–1.5 ATA以上压力下使用HBOT的研究。使用了以下搜索字符串:(“高压氧疗法”和“高氧”和;“轻度压力”)或(“高压氧疗法效果”和“氧化应激与HBOT”和“1.5 ATA”)。该综述侧重于在成年健康受试者或任何病理状态的受试者中测量组织氧水平的临床方法。搜索限制为英语同行评审期刊上发表的文章。没有对研究设计施加限制。排除了摘要报告和会议记录。
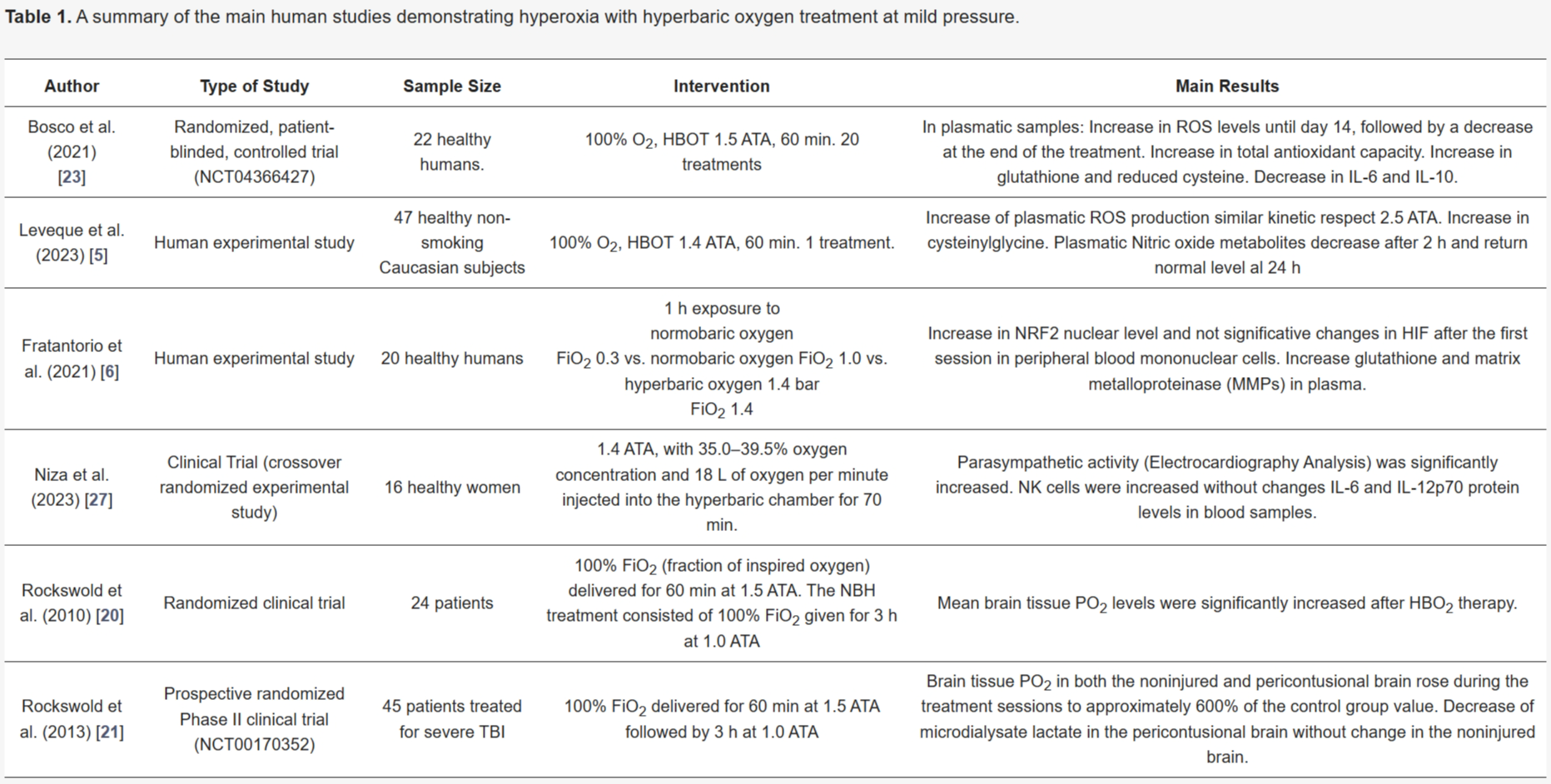
研究根据标题和摘要手动选择。(见表1)。仔细阅读选定的研究,以确定适合纳入本次审查的研究。我们从选定的研究中提取了人口统计和实验数据。对于每项研究,提取并总结了以下相关信息:调查人群的特征;氧气给药方案;应用的实验和/或临床环境;以及关于氧水平提高和/或ROS水平增强对HIF-1α途径影响的主要研究结果。
表1. 在轻度压力下进行高压氧治疗产生高氧的主要人类研究摘要。
7. 结论
在1.5 ATA下的高压氧治疗增加了溶解氧水平,产生组织高氧并对抗低氧的影响,通过提供必要的氧气来恢复细胞呼吸和线粒体功能。HBOT的效果还包括激活抗氧化机制来对抗氧化应激效应的细胞反应,并且它作用于多个过程,如血管生成和炎症等,对各种病理状态产生有益效果。这些有益效果已在包括各种压力、暴露时间和使用次数在内的各种情景中得到报告。因此,将需要进行严格的研究来调整这些变量,无论是作为独立的还是辅助的治疗手段,在可能获得益处的众多病理中进行HBO治疗,这可能会在未来导致变革性的治疗进步。
https://blog.sciencenet.cn/blog-41174-1428726.html
上一篇:氢气生理盐水是真气!
下一篇:氢气抗炎症效应的发现【经典】