博文
氢气提高细胞生物反应器病毒产量的策略
||
氢气提高细胞生物反应器病毒产量的策略
任何事情都具有两面性,本研究利用氢气抗氧化应激保护细胞的作用,设计了一种提高细胞内病毒产量的新技术。这里的病毒是作为产品看待,保护了细胞,促进病毒产生。那么如果这是人体,氢气提高某种致病病毒产生的话,就成了麻烦了。当然人体是更复杂的体系,还存在免疫系统的作用,从整体上看,氢气不一定会增加病毒的产生。但也不一定不会提高。所以,我一直强调,任何有作用的物质,都有可能产生副作用。当然就如作用一样,副作用也需要证据。从研究证据角度,氢气对人体的安全性非常高,几乎没有发现任何不良作用。
本研究方法中存在的问题,1增加氢气水平,可能会产生吹出效应,导致培养基内氧气浓度下降。2氢气可能会影响pH的测定结果,研究结果中看到pH的变化可能存在氢气的影响。
摘要
随着对病毒疫苗需求的增加,安全、高效、经济地大规模生产病毒抗原成为了一个重大挑战。为了制造疫苗抗原和蛋白质药物,最常用的方法是采用高细胞密度的生产流程。然而,在大规模细胞培养中的细胞应激反应可能会直接影响宿主细胞的生长和代谢,从而降低抗原产量并增加生产成本。本研究提供了一种抗氧化辅助系统(AAS)的新策略,通过质子交换膜(PEM)电解将氢分子(H2)供应到细胞培养基中。与高密度细胞生物反应器结合使用,AAS旨在减轻细胞应激反应并增加病毒疫苗的产量。研究结果显示,即使在高空气暴露潮汐细胞生物反应器中,AAS也能稳定地维持培养基中的H2浓度。H2处理对细胞培养是安全的,并有效缓解了氧化应激。在两个建立的病毒培养模型中,牛流行热病毒(BEFV)和猪圆环病毒2型(PCV-2),被用来验证AAS的效果。病毒产量分别在BEFV和PCV-2中增加了3.7倍和2.5倍。总之,连接了AAS的生物反应器有效地缓解了高密度细胞培养中的细胞氧化应激,并增强了病毒产量。
Zeng YJ, Hsu MK, Cai JR, Wang HY. A strategy of novel molecular hydrogen-producing antioxidative auxiliary system improves virus production in cell bioreactor. Sci Rep. 2024 Feb 19;14(1):4092.
本研究作者来自台湾屏东科技大学动物医学院动物疫苗技术研究所。
前言
生物反应器在细胞培养中生产大规模疫苗方面发挥着重要作用,它可以提供更高效、成本效益更好的疫苗生产。生物反应器中的大规模和高密度条件可能会引起细胞应激反应,然后减少病毒产生。许多细胞应激反应,如细胞氧化应激、内质网应激和类似衰老的反应,可能会抑制或减少细胞培养系统中的病毒扩增。在以前的研究中,已经报道说细胞氧化反应减少了中国仓鼠卵巢(CHO)细胞生产的蛋白质药物。在我们之前的研究中,应激诱导的类似衰老的反应也抑制了BHK-21细胞中的BEFV病毒复制。因此,如何解决高密度培养中的细胞应激反应仍然是生物反应器中的一个巨大挑战。
氧化应激是指细胞内自由基产生和抗氧化反应之间的不平衡。当活性氧(ROS)过量产生时,它们可能会触发脂质过氧化、蛋白质变性和核酸损伤。因此,氧化应激对体内外环境中的细胞造成严重损害。ROS的产生可以触发病毒感染中宿主细胞的抗病毒炎症反应。因此,在生物反应器中调节ROS水平以维持细胞稳态对生物制药行业非常重要。在制造过程中可能会出现细胞氧化应激的条件包括氧气分布不均、高细胞密度、营养缺乏、废物积累和病毒感染。消除ROS产生的常见方法包括减少机械损伤或直接在生物反应器中添加抗氧化化学试剂,如维生素C、维生素E和谷胱甘肽。然而,直接在培养基中添加化学抗氧化剂不仅需要进一步的分离过程和监测残留物,而且难以与制造过程快速调整它们的量。这里,我们提出了一种新的策略,使用H2作为抗氧化材料来快速、轻松且无残留地减少氧化应激反应。
H2是一种有效的新型抗氧化材料,可以高效减少氧化应激。水分子弱解离,分裂成H+和OH−离子。通过电解,在阴极的影响下,氢离子高效地转化为H2。H2和富氢水的生物活性已在人类、动物模型和细胞培养中得到广泛研究。许多研究报告称H2可以快速减少由辐射损伤引起的人类成纤维细胞中的氧化剂。
在这里,我们设计了一个抗氧化装置——抗氧化辅助系统(AAS),以在高密度生物反应器的细胞培养基中直接产生H2。结果显示,AAS向细胞培养基供应H2,以稳定细胞氧化应激并在生物反应器中增加病毒产量。采用了两个病毒培养模型,BHK-21细胞中的BEFV和PK-15细胞中的PCV-2。在病毒生产过程中,AAS装置有效地减少了氧化应激并增加了2至4倍的病毒产量。本研究是首次在病毒疫苗生产中应用H2。
研究结果
针对AAS与BelloCell-500AP实验室规模生物反应器的设备设计
AAS系统包括电源控制单元和PEM电解核心。电源控制单元由微控制器、电源和定时器连接的电源构建,用于实现不同的需求,如电流、电压和激活时间。PEM电解核心主要连接BelloCell-500AP系统(阴极)、纯水系统(阳极),并通过两个蠕动泵进行抽水(见图1)。H2通过PEM电解核心在阴极直接电解到培养基中,而在阳极的纯水中产生O2。在水电解的阴极区域,水分子的还原产生了氢氧根离子(OH−),导致流经阴极的培养基环境呈碱性,这可以用来平衡细胞生长过程中分泌的酸性物质。纯水系统提供了一个0.22微米过滤器以便将O2气体排出。在BelloCell-500AP实验室规模的生物反应器中,H2将逐渐通过BelloCell-500AP的空气通风过滤器消散。因此,需要电源控制系统来调节适当的激活时间并维持培养环境中的H2浓度。这种设计的优势在于它可以针对不同的实验参数进行调整,包括电解核心的激活频率、电压、电流以及补充缓冲液的流速。
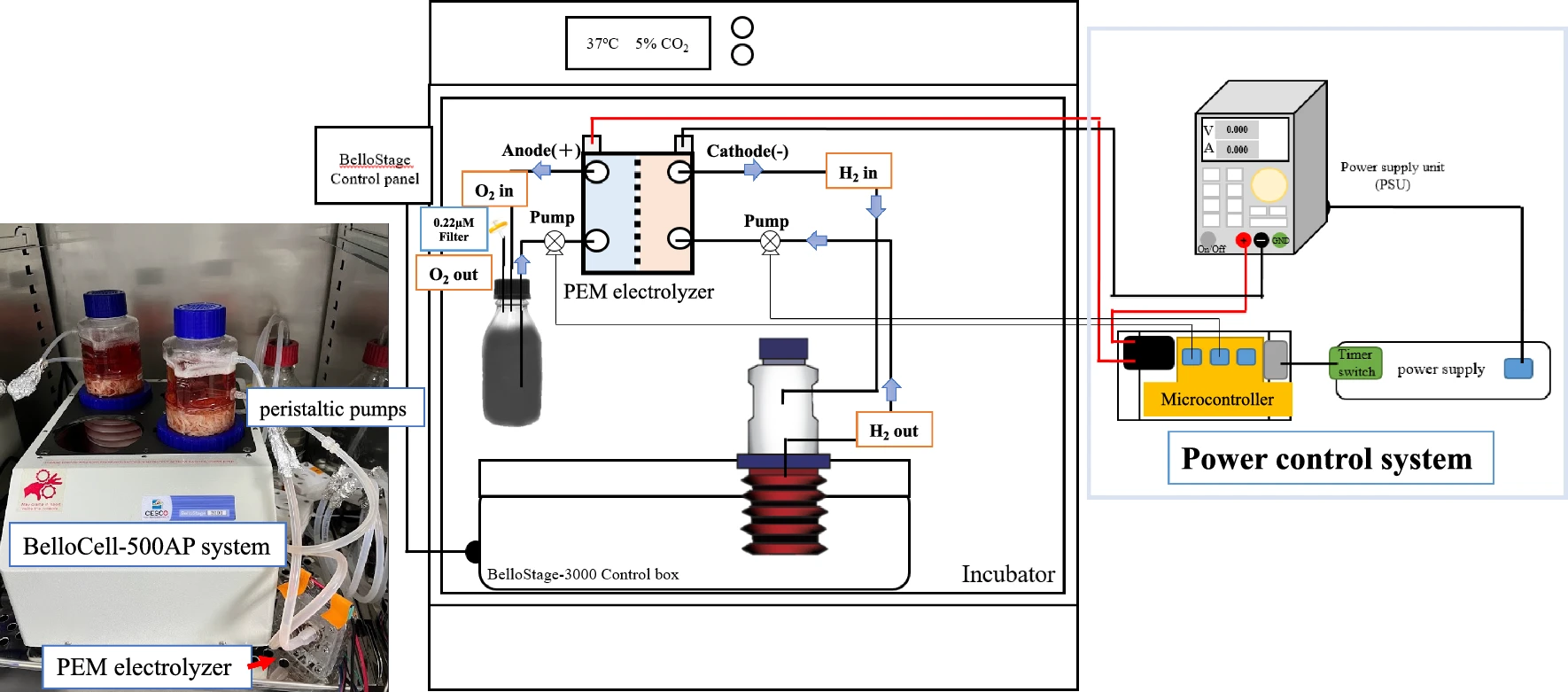
图1 AAS与实验室规模生物反应器BelloCell-500AP的连接布局。
首先,通过使用不同的电流值(0.05 A, 0.1 A, 0.2 A, 0.3 A, 0.4 A, 0.5 A, 2 A)在无细胞MEM培养基中进行15分钟激活和15分钟停用间隔的测试,以估算H2的产生量。结果表明,在500毫升培养基中,电流超过0.2 A时,H2浓度可以在25分钟内达到0.6–0.8 ppm,并且2 A的电流可以达到1 ppm(见图2A)。然而,随着电流和时间的增加,MEM培养基的pH值迅速上升(见图2B)。但是,由于高pH会伤害细胞,因此必须谨慎调节电流。
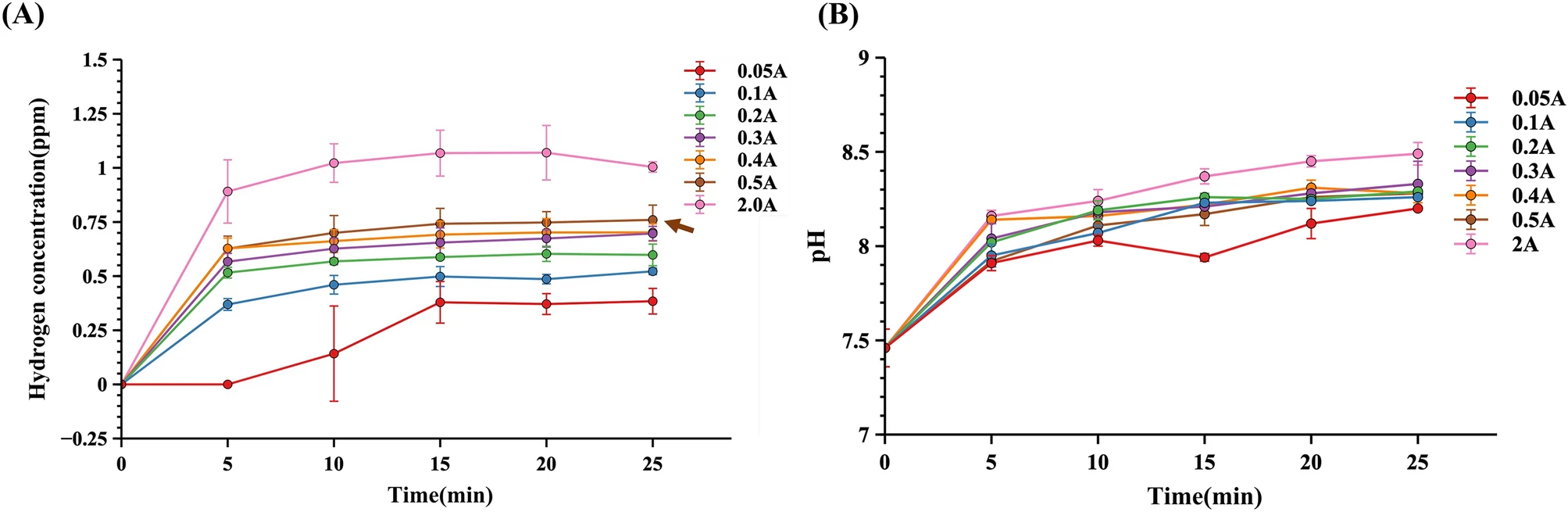
图2 更高的电流值可以在无细胞的500毫升MEM培养基中产生更多的H2浓度和更高的pH值,采用15分钟激活和15分钟停用间隔。(A)H2浓度由溶解氢测试仪DH30检测。(B)pH值由LAQUAact pH-22 pH计监测。棕色箭头表示“结果”部分中描述的0.5 A电流。
实际上,使用高电流2 A可以获得更高的氢气浓度,但电解过程中过度的pH和气泡形成可对细胞造成伤害。所有实验均采用恒定的0.5 A条件,使实验室规模的BelloCell-500AP生物反应器中的H2浓度达到0.6~0.8 ppm。生物反应器内的H2浓度和pH值可以快速调节。这一特点使得AAS能够轻松适应不同的生物反应器。
AAS在BelloCell-500AP中表现出无细胞毒性并减少了细胞氧化应激
为了确认使用AAS连接生物反应器的细胞是否表现出细胞毒性或生长抑制,采用了细胞数量和葡萄糖消耗率作为指标。从第1天到第8天,每天对接种了BHK-21细胞的AAS连接或对照生物反应器的培养基进行采样,计算细胞数量。本实验采用分批补料法。生长培养基仅在第2天更换一次。从第3天到第8天,葡萄糖以最终浓度100 mg/dl独家供应在现有的生长培养基中。细胞群体在第四天达到最大生长,随后由于仅供应葡萄糖,细胞数量开始减少。在第8天,即最后一天,生物反应器中只剩下稀疏的细胞群。这一过程便于在一个培养周期内建立细胞生长增加和饥饿减少的条件,从而容易比较两种生长条件。
在图3A中,无论是H2处理组还是未处理组,细胞生长曲线结果显示两组都在第四天达到细胞计数的峰值,分别为2.0 x 10^9个细胞/bt和1.9 x 10^9个细胞/bt。第四天后,H2处理组和未处理组的细胞数量都开始减少。结果表明,AAS产生的H2处理在生长和应激条件下不会引起细胞毒性效应。葡萄糖消耗率也显示出类似的结果,H2处理组并没有显著降低细胞葡萄糖代谢。此外,整个培养期间pH值始终稳定在7.4到7.6的范围内,这表明在本实验条件下,PEM电解不会导致pH迅速升高(见图3B)。分析了溶解氢浓度以评估AAS在连接BelloCell-500AP时的H2供应效率。结果显示,在AAS 15分钟启动、15分钟停止、0.5 A电流的条件下,生物反应器中的氢气浓度可以稳定地维持在0.6-0.8 ppm之间(见图3C)。
图 3 细胞生长曲线和葡萄糖消耗率在连接了AAS的BelloCell-500AP和对照瓶中的BHK-21细胞之间相似。(A)每天监测H2处理组和无H2组的细胞数量。(B)分析葡萄糖浓度,并计算成每日葡萄糖消耗量(mg/dl/天)。pH水平也每天监测。(C)通过溶解氢测试仪DH30分析培养基中的H2浓度。蓝色虚线将图分为无氢(左侧)和启动AAS的含氢(右侧)培养期。
为了验证AAS系统在高密度细胞培养中的抗氧化效果,将BHK-21细胞接种到BelloCell-500AP中,并按照前一节中描述的方法进行培养。第4天、第5天和第6天,将细胞从基质上用胰蛋白酶消化下来,进行ROS生成测定。第4天后,细胞面临饥饿应激条件,不更换生长培养基。在ROS测定中,用指示浓度的H2O2诱导细胞产生氧化应激,然后通过流式细胞术分析评估AAS产生的H2处理的细胞和无H2对照组细胞的ROS耐受反应。
结果显示,随着培养时间的增加,细胞内ROS水平上升,但H2处理组细胞中的ROS水平显著低于无H2组(图4A)。在4 µM、10 µM和20 µM H2O2诱导下,H2处理组和无H2组之间的差异更加明显(图4B-D)。总之,AAS能有效缓解高密度细胞生物反应器中的细胞氧化应激。
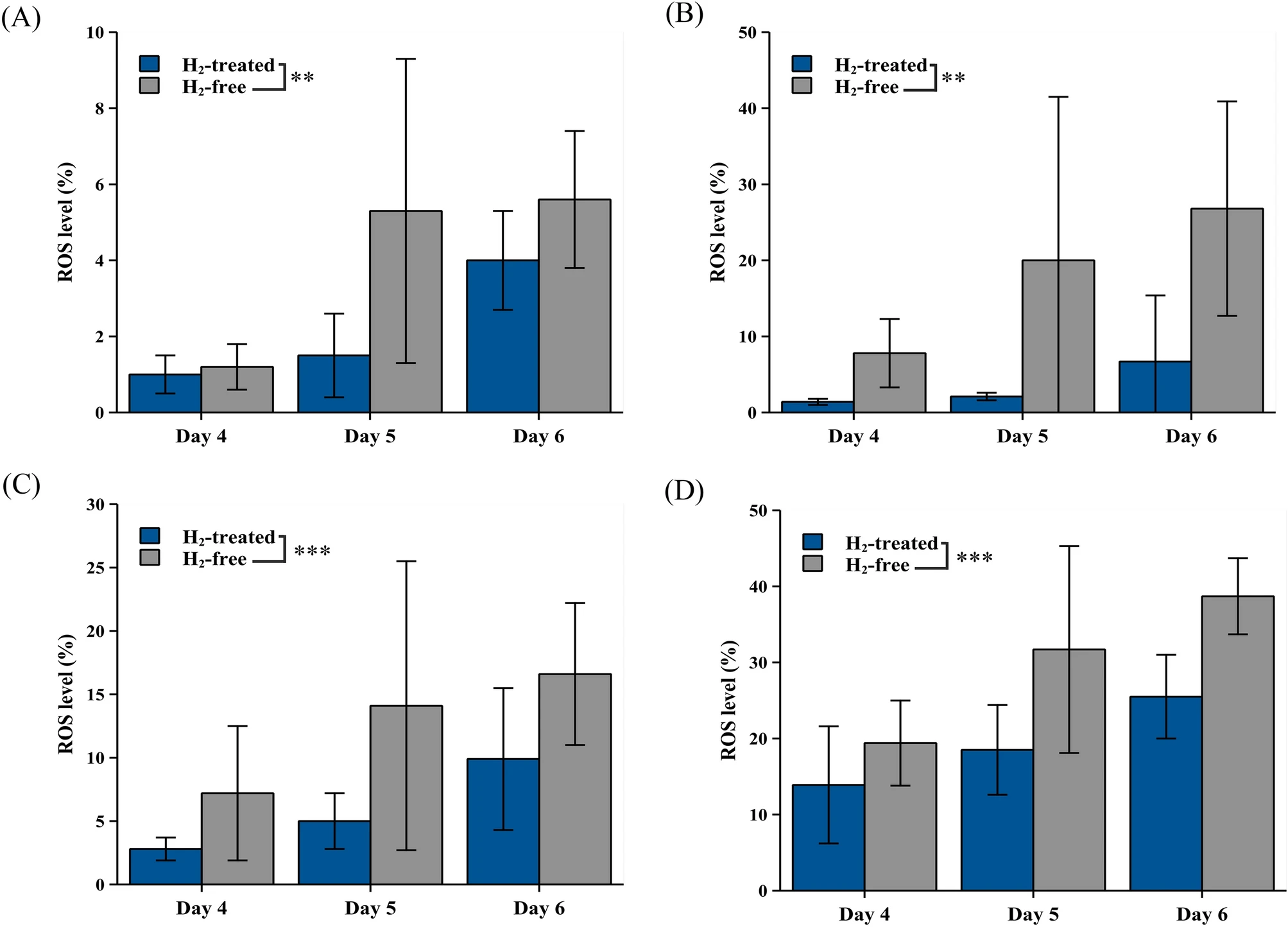
图4 AAS减少了BelloCell-500AP生物反应器中的细胞氧化应激。从第4天到第6天分离BHK-21细胞,并用(A)0 μM H2O2、(B)4 µM H2O2、(C)10 µM H2O2和(D)20 μM H2O2诱导,随后通过流式细胞术分析ROS水平。结果表示三个独立细胞样本重复实验的平均值±标准差(SD)。数据通过双因素方差分析(two-way ANOVA)。Tukey's HSD测试进一步分析了多重比较。两组细胞之间的显著性在p < 0.01和p < 0.001*时被接受。
连接AAS的BelloCell-500AP提高了BHK-21细胞中BEFV的产生
BEFV病毒在BHK-21细胞中迅速复制,并在48小时内引起明显的细胞病变效应(CPE)。这里使用BEFV模型来估计AAS连接的生物反应器在高密度细胞条件下对快速病毒生长的影响。实验过程如图5A所示。将BHK-21细胞接种到两个BelloCell-500AP瓶中,每个瓶中4.6×10^8个细胞,并在第3天细胞数量达到1.5和1.8×10^9个细胞时接种BEFV,然后分析感染后24至96小时(h.p.i)的病毒滴度。在H2处理组中,AAS在病毒感染前24小时开启(从第2天到第7天)。
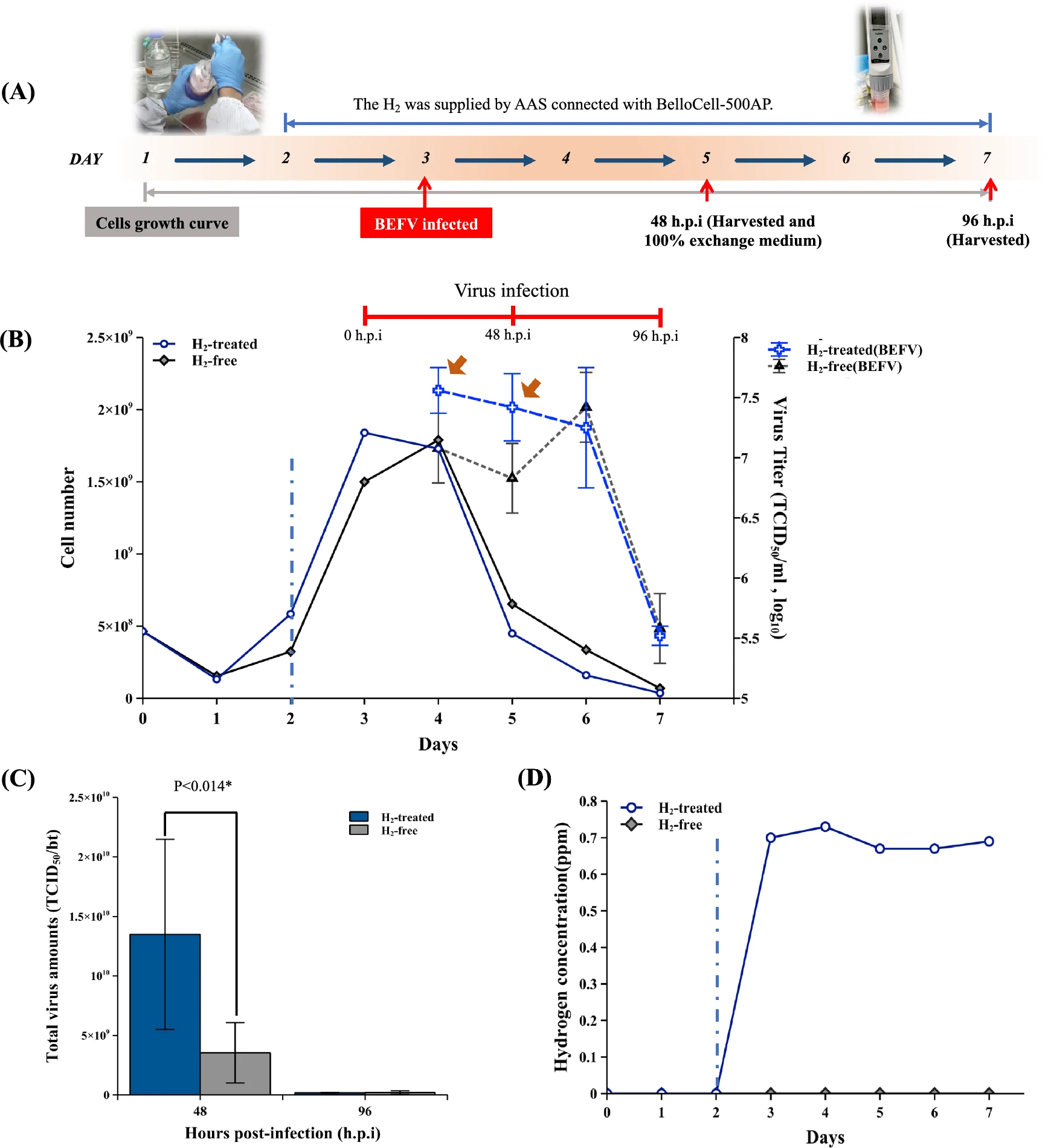
图5 BEFV的生产通过AAS在BelloCell-500AP中得到了改善。(A)带有AAS连接的BelloCell-500AP的BEFV感染BHK-21细胞生产流程。(B)细胞生长曲线和病毒滴度。(C)所有病毒培养基在48和96小时感染后(h.p.i)更换为新培养基。分析了批量中的总病毒量。(D)每天分析氢气浓度。蓝色虚线将图分为无氢(左侧)和含氢(右侧)培养期。棕色箭头指示结果部分描述的病毒快速增长。进行了Student’s t检验以进行指示的统计分析。在p < 0.05*时接受显著性。
结果显示,在H2处理组中,细胞在24和48小时感染后很快被病毒消耗。H2处理组的病毒滴度增长速度快于无H2组(图5B棕色箭头)。在48小时感染后,生物反应器中只剩下很少的细胞残留,而在96小时感染后病毒滴度显示较低。在48和96小时感染后收获批量中的总病毒抗原量如图5C所示。在48小时感染后,H2处理组的总病毒收获量显著高于无H2对照组。在48和96小时感染后,H2处理组与无H2组的倍数变化分别为3.96和0.87(补充图S1)。由于BEFV通常在72小时感染后引起CPE,无H2组的病毒滴度在72小时感染后迅速上升(图5B第6天),如同一般情况。然而,H2处理组中收获的总病毒产量显著高于无H2组(3.7倍)(补充表1)。在这个病毒培养实验中,AAS在病毒感染期间可以稳定供应0.6-0.8 ppm的溶解氢(图5D)。
AAS连接的BelloCell-500AP提高了PK-15细胞中PCV-2的产生
在PCV-2生产测试中,PCV-2在低密度条件下(起始时1.04×10^8个细胞/瓶)感染PK-15细胞,病毒复制速率较慢。这让我们能够在同一个生物反应器中多次收获病毒抗原。实验过程如图6A所示,AAS在96小时感染后开启,以最小化随后的高细胞密度和病毒复制条件引起的细胞应激反应。
图6 PCV-2的生产通过AAS在BelloCell-500AP中得到了改善。(A)带有AAS连接的BelloCell-500AP的PCV-2感染PK-15细胞生产流程。(B)细胞生长曲线和病毒滴度。(C)所有病毒培养基在96、168和216小时感染后(h.p.i)被更换为新培养基。分析了批量中的总病毒量。(D)每天分析氢气浓度。蓝色虚线将图分为无氢(左侧)和含氢(右侧)培养期。进行了Student’s t检验以进行指示的统计分析。显著性在p < 0.05*, p < 0.01**, 和 p < 0.001***时被接受。
在激活AAS之前,H2处理组和无H2组的PK-15细胞数量在96小时感染后分别达到了7.6×10^8个细胞/瓶和8.5×10^8个细胞/瓶。随后,在96至144小时感染期间,PK-15细胞数量迅速减少,尤其是在H2处理组中。在此期间,H2处理组的病毒滴度增长速度快于无H2组。在144至216小时感染期间,两组的细胞数量逐渐恢复,H2处理组显示出更快的生长速度,并且病毒滴度高于无H2组(图6B)。这种病毒生长可能是由于PCV2基因组DNA依赖于宿主细胞复制。培养基在96小时感染后(第6天)和168小时感染后(第9天)更换。因此,在第7天和第10天观察到了细胞生长。在第8天观察到了细胞死亡高峰和较低的细胞数量。同样地,通过在第9天更换新鲜培养基来收获病毒上清液,导致第10天的病毒滴度较低。值得注意的是,PCV2病毒滴度可能不会与细胞死亡呈100%相关。我们观察到至少两波PCV-2复制,第一波发生在144小时感染后(图6B,棕色箭头),第二波延伸到216小时感染后之外。在图6B中,结果显示了细胞生物反应器中细胞数量和病毒滴度的动态变化。
在96、168和216小时感染后收获批量中的病毒抗原量如图6C所示。在开启AAS之前(在96小时感染后),两组中的病毒产量相似,但在AAS连接后(168和216小时感染后),H2处理组中的病毒量显著高于无H2对照组(图6C)。H2处理过程在168小时感染后增强了4.3倍的病毒产量,在216小时感染后增强了3.2倍(补充图S1)。在H2处理组中收获的总病毒产量显著高于无H2组(2.5倍)(补充表1)。在这个病毒培养实验中,AAS可以在病毒感染期间稳定供应0.6-0.8 ppm的溶解氢(图6D)。
AAS在病毒感染期间缓解了细胞氧化应激
为了确认AAS在病毒感染细胞中的抗氧化效果。在BEFV和PCV-2感染模型中,在病毒感染后24小时分析了细胞氧化状况。结果显示,使用AAS产生的H2处理可以减轻BEFV(图7A)和PCV-2(图7B)感染细胞中的病毒诱导的细胞氧化应激反应。随着更高浓度的H2O2诱导,在BEFV中使用了10 µM和20 µM,在PCV-2中使用了80 µM,抗氧化现象变得显著。

图7 AAS在病毒感染后24小时缓解了BEFV感染的BHK-21和PCV-2感染的PK-15模型中的细胞氧化应激。(A)BHK-21细胞在BEFV感染24小时后被分离出生物反应器基质,并用不同浓度的H2O2诱导,然后进行流式细胞术分析。(B)PK-15细胞在PCV-2感染24小时后被分离出生物反应器基质,并用不同浓度的H2O2诱导,然后进行流式细胞术分析。结果表示三个独立细胞样本重复实验的平均值±标准差(SD)。进行了双尾Student’s t检验进行统计分析。显著性在p < 0.05*时被接受。
讨论
在高密度生物反应器中培养的细胞内维持稳态是生物制造过程中的一个关键方面。先前的研究提到,在生物反应器中减轻氧化应激对于高产量病毒和重组蛋白的生产是有利的[20,21]。此外,我们之前的研究发现,应激诱导的细胞衰老样反应可能会抑制BEFV病毒的产生[6]。在使用细胞生物反应器的制药行业中,如何减轻细胞反应是很重要的。在本研究中,通过使用AAS减轻ROS诱导的细胞应激反应,显著加快了病毒生产。
细胞应激反应通常通过各种因素抑制病毒生长和复制,例如细胞炎症、氧化应激、细胞周期停滞和细胞衰老[22,23,24]。然而,张和同事也发现PCV-2通过上调ROS来促进病毒复制[25,26,27,28]。细胞内ROS的增加可以诱导核高迁移率族蛋白1(HMGB1)转移到细胞质中,并增强PCV-2在核内的复制。HMGB1是一种普遍存在的DNA结合蛋白,作为促炎细胞因子在病毒感染的细胞中增强炎症反应[25,29,30]。一些研究表明,H2负向调节HMGB1功能,有效减少细胞炎症和凋亡[31,32,33]。因此,我们推测AAS增强的PCV-2生产不仅抑制了ROS诱导的细胞应激反应,而且还负向调节HMGB1以增加PCV-2生产。此外,在图6中,PK-15细胞在感染后144小时(第8天)继续生长并产生病毒抗原。这种现象与我们之前在BHK-21细胞中观察到的BEFV感染后的病毒持续细胞现象相似[6]。这些持续的细胞可能是由细胞应激反应和类似细胞衰老的反应引起的,作为一种细胞抗病毒机制。
许多研究表明,分子氢是一种新颖且有前景的抗氧化剂。然而,其有限的溶解度(在水中大约为0.00016克/100毫升)[34]对其抗氧化效果提出了挑战。本研究中的AAS可以稳定地调节流速和激活频率,实现分子氢的持续供应。这表明,在生物反应器中使用抗氧化装置可以提供长期稳定的H2供应,从而在生物反应器系统中实现最佳的抗氧化效率。直接将化学试剂添加到细胞培养基中可能是一种实现抗氧化目的的便捷方式。然而,使用AAS直接在培养基中产生H2而无需担心化学残留,将更容易被GMP制造过程采用。
在本研究中,检查了在生物反应器中应用AAS的特点,包括:(1)AAS可以连续不断地将H2输送到培养基中,而不表现出细胞毒性;(2)AAS可以显著减少高密度生物反应器中的细胞ROS;(3)将AAS与生物反应器结合可以增加BEFV和PCV-2病毒的生产。总之,我们描述了一种使用连接AAS的生物反应器的新策略,该策略有效地缓解了高密度细胞培养中的细胞氧化应激,并增加了BEFV和PCV-2的生产。使用AAS可以轻松地被GMP制造过程采用,以提高生产效率。
https://blog.sciencenet.cn/blog-41174-1422701.html
上一篇:对长新冠的正确态度:勇敢面对,积极克服【科学】
下一篇:美国开展多发性硬化细胞治疗临床试验