博文
氢气和结肠炎的关系
|
氢气和结肠炎的关系摘要肠道中的氧化还原平衡在维持肠道稳态中扮演重要角色,它与肠粘膜屏障、肠道炎症和肠道微生物群密切相关。目前关于溃疡性结肠炎治疗的研究集中在免疫紊乱、过度炎症和氧化应激上。然而,肠道氧化还原反应的失衡起到了特别关键的作用。氢气由肠道中的一些厌氧细菌通过氢化酶产生。越来越多的证据表明,作为一种惰性气体的氢气对免疫、炎症和氧化应激至关重要,并在溃疡性结肠炎中发挥保护作用。氢气维持了溃疡性结肠炎肠道中的氧化还原状态平衡,并通过其选择性抗氧化能力减少了对肠上皮细胞的损害。氢气还调节肠道菌群,减少有害细菌对肠上皮屏障的不良影响,促进肠道正常厌氧细菌的恢复,并最终改善肠上皮屏障的完整性。本综述聚焦于针对溃疡性结肠炎的氢气治疗机制。简明语言摘要:氧化还原平衡对于维持肠道整体健康至关重要。然而,这种平衡的破坏导致各种疾病的发生,例如溃疡性结肠炎。溃疡性结肠炎是一种慢性炎症性肠病,其特征是结肠和直肠内膜的炎症和溃疡。溃疡性结肠炎中的异常氧化应激导致免疫细胞过度激活、炎症加剧和肠道微生物群失衡,加速了这种疾病的发展。氢气是一种由肠道细菌产生的还原性气体,或从外部给予。它具有重要的选择性抗氧化作用,并在不影响正常生理过程的情况下缓解溃疡性结肠炎。本文通过分析相关文献,总结了氢气对溃疡性结肠炎的直接和间接影响,表明氢气是治疗溃疡性结肠炎的潜在分子药物。
本综述作者主要来自山东大学齐鲁医院消化内科,山东省消化病临床研究中心。Li J, Huang G, Wang J, Wang S, Yu Y. Hydrogen Regulates Ulcerative Colitis by Affecting the Intestinal Redox Environment. J Inflamm Res. 2024;17:933-945前言溃疡性结肠炎(UC)是一种复杂的、免疫介导的慢性炎症性疾病,主要影响直肠和结肠。它与多种因素相关,如炎症、氧化应激以及微生物群失调。目前针对UC的治疗选择包括药物治疗,例如5-氨基水杨酸、皮质类固醇,以及生物制剂如英夫利昔单抗。然而,这些药物有副作用,一些患者可能对这些药物反应不佳。使用传统治疗手段对这种疾病的整体控制并不令人满意,这支持了越来越需要确定新的药物治疗靶点的需求。分子氢是一种新近发现的医用气体,在各种临床研究中显示出了有希望的结果。它具有独特的能力穿透细胞膜,扩散到细胞质,并针对特定细胞器。它的一个关键特性是能够选择性地减少细胞毒性氧自由基,如羟基自由基(·OH)和过氧化亚硝酸盐(ONOO-),而不影响参与正常细胞信号传导的生理活性氧物种(ROS)或活性氮物种(RNS)。这种选择性靶向使得氢气成为一种安全有效的治疗选择。临床实验证明了氢气的安全性,并显示了其在包括运动医学、认知障碍、中风、癌症、代谢综合征以及COVID-19患者等不同医学领域的益处。溃疡性结肠炎的动物模型也显示了氢气的治疗效果,包括抗炎、抗氧化应激、调节内质网应激以及调节肠道菌群。氢气疗法通过直接饮用富含氢的水或腹腔注射富含氢的生理盐水给动物施用,或者通过间接给予增加肠道内氢气产生的药物,如乳果糖。本综述关注于从抗氧化角度探讨氢气对抗溃疡性结肠炎的保护机制。对氢气调节氧化应激、炎症和肠道菌群的深入了解,将为其作为UC患者治疗选择的潜力提供洞见。
结肠炎组织炎症和氧化应激
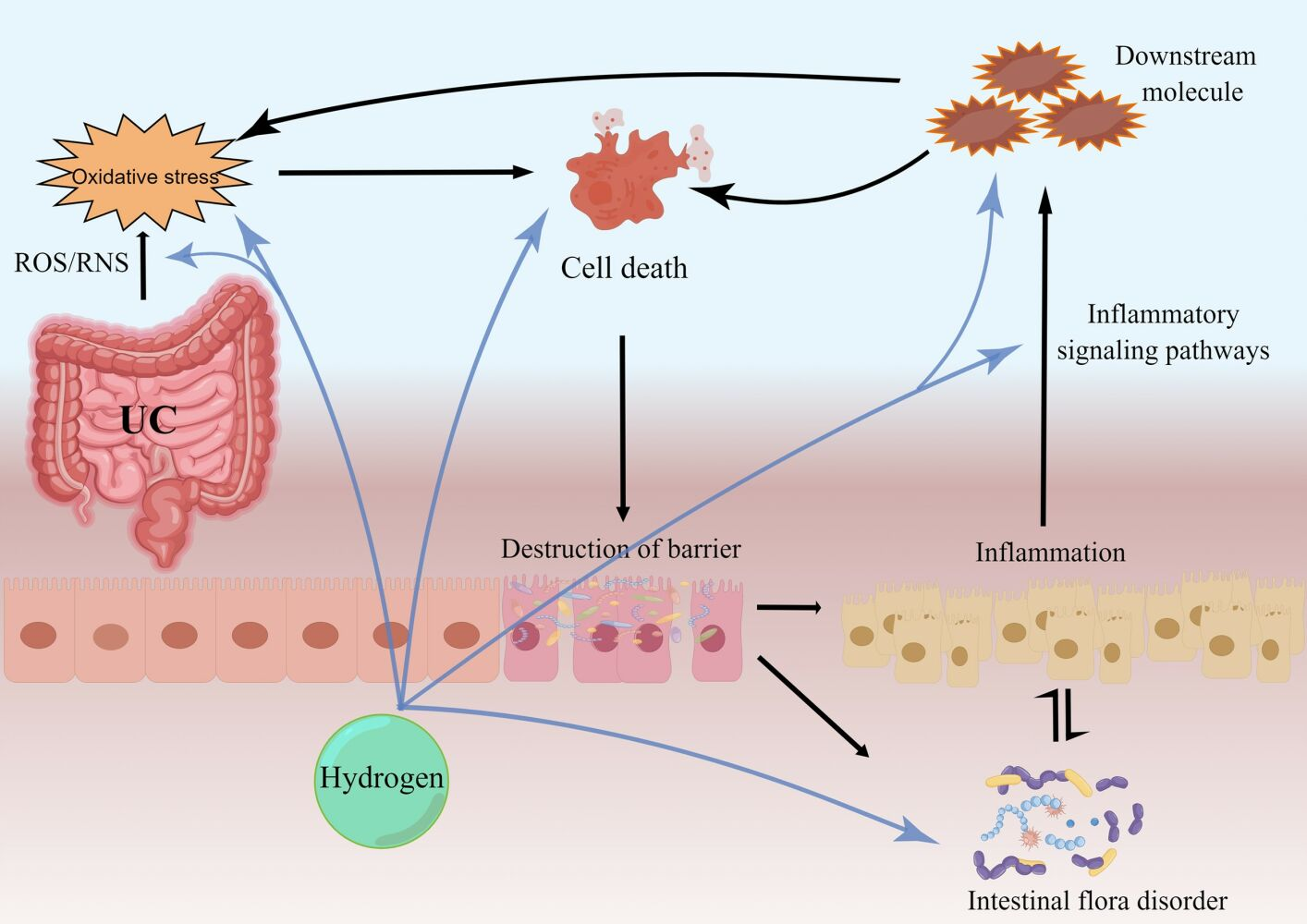
氧化应激和炎症与UC密切相关,并且是其发生和发展中涉及的主要机制之一。由于遗传、环境和微生物等多种因素,免疫细胞的过度激活和失衡导致中性粒细胞和巨噬细胞等免疫细胞产生过量的自由基。具体来说,过量的活性自由基水平持续增加,导致严重的氧化应激和氧化还原平衡的破坏,这会对蛋白质、脂质和脱氧核糖核酸造成实质性损害。当自由基攻击肠道上皮细胞(IECs)并造成损伤时,IECs的死亡增加,肠道紧密连接蛋白的表达减少,上皮屏障的通透性增加,这导致肠道细菌和其他抗原侵入肠道粘膜。受损的屏障吸收越来越多的腔内抗原,导致菌群失调和炎症加重。当炎症和氧化应激信号通路被肠道损伤、细菌和相关抗原等因素激活时,下游因子加速IECs的凋亡和坏死,这导致进一步的肠道损伤和菌群失调。
结肠和氢气
肠道中的细菌主要包括拟杆菌、厚壁菌、放线菌和变形菌。厚壁菌和拟杆菌是丰富的厌氧细菌,它们在结肠中定殖,并将复杂碳水化合物降解的最终产物产生为氢气。氢气的产生取决于产氢细菌的氢酶活性。氢酶是细菌和真菌中产生氢气的金属酶,而厚壁菌和拟杆菌中最丰富的氢酶是[FeFe]-氢酶。产生的氢气有一部分直接从胃肠道排出或被吸收进入血液。剩余的氢气可以被肠道菌群转化为其他代谢物。关于肠道内源性氢气产生对人体直接生理效应的研究相对较少。然而,动物实验表明,减少肠道中的氢气产生会增加组织损伤,而外源性补充氢气或产氢细菌可以减少组织损伤。这些发现表明,内源性氢气可能在体内具有某些生物学效应。H2是肠道细菌的主要副产物,而利用H2作为底物的微生物在厌氧肠道生态系统中具有进化优势。H2为氢营养菌的生长和能量代谢提供了额外的底物,增加了它们的丰度并促进了肠道中的氢代谢。由此产生的各种生物活性化合物进一步调节肠道菌群。例如,丙酸和硫化氢具有许多与肠道和全身免疫调节、基因表达和细胞信号转导相关的生理功能。关于外源性氢气和促进肠道内氢气产生的研究表明,氢气具有多种生物活性功能,其中选择性抗氧化效应最为显著。日本科学家发现,氢分子选择性地结合并中和有毒自由基,同时保留其他重要的ROS和RNS以进行正常的细胞信号传导。氢气还抑制肠道的氧化还原电位,这影响了包括体内细菌群落在内的各种因素。可以通过直接追踪自由基的变化来确定氢气的效果。羟基苯基荧光素(HPF)和其他活性氧物种荧光探针已被用来追踪高毒性氧化因子的变化。例如,HPF已被用于检测小鼠睾丸中高毒性氧化因子的变化。这种分子为研究人员提供了一种工具,以探索氢气在不同组织或细胞中的具体抗氧化应激机制,因为自由基的变化在氧化还原信号通路中起着关键作用。然而,氢气在体内的循环受到各种因素的影响,肠道中的氧化应激起着关键作用。肠道中的氧化应激通过过量产生ROS等物质损害正常的肠道菌群。原始的氧化还原平衡的破坏影响了肠道的厌氧环境,导致病理性需氧微生物群落与生理性厌氧微生物群落之间的失衡。当肠道中的炎症和氧化应激水平等各种因素发生变化时,产氢细菌和氢营养菌之间的动态平衡被打破,导致氢气循环的中断。
氢气对结肠炎氧化应激的直接调节作用
氧化应激与UC密切相关,在其发展和进展中起着至关重要的作用。遗传、环境因素和微生物等各种因素触发了UC患者中性粒细胞和巨噬细胞等免疫细胞的自由基过量产生。当自由基攻击生物膜时,脂质过氧化物丙二醛(MDA)的过量形成导致结构变化和免疫反应。在脱氧糖酸钠(DSS)诱导的UC小鼠模型中,中性粒细胞浸润的指标酶髓过氧化物酶(MPO)的活性随炎症损伤的严重程度而增加。MPO在应激条件下催化产生包括次氯酸在内的细胞毒性氧化物,由过氧化氢和氯离子生成。L-谷胱甘肽(GSH)是一种非酶类抗氧化剂,通过抑制氧化损伤的形成发挥保护作用。超氧化物歧化酶(SOD)通过将超氧自由基(O-)转化为过氧化氢(H2O2),从而保护细胞免受氧化损伤,发挥有益效果。然而,UC中的慢性炎症导致ROS的过量产生,导致GSH和SOD的耗尽。许多UC动物模型表明,富氢水有效地抑制了氧化应激,这一点通过抑制肠道中增加的MDA和MPO水平以及提高GSH和SOD水平得到了证实(表1)。血红素加氧酶-1(HO-1)是一种抗炎和抗氧化的细胞保护酶。富氢水上调HO-1的表达。文献表明,用富氢水处理导致UC小鼠体重恢复和结肠长度缩短,并且组织学炎症减少。当自由基攻击肠粘膜上皮细胞并造成损伤时,肠道紧密连接蛋白的表达降低,肠粘膜上皮屏障被破坏。这种损伤破坏了肠粘膜上皮屏障的完整性,使更多的腔内抗原被吸收,导致肠道损伤和炎症增加。UC中肠道上皮屏障的损伤和细菌生态系统的失衡导致Toll样受体4(TLR4)的异常激活,最终导致核因子κB(NF-κB)的异常激活和易位。这种异常激活触发了以白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等炎性细胞因子释放为特征的免疫应答。这些因素加速了IECs的凋亡和坏死,进一步加剧了UC中的炎症。大鼠和小鼠的UC模型表明,氢气对IL-1β、TNF-α和IL-6等炎性因子具有显著的抑制作用。富氢水显著下调了TLR-4和髓样分化因子88(MyD88)的蛋白表达,抑制了NF-κB α抑制亚基(IκBα)的磷酸化。这一发现表明,外源性氢气通过减少TLR-4/MyD88/NF-κB信号通路中的炎性因子水平,改善了肠道的炎症环境。当肠细胞暴露于炎症介质和氧化应激物质等应激因子时,会发生过度的内质网应激(ERS),导致上皮细胞的加速凋亡。这种凋亡损害了肠粘膜屏障并增加了肠上皮通透性。UC患者和动物模型的肠上皮细胞中存在过度的ERS,并且与疾病进展密切相关。富氢水显著降低了DSS模型中关键的ERS蛋白的表达,包括真核翻译起始因子2α亚基的磷酸化(P-EIF2 α)、激活转录因子4(ATF4)、剪切X盒结合蛋白1(XBP1s)和C/EBP同源蛋白(CHOP)。这些发现表明,氢气通过减少ERS和抑制过度凋亡,在缓解UC中发挥了关键作用(图1)。UC中自由基的过度激活导致严重的氧化应激,导致抗氧化剂和促氧化剂之间的平衡失调,导致细胞失去保护并受损。当IECs的损伤增加时,肠上皮屏障的破坏导致有害细菌和其他抗原侵入肠粘膜。受损的屏障吸收越来越多的腔内抗原,导致菌群失调和炎症恶化。当炎症和氧化应激信号通路被肠道损伤、细菌和相关抗原等因素激活时,下游因子加速了IECs的凋亡和坏死,导致进一步的肠道损伤和菌群失调。氢气对有毒自由基的选择性还原作用,通过增强抗氧化剂水平、降低促氧化剂水平和减少内质网应激来有效减少过度氧化应激的发生,从而保护细胞,保护肠上皮屏障。氢气还通过抑制相关炎症通路的表达和减少下游炎性因子,对肠细胞发挥保护作用。这些发现表明,氢气通过中和有毒自由基,在UC中发挥其选择性抗氧化作用。这种选择性效应有助于维持肠道氧化还原状态的平衡,减少肠上皮细胞的损伤,保护肠上皮屏障,最终缓解肠道炎症和溃疡性结肠炎的症状。
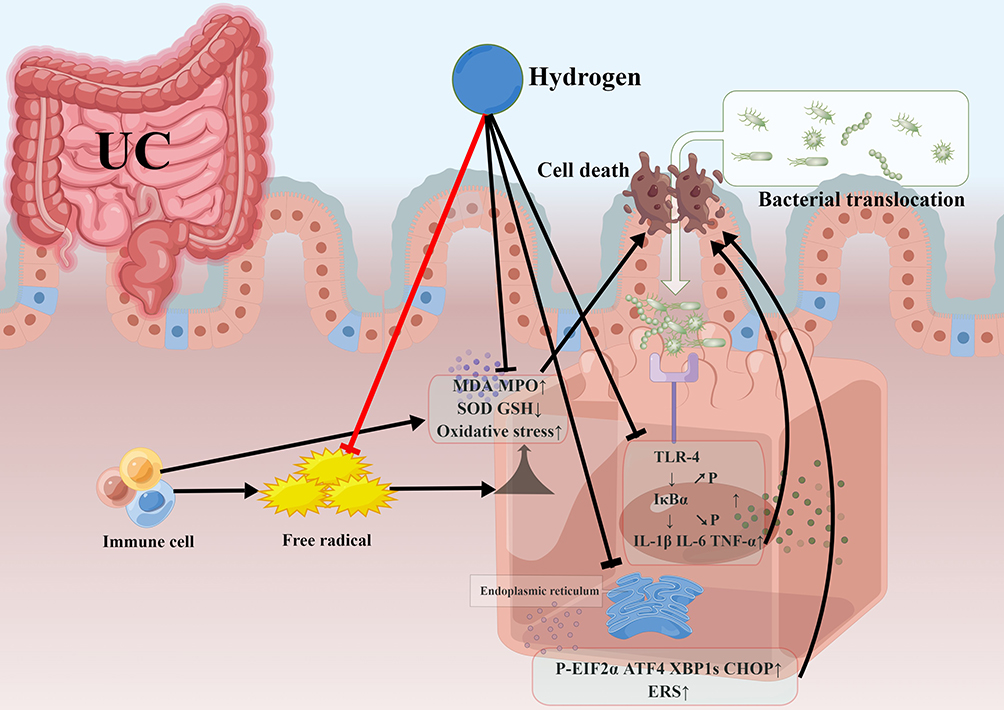
图1 氢气通过选择性的抗氧化作用维持肠道内的厌氧环境,并减少氧化损伤。氢气的功能是通过减少免疫细胞产生的过量自由基,调节氧化应激的平衡。它还通过TLR-4/MyD88/NF-κB信号通路调节内质网应激和炎症,最终保护肠道屏障并维持肠道微生物群的平衡。 Abbreviations: MDA, malondialdehyde; MPO, myeloperoxidase; GSH, glutathione; SOD, superoxide dismutase; TLR4, toll-like receptor 4; IκBα, inhibitory subunit of NF-κB α; IL-1β, interleukin-1β; IL-6, interleukin-6; TNF-α, tumor necrosis factor alpha; P-EIF2 α, phosphorylated α subunit of eukaryotic initiation factor 2; ATF4, activating transcription factor 4; XBP1s, spliced X-box binding protein 1; CHOP, C/EBP homologous protein; ERS, endoplasmic reticulum stress. This figure is original and was created using Figdraw. |
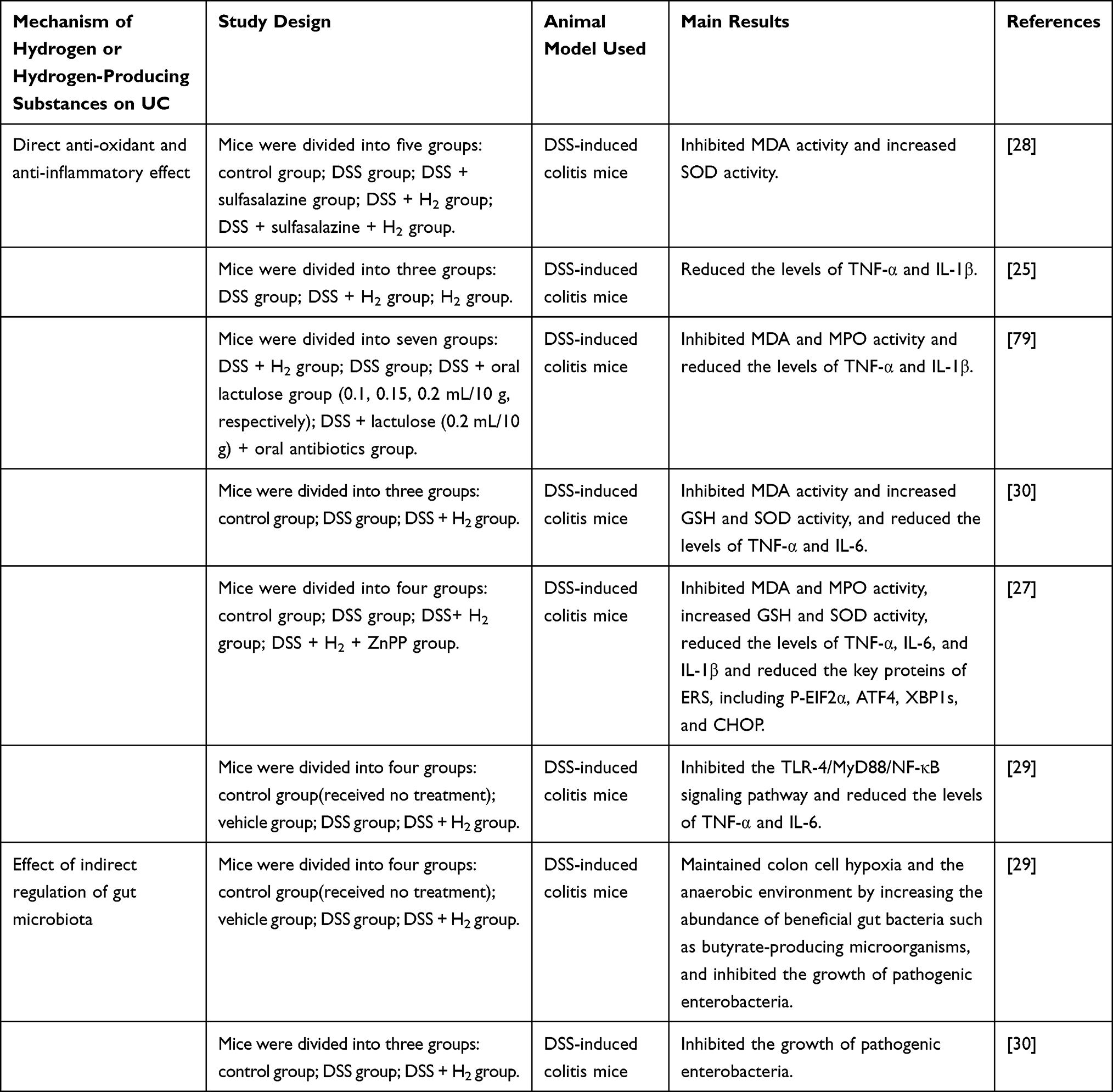
表1 氢气对结肠炎效应机制研究 |
 氢气对结肠炎氧化应激的间接调节作用
氢气对结肠炎氧化应激的间接调节作用
氢产生细菌在肠道微生物群中相对丰富。最重要的细菌是厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),它们居住在结肠中。抗性淀粉和复杂碳水化合物通过肠道细菌,如拟杆菌门和厚壁菌门,经历厌氧发酵,形成短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,这些酸被周围的上皮细胞迅速吸收,作为肠道上皮细胞的重要能量来源。氢气作为副产品产生。SCFAs有助于维持粘膜屏障的完整性,并调节炎症反应和细胞生长/分化,这有助于维持结肠上皮细胞的正常生理功能。UC肠道中的氧化应激通过过量产生ROS等物质损害正常的肠道微生物群。原始氧化还原平衡的破坏影响了肠道的厌氧环境,导致正常厌氧微生物群失衡。UC中的这种失衡表现为有益细菌拟杆菌门和厚壁菌门的整体比例下降,潜在有害细菌群,如放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的整体比例增加。肠道中产氢细菌组成的这些变化也影响了肠道氢气的产生。有益和有害肠道细菌之间的失衡破坏了肠道屏障的完整性,导致UC恶化。
作为肠道代谢的产物,氢气为氢营养菌提供了额外的底物,增加了它们的数量。这种氢营养菌数量的增加促进了肠道中的氢代谢,并导致产生额外的下游产品,包括甲烷、乙酸和硫化氢。除了改善氢营养外,消费富氢水还增加了氢分压。这种压力的增加可能会抑制肠道腔内的氧化还原电位,并导致形成厌氧环境,这有利于厌氧细菌(如拟杆菌门和厚壁菌门)和其他产SCFA细菌的生长,最终促进肠道发酵。这种发酵有利于肠道SCFAs的产生,调节肠道微生物群和宿主的代谢。氢分子和产氢物质通过调节微生物群紊乱有效缓解溃疡性结肠炎(表1)。
李歌等人最近的一项研究使用DSS模型来研究氢分子对肠道微生物群稳态和厌氧环境的具体影响。实验表明,富氢水激活了上皮过氧化物酶体增殖激活受体γ (PPAR-γ)的表达,降低了一氧化氮合酶2 (NOS2)和诱导型一氧化氮合酶 (iNOS)的表达,抑制了结肠中乳酸、硝酸盐的产生和致病肠杆菌的生长。氢通过增加产丁酸微生物的数量,维持结肠细胞缺氧和肠道厌氧环境,而厌氧肠道环境的形成抑制了兼性厌氧细菌的扩张。富氢水可能会改变特定粘液相关的粘蛋白分解细菌的丰度,以防止结肠粘液的恶化,这改善了肠道屏障功能和受干扰的肠道微生物群。这种影响是因为覆盖肠道上皮细胞的富含糖蛋白的粘液层是对抗共生微生物和入侵病原体的第一道防线。在使用慢性UC模型的实验中,富氢水有效地阻碍了粪肠球菌、产气荚膜梭菌和脆弱拟杆菌的生长。治疗组的相对丰度与正常对照组(NC)相似,这表明富氢水抑制了肠道中的有害细菌,为正常细菌群落的生存提供了有利环境,并减少了竞争压力。值得注意的是,抗生素处理后,富氢水对结肠炎的保护作用可能被削弱,这突出了肠道微生物群在介导氢分子有益效果中的重要作用(图2)。
氢促进肠道上皮屏障的修复,并保护肠道细胞,最终减少肠道损伤,并防止由有害细菌和其他抗原侵入肠道粘膜引起的细菌移位。氢在肠道中有选择地减少过量的自由基,这减少了自由基对正常肠道微生物群的损害。氢促进肠道中的氢代谢,改善氢营养,并逆转UC中氢循环的中断。氢对肠道氧化还原电位的抑制有利于肠道正常厌氧细菌的生长。恢复正常的肠道微生物群和减少有害微生物群也有助于恢复肠道炎症平衡和氧化还原平衡。主要的产氢细菌(如拟杆菌门和厚壁菌门)的数量和比例增加,内源性氢气的产生也可能恢复。这些研究表明,氢对UC具有直接和间接的治疗作用,这些作用可能是相互影响的。肠道微生物群的变化与免疫、炎症、氧化应激、内质网应激和细胞死亡等多种因素密切相关。氢通过恢复氢循环和使肠道环境和肠道微生物群正常化,充当肠道中的“稳态调节器”。这种正常化过程减少了有害细菌对肠道上皮屏障造成的损害,促进了肠道正常厌氧细菌的维持,并最终改善了肠道上皮屏障的完整性。这些发现也支持氢作为溃疡性结肠炎治疗靶标的潜力。
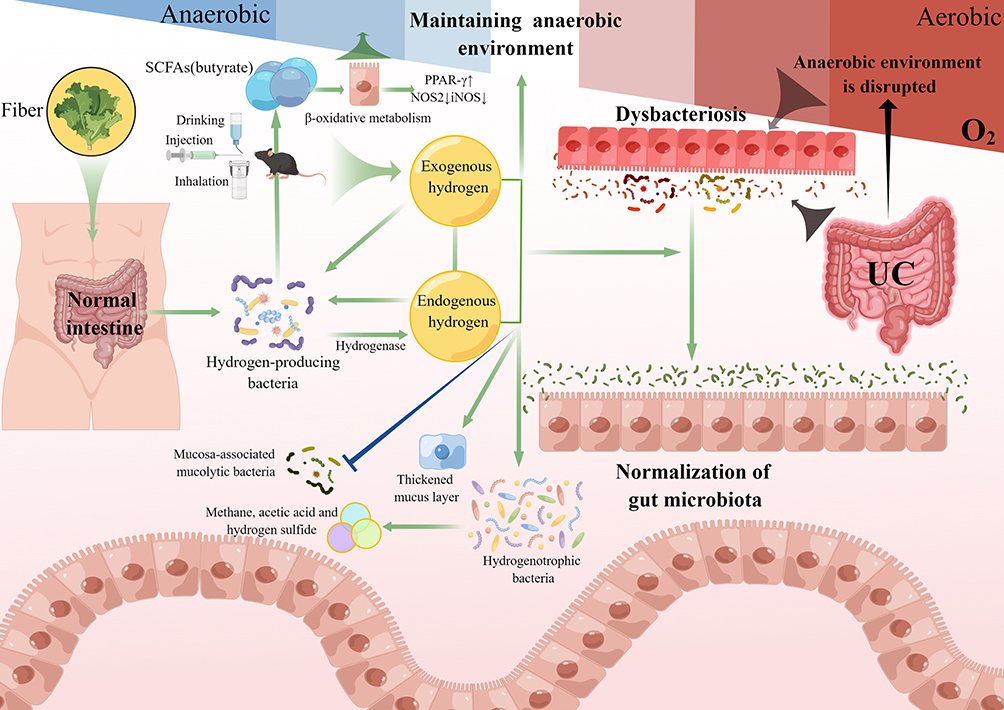
图2 氢气维持肠道微生物群的平衡,并在溃疡性结肠炎中发挥稳态调节作用。内源性产生的氢气和外源性补充的氢气相互影响,改善氢营养,这有利于通过改善肠道氧化应激来促进正常肠道微生物群的生长。它促进了肠道中短链脂肪酸的产生,这进一步维持了肠道中的正常厌氧环境。由Figdraw绘制。 Abbreviations: UC, ulcerative colitis; SCFAs, short-chain fatty acids; PPAR-γ, peroxisome proliferator-activated receptor γ; NOS2, nitric oxide synthase 2; iNOS, inducible nitric oxide synthase; O2, oxygen. This figure is original and was created using Figdraw. |
氢气治疗结肠炎研究存在的局限性
关于使用氢气治疗溃疡性结肠炎(UC)的研究存在许多局限性。首先,氢气在治疗UC中的作用机制研究仅限于相关指标的表层变化。需要更多的研究来探索氢气具体是如何发挥其抗氧化作用,它是如何作用于宿主细胞如免疫细胞和上皮细胞,它与肠道微生物群如何相互作用,以及涉及的详细信号转导途径。其次,关于氢气和产氢物质对UC影响的动物和细胞实验缺乏。同时也缺乏大样本、多中心临床随机对照研究和证据。需要进一步的研究来阐明氢气作用的潜在机制,特别强调其抗氧化效果,因为它可能在治疗溃疡性结肠炎中发挥关键作用。
结论
越来越多的证据表明,由溃疡性结肠炎引起的氧化应激可能导致肠道屏障的破坏和肠道菌群的紊乱,这可能是由于自由基的攻击、肠道还原潜力的变化,以及肠道厌氧环境的破坏。氢气作为肠道厌氧细菌的产物,选择性地减少高活性自由基以恢复肠道环境的氧化还原平衡,这最终保护了肠道上皮屏障并使肠道微生物群正常化。这些发现强调了氢气在调节UC发病机制中的重要性。研究氢气在溃疡性结肠炎中的具体作用机制将为UC的预测、诊断和治疗工具的开发提供深刻的见解。
Hydrogen regulates ulcerative colitis | JIR (dovepress.com)
https://blog.sciencenet.cn/blog-41174-1421632.html
上一篇:生物体系中氢气和氧气会不会相互作用?
下一篇:精准癌症治疗新策略:尝试一切