博文
血管周围成纤维细胞可能是ED的基础
|
伟哥的发明让人对血管内皮细胞在勃起功能方面的印象深刻,可能掩盖了重要信息,最近研究发现,血管周围成纤维细胞也具有重要的贡献。正常情况下,肾上腺素是血管收缩的关键因素,也是勃起的负向调节因子,最新研究发现血管周围的成纤维细胞存在肾上腺素的灭活机制,这也是勃起功能的重要因素。如果说内皮细胞释放的一氧化氮是油门,肾上腺素就是刹车。而成纤维细胞的功能就是解除刹车的作用。这一新发现给某些ED功能障碍的治疗提供了新的策略。
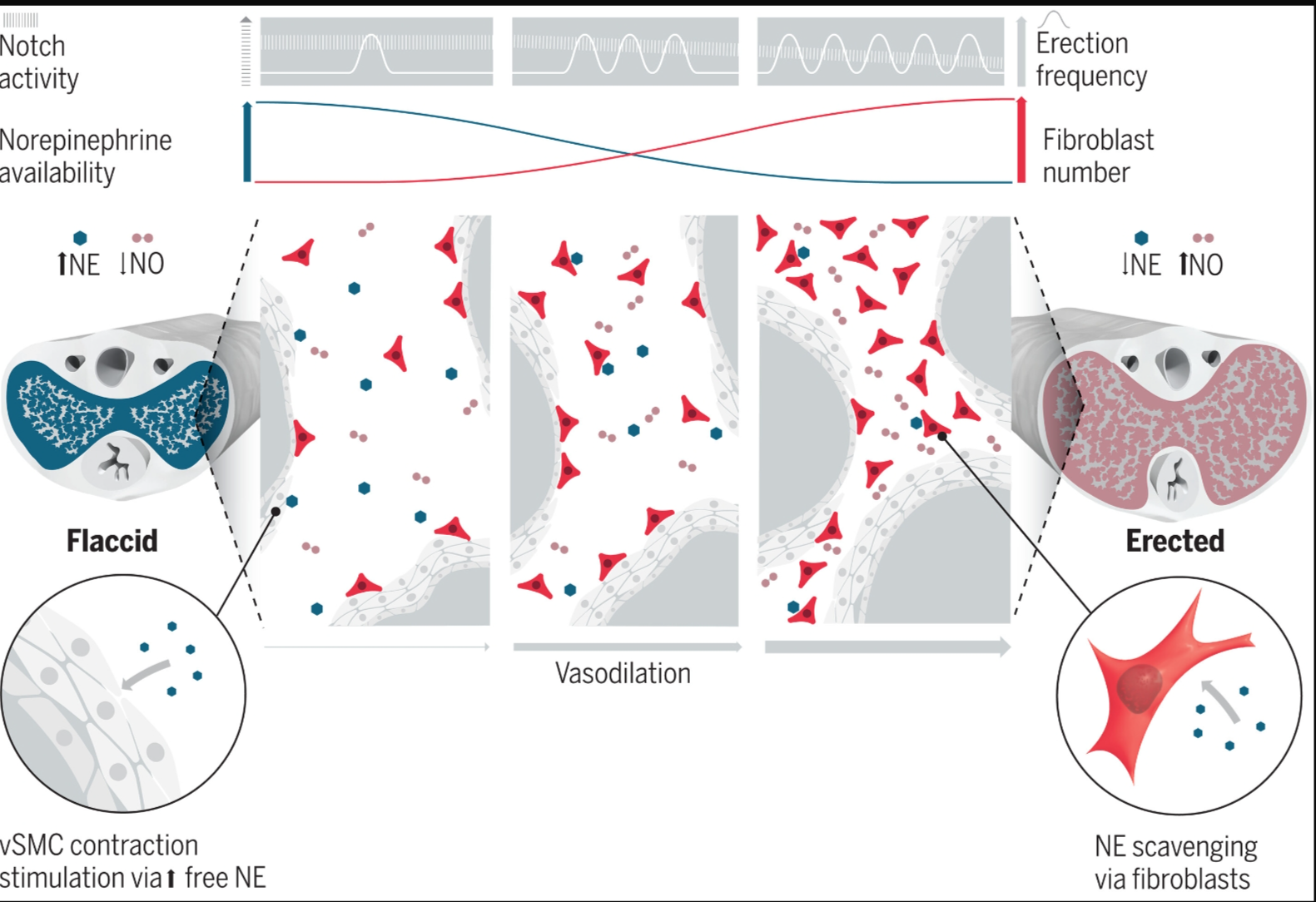
男性的性健康取决于勃起的能力,而勃起可能会受到衰老和慢性疾病(包括糖尿病和动脉粥样硬化)的影响。勃起是由乙酰胆碱和一氧化氮诱导的供应动脉和海绵状海绵体组织扩张和平滑肌松弛所致。勃起的程度和持续时间取决于这些血管扩张剂和血管收缩剂去甲肾上腺素之间的平衡。 在本期《科学》的第 604 页,Linck Guimaraes 等人报告说,表达高亲和力氨基酸转运蛋白 SLC1A3(溶质载体家族 1,成员 3)的血管周围成纤维细胞对小鼠的勃起至关重要,因为它们会降低去甲肾上腺素的可用性,从而促进海绵体的扩张。老年小鼠中SLC1A3血管周围成纤维细胞的数量减少,从而减少了血流量。由于小鼠和人类的勃起机制相似,因此这些发现可能与老年男性的勃起功能障碍有关。
Linck Guimaraes 等人报告说,在他们的转基因小鼠模型中,SLC1A3 成纤维细胞增殖通过抑制反复勃起期间的 Notch 信号传导而增加,这在极端情况下导致缺血性异常勃起(一种以持续和疼痛勃起为特征的疾病,海绵体高度僵硬)。相比之下,连续的Notch激活减少了SLC1A3成纤维细胞的数量和血流量。这些成纤维细胞主要分布在海绵体的血管和平滑肌上。作者表明,SLC1A3成纤维细胞通过SLC6A2吸收去甲肾上腺素,并通过细胞间单胺氧化酶A的活性降解去甲肾上腺素,从而降低去甲肾上腺素的可用性。
大多数勃起功能障碍的治疗方法可促进一氧化氮介导的海绵体血管平滑肌松弛。西地那非、他达拉非、伐地那非和其他 5 型磷酸二酯酶 (PDE5) 抑制剂通过阻断下游信号转导信使环磷酸鸟苷 (cGMP) 降解为 GMP 来增强一氧化氮的平滑肌松弛作用。然而,尽管PDE5抑制剂被广泛使用,但未能恢复多达30%的男性勃起,导致治疗选择有限。
Corpora cavernosa fibroblasts mediate penile erection | Science
在寻找有效的替代方法时,使用黑皮质素或多巴胺受体激动剂靶向中枢通路或使用可溶性鸟苷酸环化酶激活剂、视激酶抑制剂或钾通道打开剂靶向外周通路的临床试验尚未显示出足够的益处来获得该用途的批准。这种失败主要是由于与已批准的 PDE5 抑制剂相比,缺乏更高的疗效或更少的副作用 。
顽固性勃起功能障碍的新治疗前景
表达溶质载体家族 1 成员 3 (SLC1A3) 的成纤维细胞通过 SLC6A2 转运蛋白摄取去甲肾上腺素,导致其降解并促进小鼠勃起。因此,揭示了治疗人类难治性勃起功能障碍的各种潜在方法。

尽管Linck Guimaraes等人没有对人类进行检查,但他们的研究揭示了一种新的治疗范式,即创造增加去甲肾上腺素摄取或减少血管周围成纤维细胞Notch信号传导的条件,这可以转化为治疗对PDE5抑制剂无反应的患者的勃起功能障碍。因此,可以通过进一步的临床前测试来探索多种策略,如果有希望,可以进行临床评估。一种方法是使用可用的Notch抑制剂抑制海绵体SLC1A3成纤维细胞中的Notch信号转导(见图)。一个潜在的限制因素是,这种抑制剂的局部给药也会影响内皮细胞、平滑肌细胞、神经元和其他细胞类型,其中Notch信号转导参与勃起,但在机制上与成纤维细胞中的Notch信号转导不同。
其他方法可能包括增加去甲肾上腺素转运蛋白 SLC6A2 在海绵体 SLC1A3 血管周围成纤维细胞中的表达。然而,必须表征 SLC6A2 表达的调控机制知之甚少。另一种方法是在海绵体中植入自体 SLC1A3 成纤维细胞。然而,目前尚不清楚与海绵体相关的植入 SLC1A3 成纤维细胞的数量是否足以具有持续的 SLC6A2 去甲肾上腺素摄取活性,并且在功能上足以纠正勃起功能障碍。此外,可以开发一种神经或机械刺激器,通过增加勃起频率来扩大血管周围 SLC1A3 成纤维细胞的数量。疗效将取决于确定尚未确定的刺激参数,以促进表达 SLC6A2 的 SLC1A3 成纤维细胞的增殖。
这些新方法将需要严格的临床前和临床测试,以将在转基因小鼠身上观察到的成果转化为对男性安全有效的疗法。还需要进行其他研究来表征不同勃起功能障碍患者中海绵体成纤维细胞的异质性,其中纤维化、内皮细胞损伤、平滑肌转分化和其他异常可能是促成因素。然而,这些挑战被现有替代方案的缺点所抵消,这些替代方案涉及侵入性手术,例如将血管扩张剂注射到海绵体或手术植入假体。
可能的新干预措施不应掩盖以下证据:定期进行体育锻炼可以通过增加一氧化氮合酶的表达和活性、增强内皮细胞功能以及减少压力和焦虑来改善勃起功能 。运动和生活方式的改变可能会增加血管周围 SLC1A3 成纤维细胞的数量及其 SLC6A2 的表达。这些变化是频繁勃起的自然结果,但在勃起不频繁时会受到抑制。虽然勃起可能是维持血管周围SLC1A3成纤维细胞所必需的,但尚不清楚这是否需要有规律的性活动,或者夜间肿胀是否足够。如果久坐不动和性活动不足导致这些成纤维细胞减少,海绵体对去甲肾上腺素的敏感性增加,那么定期运动、性活动和其他生活方式的改变应该有助于性功能障碍。
编辑总结
海绵体是大量血管组织,可以充满血液,从而在刺激时扩大,形成勃起所需的结构。通过研究这一过程在小鼠中的潜在机制,Guimaraes等人确定海绵体中的血管周围成纤维细胞在勃起生理学中起关键作用。去甲肾上腺素是一种血管收缩剂,可在基线时限制血流,而性唤起释放的血管扩张剂可抵消其作用,从而实现勃起。复发性勃起活动下调Notch信号传导,从而增加血管周围成纤维细胞的数量,然后这些成纤维细胞抑制血管收缩性去甲肾上腺素信号传导。相反,衰老与这些成纤维细胞的减少有关,从而增加勃起功能障碍的风险。——叶夫根尼娅·努西诺维奇
结构化摘要
介绍
勃起是对性功能至关重要的生理过程,依赖于海绵体 (CC) 海绵状血管床内血流的复杂调节。在松弛的阴茎中,血管收缩剂去甲肾上腺素的交感神经释放可维持血管平滑肌细胞的强直收缩,从而限制阴茎血流。性唤起时,一氧化氮和乙酰胆碱从副交感神经中释放,通过血管平滑肌细胞的松弛介导血管舒张。流入的血液充满 CC,导致勃起。尽管内皮细胞和血管平滑肌细胞在勃起过程中的重要性已得到公认,但 CC 中大量的成纤维细胞在很大程度上被忽视了。
理由
成纤维细胞是人类CC中最大的细胞群,但它们的生理功能在很大程度上仍未得到探索。我们的目的是阐明CC成纤维细胞对血流调节的贡献。通过清除组织中的单细胞基因表达谱和组织学分析对 CC 成纤维细胞进行表征,揭示了它们在勃起组织中的异质性和整合性。利用遗传靶向和光遗传学诱导的成纤维细胞去极化,我们发现成纤维细胞积极参与血流的调节。此外,通过使用对负责觉醒的大脑区域进行化学遗传学调节来长期改变勃起频率,我们解决了勃起复发对成纤维细胞数量和血流调节的影响。最后,我们研究了成纤维细胞的数量是否因衰老而改变,以及成纤维细胞数量的减少如何影响血流。
结果
我们的研究表明,CC中的成纤维细胞通过调节去甲肾上腺素的可用性在支持血管舒张方面起着关键作用。这个过程的功效取决于成纤维细胞的数量,成纤维细胞的数量受勃起活动的调节。勃起会暂时改变整个 CC 细胞的空间排列,导致成纤维细胞中 Notch 信号传导的下调。抑制成纤维细胞中Notch信号转导导致成纤维细胞数量的显着增加,这可能导致异常勃起的特征性长期勃起。组成型活性Notch信号转导可减少成纤维细胞数量并降低血液灌注。提高勃起频率可减少Notch信号传导,增加成纤维细胞数量并促进血管舒张。相反,勃起复发的减少会增加Notch信号传导,减少成纤维细胞的数量并减少血液灌注。衰老是勃起功能障碍的主要危险因素之一,可减少成纤维细胞的数量并限制血液灌注。年轻动物中成纤维细胞的减少模仿了老年动物的血流表型。
结论
成纤维细胞以前被认为是静态和均质细胞,现在正在成为动态和异质的细胞群。我们发现CC成纤维细胞充当关键的血流调节剂,将血管扩张剂和血管收缩剂去甲肾上腺素之间的平衡转向血管舒张。Notch信号转导作为协调成纤维细胞周转、去甲肾上腺素敏感性以及最终勃起过程的中心枢纽。成纤维细胞数量的动态调节与勃起复发相结合,强调了勃起功能的可塑性。这种正反馈循环可能会加剧衰老或糖尿病等慢性病的勃起功能障碍。事实上,我们对老年动物的观察表明,成纤维细胞数量减少与勃起功能障碍之间存在潜在联系,这突出了了解勃起细胞机制的临床相关性。总体而言,本研究为调节勃起提供了机制,并为性健康领域的进一步研究奠定了基础。
https://blog.sciencenet.cn/blog-41174-1421413.html
上一篇:碱性水电解绿氢技术
下一篇:过敏特异性B记忆细胞