博文
氢气吸入对体外循环后血管内皮糖萼厚度的影响
|
糖萼是对由细菌、上皮细胞,或其他细胞分泌的,覆盖在细胞表层的粘稠物的统称。鱼类表皮的粘液就是一种糖萼。这个名词的本意是指覆盖在上皮组织表面的,由上皮细胞分泌的多糖结构。介于荚膜和粘液层之间的结构称为糖萼。
糖萼(glycocalyx)是覆盖于血管内皮细胞顶膜表面的多糖蛋白复合物的总称。它通过一些主干支柱与内皮细胞连接,这些支柱包括蛋白聚糖(proteoglycans)和糖蛋白(glycoproteins)。二者相互作用形成一个网状结构,这样一些血浆源性和内皮细胞源性的可溶性生物大分子并入此网络构成糖萼基本结构。可溶性的血浆成分直接或间接(通过蛋白聚糖和粘多糖)相连。在糖萼的可溶性成分与血浆之间存在一个动态的平衡,这种平衡持续的影响着糖萼的组成和和厚度,同时糖萼收到酶和剪切力的作用不断脱落,同时生成与脱落之间新的动态平衡。
炎症几乎是所有疾病的共同基础,炎症反应达到一定规模,会导致系统炎症。炎症反应会产生一系列的病理生理过程,血管内皮细胞是参与局部和全身炎症反应的重要成分,炎症反应过程也会导致内皮细胞自身的破坏,其中一个典型的损伤特征就是血管内皮糖萼消耗,这会导致血管内皮细胞功能下降,带来更严重的损伤和后果。因此如何保护血管内皮糖萼,应该作为一个重要的抗炎症损伤策略。
氢气的抗炎症效应是最近发现的新现象,又因为氢气对人体的极大安全性,适合于多种病理过程,尤其是非特异性病理过程的干预策略。例如慢性代谢性炎症是许多慢性病的普遍表现,而慢性病由于病程长,损伤不剧烈,导致难以使用副作用大的强效抗炎症药物,但长期慢性炎症依然会导致血管内皮糖萼等的破坏。使用氢气作为一种长期抗炎症干预工具,如果能有效保护血管内皮糖萼,将对于许多慢性病导致的血管等末梢器官损伤带来重要价值。长期使用氢气对血管的保护,对糖尿病后心脏肾脏视网膜等器官的保护作用,也从另一个角度,证明了氢气抗慢性炎症的价值。
最近日本学者采用体外循环这种全身炎症导致的血管内皮糖萼损伤,观察到氢气吸入对血管内皮糖萼损伤的保护效果。给氢气预防慢性病血管和器官损伤提供了新的证据。
论文摘要
体外循环 (CPB) 会导致全身炎症和内皮糖萼损伤。氢气具有抗氧化和抗炎特性;因此,我们假设氢气可以减轻CPB引起的内皮糖萼损伤。将28只雄性Sprague-Dawley大鼠随机分为4组(每组n = 7),分别为:假手术组、对照组、2%氢气组和4%氢气组。对大鼠进行 90 分钟的部分 CPB,然后观察 120 分钟。在氢气组中,CPB期间通过呼吸机和人工肺给药,CPB后通过呼吸机给药60分钟。观察后,进行采血、肺提取、灌注固定,电镜测量心、肺、脑内皮糖萼厚度。4%氢组(5.7 ± 4.4 pg/mL)的血清糖萼成分syndecan-1浓度低于对照组(19.5 ± 6.6 pg/mL)和2%氢(19.8 ± 5.0 pg/mL)组(P < 0.001),但与假手术组(6.2 ± 4.0 pg/mL,P = 0.999)无显著差异。 4%氢气组心肺内皮糖酵母较对照组厚。与对照组相比,4%氢组血清和肺组织中的炎性细胞因子浓度(白细胞介素-1β和肿瘤坏死因子-α)较低,血清丙二醛浓度也较低。与对照组相比,2%氢组血清syndecan-1浓度差异无统计学意义。然而,观察到血清和肺组织炎性细胞因子浓度以及血清丙二醛浓度的非显着降低。通过人工肺和自体肺施用 4% 氢气可减轻大鼠部分 CPB 引起的内皮糖萼损伤,这可能是由氢的抗炎和抗氧化特性介导的。
Iwata H, Katoh T, Truong SK, Sato T, Kawashima S, Mimuro S, Nakajima Y. Hydrogen attenuates endothelial glycocalyx damage associated with partial cardiopulmonary bypass in rats. PLoS One. 2023 Dec 19;18(12):e0295862.
介绍
体外循环 (CPB) 是一项必不可少的心血管手术。然而,CPB会引起全身炎症,其特征是广泛的血管内皮活化和弥漫性内皮功能障碍,并且已知会损害内皮糖萼。糖萼是覆盖血管内皮细胞表面的一层。 糖萼具有多种功能,包括血管通透性调节和炎症反应抑制。 糖萼的降解暴露了血管腔内的粘附分子,并引发了中性粒细胞与血管内皮之间的反应。糖萼的一种成分syndecan-1的血液浓度与糖萼降解有关,并与血液中炎性细胞因子的浓度相关。 糖萼受损与CPB后炎症反应加重和持续的微循环灌注障碍有关。因此,保护糖萼在CPB中很重要。
氢选择性地清除活性氧(ROS),并具有抗氧化、抗炎和抗凋亡特性。 但它并不抑制生理活动所必需的ROS的作用。虽然氢气易燃,但在空气和氧气中的浓度为<4.1%时是安全的。氢气的治疗效果已在动物的各种病理条件下得到验证。关于CPB,Fujii等人报道,通过人工肺给予1.4%的氢气可抑制大鼠CPB期间的炎症反应。然而,目前尚不清楚氢气是否能减轻CPB引起的内皮糖萼损伤。
我们旨在阐明氢对CPB大鼠模型中内皮糖萼损伤的影响。我们假设氢气可以减轻 CPB 引起的内皮糖萼损伤。为了验证这一假设,我们通过电子显微镜评估了心脏、肺和大脑中的血清 syndecan-1 浓度和内皮糖萼厚度。
材料与方法
本研究已获得滨松大学医学院动物实验伦理委员会和实验动物设施的批准。该研究符合《实验动物护理和使用指南》。雄性Sprague-Dawley大鼠(12至13周龄,体重380.2至404.3g)用于本研究。所有手术和程序均在异氟烷麻醉下进行,并尽一切努力将疼痛降至最低。动物被饲养在受控温度(24°C)下,光暗循环12-12小时,自由获取水和食物。
动物分组
将28只大鼠按简单的随机化方法随机分为4组(n=7/组),分别为:假手术组、对照组、2%氢组和4%氢气组。假手术包括静脉和动脉插管和肝素化,没有CPB。用5.0%异氟醚麻醉动物。在达到充分麻醉后,用14号静脉导管插管大鼠,并使用小动物呼吸机进行机械通气,空气 - 氧气混合物(吸入氧分数= 0.4)。呼吸频率为60次/min,潮气量为8 mL/kg,呼气末正压为3 cmH2O.在手术和 CPB 期间,用 2% 异氟醚维持麻醉以达到足够的麻醉深度。所有手术均采用标准无菌技术进行。使用加热灯和强制空气对流系统监测和调节直肠温度± 37.0°C 0.2°C。
尾动脉用 22 号静脉导管 插管作为 CPB 的动脉流入插管。用 22 号静脉导管插管右股动脉,用于动脉血压监测和血气分析。用改良的 15 号静脉导管插管右颈外静脉作为 CPB 的静脉流出。肝素(200IU)通过静脉插管给药。
CPB回路由静脉插管、储血器、定制滚筒泵、人工肺和动脉流入插管组成。用 10 mL Voluven灌注。在储液罐的顶部,插入一根 18 号针,并与由蠕动泵头、步进电机、压力传感器和单芯片微机组成的定制负压发生器连接。
实验方案
手术插管和肝素化后,将动物连接到CPB回路。稳定15分钟后,启动负压发生器,在静脉储液器中产生负压,缓慢启动体外循环。逐渐增加负压,将滚筒泵转速提高到100mL/kg/min(约占大鼠心输出量的60%)[23])。一旦达到这个流速,呼吸频率降低到20次/分钟,吸入氧的分数变为1.0。CPB 进行了 90 分钟。流向人工肺的气流由100%氧气(400毫升/分钟)和2%异氟烷组成。在CPB期间没有大鼠接受额外的注射。CPB完成后,呼吸频率增加至60次/分钟,大鼠脱离CPB。在与CPB回路断开之前,将储液器中的血容量调整到与初始血容量相同。然后,拔除右侧颈外静脉和尾动脉导管。在全身麻醉下对大鼠再随访120分钟。观察期间不需要输注大鼠。氢组中的大鼠从CPB开始到CPB结束后1小时接受选定浓度的氢。氢气由HGE-1A提供,在CPB期间通过呼吸机和人工肺给药,在CPB之后通过呼吸机给药。根据总新鲜气体流量控制生产速率,以获得所需的氢气浓度。
持续监测平均动脉压、心率和体温。它们在 CPB(基线)开始之前、CPB 开始 45 分钟和 90 分钟以及 CPB 后 60 分钟和 120 分钟记录。在同一时间点进行动脉血气分析。
样品采集
观察完成后,所有大鼠均在麻醉下行开胸手术。结扎并切除右肺下叶。将一根 22 号导管插入下腔静脉,抽取 6 mL 血液。然后,通过钳夹肺门切除左肺。在右心房切开一个切口后,将一根 21 号针插入心尖,并以 8 mL/min 的速度灌注磷酸盐缓冲盐水2 分钟,以洗掉全身的血液。随后,以 8 mL/min 的速率灌注固定液5 分钟。灌注后切除右肺、心脏和大脑。切除右肺上叶、左心室心肌和大脑皮层,在4°C下浸泡在固定/染色液中24小时。 经过适当的组织处理后,制成超薄切片。
使用Centrifuge 5425 R在4°C下以1,000 × g离心20分钟收集血清,并在-80°C下储存直至使用。测量左肺的下部,并以 5% (w/v) 的比例加入含有蛋白酶混合物抑制剂的 RIPA 缓冲液。使用 Physcotron 手持式均质器匀浆 1 分钟,使用 Power Sonic 50 型匀浆 5 分钟,然后在 4°C 下以 13,000 × g 离心 15 分钟(Centrifuge 5425 R,Eppendorf)。收集上清液并储存在-80°C直至分析。
糖萼降解成分分析。
使用酶联免疫吸附测定 (ELISA) 试剂盒测定血清 syndecan-1 测量糖萼降解。
内皮糖萼厚度测定。
通过透射电子显微镜。为每个器官随机选择10个灌注血管,并捕获图像。测量镧染色面积和血管周长,将两者测量值的比值定义为平均糖萼厚度。
炎症因子测定。
通过ELISA测量血清和肺组织中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNFα)的浓度。
氧化应激指标分析。
血清丙二醛 (MDA) 通过 ELISA 测量。MDA是由氧化应激引起的脂质代谢的最终产物,据说MDA的水平与自由基诱导的损伤有关。
肺部组织学观察。
将左肺上部包埋在石蜡中,切成 3 μm 切片,并用抗髓过氧化物酶 (MPO) 抗体染色。使用NanoZoomer S60对载玻片进行数字化。使用 HALO(美国新墨西哥州阿尔伯克基 Indica Labs)确定切片中 MPO 阳性细胞与总细胞的比率,并用作中性粒细胞活化的量度。
肺干湿重比测定。
肺湿干重量比作为肺水肿的衡量标准。切除后立即称量右下叶,在75°C烘箱中干燥组织72小时后记录干重。
统计学分析
使用 G* power 软件进行功效分析,以确定所需的试样数量。根据我们关于氢的糖萼保护作用的报道,d的效应大小为1.52。假设样本量比为1,统计功效为1 − β = 0.8以确定显着差异(α = 0.05),则每组需要7只动物。
主要结局是血清syndecan-1浓度,次要结局是心脏、肺和脑的内皮糖萼厚度;分子生物学结果;和免疫组化结果。使用 Shapiro-Wilk 检验检验变量的正态性。正态分布的数据表示为平均值±标准差,非正态分布数据表示为中位数(四分位距 [第 25-75 个百分位数])。对于四组之间的比较,使用单因素方差分析分析参数数据,然后使用Tukey-Kramer多重比较检验进行分析。当数据呈非正态分布时,使用 Kruskal-Wallis 检验,然后使用 Steel-Dwass 多重比较检验。P < 0.05(双尾)被认为具有统计学意义。使用JMP for Windows进行统计分析。
研究结果
生理指标测量
假基组、对照组、2%氢组和4%氢组的体重分别为394.3±7.9 g、392.5 ± 6.4 g、391.2 ± 7.1 g和396.3 ± 3.1 g。四组间差异无统计学意义。生理值详见表1。基线时所有组的数据相似。在CPB期间,接受CPB的三组的血细胞比容低于假手术组。假手术组的乳酸低于其他三组。观察结束时,假手术组平均动脉压高于其他3组。4%氢气组的心率低于2%氢气组和对照组,与假手术组无显著差异。4%氢气组的乳酸含量低于对照组,与假手术组无显著差异。
CPB后内皮糖萼降解
4%氢组血清syndecan-1低于对照组和2%氢组(P < 0.001),与假手术组差异无统计学意义(P = 0.999)。2%氢气组和对照组无显著差异(P = 0.999),两组均表现出高于假单<0.001的syndecan-1浓度(P 0.001)(图1)。
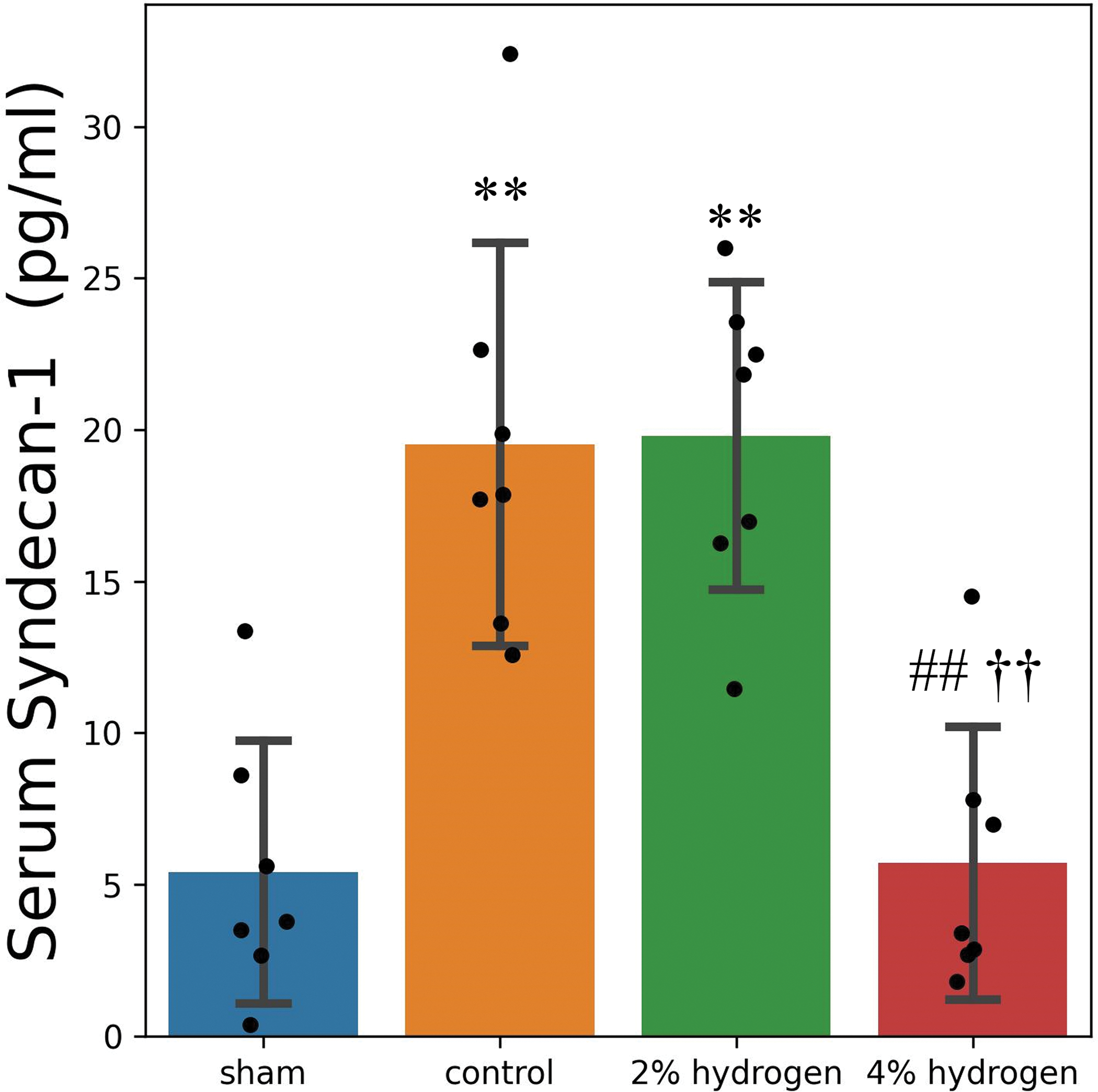
图1血清syndecan-1浓度.
CPB 后心脏、肺和大脑中的内皮糖萼厚度。
4%氢组心脏内皮糖萼较对照组厚(P = 0.016),2%氢组与对照组(P = 0.843)、2%氢组与假手术组(P = 0.276)、对照组与假手术组(P = 0.060)差异无统计学意义(图2)。

图 2. CPB 对心脏内皮糖萼的损害和氢气的影响。
4%氢组肺内皮糖萼比对照组厚(P = 0.025),对照组比假手术组薄(P = 0.036)。2%氢气组与对照组无显著差异(P = 0.577)(图3)。
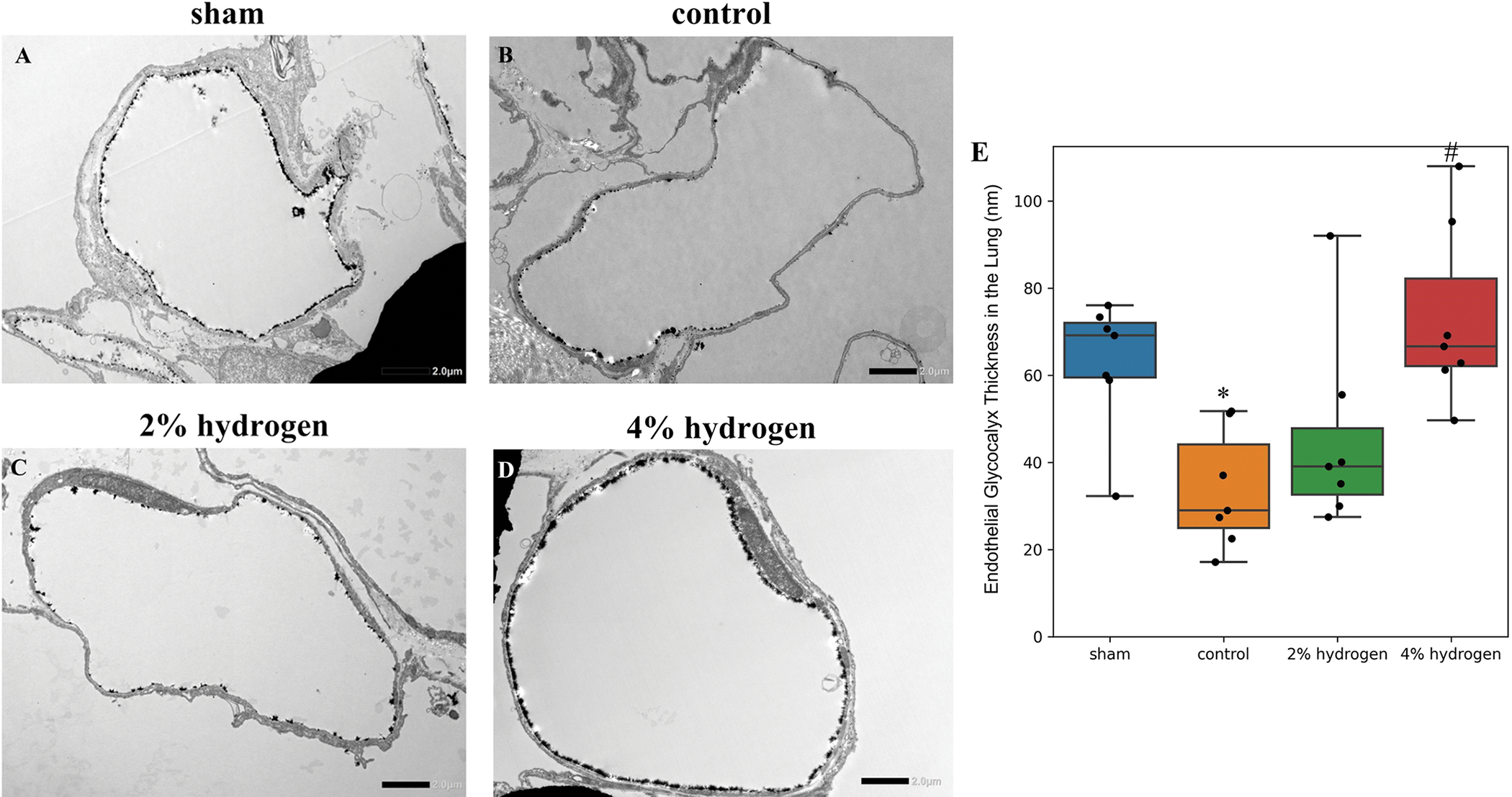
图 3. CPB对肺内皮糖萼的损害和氢气的影响。
对于脑内皮糖萼,四组间差异无统计学意义(P = 0.884)(图4)。

图 4. CPB对大脑内皮糖萼的损害和氢的影响。
血清炎性细胞因子和氧化应激
血清IL-1β在4%氢组的7个样本和假组的3个样本中低于可测量范围。假设ELISA(R&D Systems Inc.)的最小可检测值为5.0 pg/mL,则4%氢组的血清IL-1β低于对照组和2%氢组(P = 0.005),并且与假手术组没有显著差异(P = 0.133)。2%氢气组和对照组之间没有显著差异(P = 0.697),两组的IL-1β浓度均高于假手术组(P = 0.011)(图5)。
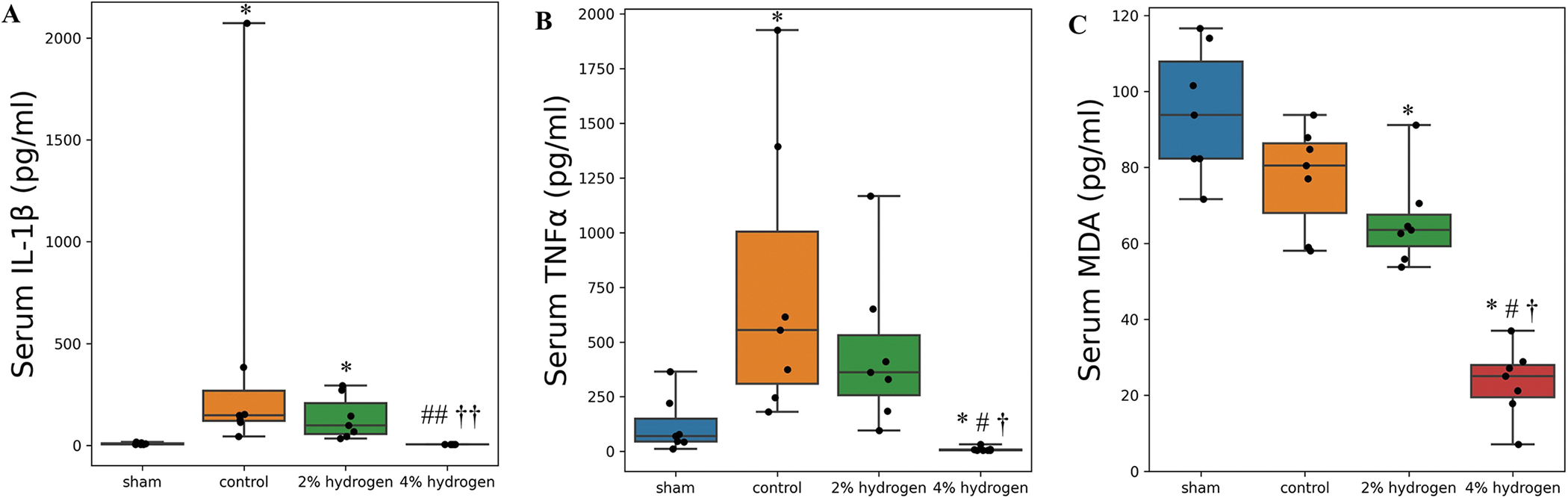
图 5. 血清 IL-1β、TNFα 和 MDA 浓度。
来自4%氢组的4个样本的血清TNFα低于可测量范围。假设ELISA(R&D Systems Inc.)的最小可检测值为5.0 pg/mL,则4%氢组的TNFα低于对照组、2%氢组和假手术组(分别为P = 0.010、P = 0.010和P = 0.015 )。对照组血清TNFα高于假手术组(P = 0.036),与2%氢组(P = 0.869)无显著差异(图5)。
4%氢组的血清MDA低于对照组、2%氢组和假手术组(P=0.011)。2%氢组血清MDA低于假手术组(P = 0.036),与对照组差异无统计学意义(P = 0.577)。对照组和假手术组之间没有观察到显着差异(P = 0.378)(图5)。
肺组织炎症
在对照组的一只动物中,固定剂污染了肺组织导致ELISA和病理学评估不准确,因此该动物的肺组织评估被认为是缺失的数据。
肺组织炎性细胞因子表达。
4%氢组肺组织中的IL-1β低于对照组和2%氢组(分别为P = 0.017和P = 0.011),与假手术组相比无显著差异(P = 0.417)。2%氢气组和对照组无显著差异(P = 0.918),两组的IL-1β浓度均高于假手术组(P = 0.036和P = 0.017 )(图6)。
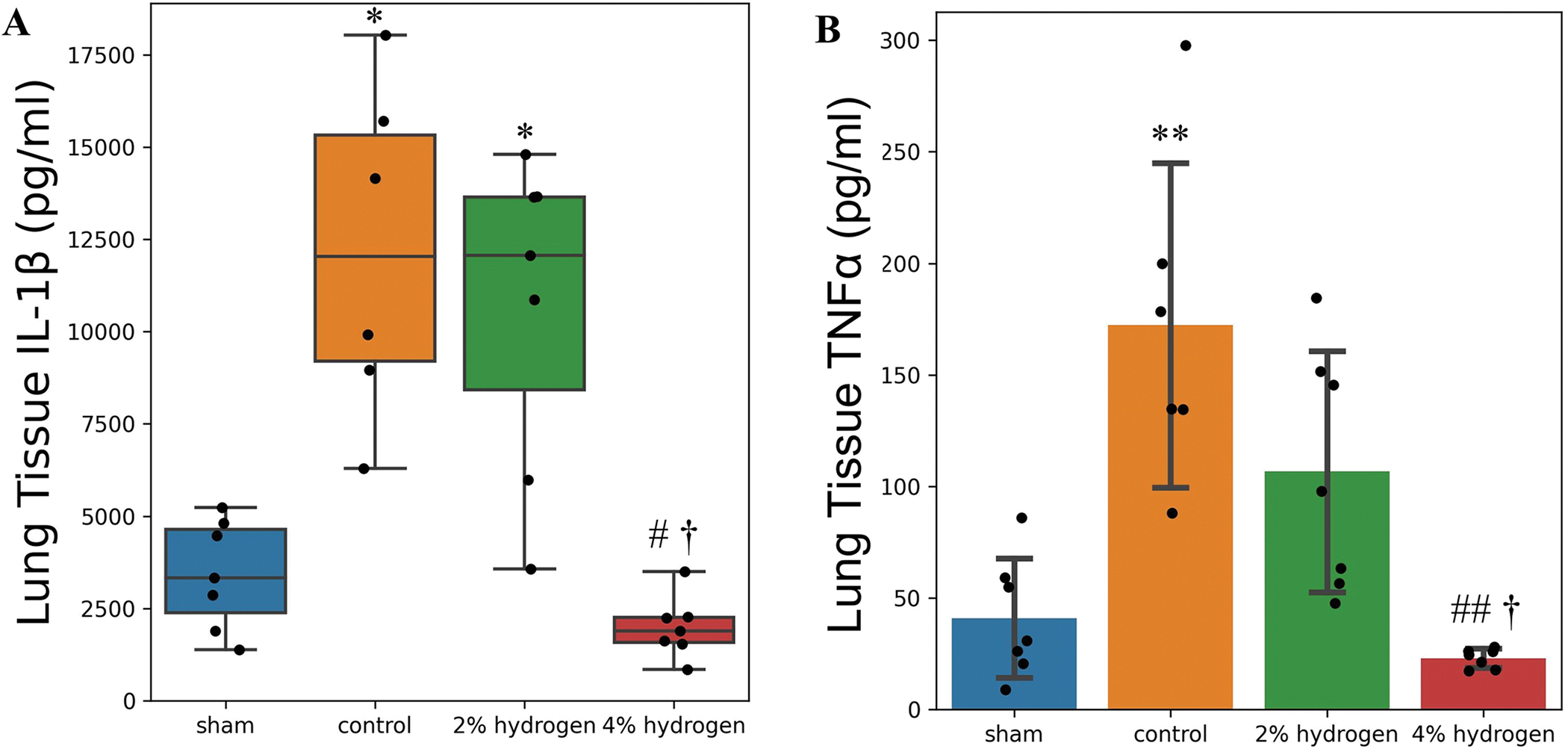
图 6. 肺组织中IL-1β和TNFα的浓度。
4%氢组肺组织中TNFα低于对照组和2%氢组(P < 0.001和P = 0.011),但与假手术组相比无显著差异(P = 0.883)。2%氢气组与对照组无显著差异(P = 0.075),对照组TNFα高于假手术组(P < 0.001)(图6)。
肺组织中的中性粒细胞。
4%氢组肺组织中MPO阳性细胞的比例低于对照组、2%氢组和假手术组(P=0.017、P=0.011和P=0.017)。对照组的比值高于假手术组(P = 0.017),2%氢气组与对照组(P = 1.000)或2%氢气组与假氢气组(P = 0.051)差异无统计学意义(图7)。
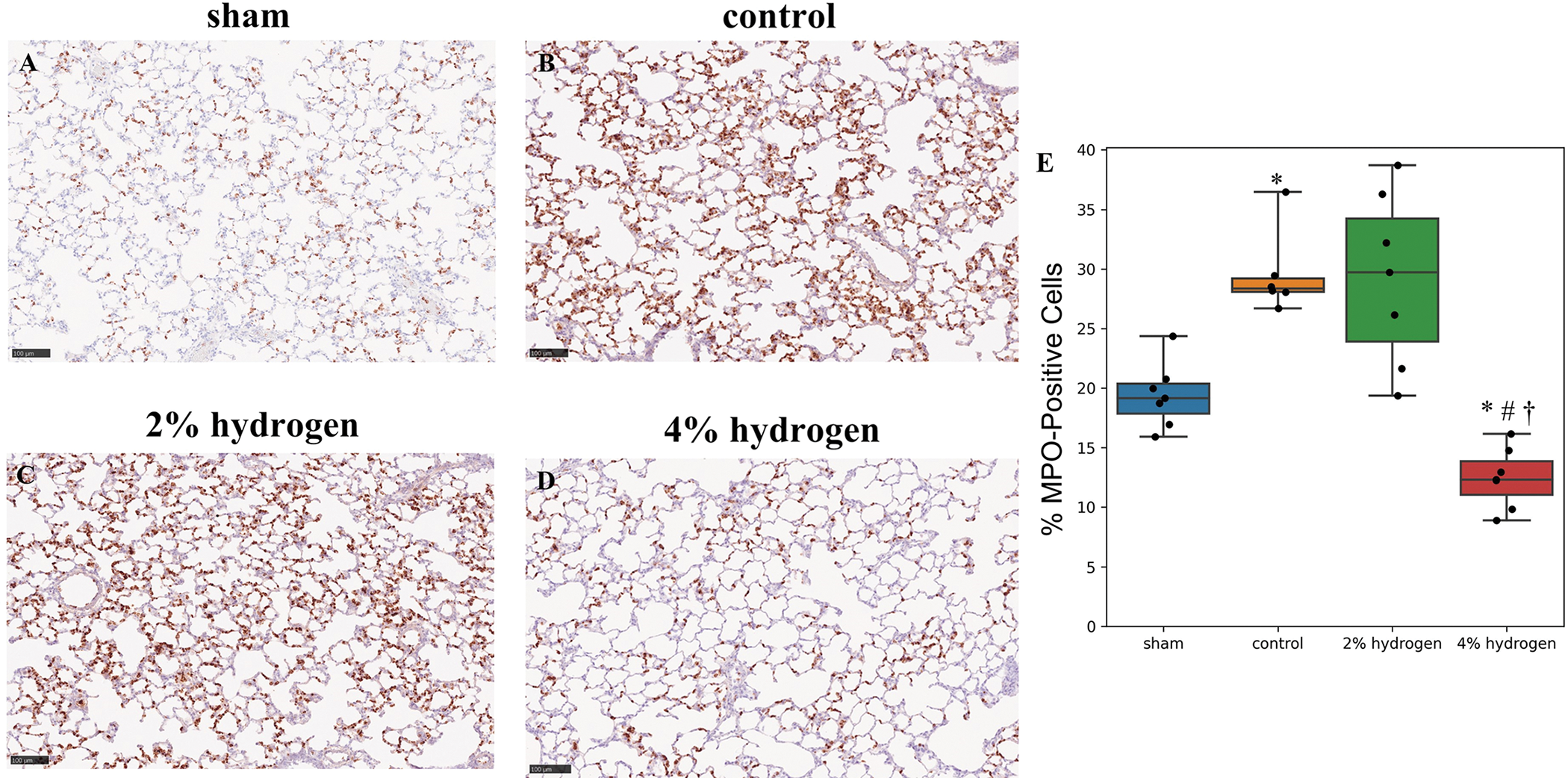
图 7. 肺组织中MPO的免疫组织化学染色。
肺组织干湿比。四组肺干湿重比差异无统计学意义(P = 0.222)(图8)。
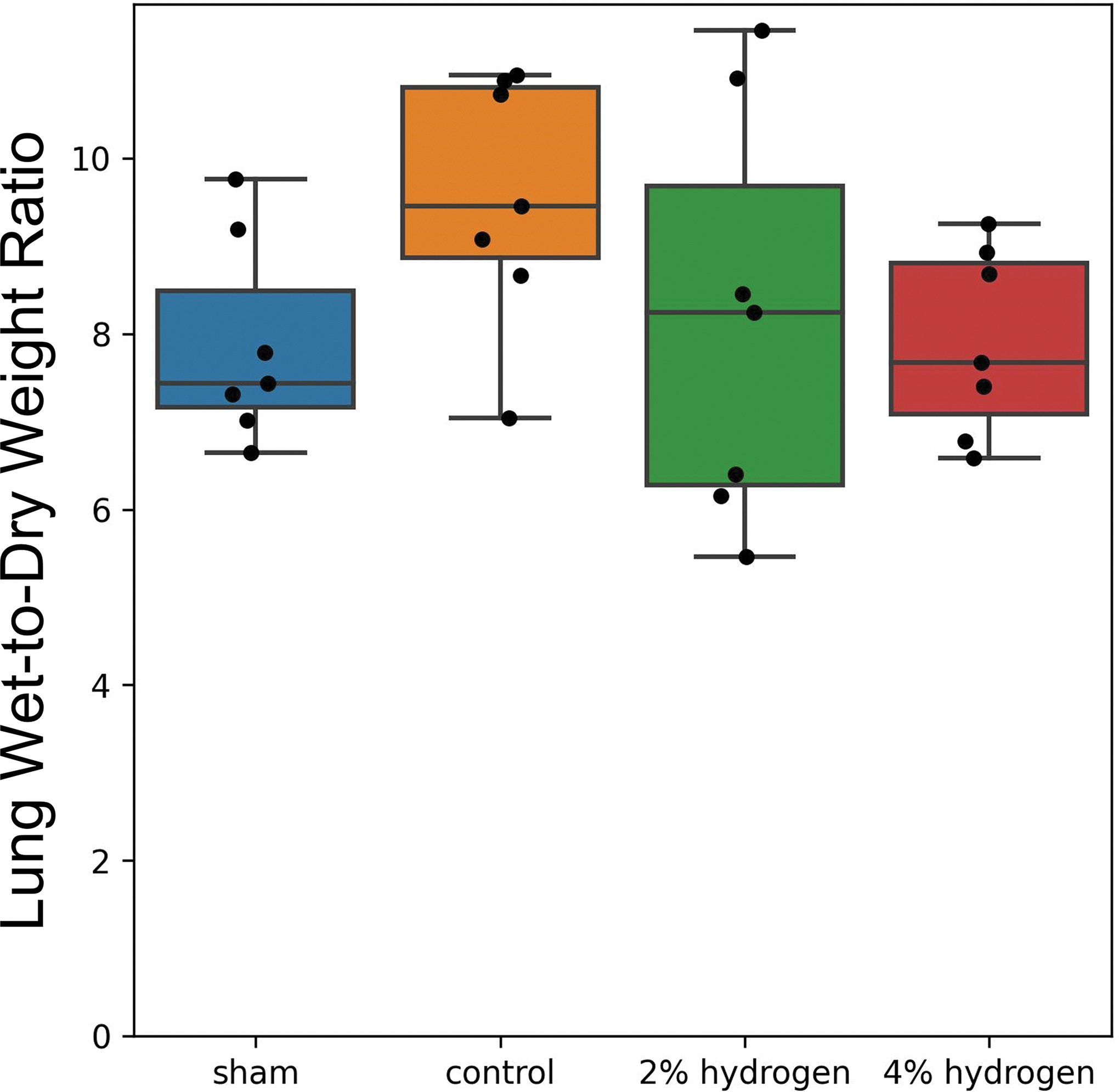
图 8. 肺干湿重比。
讨论
我们研究了氢对部分CPB大鼠模型中内皮糖萼的影响。4%氢气组血清syndecan-1浓度显著低于对照组,说明4%氢气减弱了内皮糖萼损伤。4%氢气组血清IL-1β、TNFα、MDA浓度也显著低于对照组,说明4%氢气具有抗炎和抗氧化作用。此外,4%氢组肺组织中的炎性细胞因子和中性粒细胞水平明显低于对照组,表明4%氢气缓解了肺组织炎症。
糖萼被金属蛋白酶、肝素酶和透明质酸酶降解,这些酶被IL-1β、TNFα和ROS激活。在这项研究中,4%氢组血清中的syndecan-1、IL-1β、TNFα和ROS浓度明显低于对照组。因此,氢对糖萼的保护作用很可能是由于抗炎和抗氧化作用。此外,4%氢组肺内皮糖萼较对照组厚,4%氢组肺组织中IL-1β、TNFα、中性粒细胞表达明显低于对照组。因此,建议保留肺内皮糖萼可减轻4%氢组肺组织中的炎症反应。相比之下,四组在肺的干湿重量比上没有观察到显着差异。湿肺重量包括间质渗出液、血管内血液潴留、组织出血和血管外蛋白渗漏;因此,重量测量可能包含显著误差。 此外,4%氢气组血清TNFα和MDA浓度显著降低,肺组织中MPO阳性细胞比例低于假手术组。Huang等人报道,在正常潮气量下进行5小时的机械通气可引起小鼠呼吸机诱导的肺损伤。本实验在机械通气下进行约5小时;因此,呼吸机引起的肺损伤会发生在假组中。建议 4% 的氢气可以抑制与 CPB 相关的炎症,还可以抑制长期机械通气。
在这项研究中,与对照组相比,2%氢组的血清syndecan-1没有显示出显著差异。该结果表明,2%的氢气并没有减轻对内皮糖萼的损伤。然而,与对照组相比,2%氢组的血清IL-1β、TNFα和MDA以及肺组织中的IL-1β和TNFα均无显著降低。氢气的治疗效果取决于氢气的血药浓度。据报道,当氢气经肺给药时,2%的血药浓度具有最佳的治疗效果,当浓度高于或低于此浓度时,治疗效果会减弱。然而,在这项研究中,4% 的氢气比 2% 的氢气更有效,这可能是由于部分 CPB。在CPB期间,呼吸频率降低到正常水平的三分之一,因此通过肺部的氢气吸收低于正常呼吸条件下。氢气也通过人工肺给药。在使用体外循环回路的缺血-再灌注模型中,通过人工肺给予2%氢气的研究中,当回路充满脱细胞溶液时观察到治疗效果,而当充满血液时则不然。这些报告表明,通过人工肺将氢气吸入血液可能很困难。因此,认为本实验中CPB期间的氢气血浓度可能低于经气管氢气给药的情况。此外,人类和啮齿动物体内有产生氢气的细菌[31],这表明氢气必须超过一定的血液浓度才能产生治疗效果。该报告表明,2%氢组的血液氢浓度可能太低,无法达到有效的治疗效果。由于气体浓度梯度,人工肺和肺都通过扩散交换气体,4%氢基团似乎比2%氢基团吸收更多的氢气。因此,与2%氢气组相比,4%氢气组的血液氢气浓度可能更接近治疗效果最好的血液浓度。
Fujii等人报道,通过人工肺给予1.4%氢气可抑制CPB期间的炎症反应[22]。该报告与本研究中2%氢组的结果相反。这可能与CPB持续时间有关,CPB持续时间与中性粒细胞粘附分子表达和肺损伤严重程度成正比。本研究中的CPB持续时间延长了1.5倍,这表明我们的实验引起的炎症程度高于先前的研究。如果损伤程度太严重,则很难获得氢气的治疗效果。因此,在这个实验中,炎症可能太严重了,无法观察到2%氢气的治疗效果。
除了氢气的治疗作用外,该实验还揭示了与CPB相关的内皮糖萼损伤的器官特异性。对照组心肺内皮糖萼明显薄于假手术组,而脑内皮糖萼差异无统计学意义。我们的研究结果表明,大脑内皮糖萼不太容易受到CPB的损害。脑内皮糖萼是血脑屏障的组成部分之一。Okamura等人评估了仔猪模型中CPB相关的血脑屏障损伤,发现CPB伴正常体温组与假手术组无显著差异,与我们的结果相似。此外,Ando等人报道,在脓毒症小鼠模型中,大脑中的内皮糖萼比心脏和肺部的内皮糖萼受到的破坏更少,目前的结果显示出类似的趋势。也有报道称,牛脑内皮细胞比人脐带内皮细胞带负电荷更多。这种特性可能是大脑内皮糖萼不易受损的原因。
局限性
这项研究有几个局限性。首先,由于人工肺血流限制而进行了部分CPB。因此,尚不清楚使用完全CPB是否会获得相同的氢气效果。其次,通过透射电子显微镜评估内皮糖萼需要灌注固定,这排除了心脏和大脑的炎症反应评估。最后,由于动物体型所需的血容量相对较大,因此没有测量实际的血氢浓度。
结论
在大鼠部分 CPB 期间,通过人工和自体肺施用 4% 氢气可减轻 CPB 引起的内皮糖萼损伤。氢可能是通过抑制CPB产生的炎症反应和氧化应激来保护内皮糖萼的新方法。
https://blog.sciencenet.cn/blog-41174-1414726.html
上一篇:免疫细胞在运动中保护肌肉线粒体细胞器
下一篇:为了完成使命中性粒细胞会死两次