博文
mRNA疫苗+免疫治疗胰腺癌
|
mRNA疫苗+免疫治疗胰腺癌
一种使用称为免疫检查点抑制剂(ICIs)的药物的免疫疗法的开发已经彻底改变了癌症治疗。ICI的作用是帮助释放一个人的免疫系统,对抗仅由癌细胞表达的蛋白质(称为新抗原)的突变版本。新抗原的肽片段可能被免疫系统视为外来的,并且可以激活称为T细胞的免疫细胞(特别是那些称为CD8 T细胞的免疫细胞),这些细胞能够杀死癌细胞。
Vaccine boosts T cells that target pancreatic tumours (yyttgd.top)
胰腺癌通常对ICI没有反应。这被认为部分是因为这些肿瘤表达的新抗原水平低于其他类型的肿瘤,因此不太可能激活抗肿瘤T细胞的强烈免疫反应。在《自然》发表的论文中,罗哈斯等1挑战这一观点,并描述一种可以通过编码个体特异性新抗原的疫苗激活新抗原特异性T细胞的方法。他们的研究建立在先前的工作基础上,表明胰腺癌的长期幸存者具有高质量的新抗原,可以刺激抗肿瘤T细胞2,3.
Rojas及其同事为1名肿瘤已被手术切除的胰腺癌患者设计了对应于新抗原的信使RNA疫苗(图16)。接受此类手术的人通常有高达80%的疾病复发机会4.
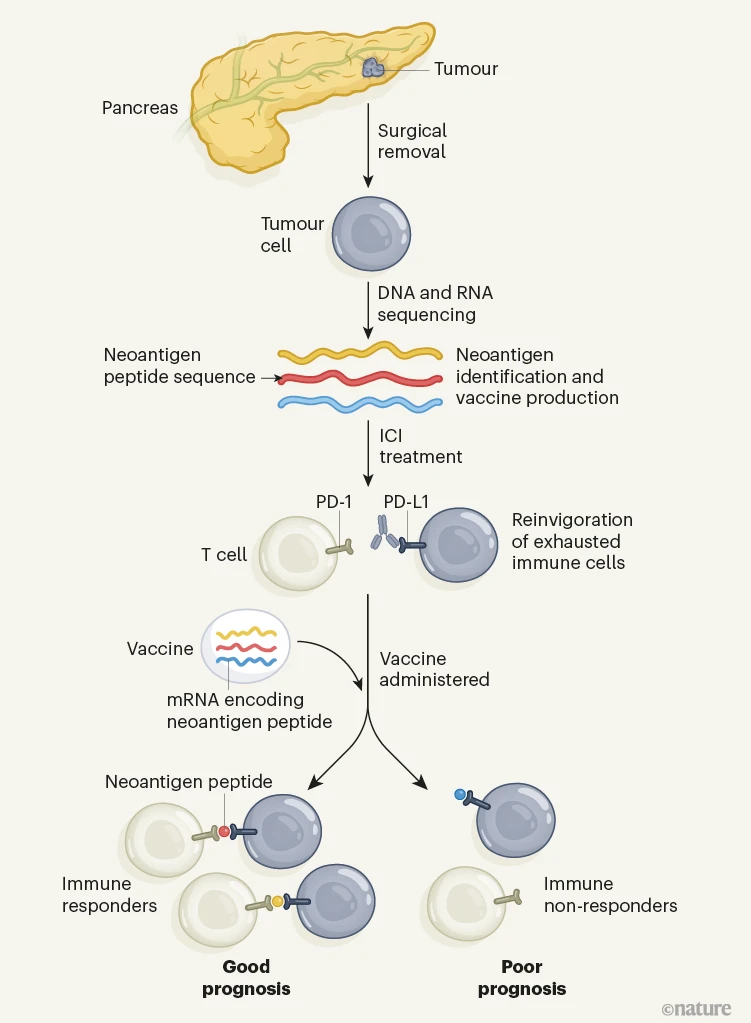
图1 |胰腺癌的治疗方法。罗哈斯等报告一项临床试验,该试验测试了治疗胰腺肿瘤的个性化方法。患者通过手术切除了胰腺癌。然后将来自每个人肿瘤的细胞标本用于DNA和RNA测序,以鉴定编码与癌细胞特异性相关的突变蛋白(新抗原)的肽片段的序列。作者利用这些新抗原信息来设计和生产含有与所选新抗原相对应的信使RNA的个性化疫苗。患者接受了免疫检查点抑制剂(ICI)。该ICI是一种靶向肿瘤细胞上的PD-L1蛋白的抗体。通过阻断PD-L1与其免疫抑制受体PD-1在称为T细胞的免疫细胞上的相互作用,ICI治疗可增强T细胞处于称为衰竭的功能失调状态。接种疫苗后,一半的个体对至少一种疫苗新抗原产生了高度的T细胞反应。那些产生免疫反应的人不太可能复发疾病,这可能是由于存在新的、疫苗诱导的、能够消除扩散肿瘤细胞的新抗原特异性T细胞。确实有疾病复发的患者可能表现出小和/或低质量的新抗原特异性T细胞反应。
mRNA疫苗为每位患者编码最多20种新抗原,通过对患者手术切除的肿瘤中的DNA和RNA进行测序来设计。手术后约九周静脉注射疫苗,计划在下一阶段的研究(II期临床试验)中加快疫苗的生成和给药时间。这种快速的治疗时间强调了基于mRNA的癌症疫苗的益处,特别是对于高度侵袭性的肿瘤。
在试验中,一半的人在接种疫苗后在血液中检测到识别与mRNA编码肽相对应的特定新抗原的T细胞 - 这些人被称为免疫应答者。在这些应答者中,一半对一种以上的新抗原有T细胞反应(多位反应),而另一半对单一新抗原产生反应(单位反应)。值得注意的是,在所有免疫应答者中,没有证据表明手术后18个月的中位随访时间为癌症复发,而无应答者的中位复发时间为13.4个月。这些数据非常有希望,将为计划的进一步临床试验提供框架。
所有患者在接种mRNA疫苗之前还接受了单剂量的称为atezolizumab的ICI。阿替利珠单抗靶向肿瘤细胞上发现的PD-L1蛋白,并通过重振先前存在的肿瘤反应性T细胞起作用,这些T细胞由于PD-L1和免疫抑制受体PD-1之间的相互作用而进入功能失调,“耗尽”状态。作者分析了ICI治疗后的患者血液样本,并确定了增殖(扩增)的T细胞谱系 - 这是T细胞激活响应新抗原识别的迹象。作者通过对与参与免疫反应的部分T细胞(T细胞受体β链)相对应的DNA测序来鉴定这些谱系。使用atezolizumab治疗增殖的T细胞与mRNA疫苗接种后增殖的T细胞不同,这提供了疫苗激活新抗原特异性T细胞的证据。
在最后一次接种mRNA疫苗四周后,患者接受了化疗,化疗有时会抑制免疫细胞,但作者发现疫苗增强的T细胞并没有受到抑制。这突出了序贯联合治疗策略对胰腺癌患者可行的事实。
也许数据集中最引人注目的部分是免疫细胞在肝脏区域中积累的证据,在接种疫苗后,一个反应者有异常变化的迹象(称为病变)。虽然在这种病变中没有癌症的证据,但在免疫细胞的集合体中发现了所有疫苗诱导的T细胞谱系。有趣的是,在病变中检测到基因TP53的突变版本,并与患者胰腺肿瘤中的TP53突变相匹配,增加了一些癌细胞迁移到该部位的可能性。肝脏病变随后消失,表明疫苗可以帮助消除已扩散到远处部位(微转移)的肿瘤细胞。
Rojas及其同事使用两种基于血液的测试(ELISpot和T细胞受体测序方法)跟踪T细胞谱系。这些有利于检测高幅度的T细胞反应(那些具有强烈T细胞活化迹象的T细胞),但可能无法捕获低幅度的反应。大约11%的接种疫苗的新抗原明显引起高度的T细胞反应。在4个人中的16个中,只有一种新抗原驱动免疫反应。因此,尽管一种高质量的新抗原可能足以触发T细胞介导的肿瘤杀伤,但重要的是要了解为什么没有检测到免疫反应以响应疫苗中的其他新抗原。此外,对于引起较低幅度T细胞反应的新抗原,有可能增强反应,例如通过给予进一步剂量的ICI,这也可能防止T细胞衰竭。
同样重要的是调查为什么一半的人对疫苗接种没有反应,因为反应者和无反应者之间的临床特征相似。两组基线免疫功能的标志,例如对另一种mRNA疫苗(一种针对冠状病毒SARS-CoV-2的疫苗)的反应和CD8 T细胞在初始胰腺肿瘤中的积累(密度)相似。
相比之下,作者发现两组之间的差异在于免疫应答者的肿瘤比无应答者的肿瘤具有更少的突变多样性。这种较低的多样性可能反映了早期免疫系统对肿瘤的反应的后果,这表明免疫系统能够更好地识别免疫反应者的肿瘤。使用应答者的数据,根据每种新抗原驱动T细胞反应的预测能力比较其质量,揭示了预测的更高质量的新抗原驱动更强的抗原特异性T细胞反应,如之前报道的那样。2,3.
与一些个性化的疫苗研究不同5,6,Rojas及其同事的研究显示,新抗原特异性CD8 T细胞的主要活化被认为是直接杀死肿瘤细胞的关键参与者。有趣的是,作者没有发现另一种类型的新抗原特异性T细胞 - CD4辅助性T细胞 - 即使疫苗中包含的新抗原被选择并优先激活两种T细胞类型(尽管旨在检测低量级T细胞反应的测试可能会捕获疫苗诱导的CD4 T细胞反应)。已知CD4 T细胞是帮助CD8 T细胞功能和延长寿命以控制肿瘤生长的关键合作伙伴7,8.
这就提出了如何生成mRNA疫苗以促进两种类型T细胞的最佳激活的问题,包括优化免疫细胞的持久性,减少衰竭和免疫记忆的发展。优先考虑CD4特异性新抗原的选择仍然是一个挑战,而改善其鉴定的技术可能反过来导致CD4 T细胞的高质量反应。9–11.此外,mRNA疫苗本身的某些方面,例如mRNA的设计和包裹疫苗的脂质纳米颗粒的组成,可能会为优化T细胞特异性反应提供进一步的机会。12.
Rojas等人已经确定了使用基于mRNA的新抗原疫苗治疗胰腺癌的可行性,胰腺癌以前被认为对个性化治疗过于激进。这些数据还强调了胰腺癌新抗原的效力,给人以希望,它们可能会导致这种难治性癌症的新治疗方案的发展。
https://blog.sciencenet.cn/blog-41174-1388105.html
上一篇:鲨鱼为保持体温会屏气潜水
下一篇:人造肉生产设备细胞生物反应器