博文
FMH | 英国罗伯特戈登大学Giovanna 教授课题组:Se和17β雌二醇在调节肥胖和NAFLD体外模型中脂质积累中  精选
精选
||

Introduction
体重增加、脂肪重新分布和血脂异常是代谢综合征的主要特征,并且与绝经后女性患心脏病、糖尿病、癌症和非酒精性脂肪肝病(NAFLD)的风险增加有关。来自绝经/绝经后女性的证据表明,雌激素(即17β 雌二醇;E2)水平下降与肥胖及相关疾病的发生/发展之间存在关联。此外,肥胖绝经后女性对微量营养素硒(Se)的膳食摄入量减少,并且有报道称硒水平与体重指数(BMI)呈负相关。因此,需要新的营养和/或激素解决方案来预防和管理绝经后女性的脂肪沉积,此类解决方案可能针对脂质沉积、氧化应激和炎症等肥胖和非酒精性脂肪肝病发病机制中的主要特征,因此可能会降低患如非酒精性脂肪肝病等与肥胖相关疾病的风险。
英国罗伯特戈登大学Giovanna 教授课题组在肥胖的体外模型(3T3-L1 细胞)中确定了Se、E2 以及两者的组合对脂质沉积以及脂肪细胞分化、脂质和能量代谢、炎症和氧化还原状态标志物的基因表达的影响;而在非酒精性脂肪肝病的体外模型(HepG2/C3A 细胞)中评估了它们对脂质沉积以及脂质和能量代谢、氧化还原状态和炎症标志物的基因表达的影响。
Results and discussion
3T3-L1 细胞分化过程中,因施用Se或 E2 而导致脂质积累减少(图 1),可以通过它们对基因表达的不同影响来解释。对于Se而言,是对氧化还原状态和炎症调节相关基因的表达产生影响;对于 E2 而言,是对脂质和能量代谢相关基因的表达产生影响。具体地说,在 3T3-L1 细胞向脂肪细胞分化过程中,用200 nmol/L的Se进行补充,可使脂质沉积减少约 20%(图 1),其方式是增加与氧化还原状态相关的基因(Gpx1、Selenow 和 Ucp2)的表达,并降低能量代谢、炎症和脂肪细胞分化标志物(LEP、COX2 和 Fabp4)的表达;而施用10 nmol/L的 E2 可调节脂质合成和代谢(降低 Fasn、Pparg 和 Hsl 的表达,并增加 Fabp4 和 Glut4 的表达)(图 2)。
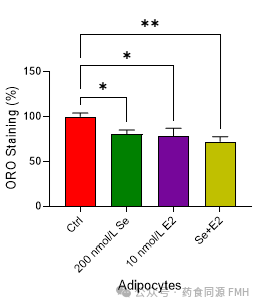
图1 Se和E2单独或组合对脂质积累的影响。
通过油红O(ORO)染色检测,3T3-L1细胞从前成熟脂肪细胞分化为成熟脂肪细胞和细胞内的脂质积累。在整个分化过程中,用200nmol/L Se或10nmol/L E2单独或组合处理3T3-L1细胞,并测量细胞内的脂质积累。
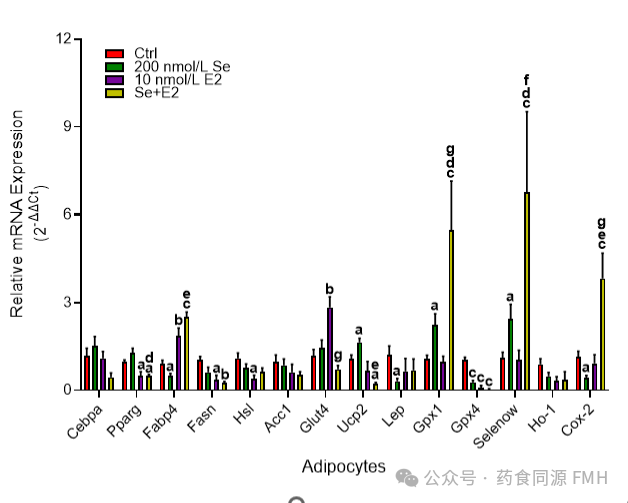
图2 Se和E2单独或组合对脂肪细胞分化、脂质和能量代谢、氧化还原状态和炎症相关基因表达的影响。
在整个分化过程中,用200 nmol/L Se或10 nmol/L E2单独或组合处理3T3-L1细胞,并通过RT-qPCR测量与脂肪细胞分化(Cebpa、Pparg、Fabp4)、脂质和能量代谢(Fasn、Hsl、Acc1、Glut4、Ucp2、LEP)、氧化还原状态(Gpx1、Gpx4、Selenow、Ho-1)和炎症(COX2)相关的基因的表达。将基因表达标准化为未处理的脂肪细胞(Ctrl)。
与在 3T3-L1 细胞中的发现类似,在 HepG2/C3A 细胞中补充Se可减少暴露于脂肪酸(FA)下的细胞中的脂质积累(图 3),创建非酒精性脂肪肝病的体外模型。此外,在暴露于脂肪酸的细胞中,E2 也可减少脂质积累,这与先前发表的研究结果一致。与在 3T3-L1 细胞中的结果类似,尽管Se和 E2 单独使用时都能减少 HepG2/C3A 细胞中的脂质积累,但当两种化合物同时使用时,没有协同效应。Se和 E2 在 HepG2/C3A 细胞中减少脂质积累的机制似乎至少部分是由于它们对参与从头脂肪生成的基因的调节。具体而言,Se和 E2 都降低了 SCD1 的表达,而 E2 也降低了 SREBF1 的表达。HepG2/C3A 细胞中脂质积累的减少也与炎症介质 COX2 和 LEP 的表达降低相关(图 4)。
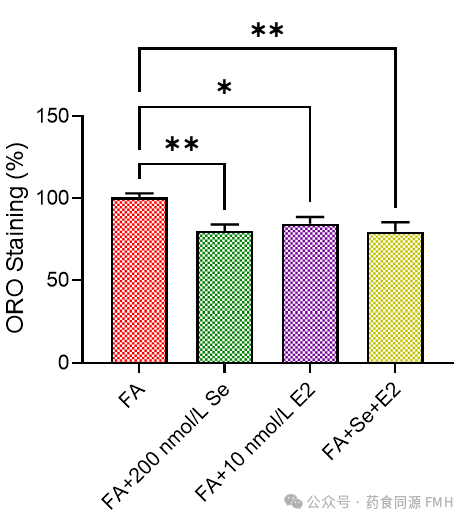
图3 Se和E2单独或组合对FA处理的HepG2/C3A细胞中脂质积累的影响。
在不存在或存在200 nmol/L Se或10 nmol/L E2的情况下,用FA单独或组合处理HepG2/C3A细胞48小时,并通过ORO染色检测细胞中的脂质积累。Se、E2或Se和E2处理的细胞中的ORO染色表示为仅用FA(即FA)处理的HepG2/C3A细胞的百分比。
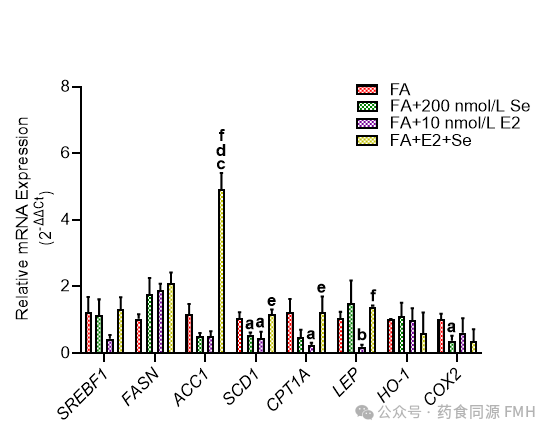
图4 Se和E2单独或组合对FA处理的HepG2/C3A细胞中与脂质和能量代谢、氧化还原状态和炎症相关的基因表达的影响。
在不存在或存在Se或E2单独或组合的情况下,用FA(0.5 mmol/L SO和PA)处理HepG2/C3A细胞48小时,并通过RT-qPCR在细胞中测量与脂质和能量代谢(SREBF1、FASN、ACC1、SCD1和CPT1A)、氧化还原状态(HO-1)和炎症(LEP和COX2)相关的基因的表达。将Se、E2或Se和E2处理的细胞中的基因表达标准化为仅用FA(即FA)处理的HepG2/C3A细胞。
Conclusions
本研究进一步证实脂肪生成不仅受Se补充的调节,雌激素治疗也可能起作用。Se补充通过调节参与氧化还原状态和炎症调节基因的表达成功地减少了体外系统中的脂质积累,而E2给药调节了与脂质和能量代谢相关的基因的表达。此外,该研究还证明了Se和E2在NAFLD管理中的作用,因为Se或E2的使用通过调节与脂质和能量代谢,以及炎症相关基因的表达来减少脂质积累。然而,这两种方法(即微量营养素补充和激素治疗)似乎对肥胖或NAFLD的管理没有协同作用。如果这些发现在体内复制并证明了生理相关性,它们可能为施用硒强化食品和/或设计基于雌激素的疗法,以预防和/或控制绝经后妇女的肥胖、NAFLD提供理论基础。
第一作者简介

Sarah K Walsh博士,英国罗伯特戈登大学研究员。研究主要集中在确定治疗心脏代谢疾病的新型治疗靶点,包括射血分数保留型心力衰竭(HFpEF)和非酒精性脂肪肝病(NAFLD)。以第一作者和资深作者的身份在《the British Journal of Pharmacology》《Biochemical Pharmacology》和《Hypertension》等期刊上发表了多篇论文,并担任众多科学期刊的审稿人。
通讯作者简介

Giovanna Bermano教授,英国罗伯特戈登大学代谢营养学教授,兼肥胖研究和教育中心(CORE)主任。研究重点是确定用于最佳营养和疾病预防的新型“营养保健品”,并在体外和体内疾病模型或临床研究中在分子和细胞水平上评估其效果。在微量营养素代谢、肥胖和健康相关研究方面享有国际声誉,在高影响力期刊上发表文章,展示了在这些领域的重大成就和有效性。研究探索了肥胖和相关疾病如非酒精性脂肪性肝病(NAFLD)、癌症和糖尿病如何改变正常生理,以确定新的营养/治疗目标。在可持续营养和营养保健品方面的工作导致了与食品和饮料行业的合作,开发了副产品增值、分离高价值/低容量化学品、评估其在生物系统中的活性以及确定用作nutra的作用机制的方法药物。
论文网址
https://www.sciopen.com/article/10.26599/FMH.2025.9420056

https://blog.sciencenet.cn/blog-3563286-1458997.html
上一篇:FMH | 北华大学孙晶波教授课题组:揭秘助眠真菌的魔力:食用菌的镇静催眠机制
下一篇:目录|《建筑模拟(英文)》2024年第8期