博文
激酶检测方法大盘点∶ 从经典放射性检测到 SPR, 一篇看懂! (详细介绍版) | MCE
|
蛋白质磷酸化由 Ed Krebs 和 Ed Fisher 在 1950 年代左右发现,自此,激酶被认为是细胞信号传导的重要调节因子。本期咱们就来唠唠有哪些激酶检测的相关方法~
Section.01
激酶的定义及作用原理
激酶 (Kinase) 是一类能够促进高能磷酸基团从 ATP 转移到特定底物,从而产生 ADP 的分子,这一过程又被称作为磷酸化。

敲重点!!!
基于这个原理,可以通过检测 ATP 的消耗量,ADP 生成量和磷酸化底物含量,检测激酶活性。
激酶的三个检测方向:活性、结合与选择性
1.抑制活性:化合物在生化水平或细胞水平抑制激酶磷酸化功能的效力。
2.结合能力:检测化合物与激酶结合的强度、速度 (结合速率) 和持续时间 (解离速率)。
3.选择性:检测化合物对目标激酶及其他数百种激酶的特异性又被称为激酶谱筛选,高选择性是激酶药物应用时低毒副作用的保障。
Section.02
激酶常见检测方法
生化水平检测
通过使用纯化的激酶蛋白,直接评估化合物对酶活性的影响。
1.放射性检测 (经典方法):
该方法是蛋白激酶检测的一种经典方法。使用放射性同位素标记 ATP,蛋白激酶将放射性标记的磷酸基团转移至肽或蛋白质底物。随后通过分离并测量底物上掺入的放射性信号来定量激酶活性。优点是灵敏度高、可以直接反映激酶活性;缺点是放射性 ATP 的半衰期较短以及存在放射性废物处理问题[2]。
荧光/发光法 (FRET, TR-FRET, AlphaScreen/LISA):
荧光法是现代高通量筛选的主力。基于能量共振转移或化学发光等原理,通过检测磷酸化底物产生的光学信号反应激酶活性。由于更易操作、高灵敏度和高通量,非常适合大规模初筛,荧光方法已在很大程度上取代了传统的放射性标记检测。缺点是如果化合物本身有很强的自发荧光或者蛋白水解酶的抑制性,会产生假阳性。
1. 时间分辨荧光 (Time-resolved fluorescence resonance energy transfer, TR-FRET)
由于样品中的蛋白质、缓冲液组分、塑料器皿等本身会产生微弱的短寿命荧光,传统荧光检测 (如 FRET,荧光共振能量转移) 通常会受到背景荧光的干扰。TR-FRET 使用具有长荧光寿命的镧系元素 (如铕 Eu3?、铽 Tb3? 等) 作为供体荧光基团,标记在磷酸化抗体/肽段上,在激发一段时间后再对荧光数值进行检测,可以极大程度消除背景荧光干扰,提高信噪比。当供体和受体 (染料,如 XL665、d2) 在足够近的距离 (通常 1-10 nM) 内,且供体的发射光谱与受体的激发光谱有重叠时,激发供体的能量会非辐射地转移到受体上,导致受体发出荧光[3]。受体荧光/供体荧光的比值与磷酸化底物的量,即激酶活性成正比。
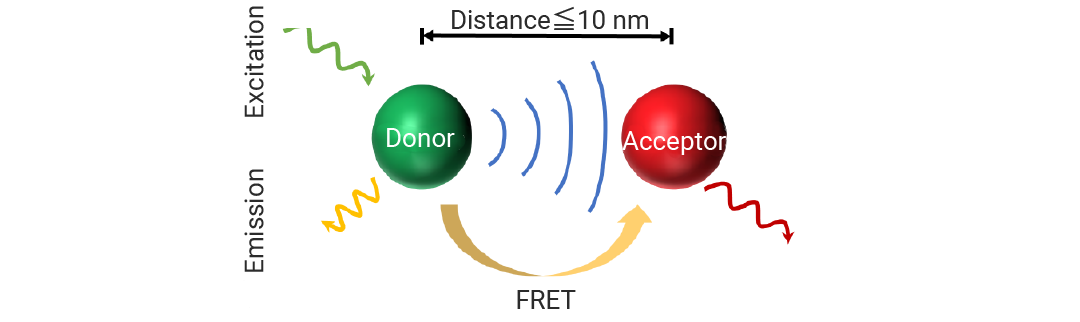
图 1. TR-FRET检测原理[3]。
2. Kinase-Glo 方法 (检测剩余 ATP):
Kinase-Glo 是一种均质的非放射性的方法,激酶反应结束后,加入等体积的 Kinase-Glo 试剂,试剂中的萤光素酶会利用反应体系中剩余的 ATP 产生化学发光信号,从而定量地检测纯化激酶的活性,信号强弱与激酶活性成反比[4][5]。Kinase-Glo 法几乎适用于任何底物为 ATP 的酶的检测,且操作简单,无需洗涤,适合大规模筛选。
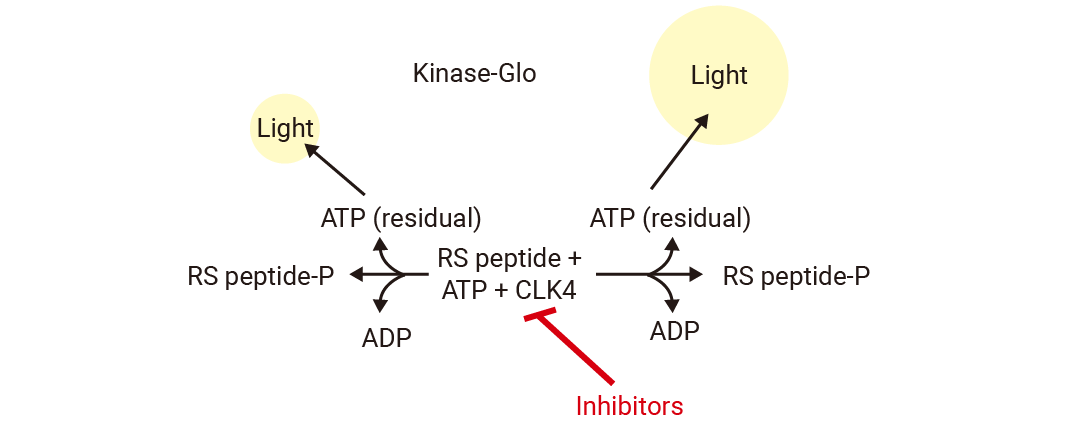
图 2. Kinase-Glo检测原理[5]。
3. ADP-Glo 方法 (检测生成的 ADP):
Kinase-Glo 实验中,通过加入 ADP-Glo 试剂终止激酶反应,并耗尽剩余的所有 ATP。此时体系中没有 ATP,不会产生背景发光。接着,加入专门的检测试剂,将第一步中激酶反应生成的 ADP 重新转化为 ATP。新生成的 ATP 通过萤光素酶系统产生化学发光信号,活性信号强弱和激酶活性成正比[5]。
由于通量高,成本较低,操作简单,Kinase-Glo/ADP-Glo 法几乎可检测任何激酶活性,是大规模高通量筛选初筛的首选方法。而相较于 Kinase-Glo 法,ADP-Glo 消除了高浓度初始 ATP 背景的干扰,可以检测更微小的活性变化,特别适用于高 ATP 浓度的反应条件。
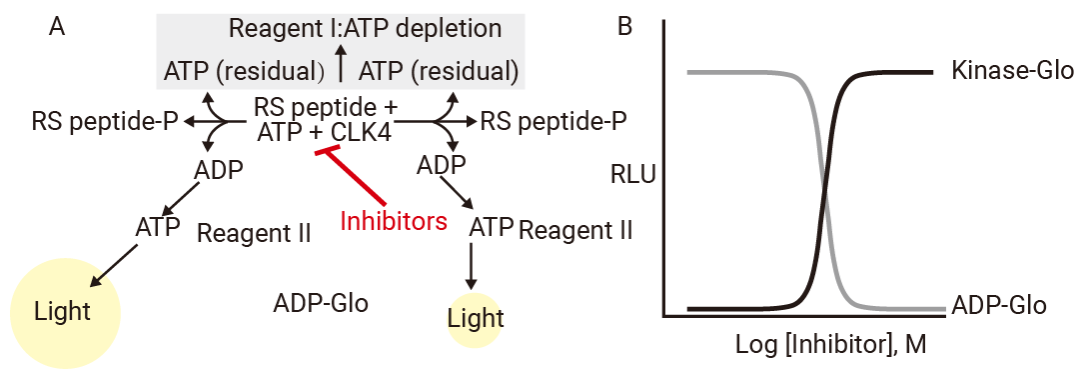
图 3. (A) ADP-Glo 检测原理;(B) 发光反应信号 (RLU) 与 ATP 耗竭实验 (Kinase-Glo测定) 中的激酶活性成反比,与 ADP-Glo 测定中的激酶活性成正比[5]。
4. AlphaScreen/AlphaLISA
AlphaScreen 与 AlphaLISA 技术的核心在于独特的“单线态氧通道能量转移”体系:供体微珠在 680 nm 激光激发下产生单线态氧,这种高能分子可在溶液中扩散约 200 nM;只有当生物相互作用将供体与受体微珠拉近至此“作用距离”内,受体微珠才能接收能量并触发内部荧光团发光。
AlphaLISA 平台是 AlphaScreen 技术的演变,旨在满足生物标志物检测高通量检测的要求,主要以即用型试剂盒形式提供。AlphaLISA 类似于 AlphaScreen,不同之处在于磁珠含有铕作为受体荧光。铕发射在光谱上比 AlphaScreen 测定中观察到的更强烈且更清晰。因此,发射波长不易受到血红蛋白或转铁蛋白等化合物的基质干扰。与 ELISA 比,AlphaLISA 分析范围更广检测更加灵敏,且可省去很多洗涤步骤,节省实验时间[6]。
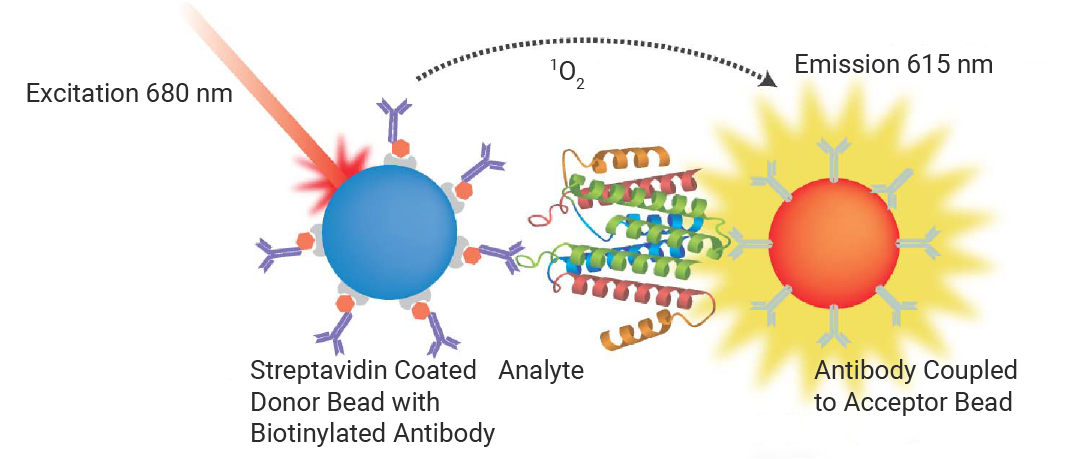
图 4. AlphaScreen 检测原理:供体和受体之间的化学能转移[6]。
细胞水平检测 (Cellular Assays)
相较于分子水平实验,细胞水平的检测更加贴近生物体的病理生理状态。将细胞 (通常是疾病相关模型,如癌细胞系) 使用化合物处理后,然后检测下游信号通路的改变。可以使用磷酸化特异性抗体,通过 Western Blot、细胞免疫荧光、流式等方法检测目标激酶的自磷酸化或底物磷酸化水平。该方法适合于单个化合物或者化合物数量不多时候的激酶活性检测,通量较低。
结合性检测 (Binding Assays)
结合性检测不直接测量酶活性,而是更加关注化合物与激酶的“亲密接触”。
1. 表面等离子共振 (Surface Plasmon Resonance,SPR):
表面等离子体共振 (Surface Plasmon Resonance, SPR) 是一种高灵敏度的生物传感技术,通过监测生物分子在金属薄膜表面的相互作用,实时、无标记地提供结合动力学和亲和力数据,广泛应用于分子互作检测。
SPR 技术的核心是利用光在不同介质中产生消逝波后与金属表面的等离子波产生共振,当固定在芯片上的配体和流经芯片的分析物发生结合和解离时,芯片表面质量变化造成共振角发生变化,传感图会实时记录相互作用下的信号值,根据此变化曲线从而得出分子间相互作用的解离常数 (KD)、结合速率常数 (Ka) 和解离速率常数 (Kd)。通过 SPR 检测,可直接获取激酶与化合物之间的亲和力数据,对生化实验筛选出的激酶抑制剂进行验证。
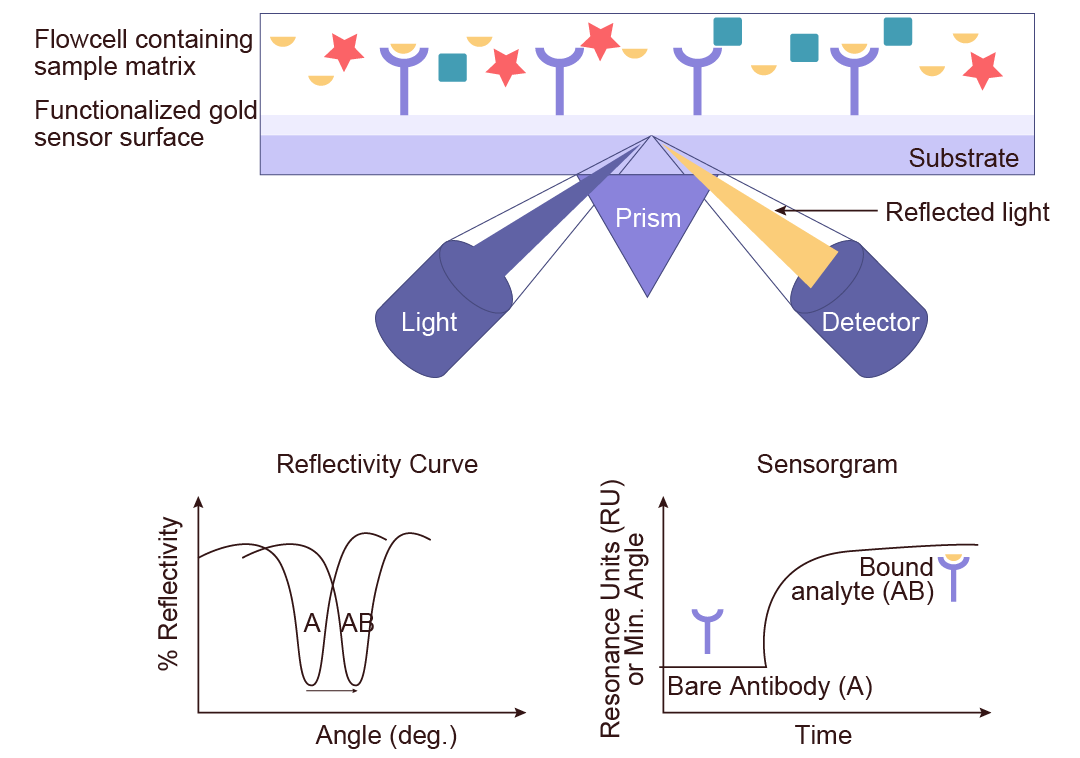
图 5. SPR 检测原理。
Section.03
小结
本期,小 M 带大家了解了激酶活性检测到底有哪些方法。当然,MCE 也可提供激酶系列化合物库,及激酶谱筛选技术服务,一站式解决激酶抑制剂活性评价需求。有需要的老师快来私戳小 M 咨询吧!
产品推荐 |
激酶抑制剂库 Mini,包含 270+ 个激酶抑制剂,每个激酶精选 1-3 个活性小分子,适合小范围的激酶药物筛选,性价比之选。 |
FDA 激酶抑制剂库,包含 300+ 个已上市的激酶抑制剂,适合激酶药物的老药新用。 |
包含 3,400+ 种激酶抑制剂,靶向蛋白激酶、脂质激酶和碳水化合物激酶。 |
包含 3,700+ 种靶向蛋白激酶的化合物。 |
包含 1,800+ 种丝氨酸/苏氨酸激酶抑制剂,靶向 PKA、Akt、PKC、MAPK/ERK 等。 |

[1] Roskoski R Jr. Properties of FDA-approved small molecule protein kinase inhibitors: A 2025 update. Pharmacol Res. 2025 Jun;216:107723.
[2] Hastie CJ, et al. Assay of protein kinases using radiolabeled ATP: a protocol. Nat Protoc. 2006;1(2):968-71.
[3] Zhang Y, et al. Progress and Prospects in FRET for the Investigation of Protein-Protein Interactions. Biosensors (Basel). 2025 Sep 19;15(9):624.
[4] Koresawa M, et al. Novel detection method for chemiluminescence derived from the Kinase-Glo luminescent kinase assay platform: Advantages over traditional microplate luminometers. MethodsX. 2014 Aug 8;1:96-101.
[5] Tanega C, et al. Comparison of bioluminescent kinase assays using substrate depletion and product formation. Assay Drug Dev Technol. 2009 Dec;7(6):606-14.
[6] Eglen RM, et al. The use of AlphaScreen technology in HTS: current status. Curr Chem Genomics. 2008 Feb 25;1:2-10.
https://blog.sciencenet.cn/blog-3536222-1513970.html
上一篇:PROTAC HIF-1α degrader-1_MedChemExpress
下一篇:免疫细胞培养∶ 常用的细胞因子及其功能解析 | MCE