博文
免疫细胞培养∶ 常用的细胞因子及其功能解析 | MCE
|
在免疫细胞培养的世界里,细胞因子犹如一把神奇的钥匙,能够解锁细胞潜能,定向引导细胞命运。掌握这些关键因子,精准调控,事半功倍!
Section.01
用于 T 细胞培养和
分化的细胞因子
T 细胞是适应性免疫的核心,其功能与分化由细胞表面的特征性标记物决定,其中最核心的是 T 细胞受体 (TCR) 和分化群分子 (CD molecules)。根据 TCR 类型,T 细胞可分为 αβ T 细胞和 γδ T 细胞两大亚群。占主导地位的 αβ T 细胞通过抗原由细胞自身的 MHC (主要组织相容性复合体) 分子携带时识别,并进一步分化为两个亚型: CD4+ T 细胞作为“辅助性” T 细胞,通过协调抗原呈递细胞 (APCs) 来调控全局免疫应答;而 CD8+ T 细胞作为“细胞毒性” T 细胞,则直接识别并杀伤异常靶细胞。与这些常规 αβ T 细胞不同, γδ T 细胞是一种特殊的 T 细胞亚群,它仅占外周血的少部分 (0.5%-5%),但其功能独特。它无需 MHC 呈递即可识别多种抗原,兼具先天免疫的快速应答和适应性免疫的记忆功能。这一特性使其在抗肿瘤免疫中具有巨大潜力[1][2]。
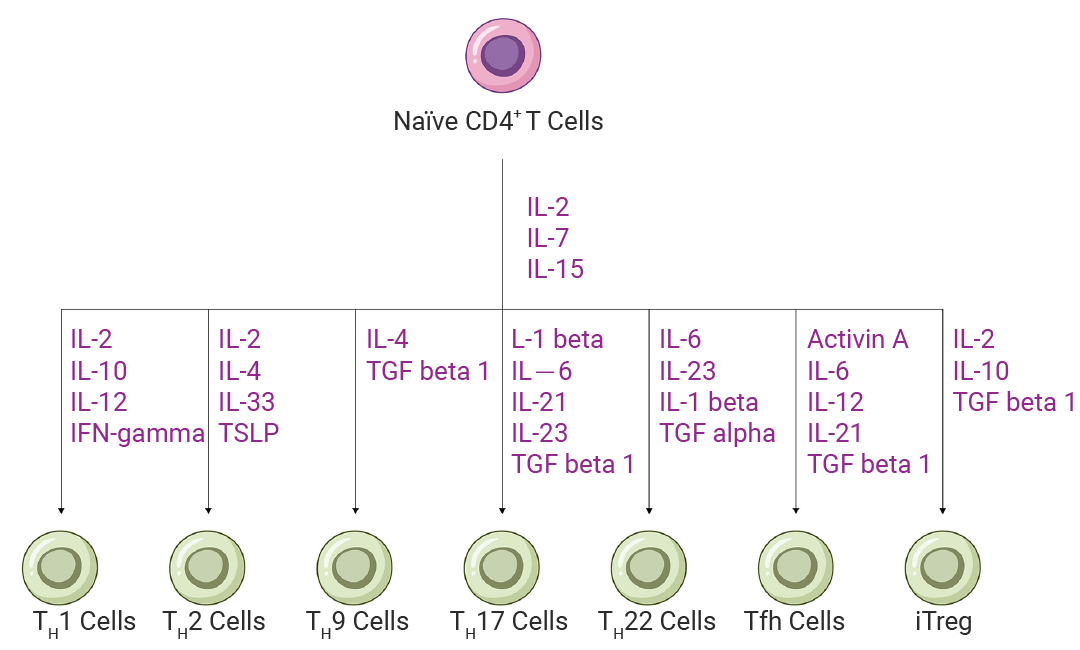
图 1. CD4+ T 细胞亚群培养和分化所需的细胞因子[3]。
Section.02
用于 B 细胞培养和
分化的细胞因子
B 细胞表达 B 细胞受体 (BCR),可以特异性地与抗原结合,产生抗体。在体外培养中,B 细胞在受到多种细胞因子刺激后,可以经历免疫球蛋白类别转换 (class switching) 和分化等事件,最终成为免疫球蛋白分泌细胞,产生抗体和分泌调节细胞因子[4]。
该过程始于 CD40L 提供的关键共刺激信号,它模拟了 T 细胞的辅助作用,是 B 细胞活化和增殖的基础。在此基础上,IL-4 是驱动 B 细胞增殖和诱导抗体类别转换 (特别是向 IgE 和 IgG1) 的核心因子;IL-21 则强力促进其终末分化为浆细胞并调节抗体分泌。B 细胞的存活与稳态则由 BAFF 和 APRIL 主导,它们是维持成熟 B 细胞和长寿命浆细胞存活的关键。此外,其他因子在特定情境下发挥重要作用: IFN-γ 诱导向 IgG2a (鼠) /IgG1 (人) 的类别转换;IL-6 和 IL-10 支持浆细胞的分化与存活;而 IL-2、IL-7 和 IL-15 则主要提供增殖支持信号[5][6]。
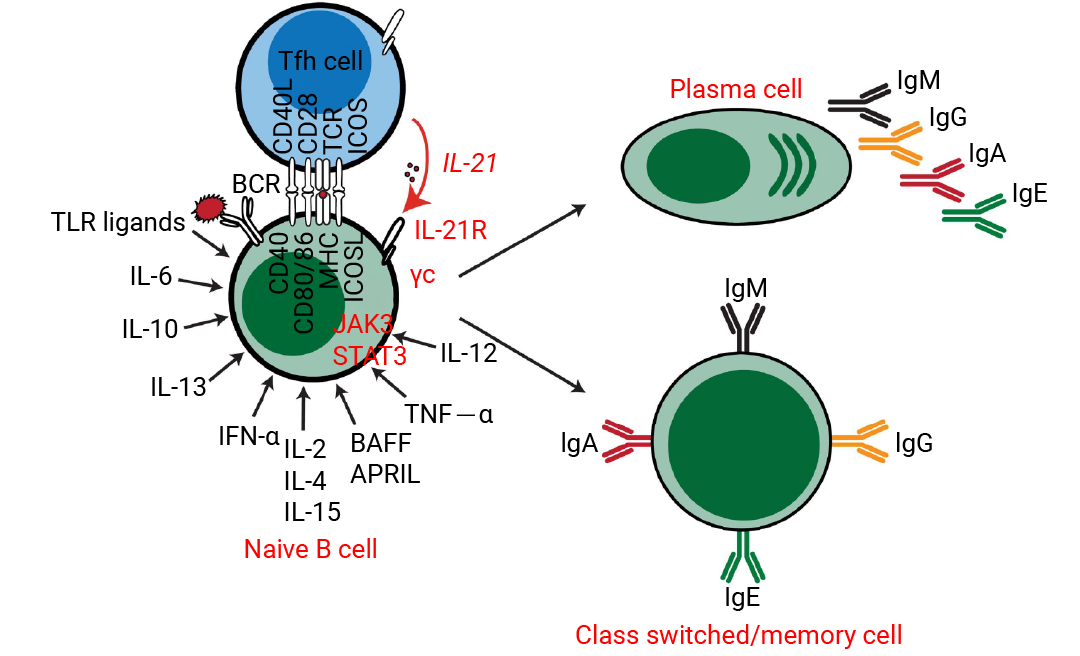
图 2. 细胞因子诱导的人类 B 细胞体外分化[6]。
Section.03
用于 NK 细胞培养和
分化的细胞因子
自然杀伤 (NK) 细胞与其他淋巴细胞 (包括 B 细胞、T 细胞和 NKT 细胞) 不同,NK 细胞不表达抗原特异性受体,例如 BCR 或 TCR。相反,NK 细胞以不依赖于抗原的方式发挥作用,具有内在的细胞毒性潜力和细胞因子产生能力[7]。
NK 细胞的体外扩增、活化及功能维持依赖于一个精细的细胞因子网络调控。其中,IL-15 是最核心的因子,它主导着 NK 细胞的发育、存活、增殖并增强其细胞毒性。为了获得功能更强的 NK 细胞,常将 IL-15 与 IL-12、IL-18 联用,后者能协同强烈诱导 NK 细胞分泌 IFN-γ,极大增强其抗肿瘤和抗病毒能力[8]。IL-21 则能调节 NK 细胞的分化状态,增强其抗体依赖性细胞毒性 (ADCC),常用于 CAR-NK 细胞的制备。此外,I 型干扰素 (IFN-α/β) 可直接激活 NK 细胞。而在从造血干细胞或祖细胞诱导生成 NK 细胞时,则需要 FLT3L 和 IL-3 来扩增和维持早期前体细胞池。需要注意的是,TGF-β 和 IL-10 是 NK 细胞功能的强效抑制因子,在肿瘤微环境中常见,在体外培养时需中和其活性以优化 NK 细胞功能[9][10]11]。
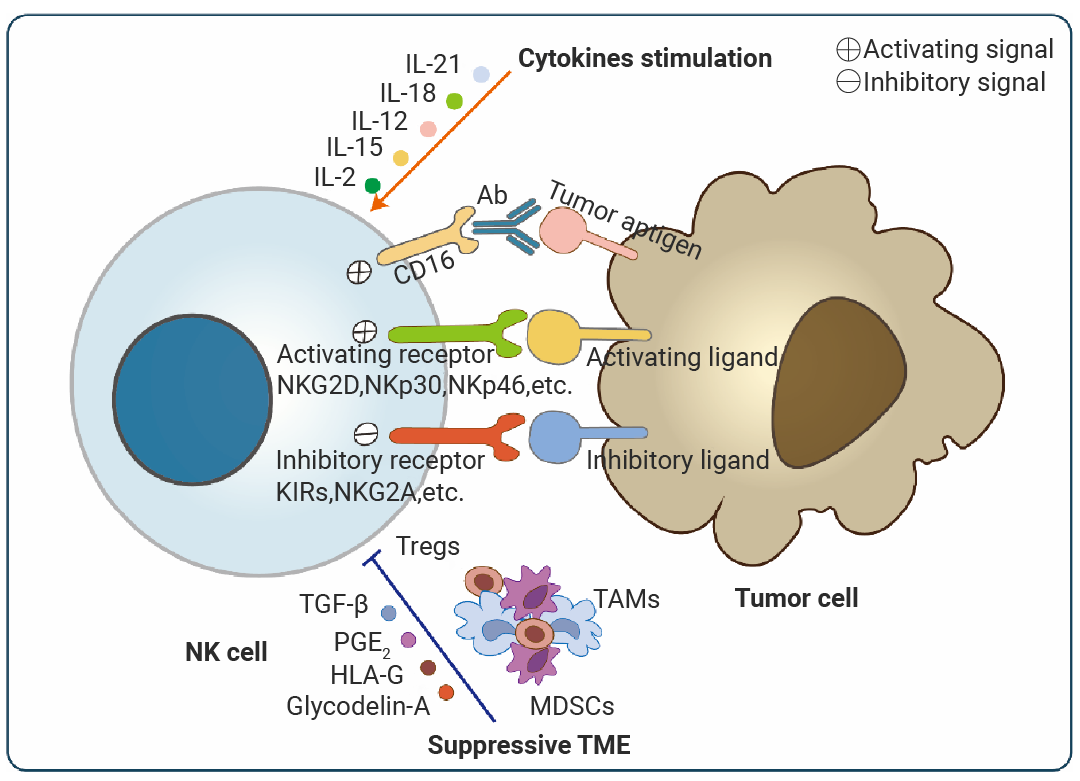
图 3. NK 细胞活化的调控机制[12]。
Section.04
用于单核细胞/巨噬细胞
培养和分化的细胞因子
单核细胞是血液中的“预备役”,它们从血液迁移到组织后,分化为执行具体任务的“常驻军”——巨噬细胞 (Macrophages, M0) 或树突状细胞。它们是先天免疫的核心,承担三大职责:吞噬清除病原体、抗原呈递以激活适应性免疫、以及分泌细胞因子指挥全局免疫反应。
在体外细胞培养中,需要各种细胞因子来维持单核细胞,激活其分化,并扩增为巨噬细胞及其亚型。例如,人源巨噬细胞源自纯化的 CD14+ 单核细胞,使用 M-CSF 培养使其分化为未极化的 M0 巨噬细胞,更换特定极化因子组合进一步培养诱导为 M1 和 M2,LPS 结合 IFN-γ 可以驱动极化为 M1 表型 (促炎),而 IL-4 和 IL-13 可以诱导极化为 M2 表型 (抗炎)。每个巨噬细胞极化状态都表现出独特的细胞因子谱和细胞表面标志谱,通常通过 ELISA 或流式细胞术进行验证 (例如 M1 巨噬细胞上调表达 CD86、MHCⅡ 等),可用于表征组织炎症状态下的巨噬细胞群体,从而进一步理解疾病的发病机制[13][14][15]。
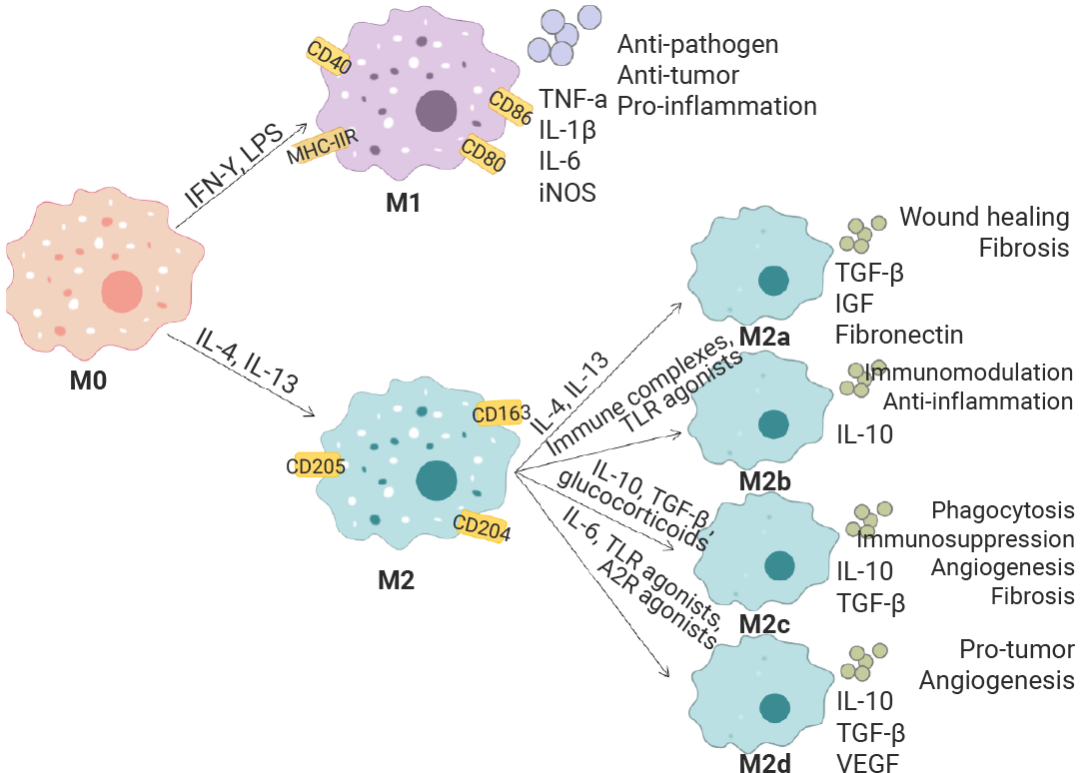
图 4. 巨噬细胞在不同环境因素作用下的分化方向[14]。
Section.05
用于树突状细胞培养和
分化的细胞因子
树突状细胞 (Dendritic Cells, DCs) 是一组不同类型的造血细胞,在先天免疫系统和后天免疫系统之间起着通道的作用。它最重要的功能是将抗原处理后呈递给免疫系统的 T 细胞,是目前公认的最有效的抗原呈递细胞,已成为癌症免疫治疗的重要靶点[16]。目前,已有文献描述了从各种样本中对 DC 细胞的培养扩增方法,包括骨髓、循环单核细胞和诱导多能干细胞 (iPSC) 等。无论是什么来源,DC 细胞的体外培养、激活和成熟需要各种细胞因子协同作用。例如, FLT-3 Ligand、SCF 和 GM-CSF 对血液来源 DC 亚群 (经典和浆细胞样) 的发育中起着决定性作用。
产品推荐 |
高剂量扩增效应 T 细胞 (CAR-T);低剂量维持 Treg 功能。 |
低浓度下诱导 Treg 或 Th17 分化;高浓度抑制免疫反应、促进纤维化;诱导 B 细胞向 IgA 类别转换。 |
经典激活 M1 型巨噬细胞;增强抗原提呈;促进 Th1 应答。 |
诱导单核细胞分化为巨噬细胞 (倾向 M1) 或树突状细胞 (DC);与 IL-5 协同支持嗜酸性粒细胞生成。 |
诱导 DC 成熟,上调共刺激分子 (CD80/86) 和 MHC-II 表达;促炎。 |
提供 B 细胞活化的关键第二信号,驱动增殖、生发中心形成和类别转换;促进 DC 成熟。 |
协同诱导 Th17 分化;激活炎症小体。 |

[1] Dong C. Cytokine Regulation and Function in T Cells. Annu Rev Immunol. 2021 Apr 26;39:51-76.
[2] Silva-Santos B, et al. γδ T cells: pleiotropic immune effectors with therapeutic potential in cancer. Nat Rev Cancer. 2019 Jul;19(7):392-404.
[3] Jiang H, et al. T Cell Subsets in Graft Versus Host Disease and Graft Versus Tumor. Front Immunol. 2021 Oct 5;12:761448.
[4] Cooper MD. The early history of B cells. Nat Rev Immunol. 2015 Mar;15(3):191-7.
[5] Marasco E, et al. B-cell activation with CD40L or CpG measures the function of B-cell subsets and identifies specific defects in immunodeficient patients. Eur J Immunol. 2017 Jan;47(1):131-143.
[6] Moens L, et al. Cytokine-Mediated Regulation of Plasma Cell Generation: IL-21 Takes Center Stage. Front Immunol. 2014 Feb 18;5:65.
[7] Hammer Q, et al. Natural killer cell specificity for viral infections. Nat Immunol. 2018 Aug;19(8):800-808.
[8] Romee R, et al. Cytokine activation induces human memory-like NK cells. Blood. 2012 Dec 6;120(24):4751-60.
[9] Vivier E, et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011 Jan 7;331(6013):44-9.
[10] Horowitz A, et al. Activation of natural killer cells during microbial infections. Front Immunol. 2012 Jan 3;2:88.
[11] Gaggero S, et al. Cytokines Orchestrating the Natural Killer-Myeloid Cell Crosstalk in the Tumor Microenvironment: Implications for Natural Killer Cell-Based Cancer Immunotherapy. Front Immunol. 2021 Jan 29;11:621225.
[12] Xiao J, et al. Natural Killer Cells: A Promising Kit in the Adoptive Cell Therapy Toolbox. Cancers (Basel). 2022 Nov 17;14(22):5657.
[13] Yunna C, et al. Macrophage M1/M2 polarization. Eur J Pharmacol. 2020 Jun 15;877:173090.
[14] Xia T, et al. Advances in the role of STAT3 in macrophage polarization. Front Immunol. 2023 Apr 4;14:1160719.
[15] Gao J, et al. Shaping Polarization Of Tumor-Associated Macrophages In Cancer Immunotherapy. Front Immunol. 2022 Jun 30;13:888713.
https://blog.sciencenet.cn/blog-3536222-1513972.html
上一篇:激酶检测方法大盘点∶ 从经典放射性检测到 SPR, 一篇看懂! (详细介绍版) | MCE
下一篇:AZD2423,1229603-37-5,99.91%_MedChemExpress