博文
饮食中的硒可能有助于对抗急性髓性白血病
||
饮食中的硒可能有助于对抗急性髓性白血病
诸平
Graphical abstract. Credit: Cell Reports (2023). DOI: 10.1016/j.celrep.2023.112794
据美国宾夕法尼亚州立大学(Pennsylvania State University)2023年10月24日提供的消息,研究人员称,饮食中的硒可能有助于对抗急性髓性白血病(Dietary selenium may help fight acute myeloid leukemia, researchers report)。
富含硒的饮食可能有助于抵御髓性白血病(myeloid leukemia),美国宾夕法尼亚州立大学农业科学学院(Penn State's College of Agricultural Sciences)的研究人员领导的一项新研究描述了这种情况发生的机制。相关研究结果于2023年7月16日已经在《细胞报告》(Cell Reports)杂志网站发表——Fenghua Qian, Shaneice K Nettleford, Jiayan Zhou, Brooke E Arner , Molly A Hall, Arati Sharma, Charyguly Annageldiyev, Randy M Rossi, Diwakar B Tukaramrao, Deborpita Sarkar, Shailaja Hegde, Ujjawal H Gandhi, Emily R Finch, Laura Goodfield, Michael D Quickel, David F Claxton, Robert F Paulson, K Sandeep Prabhu. Activation of GPR44 decreases severity of myeloid leukemia via specific targeting of leukemia initiating stem cells. Cell Reports, 2023, 42(7), 112794. DOI: 10.1016/j.celrep.2023.112794. Published: July 16, 2023. https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00805-7
参与此项研究的除了来自美国宾夕法尼亚州立大学的研究人员之外,还有来自美国辛辛那提大学医学院(University of Cincinnati College of Medicine, Cincinnati, USA)、美国北卡罗来纳大学卫生学院(University of North Carolina Health, Cary, USA)、美国圣裘德儿童研究医院(St. Jude Children's Research Hospital, Memphis, USA)、美国波士顿双环医疗公司(Bicycle Therapeutics, Boston, USA)的研究人员。
研究人员表示,上述研究结果最终可能有助于开发针对某些类型白血病(leukemia)的药物疗法,包括急性髓性白血病(acute myeloid leukemia简称AML),这是成人中最常见的血液和骨髓癌症。
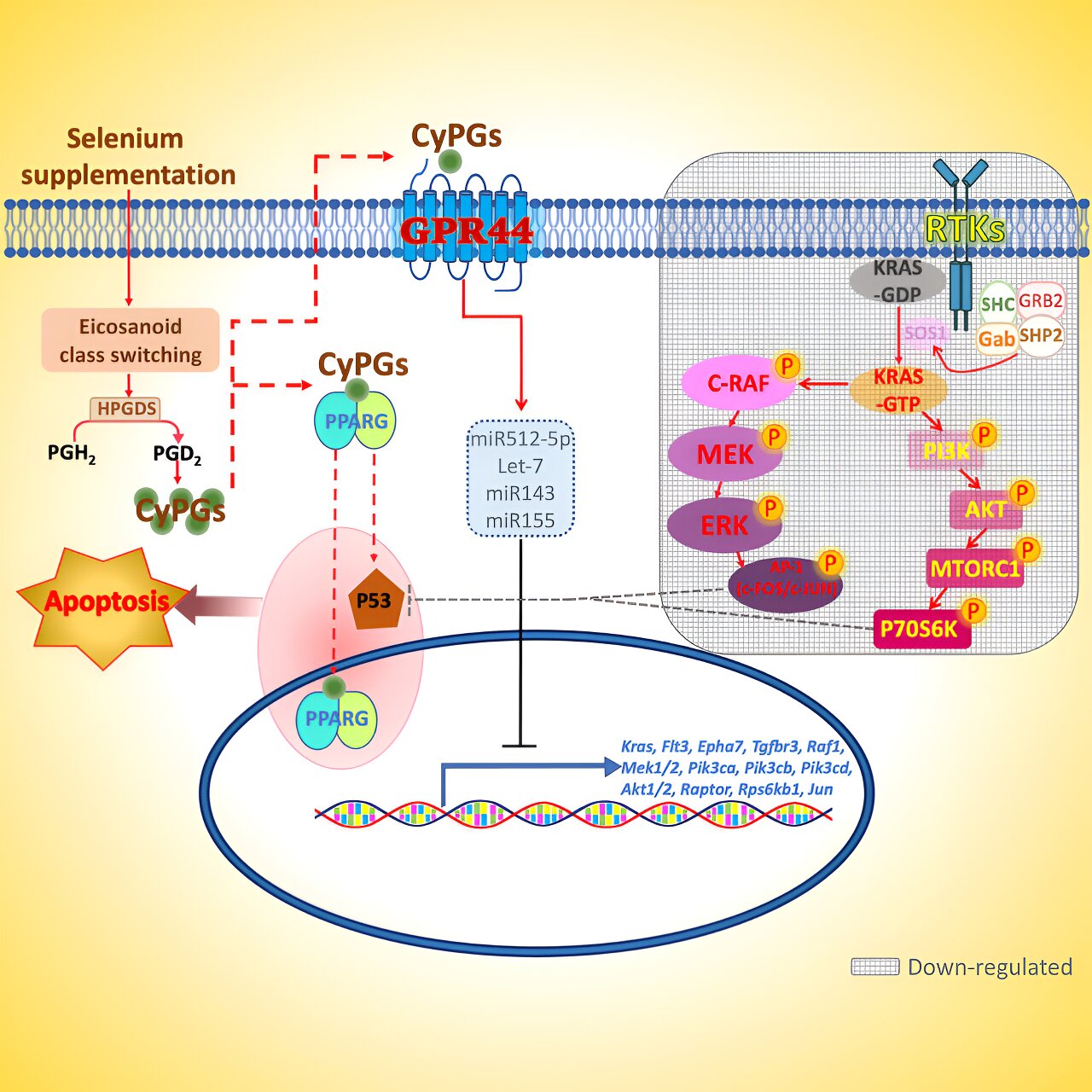
宾夕法尼亚州立大学的科学家此前发现(previously found),在老鼠的饮食中补充硒(一种在许多食物中自然存在的不同量的微量矿物质),可以刺激被称为环戊烯酮前列腺素(cyclopentenone prostaglandins简称CyPGs)的化合物的产生,这种化合物似乎可以杀死或抑制白血病干细胞(leukemia stem cells)。
他们最新的研究表明,这些被称为CyPGs的前列腺素结合并激活了一种名为GPR44的基因。该基因编码一种G蛋白偶联受体(G-protein-coupled receptor),这种受体是细胞膜(cell membrane)上的一种蛋白质,负责传递细胞外物质的信号。当在白血病干细胞上表达时,这种受体向细胞发出信号,使其经历程序性死亡。
上述研究论文的合著者、兽医和生物医学科学(biomedical sciences)教授罗伯特·保尔森(Robert Paulson)说:“我们对GPR44受体的了解还不够充分。它被描述为帮助某些免疫细胞发挥作用,帮助调节所谓的第二类免疫反应。但是我们所做的工作描述了一个全新的功能。我们从前列腺素方面得知前列腺素似乎能够诱导白血病干细胞的细胞死亡(cell death)。现在我们已经证明了它是通过GPR44工作的。”
该研究论文的通讯作者、免疫学和分子毒理学教授、兽医和生物医学科学系主任桑迪普·帕拉布(Sandeep Prabhu)解释说,AML的特点是骨髓、血液和其他组织中异常的、引发白血病的干细胞的增殖。
桑迪普·帕拉布说:“治疗急性髓性白血病(acute myeloid leukemia简称AML)具有挑战性,因为这些持续存在的、引发白血病的干细胞通常不是大多数现有疗法的目标。因此,这种疾病的复发是一个大问题。”
他指出,引发白血病的干细胞类似于正常的造血干细胞,并补充说,选择性靶向白血病干细胞的替代疗法可能为治疗急性髓性白血病(acute myeloid leukemia)和其他恶性肿瘤开辟新的途径。
为了验证GPR44在硒诱导的白血病干细胞(leukemia stem cells)死亡中发挥作用的假设,研究组将缺乏GPR44的小鼠白血病干细胞移植到含有GPR44受体的小鼠细胞中。在移植之前,这些老鼠的饮食中添加了不同量的硒。然后,研究小组观察了这种疾病在不同组中是否以及以多快的速度发展。
罗伯特·保尔森说:“我们之前已经证明,如果给小鼠补充硒或给它们注射CyPGs,我们可以治疗它们的白血病,使其侵袭性降低,甚至基本治愈。我们想了解它的工作机制,在这项研究中,我们通过去除GPR44受体(GPR44 receptor)来测试它,看看没有GPR44受体会发生什么。”
结果表明,与GPR44受体缺失的小鼠相比,补充硒的GPR44受体小鼠的预后明显更好。
桑迪普·帕拉布说:“在缺乏这种受体的老鼠身上,白血病变得极具攻击性,就像把刹车拿走了一样。”他指出,尽管CyPGs诱导白血病干细胞死亡,但它们对骨髓中正常的造血干细胞没有影响,这可能使其成为一种安全的治疗方案,也可能有助于确保白血病期间正常血细胞形成的恢复。
罗伯特·保尔森指出,GPR44在白血病细胞上表达这种受体的存在可能是白血病侵袭性的生物标志物,也可能是患者细胞是否对前列腺素和潜在的相关治疗有反应的生物标志物。
他说:“我们认为我们现在有一个很好的目标来开发治疗方法。当你测试一种新疗法时,一些患者永远不会对你的药物产生反应,因为他们没有合适的受体。现在我们知道这种受体是关键,我们可以根据患者样本和我们认为会有反应的目标来定制我们的测试。这样,我们就更有可能识别出对这种治疗有反应的白血病子集(subset of leukemias)。”
研究人员正与宾夕法尼亚州立大学医学院的研究人员合作,验证他们的发现,希望能在白血病患者身上进行临床试验。他们将这项研究的成功归功于合作者的贡献,包括医学院的科学家、兽医和生物医学科学系的同事以及研究生和本科生(undergraduate students)。
这项工作得到了美国癌症研究所(American Institute for Cancer Research)、美国国立卫生研究院(NIH R01DK077152)、UDSA-NIFA孵化项目(UDSA-NIFA Hatch project no. 4771, accession no. 0000005)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
• Exogenous and dietary selenium supplementation-induced endogenous CyPGs target LICs
• CyPG-dependent activation of GPR44 leads to apoptosis of LICs, sparing normal HSCs
• GPR44 deletion in LICs enhances RTK-activated KRAS-MAPK and -PI3K/AKT/mTORC axes
• Loss of GPR44 increases aggressiveness of AML
Relapse of acute myeloid leukemia (AML) remains a significant concern due to persistent leukemia-initiating stem cells (LICs) that are typically not targeted by most existing therapies. Using a murine AML model, human AML cell lines, and patient samples, we show that AML LICs are sensitive to endogenous and exogenous cyclopentenone prostaglandin-J (CyPG), Δ12-PGJ2, and 15d-PGJ2, which are increased upon dietary selenium supplementation via the cyclooxygenase-hematopoietic PGD synthase pathway. CyPGs are endogenous ligands for peroxisome proliferator-activated receptor gamma and GPR44 (CRTH2; PTGDR2). Deletion of GPR44 in a mouse model of AML exacerbated the disease suggesting that GPR44 activation mediates selenium-mediated apoptosis of LICs. Transcriptomic analysis of GPR44−/− LICs indicated that GPR44 activation by CyPGs suppressed KRAS-mediated MAPK and PI3K/AKT/mTOR signaling pathways, to enhance apoptosis. Our studies show the role of GPR44, providing mechanistic underpinnings of the chemopreventive and chemotherapeutic properties of selenium and CyPGs in AML.
https://blog.sciencenet.cn/blog-212210-1407507.html
上一篇:某些全氟烷基和多氟烷基“永久化学品”被确定为甲状腺癌的潜在危险因素
下一篇:欧洲性传播感染病例创历史新高