博文
挑战过去的理论——科学家在线虫中发现了一种众所周知的人类蛋白质的同系物
||
挑战过去的理论——科学家在线虫中发现了一种众所周知的人类蛋白质的同系物
诸平
Fig. 1 An image depicting Caenorhabditis elegans.
据美国荒岛山生物实验室(The Mount Desert Island Biological Laboratory简称MDIBL, Bar Harbor, ME, USA)2022年12月31日报道,科学家在蠕虫中发现了一种众所周知的人类蛋白质的同系物,这明显是对过去理论的挑战(Challenging Past Theories – Scientists Discover Homolog of a Well-Known Human Protein in a Worm)。图1(Fig. 1)是描绘秀丽隐杆线虫(Caenorhabditis elegans)的图像。在秀丽隐杆线虫中发现人类同系物为ALS也称为卢伽雷氏病(Lou Gehrig’s disease)和阿尔茨海默氏症(Alzheimer’s)等疾病提供了新的见解。相关研究结果于2022年11月3日已经在《自然通讯》(Nature Communications)杂志网站发表——Emily L. Spaulding, Alexis M. Feidler, Lio A. Cook, Dustin L. Updike. RG/RGG repeats in the C. elegans homologs of Nucleolin and GAR1 contribute to sub-nucleolar phase separation. Nature Communications, Published: 03 November 2022. 13, Article number: 6585. DOI: 10.1038/s41467-022-34225-5.
在此项研究中,埃米莉·斯波尔丁(Emily L. Spaulding)博士和达斯汀·厄普代克(Dustin L. Updike)博士在秀丽隐杆线虫(C. elegans, 一种小型透明线虫)中发现了众所周知的人类蛋白质核仁素(Nucleolin)的同系物。
核仁素与人类神经退行性疾病和癌症有关。然而,这一新发现挑战了最近关于细胞核内结构在此类疾病中可能发挥作用的理论,并为研究核仁素的功能及其对疾病的贡献提供了一个强大的新工具。
荒岛山生物实验室达斯汀·厄普代克实验室的博士后研究员埃米莉·斯波尔丁说:“核仁素是一种多功能蛋白质,在许多动物、植物和真菌中都很保守,但以前被认为在线虫中不存在。它还与家族性肌萎缩侧索硬化症和阿尔茨海默氏病有关,总体核仁功能障碍与神经退化有关。”
他们对核仁素同系物(Nucleolin homolog,命名为NUCL-1)的鉴定确立了秀丽隐杆线虫作为核仁素神经元功能和相关神经变性遗传学的新发现平台。
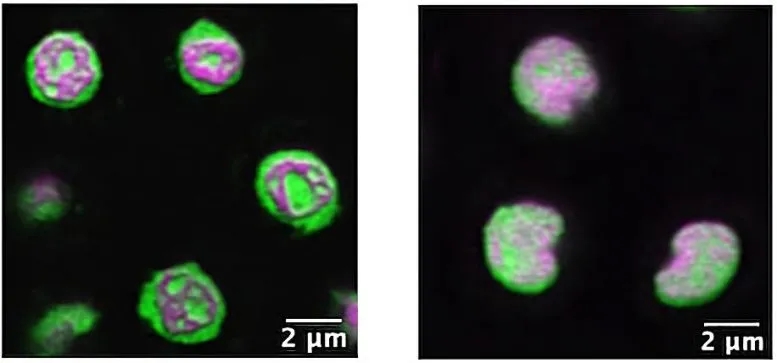
上述图2(Fig. 2)是活的野生型秀丽隐杆线虫核仁的超分辨率图像(左)显示了内部凝聚物组织良好的结构。右图则是,当一个新发现的名为 NUCL-1 的编码基因在突变蠕虫中被破坏时,该结构就会分崩离析。与一些关于核仁亚结构功能的想法相反,野生型和突变型线虫都是健康的,发育正常,并保留了生育能力。
核仁素主要存在于核仁中,核仁是细胞核内组装核糖体的工厂。与细胞内许多其他膜结合细胞器不同,核仁表现得像一个大液滴,也称为凝聚物(Condensates)。
通过液-液相分离形成冷凝物(Condensates)。有些人想象不同密度的斑点在熔岩灯内形成,但在活细胞中究竟如何实现这一点尚不清楚。埃米莉·斯波尔丁和达斯汀·厄普代克的工作表明,线虫核仁中的相分离需要 NUCL-1。
令人惊讶的是,破坏种系中的相分离对健康或生育能力没有影响(Surprisingly, disrupting phase separation in the germline had no effect on health or fertility)
由于线虫特别适用于体内显微镜,可以近距离观察活体动物体内的内源性蛋白质,因此这些发现可能会改变科学家对核仁等冷凝物特性的思考方式。
埃米莉·斯波尔丁说:“ C. elegans的透明性(transparency)使我们能够进行超分辨率成像,这使我们能够看到活体动物的核仁亚结构(nucleolar substructure)。我在其他地方从未见过这样的图像。”
埃米莉·斯波尔丁将核仁比作Tootsie Pop。她说:“它从里到外都有层次。有些蛋白质位于最内层,有些蛋白质位于最外层。这些层中的每一层都被认为代表了核糖体生物发生(ribosome biogenesis)的一个步骤。”
冷凝物亚结构(condensate substructure)的生物学意义仍存在疑问;最近的论点认为,核仁精确、分层的空间组织对于核糖体的产生至关重要。但是美国荒岛山生物实验室(MDIBL)科学家观察到,虽然在转基因秀丽隐杆线虫(transgenic C. elegans)中去除了NUCL-1的一个关键蛋白结构域,破坏了生殖细胞内的核仁结构,但突变的线虫仍然正常发育并产生正常的后代。
埃米莉·斯波尔丁说:“我们注意到,当我们拿走结构域时,核仁失去了它美丽的亚结构,但线虫完全没问题。这是一个惊喜,它暗示也许这种精确的分层组织对核仁功能并不像我们想象的那么重要。这对于理解肌萎缩侧索硬化(ALS)或阿尔茨海默氏病(Alzheimer’s Disease)可能很重要,在这种疾病中,相分离的广泛破坏被认为是导致疾病的原因。”
达斯汀·厄普代克说:“这将真正影响相分离领域,因为得出的许多结论可能是不正确的。结果应该引起广泛关注,并将在相分离、核仁结构和功能以及核仁相关人类疾病领域激发新的研究途径。”
埃米莉·斯波尔丁是2022年美国国立卫生研究院神经科学杰出学者奖(National Institutes of Health’s Outstanding Scholars In Neuroscience Award)的获得者。
本研究得到了美国国家科学基金会(NSF REU DBI-1460495)、美国国立卫生研究院(Maine INBRE fellowship NIH P20GM103423;NRSA NIH F32GM143851; NIH R01GM113933)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
The intrinsically disordered RG/RGG repeat domain is found in several nucleolar and P-granule proteins, but how it influences their phase separation into biomolecular condensates is unclear. We survey all RG/RGG repeats in C. elegans and uncover nucleolar and P-granule-specific RG/RGG motifs. An uncharacterized protein, K07H8.10, contains the longest nucleolar-like RG/RGG domain in C. elegans. Domain and sequence similarity, as well as nucleolar localization, reveals K07H8.10 (NUCL-1) to be the homolog of Nucleolin, a protein conserved across animals, plants, and fungi, but previously thought to be absent in nematodes. Deleting the RG/RGG repeats within endogenous NUCL-1 and a second nucleolar protein, GARR-1 (GAR1), demonstrates these domains are dispensable for nucleolar accumulation. Instead, their RG/RGG repeats contribute to the phase separation of proteins into nucleolar sub-compartments. Despite this common RG/RGG repeat function, only removal of the GARR-1 RG/RGG domain affects worm fertility and development, decoupling precise sub-nucleolar structure from nucleolar function.
https://blog.sciencenet.cn/blog-212210-1370196.html
下一篇:在意外放电时形成的准晶体