博文
浙江大学孙红祥教授团队:ATA靶向FDFT1发挥抗HCT116细胞增殖作用
 精选
精选
||
原文出自 IJMS 期刊
Tu, J.; Meng, X.; Wang, J.; Han, Z.; Yu, Z.; Sun, H. 3β-Hydroxy-12-oleanen-27-oic Acid Exerts an Antiproliferative Effect on Human Colon Carcinoma HCT116 Cells via Targeting FDFT1. Int. J. Mol. Sci. 2023, 24, 15020.https://www.mdpi.com/2512174
研究背景和内容
3β-羟基齐墩果-12-烯-27-羧酸 (3β-hydroxyolean-12-en-27-oic acid,ATA) 是从药用植物落新妇 (Astilbe chinensis (Maxim.) Franch. et Sav) 中分离得到的具有细胞毒作用的齐墩果烷型三萜化合物,其羧基位于C14位置上,化学结构独特。ATA已被证明具有广泛的抗肿瘤活性,但其分子机制仍未阐明。来自浙江大学动物科学学院的屠珏博士、孙红祥教授及其团队发现ATA靶向作用于FDFT1从而抑制HCT116细胞增殖,并将这一成果发表在 International Journal of Molecular Sciences (IJMS) 期刊上。
研究人员通过整合转录组学和网络药理学,并结合体内和体外实验验证,探究了ATA抗人结肠癌HCT116细胞的作用机制和潜在靶点。ATA能显著抑制HCT116细胞增殖,呈现良好的量效和时效关系,并诱导细胞周期G0/G1期阻滞、凋亡、自噬和铁死亡。转录组学、网络药理学和分子对接联合分析揭示,胆固醇合成关键酶FDFT1是介导ATA抗HCT116细胞增殖作用的关键靶点。细胞和动物实验进一步证实ATA能通过靶向抑制FDFT1基因和蛋白水平的表达,诱导HCT116细胞多种死亡形式,发挥抗肿瘤作用。本研究进一步扩展了对三萜类化合物抗肿瘤作用机制的认识,为抗癌药物的研究和设计提供新靶点。
文章亮点
1. ATA诱导HCT116细胞G0/G1期周期阻滞和细胞凋亡。
2. ATA诱导HCT116细胞自噬和铁死亡。
3. ATA靶向FDFT1发挥抗HCT116细胞增殖作用。
4. C14位羧基对于ATA的抗肿瘤活性至关重要。
5. 为抗癌药物的设计和开发提供了新靶点。
研究结果
1. ATA对结肠癌细胞呈现细胞毒性
ATA对一系列结肠癌细胞增殖均有显著的抑制作用,其中人结肠癌HCT116细胞最敏感,IC50为16.17±2.68 μM (图1A,B)。同时,以荧光显微镜观察HCT116细胞经ATA处理24小时后的形态学变化。吖啶橙 (AO) 染色可见,ATA处理后细胞核显示典型的凋亡样特征:染色质浓缩、致密,核碎片,并有凋亡小体。自噬体特异性染料MDC染色后, ATA处理细胞蓝色荧光亮点显著增多。DCFH-DA探针标记显示,作为铁死亡直接标志的细胞内活性氧 (ROS) 水平显著升高 (图1C)。流式细胞术结果显示,ATA处理HCT116细胞,G0/G1期细胞显著增多,细胞凋亡水平显著升高 (图1D-G)。
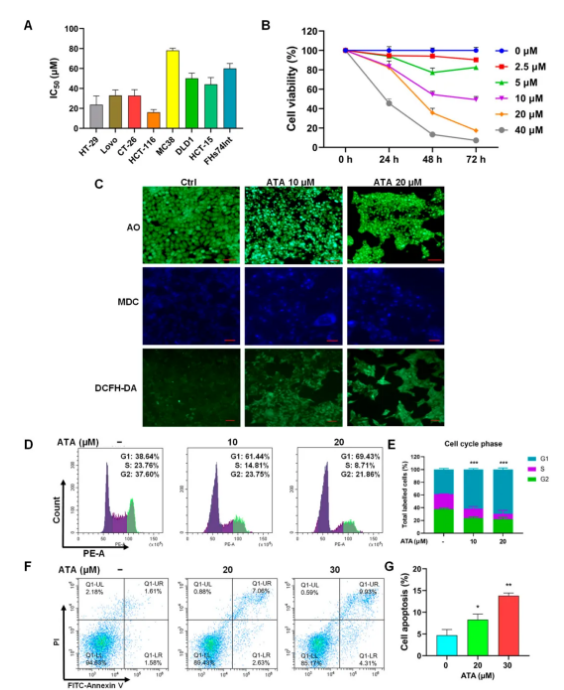
图1 ATA对结肠癌细胞的细胞毒作用
2. ATA诱导的HCT116细胞基因表达谱及DEGs分析
为了阐明ATA抗结肠癌的分子机制,对ATA处理不同时间的HCT116细胞进行转录组测序分析,流程如图2。
1550个DEGs的GO功能和KEGG通路富集分析结果表明:DEGs的生物学功能主要涉及“非折叠蛋白反应”、“上皮细胞分化”、“蛋白激酶调控”、“内质网应激反应”、“细胞增殖”、“细胞死亡调控”等条目;KEGG通路主要富集于“PI3K-Akt信号通路”、“Wnt信号通路”、“细胞周期”、“铁死亡”、“凋亡”、“p53信号通路”、“Ras信号通路”、“mTOR信号通路”等 (图3A-B)。
以STRING数据库进行PPI分析,运用Cytoscape软件MCODE插件得到35个关键模块,最高得分 (18.00) 的MCODE1中显著下调的基因都广泛参与了DNA复制和细胞周期调控。MCODE2中的基因如FASN、FDFT1和SCD主要参与胆固醇合成。此外,ER应激基因、自噬基因显著上调 (图3C-D)。以CytoHubba插件中8种算法得到11个关键基因,并以TRRUST数据库预测到调控这些关键基因的67个转录因子 (图3E)。
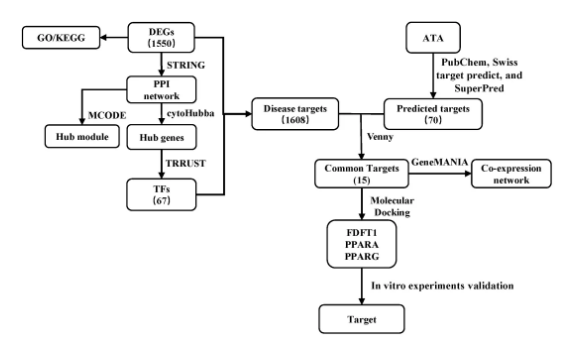
图2 转录组分析流程
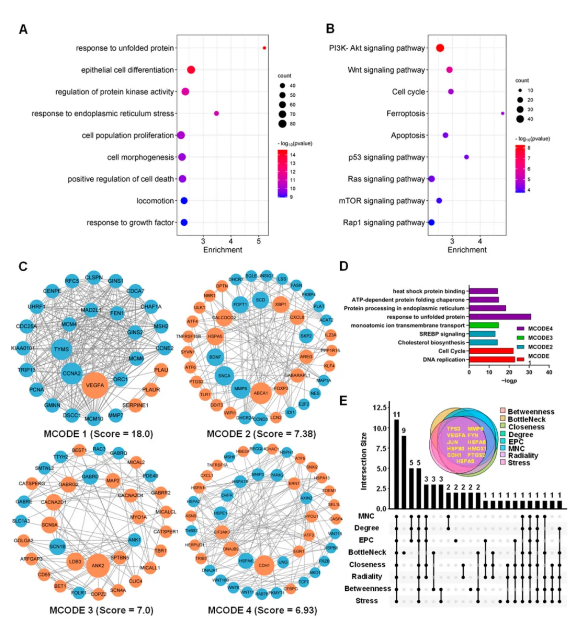
图3 DEGs功能和关键基因
3. 转录组分析联合网络药理学和分子对接获得关键靶点
搜索PubChem、Swiss Target Prediction和SuperPred数据库得到ATA潜在的70个靶点。与转录组分析得到的1608个基因做交集,获得15个共同靶点 (图4A)。通过GeneMANIA构建共表达网络,注释相关功能。15个共有靶点主要参与配体激活的转录因子活性、氧水平反应、DNA损伤反应信号通路、细胞周期检查点等生物学过程 (图4B)。采用MCODE插件筛选PPARG、PPARA、FABP5、FDFT1和SCD为潜在的关键靶点。分子对接分析显示,ATA与FDFT1、PPARA和PPARG均呈现良好的结合 (图4C)。
采用FDFT1、PPARA和PPARG的特异性抑制YM-53601、GW6471和GW9662开展抑制剂实验。FDFT1抑制剂YM-53601能显著逆转ATA对HCT116细胞的增殖抑制作用,而PPARA抑制剂和PPARG抑制剂对ATA的毒性作用没有影响 (图4D-F),表明FDFT1参与ATA对HCT116细胞的细胞毒作用。更有趣的是,通过网络药理学预测到的靶点中,FDFT1是ATA区别于它的两个同分异构体齐墩果酸 (OA) 和乌苏酸 (UA) 的特有靶点。ATA、UA和OA分子量相同,仅有甲基和羧基的位置的区别,但三者对HCT116细胞的细胞毒作用差别很大,IC50分别为13.7±1.23, 74.10±5.40和112.95±5.02 μm (图4G-H)。这些结果表明:FDFT1可能是ATA的抗肿瘤关键靶点,是其具有更优越的抗肿瘤作用的原因。
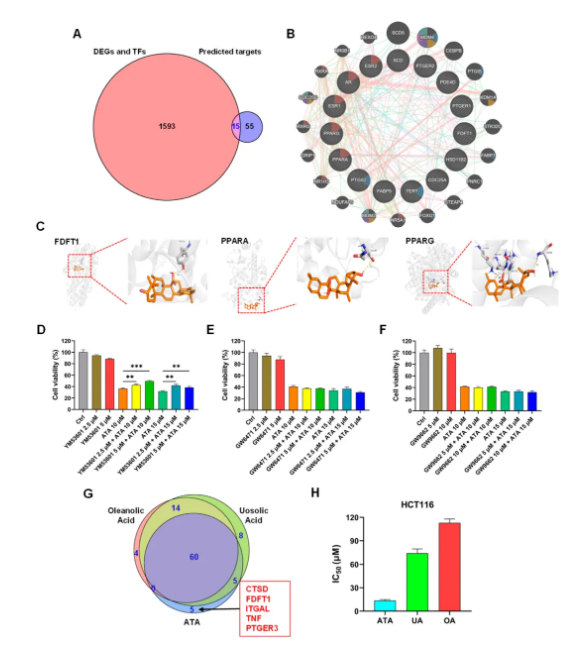
图4 ATA抗肿瘤靶点的确认
4. FDFT1介导ATA对HCT116细胞的细胞毒作用
RT-qPCR和Western blot分析结果显示:ATA能显著下调FDFT1基因和蛋白表达水平 (图5A-C)。YM-53601能显著逆转ATA对HCT116细胞的增殖抑制作用,而对UA和OA的细胞毒作用没影响 (图5D-F)。运用mRFP-GFP-LC3自噬指示系统研究表明,ATA处理后HCT116细胞红色亮点 (mRFP+GFP-) 显著增多,表明细胞自噬流的显著增强。而YM-53601能显著减弱ATA诱导的细胞自噬 (图5G)。同样地,YM-53601显著减弱ATA的促凋亡作用 (图5H-I)。进一步以siRNA敲减FDFT1,ATA的细胞毒作用显著减弱 (图5J-M)。这些结果表明FDFT1介导ATA对HCT116细胞的细胞毒作用。
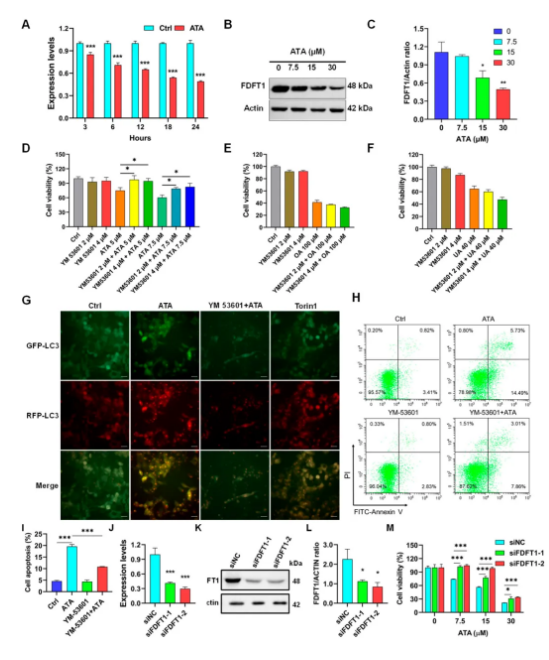
图5 FDFT1介导ATA抗HCT116作用
5. ATA靶向调控FDFT1进而抑制裸鼠HCT116异种移植瘤生长
ATA能显著抑制裸鼠HCT116异种移植瘤生长,而对小鼠体重没有影响 (图6A-D)。同时,Western blot结果显示,ATA给药组小鼠肿瘤组织FDFT1蛋白表达显著下调,伴随着细胞周期蛋白cyclinD1、凋亡蛋白pro-caspase3、抗铁死亡蛋白GPX4和自噬底物p62显著下降,而自噬标记蛋白LC3II/I显著升高 (图6E-F)。表明ATA能诱导G0/G1期阻滞,促进细胞凋亡、自噬和铁死亡,与体外实验结果一致。
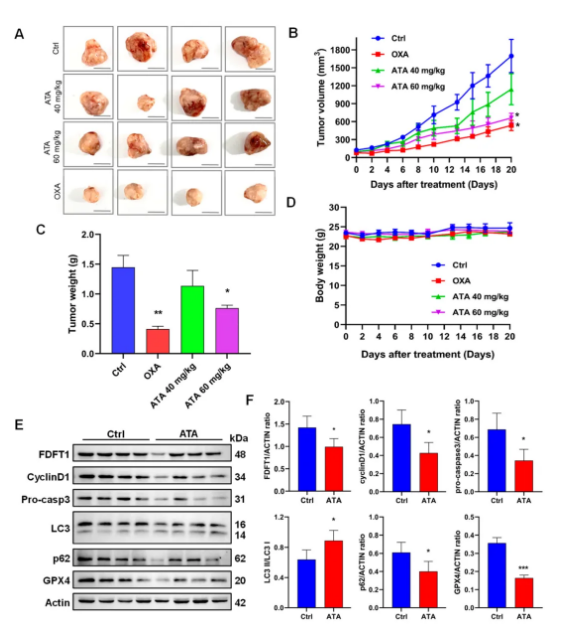
图6 ATA抑制HCT116裸鼠异种移植瘤生长
IJMS 期刊介绍
主编:Maurizio Battino, Marche Polytechnic University, Italy
期刊发表生物化学与分子生物学、生物材料、生物物理、生物医学、化学和纳米科学等分子相关领域的研究,目前已被 Scopus、SCIE (Web of Science)、PubMed 等数据库收录。
2022 Impact Factor:5.6
2022 CiteScore:7.8
Time to First Decision:16.3 Days
Acceptance to Publication:2.6 Days


https://blog.sciencenet.cn/blog-3516770-1429246.html
上一篇:MDPI 喜报 | 第一季度,37个期刊被数据库收录!
下一篇:中国水产科学研究院黄海水产研究所——中国养殖长牡蛎大规模死亡流行病学调查及主要病原致病性分析