博文
MIT:蛋白质结构为耐药机制提供了线索
 精选
精选
||
MIT:蛋白质结构为耐药机制提供了线索
诸平
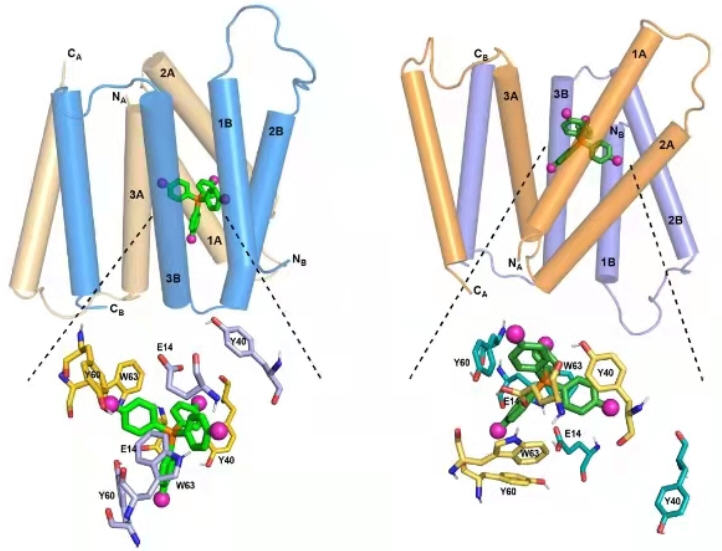
Fig. 1 MIT chemists have discovered how the structure of the EmrE transporter changes as a compound moves through it. At left is the transporter structure at high pH. As the pH drops (right), the helices begin to tilt so that the channel is more open toward the outside of the cell, guiding the compound out. Credit: MIT
据美国麻省理工学院(Massachusetts Institute of Technology简称MIT)2022年2月18日提供的消息,麻省理工学院(MIT)的化学家们和美国威斯康辛大学麦迪逊分校(University of Wisconsin at Madison)的研究人员合作,他们发现了一种蛋白质的结构,这种蛋白质可以将有毒分子从细菌细胞中泵出(Protein structure offers clues to drug-resistance mechanism)。这种蛋白质在大肠杆菌(E. coli)中发现,被认为可以帮助细菌对多种抗生素产生耐药性。
MIT的化学家已经发现了EmrE转运体的结构是如何随着化合物通过而改变的。图1(Fig.1)左边是高pH值时的转运体结构。当pH值下降时(右边),螺旋开始倾斜,通道向细胞外更开放,引导化合物出来。相关研究结果于2022年2月18日已经在《自然通讯》(Nature Communications)杂志网站发表——Alexander A. Shcherbakov, Peyton J. Spreacker, Aurelio J. Dregni, Katherine A. Henzler-Wildman, Mei Hong. High-pH structure of EmrE reveals the mechanism of proton-coupled substrate transport. Nature Communications, 2022; 13(1), Article number: 991. DOI: 10.1038/s41467-022-28556-6. Published: 18 February 2022. https://www.nature.com/articles/s41467-022-28556-6
利用核磁共振(nuclear magnetic resonance简称NMR)波谱,研究人员能够确定这种蛋白质的结构是如何随着类药物分子的移动而改变的。MIT化学教授,也是上述论文的通讯作者洪梅(Mei Hong音译)说,了解了这种详细的结构,就有可能设计出能够阻断这些转运蛋白的药物,并帮助耐药细菌对现有抗生素重新敏感。“了解了这种蛋白质的药物结合袋(drug-binding pocket)的结构,就可以尝试设计这些底物的竞争对手,这样你就可以阻止结合位点,阻止蛋白质从细胞中移除抗生素。”
MIT研究生亚历山大·柴巴可夫(Alexander Shcherbakov)是这项研究的主要作者,该研究团队还包括MIT研究生奥雷利奥·德雷格尼(Aurelio Dregni)和来自威斯康星大学麦迪逊分校的研究生佩顿·斯普瑞克(Peyton Spreacker)和生物化学教授凯瑟琳·亨茨勒-怀德曼(Katherine Henzler-Wildman)。
耐药性转运蛋白(Drug-resistance transporters)
将药物通过细胞膜排出体外是细菌逃避抗生素的众多策略之一。几年来,凯瑟琳·亨茨勒-怀德曼教授在威斯康星大学的研究小组一直在研究一种叫做EmrE的膜结合蛋白,它可以运输许多不同的有毒分子,包括除草剂和抗菌化合物。
EmrE属于一种被称为小型多药耐药(small multidrug resistance简称SMR)转运蛋白的蛋白质家族。虽然EmrE没有直接参与抗生素耐药性,但在耐药形式的结核分枝杆菌(Mycobacterium tuberculosis)和鲍曼不动杆菌(Acinetobacter baumanii)中发现了该家族的其它成员。
凯瑟琳·亨茨勒-怀德曼教授说:“SMR转运蛋白在蛋白质关键区域具有高度的序列保守性。EmrE是迄今为止在体外和体内研究得最好的家族成员,这使得它成为研究支持SMR活性的结构的理想模型系统。”
几年前,洪梅实验室开发了一种技术,允许研究人员使用核磁共振来测量蛋白质中氟探针和氢原子之间的距离。这使得确定蛋白质与含氟分子结合时的结构成为可能。洪梅在一次会议上谈到这项新技术后,凯瑟琳·亨茨勒-怀德曼建议她们合作研究EmrE。她的实验室花了多年时间研究EmrE是如何通过磷脂膜(phospholipid membrane)运输类药物分子或配体的。这个配体被称为F4-TPP+,是一个四面体分子,四个氟原子附着在它上面,每个角上一个。
利用这种配体和洪梅的新核磁共振技术,研究人员开始确定EmrE的原子分辨率结构。我们已经知道每个EmrE分子包含四个大致平行的跨膜螺旋。两个EmrE分子组装成一个二聚体,八个跨膜螺旋形成内壁,在配体通过通道时与配体相互作用。先前的研究已经揭示了螺旋的整体拓扑结构,但没有揭示延伸到通道内部的蛋白质侧链,这些侧链就像抓住配体并帮助引导它通过通道的手臂。
EmrE将有毒分子从pH值中性的细菌细胞内运送到pH值为酸性的细菌细胞外。这种跨膜pH的变化影响了EmrE的结构。在2021年的一篇论文中,洪梅和凯瑟琳·亨茨勒-怀德曼发现了这种蛋白质的结构,因为它在酸性环境中与F4-TPP+结合。在《自然通讯》(Nature Communications)发表的新研究论文中,他们分析了中性pH值下的蛋白质结构,从而确定蛋白质结构如何随着pH值的变化而变化。
一个完整的结构(A complete structure)
研究人员在这项研究中发现,在中性pH值下,构成通道的四个螺旋相对平行,创造了一个开口,配体可以很容易地进入。随着pH值的下降,细胞膜向外移动,螺旋开始倾斜,通道向细胞外更开放。这有助于将配体推出通道。与此同时,在蛋白质侧链中发现的几个环改变了它们的方向,这也有助于引导配体离开通道。此通道的酸性端也更容易接受质子,质子进入通道并帮助通道进一步打开,使配体更容易退出。
洪梅说:“这篇论文真正完善了这个故事。一个结构是不够的,需要两个,来弄清楚一个转运体是如何打开细胞膜的两边的,因为它应该把配体或抗生素化合物从细菌内部泵出细菌。”
EmrE通道被认为可以运输许多不同的有毒化合物,所以洪梅和她的同事现在计划研究其他分子是如何通过这个通道的。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
化学家揭示了流感B蛋白的结构(Chemists unveil the structure of an influenza B protein)
The homo-dimeric bacterial membrane protein EmrE effluxes polyaromatic cationic substrates in a proton-coupled manner to cause multidrug resistance. We recently determined the structure of substrate-bound EmrE in phospholipid bilayers by measuring hundreds of protein-ligand HN–F distances for a fluorinated substrate, 4-fluoro-tetraphenylphosphonium (F4-TPP+), using solid-state NMR. This structure was solved at low pH where one of the two proton-binding Glu14 residues is protonated. Here, to understand how substrate transport depends on pH, we determine the structure of the EmrE-TPP complex at high pH, where both Glu14 residues are deprotonated. The high-pH complex exhibits an elongated and hydrated binding pocket in which the substrate is similarly exposed to the two sides of the membrane. In contrast, the low-pH complex asymmetrically exposes the substrate to one side of the membrane. These pH-dependent EmrE conformations provide detailed insights into the alternating-access model, and suggest that the high-pH conformation may facilitate proton binding in the presence of the substrate, thus accelerating the conformational change of EmrE to export the substrate.
https://blog.sciencenet.cn/blog-212210-1326201.html
上一篇:迄今为止最有力的证据表明,多发性硬化症是由Epstein-Barr病毒引起的
下一篇:花甲之前动起来,古稀之后免受罪