博文
生物纳米机器的突破:可持续化学的万能钥匙  精选
精选
||
生物纳米机器的突破:可持续化学的万能钥匙
诸平
据瑞士保罗·谢勒研究所(Paul Scherrer Institute简称PSI, Villigen, Switzerland)2024年5月14日提供的消息,生物纳米机器的突破:可持续化学的万能钥匙(Bionanomachine Breakthrough: A Master Key for Sustainable Chemistry)。该研究所(PSI)的科学家们首次精确地描述了氧化苯乙烯异构酶(styrene oxide isomerase),这种酶可以以一种环保的方式用于生产有价值的化学品和药物前体。这项研究2024年5月14日发表在《自然化学》(Nature Chemistry)杂志网站——Basavraj Khanppnavar, Joel P. S. Choo, Peter-Leon Hagedoorn, Grigory Smolentsev, Saša Štefanić, Selvapravin Kumaran, Dirk Tischler, Fritz K. Winkler, Volodymyr M. Korkhov, Zhi Li, Richard A. Kammerer, Xiaodan Li. Structural basis of the Meinwald rearrangement catalysed by styrene oxide isomerase. Nature Chemistry, 2024. DOI: 10.1038/s41557-024-01523-y. Published: 14 May 2024. https://www.nature.com/articles/s41557-024-01523-y
参与此项研究的还有来自新加坡国立大学(National University of Singapore, Singapore, Singapore)、荷兰代尔夫特理工大学(Delft University of Technology, Delft, The Netherlands)、瑞士苏黎世大学(University of Zurich, Lindau, Switzerland)、德国鲁尔大学(Ruhr University Bochum, Bochum, Germany)以及瑞士苏黎世联邦理工学院(ETH Zürich, Switzerland)的研究人员。
酶是一种强大的生物分子,可以在环境条件下产生许多物质。它们可以实现绿色化学,减少合成化学过程中产生的环境污染。PSI的研究人员现在已经详细描述了一种来自自然界的工具:氧化苯乙烯异构酶。这是生物版的迈因瓦尔德反应(Meinwald reaction),是有机化学中一个重要的化学反应。
PSI生物分子研究实验室(PSI’s Biomolecular Research Laboratory)的理查德·卡默勒(Richard Kammerer)说:“几十年前发现的这种酶是由细菌产生的。”理查德·卡默勒的同事李小丹(Xiaodan Li音译)补充说:“但由于它的作用方式不为人所知,它的实际应用至今受到限制。”此二位研究人员和他们的团队已经阐明了这种酶的结构以及它的工作方式。
复杂反应的简单机理(Simple Mechanism for a Complicated Reaction)
微生物拥有特定的酶,例如,它们可以用这些酶分解有害物质并将其用作营养物质。苯乙烯氧化物异构酶就是其中之一。与另外两种酶一起,它使某些环境细菌能够在碳氢化合物苯乙烯(hydrocarbon styrene)上生长。
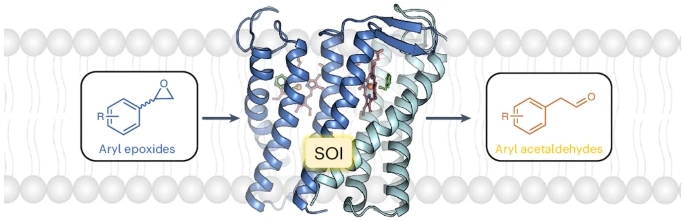
氧化苯乙烯异构酶在反应中催化一个非常特殊的步骤:它在氧化苯乙烯中分裂一个由一个氧和两个碳原子组成的三元环,即所谓的环氧化物(epoxide)。因此,此酶是高度特异性的,只产生一种产物。它还能够转化一些其他物质,生产用于医疗用途的重要前体。
一个特别的优点是,在许多化学反应中,会形成一种化合物和其镜像,这两种化合物它们可能具有完全不同的生物效应。但是这种酶只产生两种产物中的一种。在化学中,这种性质被称为立体特异性(stereospecificity),它对药物前体分子的生成尤其重要。李小丹说:“这种酶是大自然如何以简单而巧妙的方式使化学反应成为可能的一个令人印象深刻的实例。”
在化学和制药工业中非常有用(Extremely Useful in Chemical and Pharmaceutical Industries)
在部分在瑞士光源SLS(Swiss Light Source SLS)进行的研究过程中,PSI研究人员发现了这种酶的秘密:它的内部有一个含铁基团,类似于我们红细胞中的含铁色素(iron-containing pigment)。这个血红素基团(haem group)与环氧化物环结合,这就是它使反应如此简单和有效的原因。研究的其他部分由弗拉基米尔·科克霍夫(Volodymyr Korkhov)小组进行,弗拉基米尔·科克霍夫是来自PSI生物分子研究实验室(PSI Laboratory for Biomolecular Research)和苏黎世联邦理工学院生物系的副教授,擅长使用冷冻电子显微镜(cryo-electron microscopy)。
李小丹和理查德·卡默勒确信,这种酶在化学和制药工业中将被证明是非常有用的。理查德·卡默勒强调说,“这是迄今为止已知的唯一一种催化迈因瓦尔德反应(Meinwald reaction)的细菌酶。”在这种酶的帮助下,工业可以在节能和环保的条件下生产药物和重要化学品的前体。
李小丹补充说:“这种酶可能会被改变,从而产生许多新物质。”此外,该酶非常稳定,因此适合大规模的工业应用。PSI的研究人员确信,“它肯定会成为循环经济和绿色化学的一个新的重要工具。”
该项目得到了PSI生物分子研究实验室蛋白质工程小组(Protein Engineering group of the Laboratory of Biomolecular Research at PSI)的预算支持。本研究的一部分由新加坡国家研究基金会(NRF)通过竞争性研究计划(CRP){National Research Foundation (NRF), Singapore, through a Competitive Research Program (CRP) (project ID NRF-CRP17-2017-03)}和新加坡教育部{Ministry of Education, Singapore, through a MOE Tier 2 grant (project ID MOE 2016-T2-2-140) and an MOE Tier 1 grant (WBS: A-0009183-01-00)}提供资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Membrane-bound styrene oxide isomerase (SOI) catalyses the Meinwald rearrangement—a Lewis-acid-catalysed isomerization of an epoxide to a carbonyl compound—and has been used in single and cascade reactions. However, the structural information that explains its reaction mechanism has remained elusive. Here we determine cryo-electron microscopy (cryo-EM) structures of SOI bound to a single-domain antibody with and without the competitive inhibitor benzylamine, and elucidate the catalytic mechanism using electron paramagnetic resonance spectroscopy, functional assays, biophysical methods and docking experiments. We find ferric haem b bound at the subunit interface of the trimeric enzyme through H58, where Fe(III) acts as the Lewis acid by binding to the epoxide oxygen. Y103 and N64 and a hydrophobic pocket binding the oxygen of the epoxide and the aryl group, respectively, position substrates in a manner that explains the high regio-selectivity and stereo-specificity of SOI. Our findings can support extending the range of epoxide substrates and be used to potentially repurpose SOI for the catalysis of new-to-nature Fe-based chemical reactions.
https://blog.sciencenet.cn/blog-212210-1434099.html
上一篇:量子突破,麻省理工学院实现了前所未有的原子接近
下一篇:新方法揭开了慢电子之谜