博文
基于自供氢镁增强胶原膜的骨免疫代谢调控用于促进引导性骨再生
||
自供氢镁增强胶原膜促进骨再生【澳】
基于自供氢镁增强胶原膜的骨免疫代谢调控用于促进引导性骨再生
研究亮点
1. 研发创新型引导性骨再生膜,可实现氢气的局部递送,促进骨再生。
2. 氢气与镁离子的双重缓释协同调控炎症反应,增强成骨活性。
3. 镁丝增强结构提升了引导性骨再生膜的机械稳定性。
4. 镁丝增强胶原膜(Col-MMW)通过调控骨免疫代谢进程,发挥骨再生促进作用。
5. 该多功能膜材料为再生医学领域的生物材料设计提供了新方向。
摘要
尽管分子氢具有强效抗氧化与抗炎特性,但其在骨组织工程领域的局部递送策略尚未得到充分探索。本研究制备了一种负载金属酚网络涂层镁微丝的多功能胶原膜(Col-MMW),并将其应用于引导性骨再生(GBR)。
膜中嵌入的镁微丝可发挥机械增强作用,在愈合早期维持膜的结构完整性与空间占位能力;同时,镁的降解过程能够实现氢气(H2)与镁离子(Mg2+)的位点特异性持续释放,为调控骨免疫微环境提供了协同策略。
该胶原膜可清除细胞内活性氧(ROS),并介导细胞代谢模式由糖酵解向氧化磷酸化转变,进而激活核因子E2相关因子2(NRF-2)调控的氧化还原平衡通路,抑制核因子κB(NF-κB)通路驱动的炎症反应。这种骨免疫代谢重编程作用可显著减轻局部炎症应答。
大鼠皮下植入实验与颅骨缺损模型等体内研究证实,Col-MMW的免疫调控效应可有效促进成骨过程。
该材料将机械增强特性与局部代谢、免疫调控功能相结合,革新了引导性骨再生膜的设计范式。研究结果表明,Col-MMW是一种兼具结构稳定性与靶向骨免疫调控功能的新一代生物材料,有望填补骨修复领域智能生物材料的应用空白。
1 引言
引导性骨再生(GBR)是口腔医学与骨科领域的关键技术,主要用于修复骨量不足区域的新生骨组织[1,2]。传统引导性骨再生膜仅作为物理屏障维持缺损区域空间,缺乏生物活性,无法主动促进骨再生进程[3,4]。
自20世纪初以来,镁基生物材料因其优异的生物可降解性、生物相容性,以及与天然骨组织匹配的力学性能,在承重领域的应用受到广泛关注[5-8]。随着对镁离子生理功能(尤其是在骨代谢与成骨过程中的作用)的深入研究,镁基材料在再生医学领域的应用潜力进一步凸显[8,9]。
与此同时,免疫调控在组织再生中的作用逐渐成为研究热点[10,11]。其中,巨噬细胞代谢在调控免疫应答与愈合进程中发挥核心作用[10,12,13]。引导性骨再生的成功依赖于巨噬细胞从促炎表型(M1型)向促再生表型(M2型)的转化,而这一过程与细胞代谢重编程密切相关。具体而言,细胞代谢模式由糖酵解向氧化磷酸化的转变,有助于增强抗炎信号传导并促进组织修复[14]。靶向调控这一代谢轴,是改善再生微环境中成骨效率的有效策略。
尽管氢气具有潜在的治疗价值,但其在骨组织工程领域的应用却长期被忽视。1975年,多尔等人报道了高压氢气处理可使小鼠肿瘤消退,这一研究首次揭示了氢气的生物学效应[15]。此后的研究证实,氢气在多种疾病治疗中具有显著效果,包括肺功能障碍、肺气肿及新型冠状病毒肺炎(COVID-19)等,其中临床常用氧氢混合气体(氧氢体积比为1:2)吸入疗法进行干预[16,17]。
作为与一氧化氮、一氧化碳、硫化氢并列的关键气体信号分子,氢气在抗炎、缺血再灌注损伤保护、神经保护等多种病理过程中展现出良好应用前景[18-23]。与传统抗氧化剂不同,氢气可特异性清除细胞毒性羟基自由基(·OH)——这是一种缺乏天然酶促解毒途径的活性氧;同时,氢气分子体积小且具有非极性特征,可自由扩散进入细胞器发挥作用[24]。氢气在多种疾病模型中表现出的抗炎效应,暗示其在骨再生领域具有潜在应用价值[16,19,25]。然而,骨组织工程中氢气的局部递送策略仍需进一步探索。
镁基生物材料为解决这一问题提供了独特思路。尽管镁基材料存在腐蚀速率快、氢气生成量难以控制等挑战,但这些特性可被转化为治疗优势[6,8,26]。基于此,本研究制备了一种负载金属酚网络涂层镁微丝的新型胶原膜(Col-MMW)。该设计整合了专利金属酚网络(MPN)涂层技术,可有效稳定镁微丝结构,使其在生理体液环境中实现可控降解,并持续释放氢气与镁离子[27]。
Col-MMW膜通过结合机械增强特性与局部生物活性,突破了传统引导性骨再生材料的局限性。其降解产物(氢气与镁离子)具备免疫调控与抗氧化功能,有望减轻局部炎症反应,加速组织愈合。
本研究制备了兼具结构稳定性与生物相容性的Col-MMW膜,评估了其产氢能力与活性氧清除效能。我们提出假说:Col-MMW可通过调控氧化应激与免疫应答(尤其是巨噬细胞极化与代谢重编程),构建利于骨再生的微环境。
该多功能生物材料平台为提升引导性骨再生效果提供了具有临床转化潜力的策略,其潜在应用包括种植术前的牙槽骨再生,以及骨科非承重部位节段性骨缺损的修复治疗。
2 材料与方法
2.1 镁微丝增强胶原膜(Col-MMW)的制备与表征
参照课题组前期方法提取胶原[12]。简要步骤如下:将猪皮来源的胶原溶解于含12.5 mg/mL胃蛋白酶(澳大利亚Chem Supply公司,货号PL082)的50 mM乙酸溶液(澳大利亚Sigma-Aldrich公司,货号A6283)中,于4℃条件下搅拌溶解。一周后,将上清液置于0.7 M氯化钠溶液(澳大利亚Sigma-Aldrich公司,货号567440)中,4℃、12000×g条件下超速离心60 min,使胶原沉淀。
先后使用1 M与1.8 M氯化钠溶液沉淀并去除杂蛋白,剩余含Ⅰ型胶原的溶液在2.4 M氯化钠溶液中4℃静置过夜,完成胶原沉淀。将沉淀的Ⅰ型胶原重新溶解于25 mM乙酸溶液,经超纯水透析后冷冻干燥,备用。
镁微丝(MMW,直径300 μm)由西北有色金属研究院陕西省生物医用金属材料重点实验室提供。为降低镁微丝的腐蚀与降解速率,参照课题组前期专利方法(WO 2020/243768 A9)并稍作改进,在其表面制备金属酚网络涂层[27,28]。简要步骤如下:涂层前,将镁微丝置于pH 10.0的氢氧化钠溶液(澳大利亚Sigma-Aldrich公司,货号567530)中处理1.5 h;配置涂层液(含1 mg/mL单宁酸(澳大利亚Sigma-Aldrich公司,货号403040)与3.6 mg/mL氯化镁(澳大利亚Sigma-Aldrich公司,货号M8266));将镁微丝浸入涂层液30 min后,用去离子水冲洗并立即干燥;重复涂层操作两次,确保涂层均匀覆盖[27]。
采用双层胶原基质包埋涂层镁微丝(负载量2.5 mg/cm²)的方法制备镁微丝增强胶原膜,膜尺寸为1 cm×2 cm(图1A)。简要步骤如下:将下层胶原溶液倒入模具并冷冻,形成稳定基底;将涂层镁微丝精准放置于冷冻胶原层中央,随后覆盖等体积上层胶原溶液;二次冷冻后,将复合材料转移至冻干机冻干;参照课题组前期方法,使用N-羟基琥珀酰亚胺(澳大利亚Sigma-Aldrich公司,货号56480)与1-乙基-3-(3-二甲胺基丙基)碳二亚胺盐酸盐(澳大利亚Sigma-Aldrich公司,货号E7750)混合液对冻干膜进行化学交联24 h(图1)[12];充分洗涤以去除过量交联剂,再次冻干;最后对复合材料施加2吨压力,制备致密的增强型胶原膜。采用相同方法制备不含镁微丝的空白胶原膜(Col)作为对照。
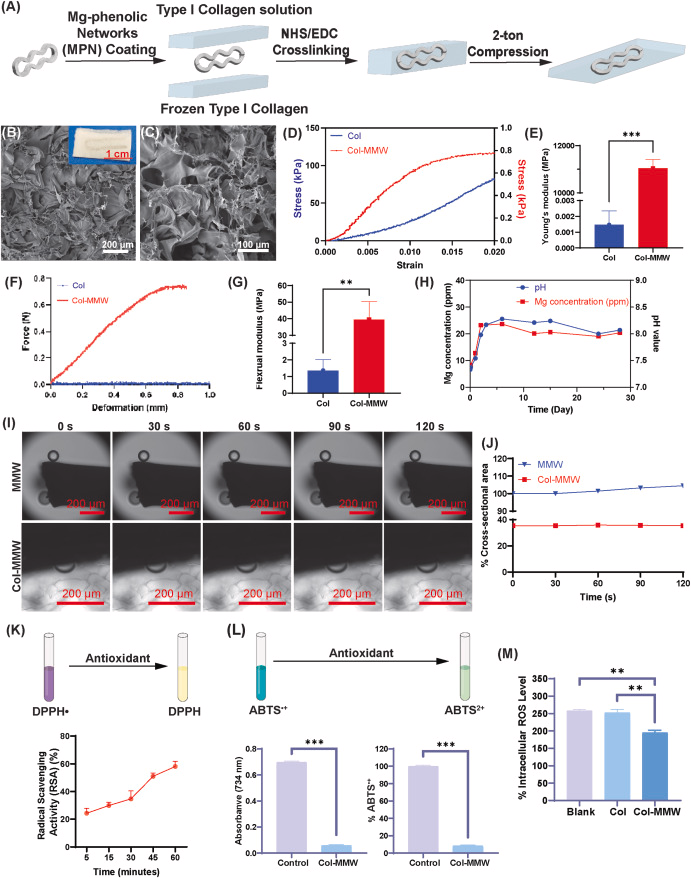
图1 镁微丝增强胶原膜(Col-MMW)的表征及其活性氧清除性能
(A)Col-MMW的制备流程示意图:将涂层镁微丝(2.5 mg/cm²)嵌入双层胶原基质(1 cm×2 cm)中,经依次冷冻、冻干、化学交联(EDC/NHS)、洗涤及加压处理,制备致密的增强型胶原膜;
(B–C)Col-MMW膜加压后的扫描电镜图像:(B)低倍镜图像显示膜表面粗糙(插图为膜的实物照片);(C)高倍镜图像显示膜的多孔微观结构(注:两张电镜图为膜的不同区域,并非放大或缩小关系);
(D)空白胶原膜(Col)与Col-MMW膜的应力-应变曲线,二者斜率存在显著差异;
(E)Col与Col-MMW膜的杨氏模量对比,镁微丝的引入显著提升了膜的杨氏模量;
(F)Col与Col-MMW膜的力-形变曲线,显示二者弯曲性能差异显著;
(G)Col-MMW膜的弯曲模量高于Col膜,证实镁微丝实现了机械增强效果;
(H)28天内Col-MMW膜在磷酸盐缓冲液中的镁离子释放曲线(红色,左纵轴)及体系pH值变化曲线(蓝色,右纵轴)(ppm:百万分之一浓度单位,等效于mg/L);
(I)氢气气泡生长过程的时序截图(观测时长120 s,上排为镁微丝组,下排为Col-MMW组);
(J)用于定量分析的代表性氢气气泡图像(为保证成像与测量的一致性,每组选取单个气泡进行分析);
(K)DPPH自由基清除实验:Col-MMW膜的自由基清除活性随时间延长(60 min内)逐渐增强;
(L)ABTS自由基清除实验:Col-MMW膜可显著清除ABTS•+自由基(*p*<0.0001)(左图:734 nm处吸光度值;右图:对应的自由基清除率),统计方法为非配对*t*检验;
(M)RAW 264.7巨噬细胞的DCFH-DA荧光探针实验:Col-MMW组细胞内活性氧水平显著降低,统计方法为单因素方差分析结合图基事后检验(空白组 vs Col-MMW组,*p*=0.0051;Col组 vs Col-MMW组,*p*=0.0066;空白组 vs Col组,*p*=0.7177)。
2.1 镁微丝增强胶原膜(Col-MMW)的形貌观察与力学性能测试
采用扫描电子显微镜(SEM,型号TESCAN MIRA3,泰思肯公司)观察Col-MMW的微观形貌。简要步骤如下:冻干后的Col-MMW样品经喷金仪(型号EM SC005,徕卡显微系统私人有限公司)喷镀10 nm金膜后,置于扫描电镜下观察;成像时设置加速电压为3 kV,束流强度为8 mA。
使用拉伸试验机(型号MTS Tytron 250,MTS系统公司),通过拉伸试验和三点弯曲试验评估Col-MMW的力学性能。
1. 拉伸试验:对空白胶原膜(Col)和Col-MMW膜进行纵向拉伸,实时记录轴向位移(单位:mm)与轴向力(单位:N);依据应力-应变曲线线性阶段的斜率,结合公式(1)、(2)、(3)计算两种膜的杨氏模量。

2. 三点弯曲试验:在Col膜和Col-MMW膜的中点处垂直施加载荷,产生弯矩使膜发生形变,实时记录挠度(单位:mm)与载荷力(单位:N);根据公式(4)、(5)计算弯曲模量。
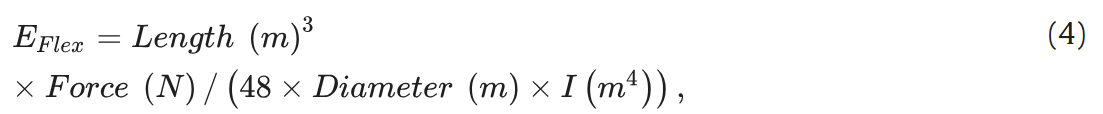
式中,$I$ 代表材料横截面的惯性矩,计算公式如下:

采用电感耦合等离子体发射光谱仪(ICP-OES,型号Agilent 5800,安捷伦科技公司),测定28天内Col-MMW膜的镁离子释放曲线。简要步骤如下:将1 cm×2 cm的Col-MMW膜(镁负载量2.5 mg/cm²)浸入2 mL磷酸盐缓冲液(PBS)中,置于37℃环境孵育;分别在1 h、3 h、24 h、2 d、3 d、6 d、12 d、15 d、24 d、28 d时间点取样,检测镁离子浓度,并同步记录溶液pH值。
借助配备科学级互补金属氧化物半导体(sCMOS)相机的倒置光学显微镜(型号IX73,奥林巴斯澳大利亚公司),观察镁微丝(MMW)与Col-MMW膜的产氢情况。简要步骤如下:将样品置于载玻片上,滴加500 μL去离子水完全覆盖样品表面;以每秒2帧的速率录制视频,动态监测氢气气泡的生成与生长过程。
2.2 自由基清除能力检测
采用2,2-二苯基-1-苦基肼基(DPPH,货号D9132,西格玛奥德里奇澳大利亚公司)法,测定Col-MMW膜的总抗氧化活性。简要步骤如下:将1 cm×2 cm的膜样品浸入1 mL 0.1 mM DPPH甲醇溶液中;于37℃避光条件下分别孵育5 min、15 min、30 min、1 h后,测定上清液在517 nm波长处的吸光度值(OD值);依据517 nm处DPPH的脱色程度,通过公式(6)计算自由基清除率(RSA)。
此外,采用ABTS法测定Col-MMW膜对羟基自由基(·OH)的清除能力。简要步骤如下:将7 mM 2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)与2.45 mM过硫酸钾(货号216224,西格玛奥德里奇澳大利亚公司)混合,室温避光反应16 h,制备ABTS·+自由基阳离子工作液;稀释该工作液,使其在734 nm波长处的吸光度值调至约0.700;将Col-MMW膜浸入1 mL ABTS·+工作液中,避光孵育10 min;测定734 nm处的吸光度值,计算脱色程度,并与对照组(ABTS·+工作液)进行比较。
为进一步评估Col-MMW膜清除细胞内活性氧(ROS)的能力,将RAW 264.7巨噬细胞分别培养于三组样品的浸提液中:细胞培养基组(空白组)、空白胶原膜浸提液组(Col组)、Col-MMW膜浸提液组(Col-MMW组)。简要步骤如下:参照2.3.1节方法培养RAW 264.7细胞,以每孔5×10⁴个细胞的密度接种;向培养基中加入各组浸提液,并添加100 ng/mL脂多糖(LPS,货号L3491,西格玛奥德里奇澳大利亚公司),孵育24 h。
浸提液的制备方法如下:将膜样品浸入标准细胞培养基中,37℃恒温振荡孵育24 h;采用注射器滤器(孔径0.2 μm,莎斯特德国公司)过滤浸提液;向滤液中添加10%胎牛血清,用于后续细胞处理。所有体外实验均使用浸提液,以排除材料表面特性对实验结果的干扰。
孵育24 h后,向细胞中加入10 μM 2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA,货号D6883,西格玛奥德里奇澳大利亚公司),37℃避光染色30 min;使用克拉里奥星酶标仪(BMG LABTECH公司),在激发波长485 nm、发射波长535 nm条件下,测定荧光强度,以此反映细胞内活性氧水平。
2.3 细胞培养与细胞毒性测试
2.3.1 细胞株与培养条件
小鼠巨噬细胞系RAW 264.7(编号TIB-71,美国模式培养物集存库)和小鼠前成骨细胞系MC3T3-E1(编号CRL-2593,美国模式培养物集存库)均购自美国模式培养物集存库(ATCC)。两种细胞均培养于杜氏改良伊格尔培养基(DMEM,赛默飞世尔科技澳大利亚公司)中,培养基含1%青霉素-链霉素双抗和10%胎牛血清;培养环境为37℃、5%二氧化碳的恒温培养箱,每3天更换一次培养基。
当细胞融合度达到80%–90%时进行传代:RAW 264.7细胞采用刮除法传代,MC3T3-E1细胞采用胰蛋白酶消化法传代。
#2.3.2 细胞毒性测试
将细胞分别培养于三组样品的浸提液中(空白组、Col组、Col-MMW组),最长孵育3天,以此评估膜材料的细胞毒性。将RAW 264.7巨噬细胞和MC3T3-E1前成骨细胞以每孔1×10⁴个细胞的密度接种于96孔板;参照试剂盒说明书,采用阿尔玛蓝细胞活力检测试剂(赛默飞世尔科技澳大利亚公司)评估细胞代谢活性。简要步骤如下:用培养基充分洗涤细胞后,加入含10%(v/v)阿尔玛蓝试剂的培养基孵育;使用克拉里奥星酶标仪,在激发波长560 nm、发射波长590 nm条件下测定荧光强度;以第1天空白组的细胞活力为基准,计算各组细胞的相对活力。
2.3.3 RAW 264.7细胞炎症模型的建立
将RAW 264.7细胞以7×10⁵个细胞/cm²的密度接种,加入100 ng/mL LPS刺激24 h,构建细胞炎症模型。通过检测炎症相关标志物的mRNA和蛋白表达水平,评估巨噬细胞极化情况。以经LPS刺激但未添加材料浸提液的RAW 264.7细胞组作为校准组(空白组),所有实验样品均设置3个重复。
LPS刺激结束后,将细胞置于无血清DMEM培养基中饥饿培养6 h;收集细胞上清液,即得炎症状态下RAW 264.7细胞的条件培养基,用于后续实验。
2.3.4 RAW 264.7细胞调控微环境对成骨分化的影响评估
将MC3T3-E1前成骨细胞培养于LPS刺激后的RAW 264.7细胞条件培养基中,评估巨噬细胞调控的炎症微环境对成骨分化的影响。简要步骤如下:以每孔2.5×10⁴个细胞的密度接种MC3T3-E1细胞;分别加入三组条件培养基培养14天,三组分别为:空白(+)组(经LPS刺激但未加材料浸提液的RAW细胞条件培养基)、Col(+)组(经LPS刺激且添加Col膜浸提液的RAW细胞条件培养基)、Col-MMW(+)组(经LPS刺激且添加Col-MMW膜浸提液的RAW细胞条件培养基)。
将条件培养基与新鲜DMEM培养基按1:1体积比混合,混合培养基中添加10%胎牛血清、10 mM β-甘油磷酸钠(β-GP,货号G9422,西格玛奥德里奇澳大利亚公司)和50 μg/mL L-抗坏血酸-2-磷酸酯(AA,货号A4403,西格玛奥德里奇澳大利亚公司),以促进成骨分化。以空白(+)组作为校准组,代表未经材料干预的炎症微环境。
2.3.5 细胞形态与增殖的显微观察
采用扫描电子显微镜和SpinSR共聚焦显微镜(埃万特公司),进一步观察细胞形态与增殖情况。在各时间点取样,处理步骤如下:用2.5%戊二醛(货号G5882,西格玛奥德里奇澳大利亚公司)固定细胞;经梯度浓度乙醇(20%、30%、40%、50%、70%、90%、100%)脱水;采用六甲基二硅氮烷(HMDS,西格玛奥德里奇澳大利亚公司)进行临界点干燥;对样品喷镀10 nm金膜后,置于扫描电镜下观察,设置加速电压3 kV、束流强度8 mA。
采用SpinSR共聚焦显微镜观察时,处理步骤如下:用4%多聚甲醛(货号C004,普罗赛克科技公司)固定细胞;加入0.25%曲拉通X-100(货号T8787,西格玛奥德里奇澳大利亚公司)通透细胞膜;采用Alexa Fluor 594标记的鬼笔环肽(赛默飞世尔科技澳大利亚公司)和4',6-二脒基-2-苯基吲哚(DAPI,赛默飞世尔科技澳大利亚公司)对细胞进行染色;染色完成后置于共聚焦显微镜下观察。所有实验样品均设置3个重复。
2.4 RAW 264.7细胞的代谢谱分析
采用海马XFp细胞能量代谢分析仪(安捷伦科技公司),检测RAW 264.7细胞的代谢谱。分别使用海马XFp线粒体压力测试试剂盒(货号103010-100,体外技术公司)和海马XFp糖酵解压力测试试剂盒(货号103017-100,体外技术公司),参照试剂盒说明书,测定细胞的耗氧率(OCR)和细胞外酸化率(ECAR)。
简要步骤如下:以每孔2×10⁴个细胞的密度,将RAW 264.7细胞接种于海马XF细胞培养微孔板(货号103025-100,体外技术公司);分别加入三组培养基孵育24 h,三组分别为:含100 ng/mL LPS的培养基(空白组)、含100 ng/mL LPS的Col膜浸提液(Col组)、含100 ng/mL LPS的Col-MMW膜浸提液(Col-MMW组);孵育结束后,采用能量代谢分析仪进行代谢谱检测。
检测完成后,参照试剂盒说明书,采用二辛可宁酸(BCA)蛋白定量试剂盒(货号23227,赛默飞世尔科技公司)测定每孔细胞的蛋白浓度;将各组的耗氧率和细胞外酸化率数据以蛋白浓度进行归一化处理,所有实验样品均设置3个重复。
采用线粒体超氧化物指示剂MitoSOX™绿色试剂(赛默飞世尔科技澳大利亚公司)对细胞进行染色,通过SpinSR共聚焦显微镜观察各组细胞的线粒体活性氧水平。采用JC-1荧光染料(赛默飞世尔科技澳大利亚公司)染色,通过克拉里奥星酶标仪检测线粒体膜电位,并利用SpinSR共聚焦显微镜观察线粒体形态变化。
2.5 RAW 264.7细胞的炎症应答检测
参照试剂盒说明书,采用TRIzol试剂(赛默飞世尔科技澳大利亚公司)提取细胞总RNA;使用纳米分光光度计(Nanodrop ND-1000,纳米滴技术公司)测定RNA浓度与纯度。取500 ng总RNA,采用SensiFast cDNA合成试剂盒(生物莱恩公司,默里迪恩生物科学公司)反转录为cDNA。
采用实时荧光定量PCR仪(QuantStudio,应用生物系统公司,赛默飞世尔科技公司),检测炎症相关标志物的基因表达水平。检测的炎症细胞因子标志物包括白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),以及促炎型巨噬细胞表型标志物诱导型一氧化氮合酶(iNOS),以此评估炎症微环境中RAW 264.7细胞的极化情况。引物序列详见补充材料。以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参,对目的基因的循环阈值(Ct值)进行归一化处理。
参照试剂盒说明书,采用酶联免疫吸附试验(ELISA)检测LPS刺激后的RAW 264.7细胞分泌的IL-1β和TNF-α细胞因子含量(试剂盒为小鼠IL-1β定量ELISA试剂盒、小鼠TNF-α定量ELISA试剂盒,均购自R&D系统公司);依据标准曲线计算各细胞因子浓度。
此外,采用SpinSR共聚焦显微镜观察iNOS和精氨酸酶-1(Arg-1)的蛋白表达水平。简要步骤如下:细胞经100 ng/mL LPS孵育24 h后,按前述方法进行固定与通透处理;加入4%牛血清白蛋白(BSA,西格玛奥德里奇澳大利亚公司)封闭非特异性结合位点;分别加入iNOS抗体(货号ab283655,艾博抗公司)和Arg-1抗体(货号93668,细胞信号技术公司),室温孵育1 h;充分洗涤后,加入Alexa Fluor 488标记的兔抗IgG二抗(货号ab150077,艾博抗公司),室温孵育1 h;按前述方法加入DAPI染色细胞核。
采用同样方法,观察核因子κB p65亚基(NF-κB p65,货号8242,细胞信号技术公司)、核因子E2相关因子2(NRF-2,货号12721S,细胞信号技术公司)和血红素氧合酶-1(HO-1,货号70081S,细胞信号技术公司)的蛋白表达水平。使用Image J软件对目标标志物的荧光强度进行半定量分析(样本数$N=10$),并分析NF-κB p65与NRF-2的核转位情况。
同时,采用扫描电子显微镜观察炎症状态下RAW 264.7细胞的形态,样品处理方法同前。根据扫描电镜图像中细胞的形态特征,统计M1型巨噬细胞(蓝色)的占比,以及M1型与M2型巨噬细胞(蓝绿色)的比值。
2.6 骨免疫调控作用评估
将MC3T3-E1前成骨细胞培养于炎症状态RAW 264.7细胞的条件培养基中,最长孵育3天,评估巨噬细胞调控微环境对成骨分化的影响。炎症状态RAW细胞条件培养基的制备方法如下:细胞经无血清DMEM培养基饥饿培养6 h后,收集上清液。MC3T3-E1前成骨细胞的培养方法同2.3.4节。以培养于RAW细胞条件培养基中的MC3T3-E1细胞组作为校准组(空白(+)组)。
检测成骨相关基因的表达水平,包括碱性磷酸酶(ALP)、成骨转录因子(Sp7)、 Runt相关转录因子2(Runx2)和血管内皮生长因子(VEGF),引物序列详见补充材料。采用免疫荧光染色法观察ALP的蛋白表达水平(抗体货号ab224335,艾博抗公司),染色方法同前;使用ImageJ软件测定荧光强度。
此外,参照试剂盒说明书,采用碱性磷酸酶活性检测试剂盒(比色法,货号ab83369,艾博抗澳大利亚公司),测定培养第3天和第7天的细胞ALP活性。简要步骤如下:收集经LPS刺激的RAW细胞条件培养基培养3天和7天的MC3T3-E1细胞,裂解细胞;向裂解液中加入对硝基苯磷酸钠底物,室温避光孵育1 h;测定反应产物对硝基苯酚的吸光度值,以此反映ALP的酶活性;以细胞总蛋白浓度对ALP活性数据进行归一化处理。
培养14天后,采用茜素红S染色法观察MC3T3-E1细胞的矿化结节形成情况,以此评估RAW细胞条件培养基对细胞钙沉积的影响。简要步骤如下:用4%多聚甲醛固定细胞20 min;蒸馏水充分洗涤后,加入2%茜素红S染液(pH 4.2),室温染色20 min;蒸馏水洗涤去除多余染液;置于明场显微镜下观察并拍照;使用ImageJ软件分析染色区域面积,定量评估钙沉积水平。所有实验样品均设置3个重复。
2.7 皮下植入模型
2.7 大鼠皮下植入实验
为评估愈合早期(最长14天)膜材料的降解性能、生物相容性及宿主应答情况,开展大鼠皮下植入实验。所有实验操作均经昆士兰大学动物伦理委员会批准(批准号:2021/AE000465)。共购入6只雄性Wistar大鼠(体重450-500 g,3月龄),饲养于赫斯顿医学研究中心。为最大程度减轻大鼠疼痛与不适,实验全程采取精细化护理措施。
手术过程中采用异氟醚吸入麻醉,确保大鼠全程处于无意识状态。麻醉流程如下:先在诱导舱内启动麻醉,随后通过鼻锥持续给药,异氟醚与氧气的配比严格遵循机构实验规程。术前1天起,在大鼠饮水中添加对乙酰氨基酚,以降低痛觉敏感性并建立基础镇痛效果;皮肤切开前,于手术部位局部注射利多卡因,实现靶向镇痛;术后连续5天,饮水中持续添加对乙酰氨基酚。此外,手术过程中在大鼠身下放置加热垫,维持其体温稳定,防止低体温症发生。
使用手术刀(澳大利亚SSS公司)在大鼠背部两侧作长15 mm的全层皮肤切口。切口前,先对手术区域剃毛,并用10%碘溶液(澳大利亚SSS公司)消毒。切口方向与大鼠脊柱纵轴垂直(距脊柱腹侧约10 mm),且与皮肤纹理走向平行(距肩胛骨尾部约10 mm)。随后用精细止血钳(澳大利亚SSS公司)沿纵轴向尾部方向扩大切口,分离皮下筋膜至深度达25 mm。将尺寸为20 mm×10 mm的胶原膜(Col组,样本数$N=6$)和镁微丝增强胶原膜(Col-MMW组,样本数$N=6$)分别植入皮下腔隙,随后对切口进行全层缝合。
术后第3、7、14天,采用便携式X光机(Faxitron X射线成像系统)检测大鼠皮下氢气生成情况,成像过程中通过呼吸回路维持大鼠麻醉状态。术后第14天,采用二氧化碳吸入法处死大鼠,完整剥离植入膜及周围组织,置于4%多聚甲醛溶液(货号C004,普罗赛克科技公司)中固定,以备后续分析。动物实验所用全部材料,术前均在生物安全柜内接受双面紫外线照射灭菌,每次照射时长60 min。
2.8 颅骨缺损模型
本动物实验的所有操作均经昆士兰大学动物伦理委员会批准(批准号:2021/AE000465)。共购入36只雄性Wistar大鼠(体重450-500 g,3月龄),饲养于赫斯顿医学研究中心。采用前述方案减轻大鼠的疼痛与不适。
在严格无菌条件下,使用环钻(士卓曼集团诺登特公司)在大鼠颅骨上制备直径5 mm的圆形缺损。切口前,对手术区域剃毛并以10%碘溶液(澳大利亚SSS公司)消毒,所有操作均遵循无菌操作规范,麻醉方式为异氟醚吸入麻醉。颅骨骨片移除后,缺损部位采用三种处理方式:不做任何处理(空白组)、覆盖胶原膜(Col组)、覆盖镁微丝增强胶原膜(Col-MMW组)。
实验设置3个组别,并在两个时间节点(术后4周和8周)进行检测,具体分组如下:(1)空白对照组(Blank);(2)胶原膜组(Col);(3)镁微丝增强胶原膜组(Col-MMW)。每个时间节点每组各6只大鼠(样本数$N=6$)。在各时间节点,采用二氧化碳吸入法处死18只大鼠,剥离颅骨缺损标本,置于4%多聚甲醛溶液中固定,以备后续分析。手术所用全部材料,植入前均在生物安全柜内接受双面紫外线照射灭菌,每次照射时长60 min。
2.9 显微计算机断层扫描(显微CT)
对颅骨缺损模型两个时间节点收集的标本,采用显微计算机断层扫描仪(型号μCT50,斯坎科医疗公司)进行扫描。X射线采集参数设置如下:管电压70 kVp,管电流114 μA,各向同性体素尺寸20.0 μm,积分时间1001 ms。采用3D SUITE软件包(布鲁克公司)对扫描图像进行三维重建、可视化处理及定量分析。
主要检测指标为骨体积分数(%BV/TV),即感兴趣区域内骨体积(BV)与总体积(TV)的比值。为精准量化新生骨组织,需严格界定感兴趣区域(ROI):仅包含缺损区域,排除周围正常骨组织。具体操作流程如下:图像采集完成后,依据解剖学标志手动划定感兴趣区域,且所有标本的区域划定标准保持一致;设定阈值参数,区分矿化骨组织、软组织及背景噪声,实现精准分割与体积分析;最后将重建图像与划定的感兴趣区域叠加,直观呈现术后4周和8周缺损区域的骨再生程度。
2.10 组织学染色
颅骨缺损模型收集的所有标本,依次进行脱钙、浸蜡及石蜡包埋处理(石蜡购自澳大利亚西格玛奥德里奇公司)。使用切片机(型号RM2245,徕卡公司)将包埋好的组织块切成厚度为5 μm的连续切片。采用自动染色机(型号CV3050,徕卡公司)对切片进行苏木精-伊红染色(苏木精与伊红均购自澳大利亚西格玛奥德里奇公司)。
此外,通过免疫组织化学染色(IHC)和免疫荧光染色(IF),标记组织切片中的目标蛋白标志物。针对皮下植入模型,检测与氧化还原平衡相关的标志物(NRF-2、HO-1)、促炎标志物(iNOS)及抗炎标志物(Arg-1),以此探究愈合早期胶原膜对周围组织的影响。针对颅骨缺损模型,检测大鼠颅骨缺损区域周围Runt相关转录因子2(RUNX2,货号ab192256,艾博抗公司)的表达情况——该因子是成骨细胞分化及骨组织再生过程中至关重要的转录因子。
参照已发表文献的方法[29],采用ImageJ软件对免疫组织化学染色结果进行定量分析[29]。简要步骤如下:运用“Color Deconvolution”插件,选择“H DAB”向量分离苏木精染色通道(标记细胞核)和二氨基联苯胺(DAB)染色通道(标记目标蛋白);对DAB通道图像设定阈值,生成二值化掩码,凸显阳性染色区域;通过测量阈值化后的DAB信号面积,量化目标蛋白的染色覆盖率。为消除细胞密度差异造成的影响,将阳性染色面积与细胞核总面积进行归一化处理,实现不同标本间的一致性比较。所有标本的图像处理参数保持一致,确保实验结果的可重复性。
同理,采用ImageJ软件对免疫荧光染色结果进行定量分析:测定荧光强度,并以细胞核染色强度进行归一化处理,校正细胞密度差异。所有标本采用统一的阈值设定和分析参数,保证实验结果的可比性与可重复性。
2.11 统计学分析
采用GraphPad Prism 10软件(版本10.2.3)进行统计学分析。所有实验数据均以均值±标准差表示(除非另有说明,样本数均为$N=3$)。采用夏皮罗-威尔克检验(Shapiro-Wilk test)判断数据是否符合正态分布。
对于正态分布数据,根据实验设计分别采用以下统计方法:两组间比较采用学生氏t检验;多组间比较采用单因素方差分析,随后进行图基多重比较检验;若涉及两个自变量,则采用双因素方差分析,随后进行希达克多重比较检验。具体统计方法详见各图图例。
3 结果与讨论
3.1 镁微丝增强胶原膜(Col-MMW)的表征
本研究制备了一种镁微丝增强胶原膜(Col-MMW),并将其应用于引导性骨再生(GBR)。为提升镁微丝的耐腐蚀性、调控其降解速率,我们采用自主研发的专利金属酚网络(MPN)涂层技术对镁丝进行表面改性[27]。该技术的核心原理为:利用单宁酸分子中的酚羟基与镁离子($\text{Mg}^{2+}$)发生螯合反应,在镁丝表面形成一层超分子无机-有机杂化涂层,具体操作流程参照课题组已发表的研究方法[27,28]。
单宁酸不仅富含酚羟基基团,具备极强的金属螯合能力[30];其分子中的邻苯二酚基团还能与多种基底材料形成牢固粘附,具有优异的粘接性能[31,32]。本研究采用双层胶原基质包埋涂层镁微丝的方法制备Col-MMW膜,具体流程见图1A。扫描电镜(SEM)图像显示:经加压处理后,Col-MMW膜仍保持粗糙表面与多孔结构(图1B、C),体现出良好的结构稳定性,同时这种形貌特征有利于细胞粘附与向内生长。
为评估Col-MMW膜的物理性能及其作为引导性骨再生膜的适用性,我们测定了膜的杨氏模量与弯曲模量。力学测试结果显示:与未增强的纯胶原膜相比,Col-MMW膜的应力-应变曲线斜率显著增大,表明其刚度显著提升(图1D)。具体而言,Col-MMW膜的杨氏模量约为11 GPa(图1E),弯曲模量约为40 MPa(图1F、G),已接近人类股骨皮质骨的力学性能(杨氏模量约18 GPa)[33]。
上述数值远超传统可吸收胶原膜的力学指标——传统胶原膜的杨氏模量通常在0.1-1 GPa之间,往往缺乏在生理环境下维持缺损空间的刚性[34]。这表明,镁微丝的引入在保持膜材柔韧性的同时,显著提升了其机械完整性。凭借优异的刚度与抗弯强度,Col-MMW膜能够抵抗软组织的压力,在整个愈合周期内维持缺损区域的空间体积,尤其适用于非承重部位的骨修复临床场景,例如牙种植术前的牙槽嵴增高术,以及创伤或肿瘤切除术后的节段性骨缺损修复。
3.2 Col-MMW膜的产氢性能与活性氧清除能力
镁基合金在骨科领域被广泛用作骨修复生物材料,这不仅得益于其良好的结构稳定性,更在于镁离子($\text{Mg}^{2+}$)能够调控组织愈合微环境[35,36]。但镁与水接触时会发生反应,生成氢气(H2)和碱性氢氧化镁,反应方程式见式(7)。因此,本研究借鉴课题组前期研究成果[27,28],采用金属酚网络(MPN)涂层技术提升镁丝的耐腐蚀性。
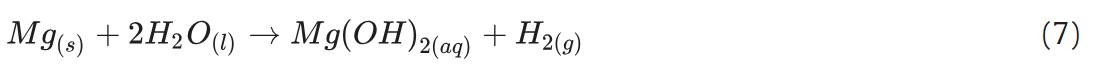
图1H中红色曲线显示:28天内,Col-MMW膜的镁离子累积释放量约为25 ppm。根据化学反应计量关系,这相当于约$1.6\times10^{-6}\ \text{mol}$的镁与水发生反应,理论上可生成$3.2\times10^{-6}\ \text{mol}$的氢氧根离子($\text{OH}^-$)。经计算,该浓度的氢氧根离子对应的溶液pH值约为8.5,与图1H中蓝色曲线所示的实测pH值一致。
通过观察微气泡的生成情况,可直观反映氢气的产生过程(图1I及补充视频)。为观察氢气释放过程,我们将镁微丝(MMW)和Col-MMW膜分别置于载玻片上,滴加500 μL去离子水,实时拍摄气泡生成过程。图1I及定量分析结果(图1J)显示:当涂层镁微丝直接接触水时,其表面生成的氢气气泡会随时间缓慢膨胀;而Col-MMW膜内的气泡在120 s内体积保持相对稳定。这种差异源于胶原基质的空间限制作用——胶原基质产生的压缩力抑制了气泡膨胀。镁微丝组的金属表面完全暴露,气泡可自由膨胀;而Col-MMW膜中的镁丝被胶原基质包裹,受到空间约束。为保证成像与定量分析的一致性,每组仅选取一个代表性气泡进行测量,具体见图1J。
尽管体外和体内环境中氢气的体积难以直接测定,但可通过理想气体状态方程(式(8))进行理论估算。基于28天降解实验测得的镁离子浓度及对应的pH值(图1H),可计算出氢气的总生成量约为$1.6\times10^{-6}\ \text{mol}$。在标准温度与压力条件下(0℃、1个标准大气压),该物质的量对应的氢气体积约为35.84 μL。

氢气是自然界中分子量最小、含量最丰富的气体分子。近年来,其抗氧化功能被广泛研究——氢气可有效中和活性氧(ROS)的损伤作用,包括超氧阴离子自由基($\text{O}_2^-\cdot$)和过氧化氢($\text{H}_2\text{O}_2$)等[16,19,24,37]。活性氧在细胞信号传导中发挥重要作用,但其浓度过高会对细胞及细胞器造成严重损伤[24]。超氧阴离子自由基主要来源于线粒体电子传递链的电子泄漏及烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的催化反应[38]。两个超氧阴离子自由基发生电子转移,可生成过氧化氢和氧气[20,39]。
超氧阴离子自由基和过氧化氢既可通过直接氧化作用造成损伤,也可通过芬顿反应或韦斯反应生成极具活性的羟基自由基(OH),间接引发氧化损伤[38]。羟基自由基会与附近含有孤对电子的生物分子(如DNA、蛋白质和脂质)发生自发反应,尤其容易攻击带有氨基、巯基或羟基等官能团的位点[38]。目前已知的酶类或解毒系统均无法有效清除具有细胞毒性的羟基自由基[24]。
令人振奋的是,研究发现氢气可选择性清除羟基自由基,通过如下化学反应有效保护细胞:
H2 + OH· = H2O + H·, followed by H· + O2− = HO2−
与大多数无法穿透脂质膜的抗氧化剂不同,氢气分子体积小、质量轻、呈电中性且具有非极性,可被动扩散进入细胞质及细胞器,尤其是线粒体[20,25,37,40]。这种特性使氢气能够选择性清除线粒体中的羟基自由基,从而保护线粒体组分免受氧化损伤[20,37]。
在Col-MMW膜体系中,氢气的可控释放赋予材料抗氧化能力,进而调控免疫调节、成骨分化及骨再生等关键生物学过程[16,25,41,42]。氢气与镁离子在维持线粒体功能方面具有协同作用[24,43]:氢气可通过减轻氧化应激保护线粒体膜与线粒体DNA,维持三磷酸腺苷(ATP)的合成效率,在炎症与组织损伤过程中保障线粒体结构完整[16,24,42];镁离子则是线粒体酶活性的必需因子,参与ATP合成与氧化磷酸化过程,同时在调控线粒体钙摄取方面发挥重要作用[43-45]。
因此,在Col-MMW膜介导的骨再生微环境中,氢气与镁离子的协同作用可减轻氧化应激、增强线粒体功能,通过发挥抗氧化功效,为愈合过程中的免疫调控与成骨分化提供有利条件。
为了通过检测抗氧化性氢气的释放来评估镁微丝增强胶原膜(Col-MMW)的抗氧化性能,本研究在无细胞模型中分别开展了DPPH自由基清除实验和ABTS自由基清除实验。如图1K所示,Col-MMW膜在60分钟内对DPPH的脱色率达到约60%,表明其具备显著的自由基清除能力。这种抗氧化活性主要源于胶原基质中嵌入的镁微丝——镁微丝在水环境中发生腐蚀,释放出氢气和镁离子。已有研究表明,该过程中产生的氢气能够选择性中和高活性氧自由基,这也是本研究观察到抗氧化效果的关键原因[16,19,24,37]。本实验未设置纯胶原膜对照组,原因在于胶原本身不具备固有自由基清除活性,且在同类实验中始终仅表现出极低的清除能力。
此外,本研究借助ABTS自由基清除实验评估Col-MMW膜对羟基自由基(·OH)的清除效果[38]。如图1L所示,Col-MMW膜与ABTS溶液孵育后,体系在734 nm波长处的吸光度显著下降,这表明该膜在10分钟内对羟基自由基的清除率最高可达90%。上述结果说明,Col-MMW膜具备清除细胞内活性氧的潜力,进而有望缓解炎症反应——羟基自由基具有强细胞毒性,且无法被已知的酶类物质有效中和[24]。
但无细胞实验的结果可能与细胞存在时的实际效果存在差异。因此,为进一步验证Col-MMW膜清除细胞内活性氧的潜力,本研究检测了脂多糖(LPS)刺激的RAW 264.7巨噬细胞中DCFH-DA荧光探针的信号强度。如图1M所示,Col-MMW组细胞的荧光强度显著降低,这提示细胞内活性氧水平大幅下降,其作用机制可能与羟基自由基的中和作用有关。上述研究结果表明,Col-MMW膜能够在细胞层面发挥抗氧化作用,从而为组织再生构建更适宜的微环境。
3.3 镁微丝增强胶原膜(Col-MMW)的细胞相容性
本研究采用小鼠巨噬细胞系RAW 264.7和小鼠前成骨细胞系MC3T3-E1,对Col-MMW膜的细胞相容性进行评估。通过阿尔玛蓝细胞活力检测实验评估细胞活性,该实验的原理是检测代谢活跃的细胞对蓝色刃天青染料的还原能力。如补充图1所示,RAW 264.7细胞在培养第1至3天内呈现显著增殖趋势,且各实验组在两个时间点的细胞活性均无统计学差异。实验以第1天对照组的检测读数为基准(设为100%),计算各组的细胞相对存活率。对细胞骨架(红色)和细胞核(蓝色)的免疫荧光染色结果进一步证实,所有实验组的细胞密度均随培养时间延长而升高(补充图2)。与之类似,MC3T3-E1细胞在培养第1至3天的活性也显著上升(补充图3),且扫描电镜图像显示所有实验组的细胞均呈现健康的形态特征(补充图4)。上述结果共同表明,纯胶原膜(Col)和镁微丝增强胶原膜(Col-MMW)在巨噬细胞和前成骨细胞的体外培养体系中均具有良好的细胞相容性。
3.4 Col-MMW膜在炎症条件下介导细胞代谢重编程
线粒体代谢是调控巨噬细胞炎症信号通路的核心环节[14]。Col-MMW膜降解释放的镁离子和氢气,是线粒体生物能量代谢与氧化还原稳态的潜在调控因子,二者可通过不同但互补的作用机制发挥抗氧化与抗炎功效。为明确炎症条件下Col-MMW膜对线粒体功能的影响,本研究采用海马能量代谢分析仪检测、线粒体活性氧染色及线粒体膜电位检测等方法,评估了LPS刺激的RAW 264.7细胞的代谢水平与线粒体功能。
已知LPS刺激可诱导巨噬细胞发生促炎型代谢转变,其典型特征为糖酵解作用增强、线粒体功能受损[14,46]。如图2所示,相较于未经膜材料处理的LPS刺激组(空白组),Col-MMW膜对LPS诱导的RAW 264.7细胞代谢表型具有显著调控作用。在糖酵解压力测试中,加入葡萄糖和寡霉素后,Col-MMW组细胞的胞外酸化率(ECAR)更低,提示细胞的糖酵解通量受到抑制(图2A)。对糖酵解关键参数(糖酵解水平、糖酵解容量、糖酵解储备能力)的定量分析显示,与空白组相比,Col-MMW组的各项指标均呈下降趋势,但差异未达到统计学显著性水平(图2B)。这一结果表明,Col-MMW膜可部分减弱细胞的糖酵解活性,暗示其可能逆转LPS诱导的促炎型代谢状态。
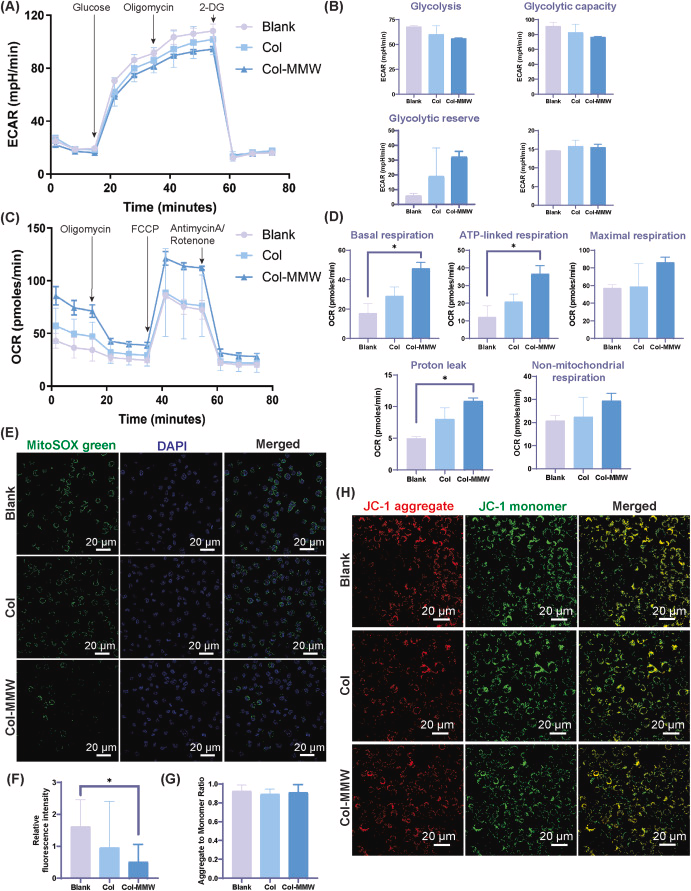
图2 Col-MMW膜恢复LPS诱导的炎症状态RAW 264.7细胞线粒体功能并减轻氧化损伤
统计方法采用单因素方差分析结合图基事后检验。(A)采用海马XF糖酵解压力测试检测不同处理组LPS刺激RAW 264.7细胞的胞外酸化率(ECAR)变化曲线,实验过程中依次加入葡萄糖、寡霉素和2-脱氧葡萄糖三种调节剂;(B)糖酵解水平(空白组 vs Col-MMW组,*p*=0.1861;Col组 vs Col-MMW组,*p*=0.7259;空白组 vs Col组,*p*=0.3799)、糖酵解容量(空白组 vs Col-MMW组,*p*=0.2356;Col组 vs Col-MMW组,*p*=0.6872;空白组 vs Col组,*p*=0.5178)、糖酵解储备能力(空白组 vs Col-MMW组,*p*=0.2015;Col组 vs Col-MMW组,*p*=0.5523;空白组 vs Col组,*p*=0.5598)及非糖酵解酸化水平(空白组 vs Col-MMW组,*p*=0.7163;Col组 vs Col-MMW组,*p*=0.9670;空白组 vs Col组,*p*=0.5901)的定量分析结果显示,Col-MMW组的各项糖酵解参数均有所降低,但无统计学差异;(C)采用海马XF线粒体压力测试检测不同处理组LPS刺激RAW 264.7细胞的耗氧率(OCR)变化曲线,实验过程中依次加入寡霉素、羰基氰化物-4-(三氟甲氧基)苯腙(FCCP)和抗霉素A/鱼藤酮三种调节剂;(D)线粒体呼吸关键参数的定量分析结果显示,Col-MMW组的基础呼吸水平(空白组 vs Col-MMW组,*p*=0.0268;Col组 vs Col-MMW组,*p*=0.0935;空白组 vs Col组,*p*=0.2513)、ATP耦联呼吸水平(空白组 vs Col-MMW组,*p*=0.0367;Col组 vs Col-MMW组,*p*=0.1090;空白组 vs Col组,*p*=0.3522)、质子泄漏水平(空白组 vs Col-MMW组,*p*=0.0225;Col组 vs Col-MMW组,*p*=0.1420;空白组 vs Col组,*p*=0.1193)均呈上升趋势,最大呼吸水平(空白组 vs Col-MMW组,*p*=0.2935;Col组 vs Col-MMW组,*p*=0.3211;空白组 vs Col组,*p*=0.9945)与非线粒体呼吸水平(空白组 vs Col-MMW组,*p*=0.3724;Col组 vs Col-MMW组,*p*=0.4880;空白组 vs Col组,*p*=0.9518)也有上升趋势;(E)线粒体超氧化物指示剂MitoSOX™绿色荧光染色结果显示,Col-MMW组的荧光信号显著减弱;(F)MitoSOX™绿色荧光相对强度定量分析结果显示,Col-MMW组的荧光强度显著降低(空白组 vs Col-MMW组,*p*=0.0398;Col组 vs Col-MMW组,*p*=0.4774;空白组 vs Col组,*p*=0.4269);(G)基于酶标仪检测的JC-1染色聚集体/单体荧光强度比值显示,各组间线粒体膜电位无统计学差异(空白组 vs Col-MMW组,*p*=0.9534;Col组 vs Col-MMW组,*p*=0.9475;空白组 vs Col组,*p*=0.8204);(H)JC-1染色荧光图像显示,所有实验组的红色荧光(JC-1聚集体)与绿色荧光(JC-1单体)信号强度总体相近。
线粒体压力测试结果进一步显示,Col-MMW组细胞的耗氧率(OCR)显著升高(图2C)。值得注意的是,该组细胞的基础呼吸水平和ATP耦联呼吸水平均显著上升,表明线粒体的能量生成能力得到增强(图2D)。线粒体功能的改善,或许可以解释加入寡霉素后胞外酸化率降低的现象——这意味着细胞的糖酵解储备能力下降,对糖酵解途径的代偿依赖减弱。尽管最大呼吸水平同样呈上升趋势,但未达到统计学显著性(图2D)。
综上,上述结果表明,Col-MMW膜可介导巨噬细胞的代谢模式由糖酵解向氧化磷酸化转变,而这种代谢特征通常与巨噬细胞的抗炎或促再生表型密切相关[14]。由此可见,Col-MMW膜有望通过介导免疫代谢重编程,为组织再生营造更有利的细胞微环境。
为进一步探究线粒体氧化应激状态与膜电位变化,本研究通过MitoSOX™绿色荧光染色检测线粒体超氧化物生成量,并结合JC-1染色评估线粒体膜电位(图2E–H)。与LPS刺激的炎症状态RAW 264.7细胞经Col-MMW膜处理后的代谢转变趋势一致,Col-MMW组细胞的线粒体超氧化物水平显著降低(图2E、F)。荧光强度定量分析结果证实,细胞内活性氧水平大幅下降,这表明Col-MMW膜可有效缓解炎症相关的氧化应激损伤。有趣的是,Col-MMW组细胞的质子泄漏水平与非线粒体呼吸水平略有上升,同时其超氧化物水平显著降低(图2D)。这一现象可能是细胞在代谢重编程过程中维持氧化还原稳态的一种代偿机制,或许与线粒体呼吸功能恢复过程中伴随的适应性解偶联反应有关[14,47]。
本研究借助酶标仪检测JC-1染色的聚集体/单体荧光强度比值,进一步评估线粒体膜电位。结果显示,所有实验组间的比值无统计学差异,这表明各实验组细胞的线粒体膜电位均保持稳定(图2H)。上述研究结果表明,Col-MMW膜可通过增强氧化磷酸化水平、降低线粒体活性氧生成量,介导炎症状态巨噬细胞的代谢重编程,且该过程不会破坏线粒体膜的完整性。线粒体功能的恢复与氧化应激水平的降低,有望进一步影响细胞内氧化还原敏感的信号通路,而这类通路对于调控炎症条件下的免疫应答具有关键作用[14,24,46]。
3.5 Col-MMW膜在炎症条件下调控细胞氧化还原平衡
为进一步明确炎症条件下Col-MMW膜对氧化还原敏感信号通路的调控机制,本研究检测了核因子E2相关因子2(NRF-2)及其下游抗氧化酶血红素氧合酶-1(HO-1),以及促炎转录因子核因子κB(NF-κB)的活化水平。上述信号通路在维持细胞氧化还原稳态、调控炎症反应过程中发挥着核心作用。
与空白组相比,经Col-MMW膜处理的RAW 264.7细胞中NRF-2的平均荧光强度显著升高,且发生核转位的细胞比例明显增加(图3A、B),这表明NRF-2通路被显著激活。与之相应,Col-MMW组细胞中HO-1的表达水平也显著上调(图3C、D),这提示NRF-2/HO-1信号轴被成功激活。已有研究证实,NRF-2可通过两种途径缓解氧化应激:一是通过募集RNA聚合酶Ⅱ结合至白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)基因位点,直接抑制促炎细胞因子的转录;二是通过诱导血红素氧合酶-1等细胞保护酶类与蛋白的合成,间接发挥抗氧化作用[25,48-50]。HO-1的表达受NRF-2及其共激活因子的精密调控,该酶在维持巨噬细胞氧化还原平衡、抑制炎症相关基因表达方面具有关键作用[39,51,52]。上述结果表明,Col-MMW膜通过激活NRF-2/HO-1信号通路缓解氧化应激,这一效应可能源于膜材料降解释放的镁离子与氢气[21,49,53]。
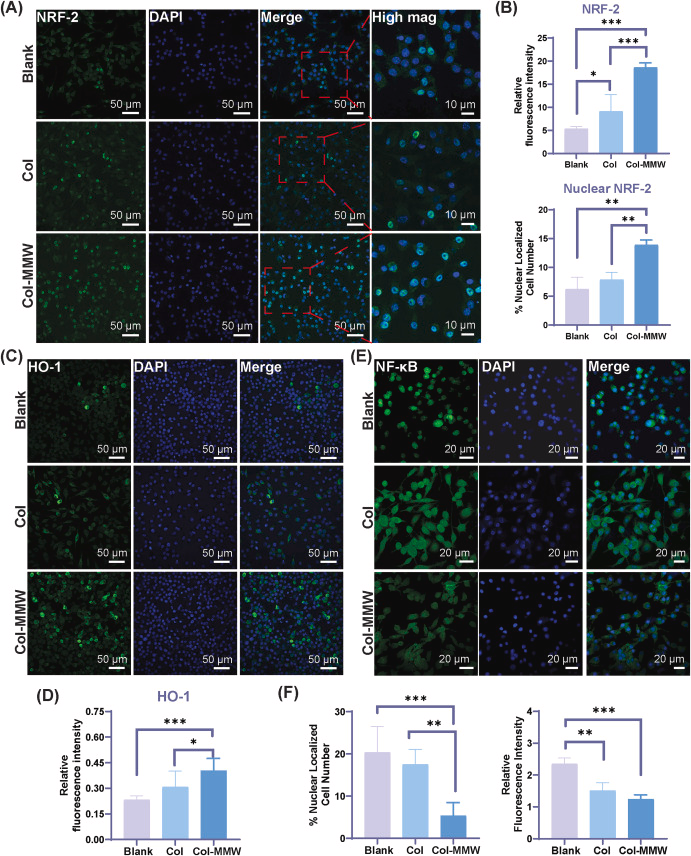
图3 Col-MMW膜激活LPS诱导的炎症状态RAW 264.7细胞抗氧化通路
统计方法采用单因素方差分析结合图基事后检验。(A)采用SpinSR共聚焦显微镜观察NRF-2的活化情况(NRF-2为绿色荧光,细胞核为蓝色荧光),通过NRF-2与细胞核的共定位判断其活化水平;(B)NRF-2活化水平定量分析结果显示,Col-MMW膜可显著上调NRF-2活性:NRF-2相对荧光强度(上图,空白组 vs Col-MMW组,*p*<0.0001;Col组 vs Col-MMW组,*p*<0.0001;空白组 vs Col组,*p*=0.0465)及NRF-2核转位细胞比例(下图,空白组 vs Col-MMW组,*p*=0.0018;Col组 vs Col-MMW组,*p*=0.0061;空白组 vs Col组,*p*=0.4246)均显著升高;(C)采用SpinSR共聚焦显微镜观察HO-1的表达情况(HO-1为绿色荧光,DAPI染色的细胞核为蓝色荧光),结果显示Col-MMW组细胞的HO-1荧光信号显著增强;(D)HO-1相对荧光强度定量分析结果显示,Col膜与Col-MMW膜均可显著上调HO-1表达,且Col-MMW膜的诱导效果最强(空白组 vs Col-MMW组,*p*=0.0006;Col组 vs Col-MMW组,*p*=0.0465;空白组 vs Col组,*p*=0.1289);(E)采用SpinSR共聚焦显微镜观察NF-κB p65的核转位情况(NF-κB p65为绿色荧光,DAPI染色的细胞核为蓝色荧光);(F)NF-κB p65核转位阳性细胞数与荧光强度定量分析结果显示,Col-MMW组的阳性细胞数与荧光强度均显著降低(细胞数:空白组 vs Col-MMW组,*p*=0.0008;Col组 vs Col-MMW组,*p*=0.0119;空白组 vs Col组,*p*=0.6329;荧光强度:空白组 vs Col-MMW组,*p*=0.0011;Col组 vs Col-MMW组,*p*=0.3010;空白组 vs Col组,*p*=0.0044)。
与此同时,本研究通过检测NF-κB的活化水平,明确Col-MMW膜对促炎信号通路的影响。如图3E、F所示,Col-MMW组细胞中发生核转位的NF-κB阳性细胞数与总荧光强度均显著降低,这表明NF-κB通路的活化受到显著抑制。这种抑制效应可能源于NRF-2/HO-1信号轴介导的氧化还原代谢调控,同时也得益于镁离子与氢气的抗氧化作用[51,54-56]。
综上,上述结果证实,Col-MMW膜通过增强NRF-2/HO-1信号通路、抑制NF-κB通路活化,介导LPS刺激巨噬细胞的氧化还原代谢重编程。这种对氧化应激与炎症信号通路的双重调控作用,表明Col-MMW膜具备潜在的抗炎功效,而这一功效对于改善组织愈合微环境、影响骨修复效果至关重要[10,57]。
3.6 镁微丝增强胶原膜(Col-MMW)的抗炎性能
为探究Col-MMW的抗炎作用,本研究检测了巨噬细胞的极化状态及炎症相关标志物的表达水平[12]。如图4A所示,与空白组和纯胶原膜(Col)组相比,Col-MMW组细胞中核心促炎基因的表达水平显著下调,涉及的基因包括白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)以及诱导型一氧化氮合酶(iNOS)。与之相符的是,在脂多糖(LPS)存在的条件下,经Col-MMW膜浸提液孵育24小时后,细胞培养上清液中IL-1β和TNF-α两种细胞因子的分泌量也显著降低(图4B)。
此外,本研究通过免疫荧光染色对巨噬细胞表型标志物进行可视化检测,包括促炎表型M1巨噬细胞标志物iNOS,以及促愈合表型M2巨噬细胞标志物精氨酸酶-1(Arg-1)(图4C)。定量分析结果显示,Col-MMW组细胞中iNOS的表达显著降低,Arg-1的表达显著升高,这表明巨噬细胞的表型向抗炎、促再生方向转变(图4D)。扫描电子显微镜(SEM)的形态学评估进一步验证了这一结论:在Col-MMW组中,具有扁平盘状形态(伪彩色标注为青色)的M1型巨噬细胞数量减少,而具有细长纺锤形形态(伪彩色标注为黄绿色)的M2型巨噬细胞占比显著提高[58](图4E)。定量统计结果证实,Col-MMW组的M1型巨噬细胞比例显著下降,M2/M1比值显著升高,这表明Col-MMW可促进巨噬细胞向促愈合表型极化[58,59]。
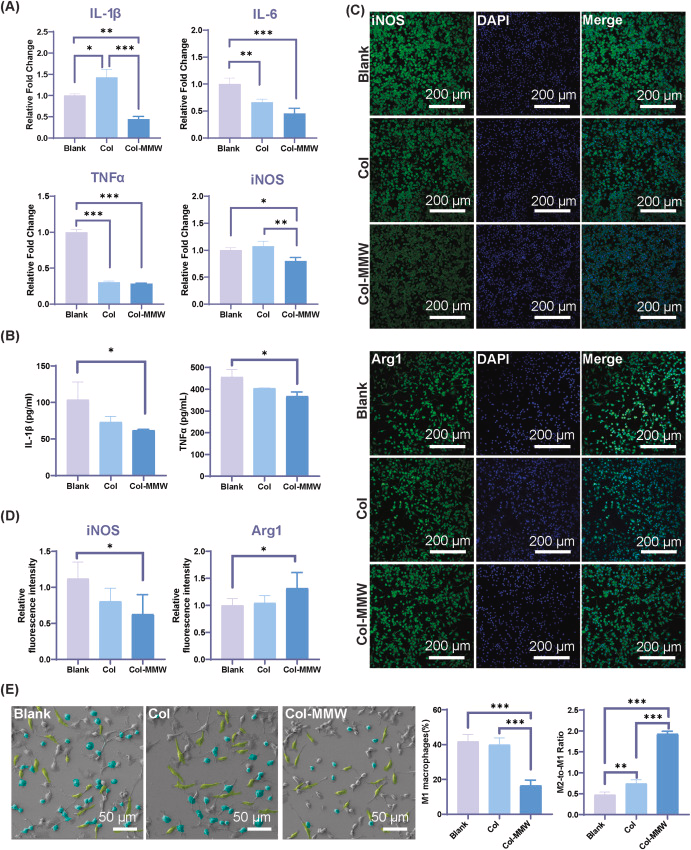
图4 Col-MMW的抗炎性能
统计学分析采用单因素方差分析结合图基事后检验。实验分组如下:经LPS刺激的RAW 264.7巨噬细胞分别用Col膜浸提液、Col-MMW膜浸提液处理,未处理组设为空白对照组。实验组(Col组和Col-MMW组)细胞均采用膜材料的培养基浸提液处理,而非直接与膜材料接触。(A)促炎标志物(IL-1β、IL-6、TNF-α、iNOS)的基因表达分析显示,Col-MMW组的基因表达水平显著下调(*p*值:IL-1β,空白组 vs Col-MMW组,*p*=0.0031;Col组 vs Col-MMW组,*p*=0.0001;空白组 vs Col组,*p*=0.0120;IL-6,空白组 vs Col-MMW组,*p*=0.0007;Col组 vs Col-MMW组,*p*=0.0644;空白组 vs Col组,*p*=0.0082;TNF-α,空白组 vs Col-MMW组,*p*<0.0001;Col组 vs Col-MMW组,*p*=0.5728;空白组 vs Col组,*p*<0.0001;iNOS,空白组 vs Col-MMW组,*p*=0.0325;Col组 vs Col-MMW组,*p*=0.0079;空白组 vs Col组,*p*=0.4524);(B)酶联免疫吸附实验(ELISA)对分泌型细胞因子的定量分析结果显示,Col-MMW组的IL-1β和TNF-α含量降低(*p*值:IL-1β,空白组 vs Col-MMW组,*p*=0.0304;Col组 vs Col-MMW组,*p*=0.6338;空白组 vs Col组,*p*=0.0976;TNF-α,空白组 vs Col-MMW组,*p*=0.0475;Col组 vs Col-MMW组,*p*=0.4364;空白组 vs Col组,*p*=0.2000);(C)iNOS(促炎标志物,上图)与Arg-1(抗炎标志物,下图)的免疫荧光染色结果;(D)荧光强度定量分析显示,Col-MMW组的iNOS表达显著下调(*p*值:空白组 vs Col-MMW组,*p*=0.0006;Col组 vs Col-MMW组,*p*=0.5533;空白组 vs Col组,*p*=0.5822),Arg-1表达显著上调(*p*值:空白组 vs Col-MMW组,*p*=0.0463;Col组 vs Col-MMW组,*p*=0.0866;空白组 vs Col组,*p*=0.9134);(E)LPS刺激的RAW 264.7巨噬细胞形态学分析,M1型和M2型巨噬细胞分别用青色和黄绿色伪彩标注。定量结果显示,Col-MMW组的M1型巨噬细胞占比显著降低(*p*值:空白组 vs Col-MMW组,*p*=0.0004;Col组 vs Col-MMW组,*p*=0.0006;空白组 vs Col组,*p*=0.8233),M2/M1比值显著升高(*p*值:空白组 vs Col-MMW组,*p*<0.0001;Col组 vs Col-MMW组,*p*<0.0001;空白组 vs Col组,*p*=0.0096)。
综上,上述结果表明Col-MMW在体外可有效缓解炎症反应。其抗炎作用可能是多种机制共同介导的结果,包括清除活性氧、介导代谢重编程、激活NRF-2/HO-1抗氧化通路以及抑制NF-κB信号通路。这些免疫调控特性对于构建适宜的组织愈合微环境具有关键作用,关于这一点,我们将在下文的骨免疫调控部分展开进一步探讨。
3.7 Col-MMW对骨免疫微环境的调控作用
近几十年来,骨免疫微环境在骨再生过程中的重要性已得到充分阐释,尤其是在骨组织工程生物材料的研发领域[10]。基于前文证实的Col-MMW抗炎作用,本研究进一步探究其通过调控骨免疫微环境促进成骨分化的作用机制。实验采用2.3.4节所述方法,将小鼠前成骨细胞系MC3T3-E1分别培养于三种条件培养基中,即未经处理的LPS刺激RAW细胞条件培养基、经Col膜浸提液预处理的LPS刺激RAW细胞条件培养基,以及经Col-MMW膜浸提液预处理的LPS刺激RAW细胞条件培养基。
如图5A所示,Col-MMW(+)组细胞中成骨相关基因的mRNA表达水平显著升高,包括碱性磷酸酶(*ALP*)和成骨转录因子*Sp7*(又称成骨特异性转录因子)。碱性磷酸酶(ALP)是成骨细胞分化早期的核心标志物,本研究通过免疫荧光染色和酶活性检测进一步在蛋白水平对其进行分析。结果显示,尽管Col-MMW(+)组的ALP荧光强度高于Blank(+)组和Col(+)组,但差异未达到统计学显著性(图5B、C)。然而,通过检测对硝基苯磷酸钠向对硝基苯酚的转化效率发现,Col-MMW(+)组细胞在培养第3天和第7天的ALP酶活性均显著升高(图5D),这表明其成骨活性得到增强。上述结果说明,经Col-MMW调控的免疫微环境有利于早期成骨分化过程。
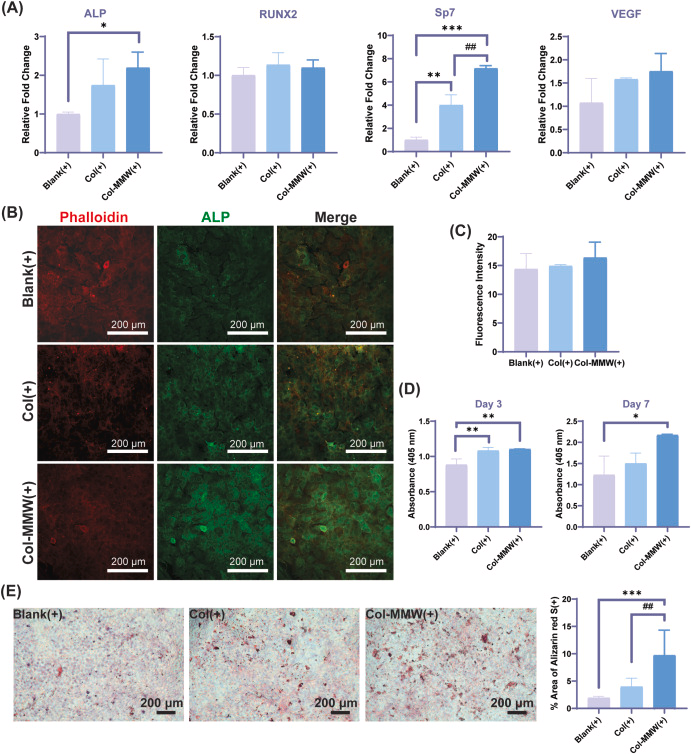
图5 经Col膜与Col-MMW膜调控的骨免疫微环境对前成骨细胞系MC3T3-E1成骨分化的影响
统计学分析采用单因素方差分析结合图基事后检验。实验将MC3T3-E1细胞培养于经Col膜或Col-MMW膜预处理的RAW 264.7巨噬细胞条件培养基中,模拟骨免疫微环境。实验组名称中标注“(+)”即代表使用该条件培养基。(A)成骨相关标志物(ALP、RUNX2、Sp7、VEGF)的基因表达分析显示,Col-MMW(+)组的基因表达水平上调(*p*值:*ALP*,Blank(+)组 vs Col-MMW(+)组,*p*=0.0419;Col(+)组 vs Col-MMW(+)组,*p*=0.4863;Blank(+)组 vs Col(+)组,*p*=0.1942;*RUNX2*,Blank(+)组 vs Col-MMW(+)组,*p*=0.6987;Col(+)组 vs Col-MMW(+)组,*p*=0.9424;Blank(+)组 vs Col(+)组,*p*=0.4518;*Sp7*,Blank(+)组 vs Col-MMW(+)组,*p*=0.0002;Col(+)组 vs Col-MMW(+)组,*p*=0.0047;Blank(+)组 vs Col(+)组,*p*=0.0036;*VEGF*,Blank(+)组 vs Col-MMW(+)组,*p*=0.2033;Col(+)组 vs Col-MMW(+)组,*p*=0.8959;Blank(+)组 vs Col(+)组,*p*=0.4300);(B)成骨早期标志物碱性磷酸酶(ALP)的免疫荧光染色结果显示,Col-MMW(+)组的ALP表达略有增强;(C)ALP荧光强度定量分析证实其成骨活性小幅提升(*p*值:Blank(+)组 vs Col-MMW(+)组,*p*=0.5990;Col(+)组 vs Col-MMW(+)组,*p*=0.7909;Blank(+)组 vs Col(+)组,*p*=0.9686);(D)ALP酶活性检测结果显示,Col-MMW(+)组在两个时间点的酶活性均显著升高(*p*值:第3天,Blank(+)组 vs Col-MMW(+)组,*p*=0.0058;Col(+)组 vs Col-MMW(+)组,*p*=0.8622;Blank(+)组 vs Col(+)组,*p*=0.0099;第7天,Blank(+)组 vs Col-MMW(+)组,*p*=0.0181;Col(+)组 vs Col-MMW(+)组,*p*=0.0696;Blank(+)组 vs Col(+)组,*p*=0.5332);(E)茜素红S染色结果显示,Col-MMW(+)组的矿化结节形成数量增多,表明基质矿化水平增强(*p*值:Blank(+)组 vs Col-MMW(+)组,*p*=0.0004;Col(+)组 vs Col-MMW(+)组,*p*=0.0054;Blank(+)组 vs Col(+)组,*p*=0.3657)。
为进一步评估Col-MMW对基质矿化的影响,本研究将MC3T3-E1细胞在预处理RAW细胞的条件培养基中培养14天后,进行茜素红S染色。如图5E所示,Col-MMW(+)组的矿化结节数量显著增多,这表明Col-MMW可通过调控骨免疫微环境,对晚期成骨分化发挥显著的促进作用。
综上,Col-MMW兼具机械支撑功能与免疫、氧化还原微环境的生物活性调控能力,展现出多维度的治疗潜力。通过可控释放镁离子和氢气,Col-MMW可减轻氧化应激、介导巨噬细胞代谢重编程、激活NRF-2/HO-1通路并抑制NF-κB介导的炎症反应。这些免疫调控作用促使巨噬细胞从促炎的M1表型向促愈合的M2表型转变,从而构建出适宜的骨免疫微环境。在此基础上,经Col-MMW处理的巨噬细胞条件培养基能够增强前成骨细胞的成骨分化与基质矿化能力,凸显出其作为引导骨再生功能膜材料的应用潜力。这种集多种功能于一体的特性,使Col-MMW成为一种极具前景的骨修复生物材料,有望应用于牙种植术前的牙槽骨再生、非承重部位节段性骨缺损修复等临床场景。
尽管上述体外实验结果为阐释Col-MMW的免疫调控及骨免疫调控作用机制提供了重要依据,但需要指出的是,体外模型无法完全模拟体内复杂的细胞间相互作用、细胞外基质动态变化及全身系统性因素的影响[11]。因此,为验证Col-MMW的转化应用价值并进一步评估其治疗潜力,本研究构建了皮下植入模型和临界尺寸颅骨缺损模型开展体内实验。这些动物实验旨在在更接近生理的环境中,评估Col-MMW的生物相容性、宿主免疫应答、组织整合能力及骨再生效能。
3.8 镁微丝(MMW)的体内降解特性
镁基生物材料在生理环境中的快速降解问题,是限制其生物医学应用的关键瓶颈之一[60]。这种以腐蚀为主要驱动的降解过程,可能导致材料过早发生结构失效,并引发过度析氢、局部组织碱化等不良生物学反应[42]。为缓解上述问题,本研究采用基于金属酚网络的涂层技术对镁微丝表面进行改性处理(相关专利:WO 2020/243768 A9),旨在延缓其降解速率并实现氢气释放的可控性[27,28]。
本研究借助皮下植入模型评估镁微丝的体内降解行为及其对周围组织的影响(图6A)。分别在植入后第3、7、14天对大鼠进行X射线成像,监测植入部位的变化情况。如图6A所示,大鼠背部左侧植入Col膜,右侧植入Col-MMW膜。图6B中间面板的X射线影像清晰显示了大鼠脊柱和肋骨的部分结构,红色箭头标注出大鼠背部两侧的植入位点;黄色箭头指示植入膜材料的位置;右侧面板的黄色箭头则标注出Col-MMW组的气体泡囊形成区域。影像学结果显示,植入后第3天局部出现明显的气体腔隙,而到第14天该气体腔隙已显著缩小,这表明氢气的累积量逐渐减少,材料的降解速率有所下降。这一观察结果与已有镁合金相关研究的结论一致——镁合金的腐蚀速率会随时间推移逐渐降低[61]。补充的创面照片进一步展示了植入后第3、7、14天的组织反应情况(补充图5)。值得注意的是,第7天时Col-MMW植入侧出现局部肿胀,这是镁微丝降解产氢导致的现象;但到第14天时肿胀完全消退,两侧植入部位均呈现组织修复的迹象,这与X射线检测结果及已知镁基材料的降解行为相符。
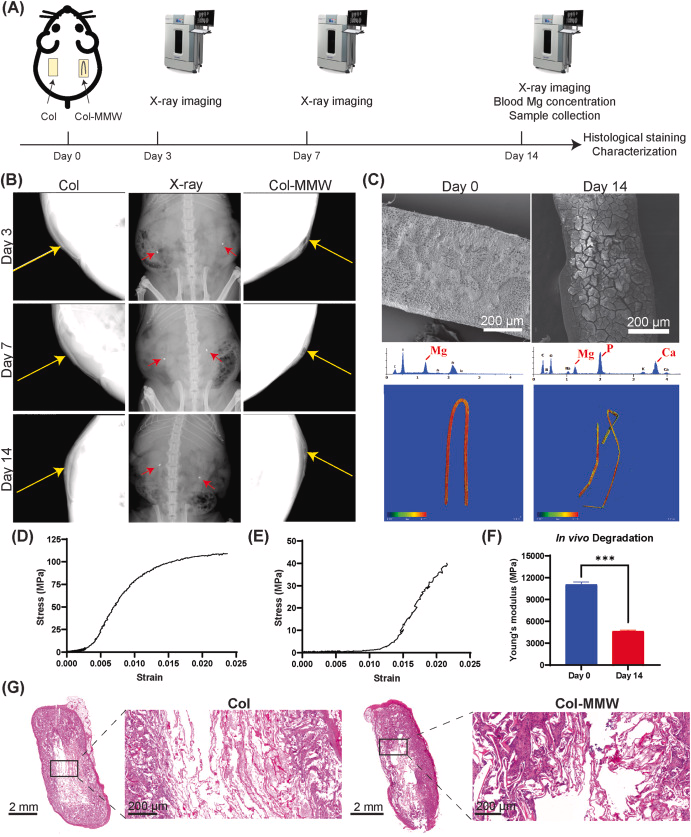
图6 镁微丝增强胶原膜(Col-MMW)的体内降解特性
统计学分析采用非配对学生氏t检验。将纯胶原膜(Col)与镁微丝增强胶原膜(Col-MMW)皮下植入大鼠体内,评估材料随时间的降解情况。(A)皮下植入手术流程示意图;(B)皮下植入后第3、7、14天,Col膜(左侧植入)与Col-MMW膜(右侧植入)的X射线影像。Col膜组(左图)中,黄色箭头标记植入膜的位置;Col-MMW膜组(右图)可见组织表面出现隆起,黄色箭头指示植入膜的位置,该膜位于气体诱导的隆起下方。中间面板为大鼠代表性X射线影像,显示脊柱与肋骨结构,红色箭头标注植入位点;(C)镁微丝(MMW)植入前(第0天)与体内植入14天后(第14天)的表征结果:扫描电子显微镜(SEM)照片显示表面形貌变化(上图);X射线能谱(EDS)图谱反映元素组成变化(中图);显微CT热图体现材料密度差异,其中红色代表最高密度,蓝色代表最低密度。初始状态下,镁微丝呈红色(第0天),表明其结构完整致密;植入14天后,颜色转变为红黄色相间,提示降解导致材料密度下降(下图);(D)Col-MMW膜植入前的应力-应变曲线;(E)Col-MMW膜皮下植入14天后的应力-应变曲线;(F)植入前后杨氏模量对比,结果显示材料的力学刚度显著下降(*p*<0.0001);(G)植入14天后,Col膜(左)与Col-MMW膜(右)周围组织切片的苏木精-伊红(H&E)染色结果,可用于观察组织反应与材料降解情况。
通过扫描电子显微镜观察植入14天后镁微丝的表面形貌,可见其表面出现裂纹与不规则凹陷,且伴有钙(Ca)、磷(P)元素沉积(图6C)。这种富钙磷层的形成,是镁微丝具备生物活性的标志,同时该层可作为保护性表面屏障,有助于降低材料的降解速率[62,63]。该现象的成因在于,氢氧化镁生成过程会导致局部pH升高,进而促进体液中的钙、磷离子发生沉积[42,63]。
显微CT定量分析结果显示,14天内镁微丝的降解率为50.05%±0.03%(图6C,下图)。CT热图用于反映材料密度,红色代表高密度,蓝色代表低密度。初始状态下镁微丝呈红色,对应完整致密的结构;体内植入14天后,颜色变为红黄色相间,表明降解造成材料密度降低。力学测试结果显示,材料刚度大幅下降,植入14天后应力-应变曲线的斜率显著变小(图6D、E)。杨氏模量下降幅度超过一半,但仍显著高于天然牙龈组织的杨氏模量(19.75±6.20 MPa)[64],这提示Col-MMW膜在愈合早期可维持足够的力学完整性(图6F)。
上述结果证实,金属酚网络(MPN)涂层可有效调控镁微丝的体内降解动力学,减少氢气释放并维持材料的力学稳定性。表面富钙磷层的形成,可能进一步促进组织整合并诱导正向愈合反应[62]。显微CT分析直观呈现了这一降解过程:热图颜色从代表完整高密度镁的红色,转变为14天后的红黄色相间,提示材料发生损耗。但需要指出的是,本研究仅评估了材料的短期降解行为与力学性能。尽管Col-MMW膜在愈合早期具备足够的稳定性,但仍需开展长期研究,以明确其结构完整性的维持时长与长期降解规律。此外,本研究虽观察到氢气的释放与消散过程,但周围组织的生物学应答(尤其是炎症反应与免疫细胞浸润情况)仍需进一步探究。为弥补上述不足,后续研究通过组织学分析评估材料的组织相容性与炎症应答。
3.9 Col-MMW膜在体内对炎症反应的调控作用
为探究Col-MMW膜降解对局部组织微环境的影响,研究人员在皮下植入14天后收集周围组织进行组织学分析。通过苏木精-伊红(H&E)染色,可全面观察组织形态、膜材料完整性及宿主应答情况。组织样本取材时,需小心从Col-MMW膜中取出镁微丝,避免对后续组织学与分析实验造成干扰。如图6G所示,Col-MMW膜内部出现空腔结构,该区域对应植入前镁微丝的位置。尽管如此,Col膜组与Col-MMW膜组的细胞浸润程度相近,细胞均匀分布于膜材料内部,未形成致密细胞簇或炎症灶。这一现象表明,材料与宿主之间存在良好的相互作用,具备促进组织整合的潜力。尤为重要的是,周围组织中未观察到明显的气体腔隙或空泡结构,说明镁降解产生的氢气未造成组织结构破坏或引发不良组织反应。上述结果证实,Col-MMW膜在植入早期具有良好的生物相容性与结构稳定性。但苏木精-伊红染色仅能提供形态学信息,无法阐释分子与细胞层面的作用机制。因此,为进一步探究Col-MMW膜除结构相容性外的生物学效应,本研究分析了其对周围组织中氧化还原敏感信号通路及炎症标志物的调控作用。
研究人员采用免疫组织化学染色(IHC)与免疫荧光染色(IF)技术,检测周围组织中核因子E2相关因子2(NRF-2)及其下游效应分子血红素氧合酶-1(HO-1)的表达情况[49,65]。与体外实验结果一致,Col-MMW膜组的NRF-2与HO-1信号强度及分布范围均显著高于Col膜组,这表明该材料在体内可激活抗氧化防御机制(图7A–F)。为进一步评估Col-MMW膜的免疫调控作用,本研究检测了炎症相关标志物的表达。免疫荧光与免疫组织化学染色结果显示,Col-MMW膜组的促炎标志物诱导型一氧化氮合酶(iNOS)表达下调,抗炎标志物精氨酸酶-1(Arg-1)表达上调,提示局部免疫表型向促愈合方向转变(图7G–L)。上述结果与体外实验结论相符,进一步证实Col-MMW膜在体内可发挥抗炎信号调控作用。
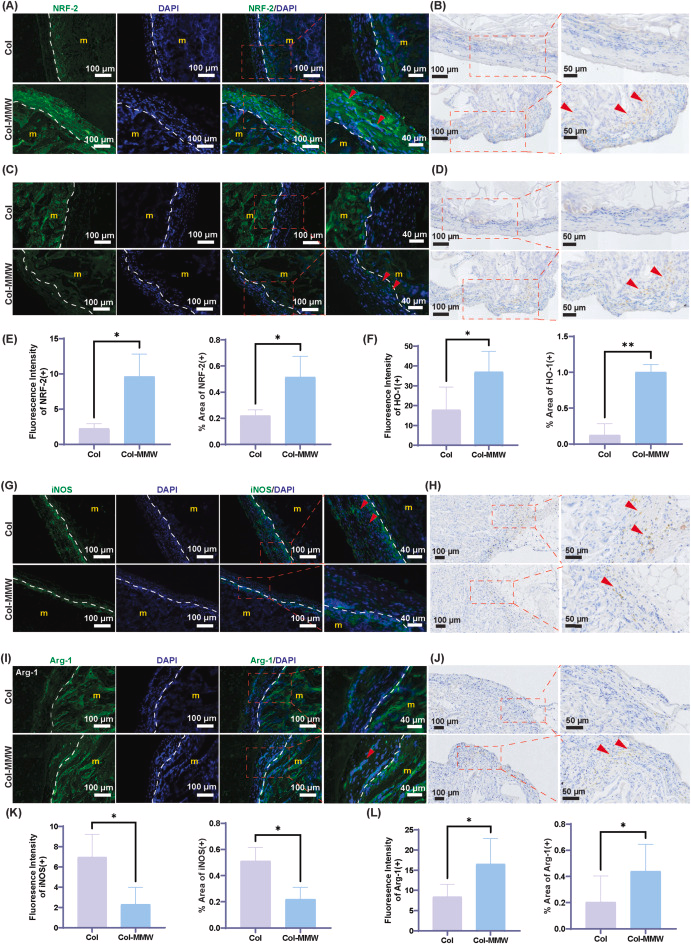
图7 皮下植入14天后,植入周围组织中氧化还原平衡及炎症相关标志物的免疫荧光(IF)与免疫组织化学(IHC)染色结果
白色虚线标记膜材料边界;“m”代表膜材料;红色箭头标注阳性染色区域。统计学分析采用非配对学生氏t检验。(A–D)代表性免疫荧光与免疫组织化学染色图像显示,Col-MMW膜处理组组织中NRF-2与HO-1的阳性信号更多,表明抗氧化通路被激活;(E)NRF-2表达水平定量分析:免疫荧光荧光强度(左图,*p*=0.0179)与免疫组织化学阳性面积(右图,*p*=0.0371)在Col-MMW膜组均显著更高;(F)HO-1表达水平定量分析:免疫荧光荧光强度(左图,*p*=0.0253)与免疫组织化学阳性面积(右图,*p*=0.0013)在Col-MMW膜组均显著更高;(G–J)炎症标志物iNOS与Arg-1的免疫荧光及免疫组织化学染色结果显示,Col-MMW膜处理组组织中促炎因子iNOS表达减少、抗炎因子Arg-1表达增加,提示巨噬细胞向促再生表型极化;(K)iNOS表达水平定量分析:免疫荧光荧光强度(左图,*p*=0.0441)与免疫组织化学阳性面积(右图,*p*=0.0208)在Col-MMW膜组均显著更低;(L)Arg-1表达水平定量分析:免疫荧光荧光强度(左图,*p*=0.0492)与免疫组织化学阳性面积(右图,*p*=0.0497)在Col-MMW膜组均显著更高。
综上,上述结果表明,Col-MMW膜在早期降解过程中不仅能维持生物相容性与结构完整性,还可主动调控局部免疫微环境。通过减轻氧化应激与调控炎症反应,Col-MMW膜有望诱导组织发生再生性修复。为进一步评估其在骨组织工程领域的治疗潜力,后续研究借助临界尺寸颅骨缺损模型,通过显微CT与组织学染色技术,评估了Col-MMW膜在4周与8周时间点的骨再生能力。
3.10 Col-MMW膜在骨缺损模型中促进骨组织再生
14天皮下植入实验证实,Col-MMW膜在早期降解阶段可维持生物相容性与结构完整性,可控释放氢气并激活NRF-2/HO-1抗氧化通路,同时通过调控iNOS与Arg-1的表达水平发挥炎症调控作用。但该模型无法评估Col-MMW膜支持功能性骨再生的能力。为此,本研究构建大鼠临界尺寸颅骨缺损模型,通过显微CT与组织学分析,评估了术后4周与8周的骨愈合情况(图8)。
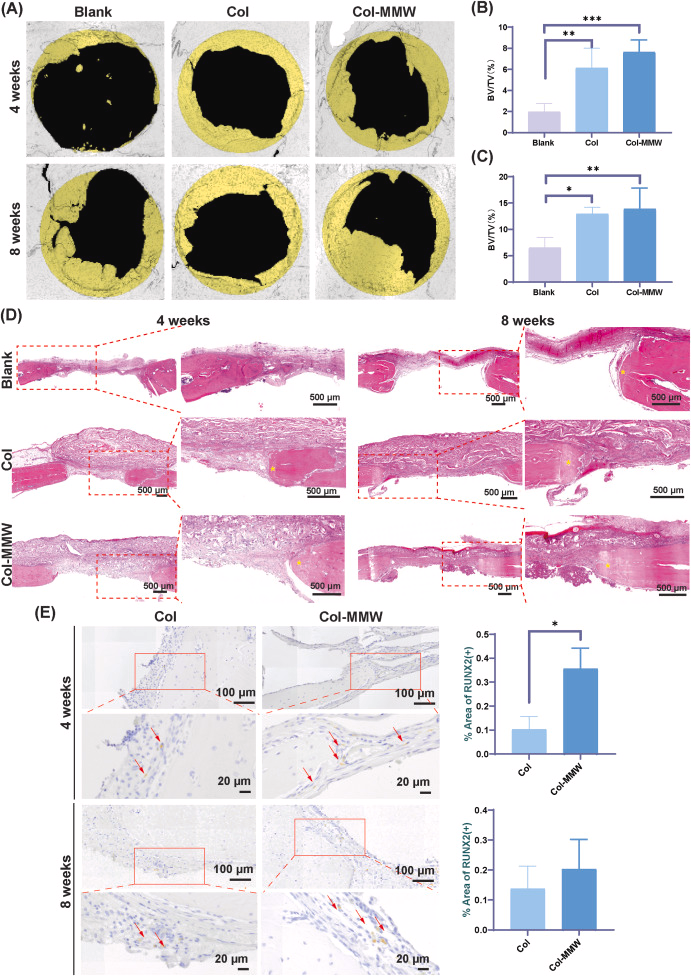
图8 大鼠颅骨缺损模型中,植入Col膜与Col-MMW膜后的骨再生能力评估
显微CT定量分析采用单因素方差分析结合图基事后检验,免疫组织化学分析采用非配对学生氏t检验。(A)植入后4周与8周,Col膜组与Col-MMW膜组颅骨缺损区域的代表性显微CT扫描图像;(B)4周时骨体积与组织体积比值(BV/TV)定量分析结果显示,Col-MMW膜组的骨再生量显著高于空白对照组(*p*=0.0002),而Col膜组与Col-MMW膜组之间无统计学差异(*p*=0.2691);(C)8周时骨体积与组织体积比值定量分析结果显示,Col-MMW膜组的成骨能力仍优于空白对照组(*p*=0.0094),Col膜组与Col-MMW膜组之间无统计学差异(*p*=0.8921);(D)4周与8周时缺损部位的苏木精-伊红(H&E)染色结果,星号(∗)标记新生骨组织区域;(E)4周与8周时RUNX2表达的免疫组织化学染色及定量分析结果。4周时Col-MMW膜组的RUNX2表达水平显著更高(*p*=0.0123),8周时两组无统计学差异(*p*=0.4178),提示该材料可诱导早期成骨活化。
显微CT定量分析结果显示,与空白对照组相比,Col膜组与Col-MMW膜组的新生骨组织形成量均显著增加,这证实了胶原支架具有骨传导活性[12,34](图8A、B)。尽管Col-MMW膜组的骨体积略高于Col膜组,但差异未达到统计学显著性。这一微弱差异与体外实验结果形成对比——在体外实验中,经膜材料处理的巨噬细胞条件培养基可显著增强成骨分化与基质矿化,体现了膜材料调控骨免疫微环境的作用。因此,体外与体内实验结果的差异,可能源于体内环境的复杂性,包括全身免疫应答、血管新生及力学因素等,这些因素可能削弱材料的局部作用效果。此外,尽管本研究的样本量(*N*=6)是经功效分析确定且符合研究要求的,但实验动物之间固有的生物学差异,可能限制了对骨再生细微差异的检测能力。未来可通过扩大样本量与延长观察周期,进一步验证上述结果,并深入阐释Col-MMW膜在体内的作用优势。这些发现也强调,需结合体外与体内实验数据,才能全面评估生物材料的性能。
为进一步明确新生骨组织的质量与空间分布特征,本研究对植入后4周与8周的样本进行苏木精-伊红染色与组织学分析。结果显示,Col膜组与Col-MMW膜组的天然骨与再生骨之间边界清晰,证实缺损区域内存在活跃的成骨活动(图8D)。缺损边缘可见新生骨组织形成,这与显微CT结果一致,表明植入膜材料可与宿主组织逐步实现结构整合,是材料具备生物相容性的重要标志。
为在细胞层面探究成骨信号通路的激活情况,本研究通过免疫组织化学染色检测了成骨细胞分化关键转录因子RUNX2的表达。如图8E所示,Col-MMW膜组的RUNX2阳性信号高于Col膜组,提示Col-MMW膜可能通过免疫调控作用,更有效地促进成骨分化。鉴于前文已证实Col-MMW膜可减轻氧化应激、调控炎症反应,RUNX2阳性信号的增强,可能反映其为骨再生营造了更适宜的局部微环境。已有研究表明,适度的炎症调控与氧化应激减轻,有利于成骨细胞活性增强与基质沉积,这也解释了尽管Col-MMW膜组的骨体积增量不显著,但其仍具备生物学优势的原因[10,11]。
综上,体内实验证实Col-MMW膜可促进骨组织再生,表现为RUNX2表达上调及组织学层面的结构整合。尽管其骨形成量与Col膜组无显著差异,但RUNX2的高表达与免疫调控特性表明,该材料具有重要的生物学作用价值。上述发现凸显了Col-MMW膜作为多功能引导骨再生(GBR)材料的应用潜力,其既能提供结构支撑,又可主动调控愈合微环境。
3.11 研究局限性与未来展望
本研究证实Col-MMW膜具有良好的再生潜力,但仍存在若干局限性。第一,尽管动物实验的样本量(*N*=6)是经功效分析确定且符合研究规范的,但实验动物个体间的生物学差异,可能降低了检测骨再生细微差异的灵敏度。第二,本研究聚焦于愈合早期阶段(最长观察8周),未来需开展长期研究,评估膜材料的降解规律、结构稳定性、骨重塑动态变化及功能性骨整合情况。同样,皮下植入模型的观察周期仅为14天,该设计旨在探究早期免疫应答与氧化应激反应,虽有助于阐明材料与宿主的早期相互作用机制,但仍需通过长期研究明确其免疫调控作用的持续性、长期生物相容性及组织整合效果。第三,本研究采用的颅骨缺损模型属于非承重部位,无法完全模拟临床骨缺损的力学需求。此外,在口腔应用场景中,膜材料需面临富含细菌与炎症刺激的复杂口腔环境,而本研究未评估材料的抗菌性能及在此类环境下的稳定性。未来研究应构建污染或感染模型,更精准地模拟临床应用场景,解决材料在承重部位与细菌暴露环境下的性能问题等转化应用挑战。
基于本研究结果,未来可通过扩大样本量、延长观察周期,并构建下颌骨或长骨缺损等其他模型,进一步验证Col-MMW膜的治疗效果与临床应用价值。同时,开展体内免疫细胞动态变化及材料-宿主相互作用的机制研究,有助于深入阐释Col-MMW膜的骨免疫调控作用通路。
4 结论
本研究研发了一种集力学增强与靶向免疫代谢调控功能于一体的引导骨再生(GBR)膜材料。Col-MMW膜可清除活性氧(ROS)、激活NRF2/HO-1抗氧化通路并抑制NF-κB信号通路,进而发挥抗炎作用。上述效应可介导巨噬细胞代谢模式向氧化磷酸化转变,促使免疫应答向促再生表型极化。这种免疫代谢调控作用,在体外与体内实验中均能增强成骨分化并促进骨再生。嵌入的镁微丝为膜材料提供力学稳定性,是其具备临床应用潜力的关键支撑。综上,本研究结果表明,Col-MMW膜是一种极具前景的新一代引导骨再生材料,实现了结构完整性与靶向免疫代谢调控的有机结合,有望在骨组织工程与再生医学领域得到广泛应用。
Mu Y, Du Z, Gao W, He Z, Xiao L, Zhou Y, Ahmed I, Dai H, Liu M, Liu J, Wang X, Yu S, Xiao Y. Osteoimmunometabolic modulation via hydrogen-self-supplying magnesium-reinforced collagen membrane for enhanced guided bone regeneration. Biomaterials. 2025 Dec 19;329:123928.
https://blog.sciencenet.cn/blog-41174-1515635.html
上一篇:少量白藜芦醇与铜有治愈脑胶质母细胞瘤的可能
下一篇:开创疾病建模领域的革命性变革